人教版选修二 3.4.1 配合物 课件(22张ppt)
文档属性
| 名称 | 人教版选修二 3.4.1 配合物 课件(22张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-20 18:18:21 | ||
图片预览








文档简介
(共22张PPT)
课时1 配合物
第四节 配合物与超分子
《物质结构与性质》
01
学习目标
CONTENT
配位键
02
配合物
03
配合物的应用
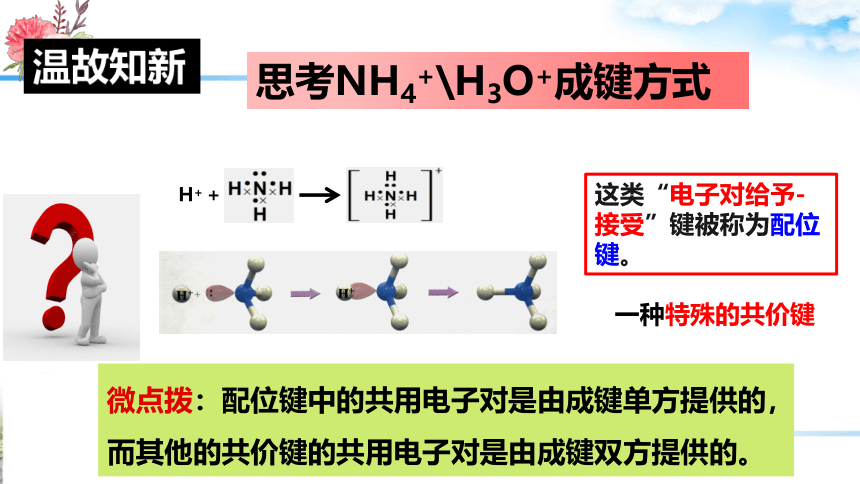
思考NH4+\H3O+成键方式
H+ +
这类“电子对给予-接受”键被称为配位键。
一种特殊的共价键
微点拨:配位键中的共用电子对是由成键单方提供的,而其他的共价键的共用电子对是由成键双方提供的。
温故知新
H
O
H
H
Cu
H2O
H2O
H2O
OH2
2+
请你写出NH4+的配位键的表示法?
平面正方形结构
[Cu(H2O)4]2+
(电子对给予体)A→B(电子对接受体)或A—B
配位键的表示方法
配位键的形成条件
①成键原子一方能提供孤电子对。如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。
②成键原子另一方能提供空轨道。如H+、Al3+、B及过渡金属的原子或离子。
(3)配位键同样具有饱和性和方向性。一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。。
形成条件
一方能给予孤电子对
另一方能接受电子对
(有空轨道)
一种特殊的共价键
配位键:“电子对给予-接受”键。
、H2O、Cl-、SCN-等。
、Fe3+、Cu2+、Zn2+、Mg2+、Al3+、Fe、Ni等
H+、Ag+
NH3
大多为过渡金属的原子或离子。
血红色溶液
【思考与讨论】
中心原子(离子):提供空轨道,接受孤电子对。通常是过渡元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等。
配位体:提供孤电子对的分子或离子,如分子CO、NH3、H2O等,阴离子F-、CN-、Cl-等。
注意
①配位键是一种特殊的共价键,配位键与共价键性质完全相同.
②H3O+、NH4+中含有配位键.
③配位键同样具有饱和性和方向性,一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
配位键实质上是一种特殊的共价键。配位键的共用电子对由成键原子单方面提供,普通共价键的共用电子对则由成键原子双方共同提供,但实质是相同的。
(1) 中的配位键与其他三个N—H键的键参数是否相同
提示:相同。 可看成NH3分子结合1个H+后形成的,在NH3分子中中心原子氮采取sp3杂化,孤电子对占据一个杂化轨道,3个未成对电子分别占据另3个杂化轨道,分别结合3个H原子形成3个σ键,由于孤电子对的排斥,所以NH3分子的空间结构为三角锥形,键角压缩至107°。当遇到H+时,N原子的孤电子对会进入H+的空轨道,以配位键形成 ,这样N原子就不再存在孤电子对,键角恢复至109°28',故 为正四面体形,4个N—H键完全相同,配位键与普通共价键形成过程不同,但各种键参数完全相同。
【思考与讨论】
(2)配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些
提示:[Cu(NH3)4]SO4中含有的化学键有离子键、共价键和配位键。
(3)配制银氨溶液时,向AgNO3溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,为什么
提示:氨水呈弱碱性,滴入AgNO3溶液中会生成AgOH白色沉淀;继续滴加氨水时,NH3分子与Ag+形成[Ag(NH3)2]+配合离子,使AgOH逐渐溶解,反应过程如下:
【思考与讨论】
把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键 结合形成的化合物称为配位化合物,简称配合物。如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物。
[Cu(H2O)4 ] S O 4
内界(配离子)
外界(离子)
中
心
离
子
配
位
体
配
位
原
子
配
位
数
思考:NH4Cl是配合物吗?
配位化合物:
实验操作 实验现象 实验原理
向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水
继续添加氨水并振荡试管
再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁
形成难溶物
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
难溶物溶解,得到深蓝色的透明溶液
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
析出深蓝色晶体
深蓝色晶体为[Cu(NH3)4]SO4·H2O,说明该配合物在乙醇中的溶解度小于在水中的溶解度
实验3-3
实验证明,无论在得到的深蓝色透明溶液中,还是在析出的深蓝色的晶体中,深蓝色都是由于存在 [Cu(NH3)4]2+,它是Cu2+的另一种常见配离子,中心离子仍然是Cu2+,而配体是NH3,配位数为4。
实验3-3
实验操作 向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液。
实验现象
实验原理
溶液变为红色
利用硫氰化铁配离子等颜色,可用于鉴别溶液中存在Fe3+;
Fe3++nSCN- = [Fe(SCN)n]3-n
n = 1-6,随SCN-的浓度而异
配位数可为1—6
实验3-4
实验操作 向盛有少量0.1moI/ L NaCl溶液的试管里滴几滴0.1 mol/L AgNO3溶液,产生难溶于水的白色的AgCl沉淀,再滴入1molL氨水,振荡,观察实验现象。
实验现象
实验原理
AgCl+2NH3=== [Ag(NH3)2]Cl
Ag++Cl-===AgCl↓
先产生白色沉淀,滴加氨水后白色沉淀溶解
实验3-5
(1)对溶解性的影响
一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。
(2)颜色的改变
当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。
配合物的形成对性质的影响
(1) 在生命体中的应用
(2)在医药中的应用
叶绿素
血红素
抗癌药物
酶
维生素B12
钴配合物
含锌的配合物
含锌酶有80多种
Fe2+的配合物
Mg2+的配合物
(3) 配合物与生物固氮
固氮酶
(4)在生产生活中的应用
王水溶金
电解氧化铝的助熔剂 Na3[AlF6]
热水瓶胆镀银 [Ag(NH3)2]+
H[AuCl4]
配合物的应用
配合物 内界 外界 中心粒子 配位体 配位数
[Ag(NH3)2]OH 氢氧化二氨合银
K3[Fe(CN)6]
[Co(NH3)5Cl]Cl2
Ni(CO)4
请根据给出的配合物完成下表
[Ag(NH3)2]+
OH-
Ag+
NH3
2
【思考与讨论】
配合物 内界 外界 中心粒子 配位体 配位数
[Ag(NH3)2]OH 氢氧化二氨合银 [Ag(NH3)2]+ OH- Ag+ NH3 2
K3[Fe(CN)6] 六氰合铁酸钾 [Fe(CN)6]3- K+ Fe3+ CN- 6
[Co(NH3)5Cl]Cl2 [Co(NH3)5Cl]2+ Cl- Co3+ NH3、Cl- 6
Ni(CO)4 四羰基镍 Ni(CO)4 无 Ni CO 4
请根据给出的配合物完成下表
【思考与讨论】
配合物结构小结:
1、配合物有些存在外界、有些无外界;
2、中心粒子可以是阳离子,也可以是中性原子;
3、配位体可以是离子或分子,可以有一种或同时存在多种;
4、配位数通常为2、4、6、8这样的偶数。
配合物的结构特点
1.0.01mol氯化铬(CrCl3· 6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀。此氯化铬最可能是( )
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O
B
[课堂练习]
2.下列化合物属于配合物的是( )
A.Cu2(OH)2SO4 B.NH4Cl C.[Zn(NH3)4]SO4 D.KAl(SO4)2
3.某物质A的实验式为CoCl3·4NH3,1 mol A中加入足量的AgNO3溶液中能生成1 mol白色沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
A.Co3+只与NH3形成配位键 B.配合物配位数为3
C.该配合物可能是平面正方形结构
D.此配合物可写成[Co(NH3)4 Cl2] Cl
D
D
[课堂练习]
课时1 配合物
第四节 配合物与超分子
《物质结构与性质》
01
学习目标
CONTENT
配位键
02
配合物
03
配合物的应用
思考NH4+\H3O+成键方式
H+ +
这类“电子对给予-接受”键被称为配位键。
一种特殊的共价键
微点拨:配位键中的共用电子对是由成键单方提供的,而其他的共价键的共用电子对是由成键双方提供的。
温故知新
H
O
H
H
Cu
H2O
H2O
H2O
OH2
2+
请你写出NH4+的配位键的表示法?
平面正方形结构
[Cu(H2O)4]2+
(电子对给予体)A→B(电子对接受体)或A—B
配位键的表示方法
配位键的形成条件
①成键原子一方能提供孤电子对。如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。
②成键原子另一方能提供空轨道。如H+、Al3+、B及过渡金属的原子或离子。
(3)配位键同样具有饱和性和方向性。一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。。
形成条件
一方能给予孤电子对
另一方能接受电子对
(有空轨道)
一种特殊的共价键
配位键:“电子对给予-接受”键。
、H2O、Cl-、SCN-等。
、Fe3+、Cu2+、Zn2+、Mg2+、Al3+、Fe、Ni等
H+、Ag+
NH3
大多为过渡金属的原子或离子。
血红色溶液
【思考与讨论】
中心原子(离子):提供空轨道,接受孤电子对。通常是过渡元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等。
配位体:提供孤电子对的分子或离子,如分子CO、NH3、H2O等,阴离子F-、CN-、Cl-等。
注意
①配位键是一种特殊的共价键,配位键与共价键性质完全相同.
②H3O+、NH4+中含有配位键.
③配位键同样具有饱和性和方向性,一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
配位键实质上是一种特殊的共价键。配位键的共用电子对由成键原子单方面提供,普通共价键的共用电子对则由成键原子双方共同提供,但实质是相同的。
(1) 中的配位键与其他三个N—H键的键参数是否相同
提示:相同。 可看成NH3分子结合1个H+后形成的,在NH3分子中中心原子氮采取sp3杂化,孤电子对占据一个杂化轨道,3个未成对电子分别占据另3个杂化轨道,分别结合3个H原子形成3个σ键,由于孤电子对的排斥,所以NH3分子的空间结构为三角锥形,键角压缩至107°。当遇到H+时,N原子的孤电子对会进入H+的空轨道,以配位键形成 ,这样N原子就不再存在孤电子对,键角恢复至109°28',故 为正四面体形,4个N—H键完全相同,配位键与普通共价键形成过程不同,但各种键参数完全相同。
【思考与讨论】
(2)配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些
提示:[Cu(NH3)4]SO4中含有的化学键有离子键、共价键和配位键。
(3)配制银氨溶液时,向AgNO3溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,为什么
提示:氨水呈弱碱性,滴入AgNO3溶液中会生成AgOH白色沉淀;继续滴加氨水时,NH3分子与Ag+形成[Ag(NH3)2]+配合离子,使AgOH逐渐溶解,反应过程如下:
【思考与讨论】
把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键 结合形成的化合物称为配位化合物,简称配合物。如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物。
[Cu(H2O)4 ] S O 4
内界(配离子)
外界(离子)
中
心
离
子
配
位
体
配
位
原
子
配
位
数
思考:NH4Cl是配合物吗?
配位化合物:
实验操作 实验现象 实验原理
向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水
继续添加氨水并振荡试管
再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁
形成难溶物
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
难溶物溶解,得到深蓝色的透明溶液
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
析出深蓝色晶体
深蓝色晶体为[Cu(NH3)4]SO4·H2O,说明该配合物在乙醇中的溶解度小于在水中的溶解度
实验3-3
实验证明,无论在得到的深蓝色透明溶液中,还是在析出的深蓝色的晶体中,深蓝色都是由于存在 [Cu(NH3)4]2+,它是Cu2+的另一种常见配离子,中心离子仍然是Cu2+,而配体是NH3,配位数为4。
实验3-3
实验操作 向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液。
实验现象
实验原理
溶液变为红色
利用硫氰化铁配离子等颜色,可用于鉴别溶液中存在Fe3+;
Fe3++nSCN- = [Fe(SCN)n]3-n
n = 1-6,随SCN-的浓度而异
配位数可为1—6
实验3-4
实验操作 向盛有少量0.1moI/ L NaCl溶液的试管里滴几滴0.1 mol/L AgNO3溶液,产生难溶于水的白色的AgCl沉淀,再滴入1molL氨水,振荡,观察实验现象。
实验现象
实验原理
AgCl+2NH3=== [Ag(NH3)2]Cl
Ag++Cl-===AgCl↓
先产生白色沉淀,滴加氨水后白色沉淀溶解
实验3-5
(1)对溶解性的影响
一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。
(2)颜色的改变
当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。
配合物的形成对性质的影响
(1) 在生命体中的应用
(2)在医药中的应用
叶绿素
血红素
抗癌药物
酶
维生素B12
钴配合物
含锌的配合物
含锌酶有80多种
Fe2+的配合物
Mg2+的配合物
(3) 配合物与生物固氮
固氮酶
(4)在生产生活中的应用
王水溶金
电解氧化铝的助熔剂 Na3[AlF6]
热水瓶胆镀银 [Ag(NH3)2]+
H[AuCl4]
配合物的应用
配合物 内界 外界 中心粒子 配位体 配位数
[Ag(NH3)2]OH 氢氧化二氨合银
K3[Fe(CN)6]
[Co(NH3)5Cl]Cl2
Ni(CO)4
请根据给出的配合物完成下表
[Ag(NH3)2]+
OH-
Ag+
NH3
2
【思考与讨论】
配合物 内界 外界 中心粒子 配位体 配位数
[Ag(NH3)2]OH 氢氧化二氨合银 [Ag(NH3)2]+ OH- Ag+ NH3 2
K3[Fe(CN)6] 六氰合铁酸钾 [Fe(CN)6]3- K+ Fe3+ CN- 6
[Co(NH3)5Cl]Cl2 [Co(NH3)5Cl]2+ Cl- Co3+ NH3、Cl- 6
Ni(CO)4 四羰基镍 Ni(CO)4 无 Ni CO 4
请根据给出的配合物完成下表
【思考与讨论】
配合物结构小结:
1、配合物有些存在外界、有些无外界;
2、中心粒子可以是阳离子,也可以是中性原子;
3、配位体可以是离子或分子,可以有一种或同时存在多种;
4、配位数通常为2、4、6、8这样的偶数。
配合物的结构特点
1.0.01mol氯化铬(CrCl3· 6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀。此氯化铬最可能是( )
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O
B
[课堂练习]
2.下列化合物属于配合物的是( )
A.Cu2(OH)2SO4 B.NH4Cl C.[Zn(NH3)4]SO4 D.KAl(SO4)2
3.某物质A的实验式为CoCl3·4NH3,1 mol A中加入足量的AgNO3溶液中能生成1 mol白色沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
A.Co3+只与NH3形成配位键 B.配合物配位数为3
C.该配合物可能是平面正方形结构
D.此配合物可写成[Co(NH3)4 Cl2] Cl
D
D
[课堂练习]
