(基础篇)2022-2023学年下学期初中化学鲁教新版九年级第8单元练习卷(含解析)
文档属性
| 名称 | (基础篇)2022-2023学年下学期初中化学鲁教新版九年级第8单元练习卷(含解析) |
|
|
| 格式 | doc | ||
| 文件大小 | 159.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-21 00:00:00 | ||
图片预览




文档简介
(基础篇)2022-2023学年下学期
初中化学鲁教版九年级
第8单元练习卷
一.选择题(共10小题)
1.海洋是人类宝贵的自然资源。下列说法错误的是( )
A.海水淡化——利用物质的溶解度不同进行蒸馏分离
B.海水晒盐——利用太阳能和风能蒸发水分得到粗盐
C.海水制镁——利用碱将镁元素富集,提纯后电解
D.海水“制碱”——利用氨碱法以食盐等原料制取纯碱
2.海洋是人类巨大的资源宝库,海洋资源开发前景十分广阔。下列说法正确的是( )
A.“可燃冰”是指可燃烧的冰
B.“晒盐”过程中氯化钠的质量增加
C.锰结核中含多种金属元素
D.可利用海水提取的铝盐制取金属铝
3.利用如图装置研究铜绿的性质实验(无水硫酸铜遇水变蓝)。下列说法不正确的是( )
A.装置①中固体由绿色变为黑色
B.装置②中固体变蓝,证明有H2O生成
C.装置③中石蕊试液变为蓝色
D.实验结束后先拆除装置③,再熄灭酒精灯,目的是防止溶液倒吸
4.下列说法中,不正确的是( )
A.化学反应前后各物质的质量总和不变,是因为反应前后分子和原子的种类保持不变
B.当其它条件一样时,可燃物与氧气接触面积越大燃烧就越剧烈
C.化学反应时不但物质发生改变,还伴随着能量的变化
D.同一溶质的饱和溶液与不饱和溶液在一定条件下可以相互转化
5.下列物质都是初中化学中常见的物质:①氧气、②氧化铜、③铁、④硫酸、⑤碳酸钠溶液、⑥氢氧化钠溶液、⑦二氧化碳、⑧碳、⑨氯化钡溶液、⑩硝酸钾溶液,十种物质中两两间能发生的复分解反应的个数是( )
A.4 个 B.8个 C.7个 D.5个
6.下列各组物质中,能发生复分解反应且反应前后溶液总质量变大的是( )
A.氢氧化铁和稀硫酸
B.锌和硫酸铜溶液
C.氯化钠溶液和碳酸钾溶液
D.硫酸钠溶液和氯化钡溶液
7.对于复分解反应:X+2NaOH=2Y+Cu(OH)2↓,下列分析中正确的是( )
A.X不一定是CuCl2 B.Y的化学式一定是NaCl
C.Y可能是H2O D.Y可能是Na2SO4
8.粗盐提纯的实验中,相关说法正确的是( )
A.为加快溶解速度,溶解时用多些水
B.过滤时用玻璃棒搅拌
C.过滤可以除去粗盐中的所有杂质
D.蒸发至大量固体出现熄灭酒精灯
9.下列有关“粗盐中难溶性杂质的去除”实验的说法,正确的是( )
A.称量时托盘天平上可以不垫称量纸
B.溶解时加入的水越多越好
C.过滤时需用玻璃棒不断搅拌
D.蒸发时出现较多固体时,停止加热
10.下列关于氯化钠(NaCl)的说法正确的是( )
A.氯化钠是由氯化钠离子构成的
B.中和反应生成的盐一定是氯化钠
C.粗盐提纯的主要步骤是溶解、过滤、蒸发
D.波尔多液是硫酸铜与氯化钠的混合物
二.填空题(共1小题)
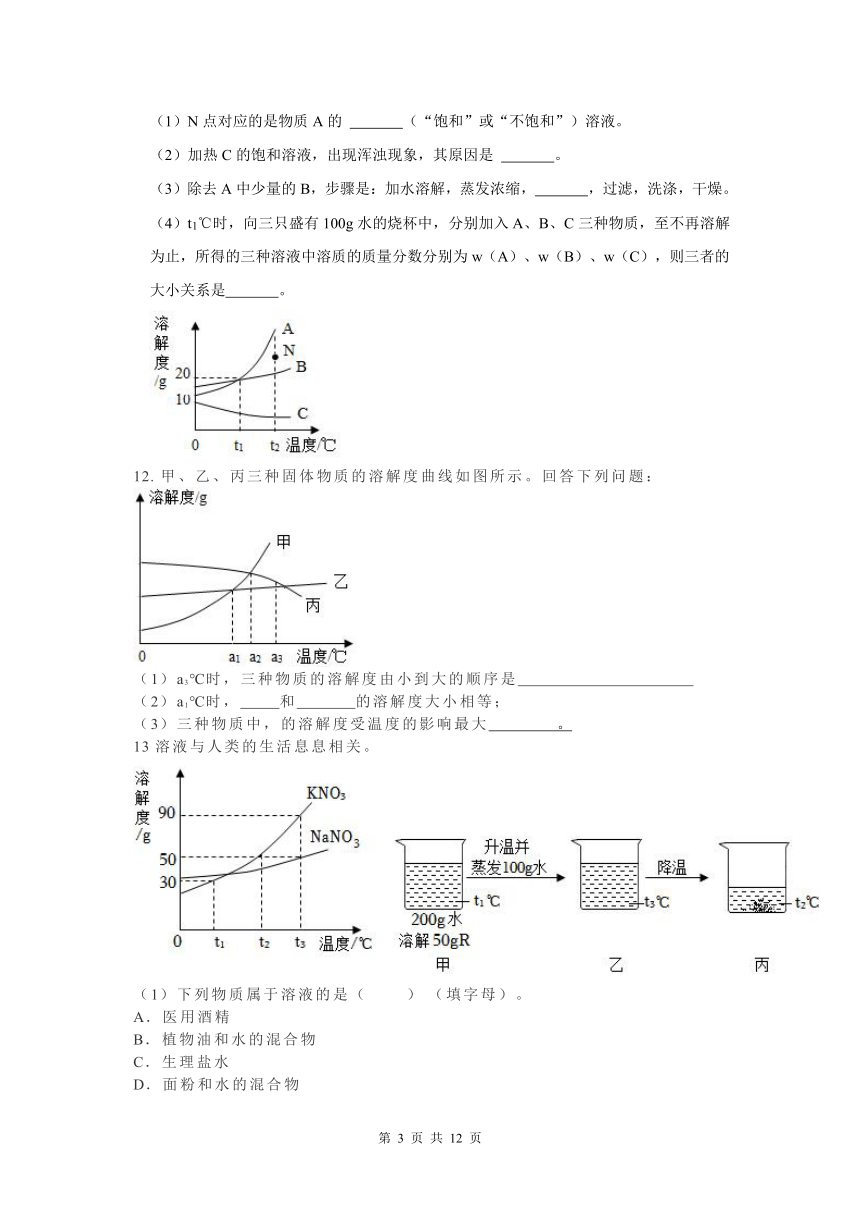
11.A、B、C三种物质的溶解度曲线如图所示,回答下列问题:
(1)N点对应的是物质A的 (“饱和”或“不饱和”)溶液。
(2)加热C的饱和溶液,出现浑浊现象,其原因是 。
(3)除去A中少量的B,步骤是:加水溶解,蒸发浓缩, ,过滤,洗涤,干燥。
(4)t1℃时,向三只盛有100g水的烧杯中,分别加入A、B、C三种物质,至不再溶解为止,所得的三种溶液中溶质的质量分数分别为w(A)、w(B)、w(C),则三者的大小关系是 。
甲、乙、丙三种固体物质的溶解度曲线如图所示。回答下列问题: (1)a3℃时,三种物质的溶解度由小到大的顺序是
(2)a1℃时, 和 的溶解度大小相等;
(3)三种物质中,的溶解度受温度的影响最大 。
13溶液与人类的生活息息相关。
(1)下列物质属于溶液的是( ) (填字母)。
A.医用酒精
B.植物油和水的混合物
C.生理盐水
D.面粉和水的混合物
(2)KNO3和NaNO3的溶解度曲线如图所示。①t3℃时,KNO3的溶解度为 g。
②t2℃时,将30gKNO3固体加入到50g水中,充分溶解,所得溶液的质量为 g。
(3)已知固体R是这两种物质中的一种,现用R进行如图所示实验。
①R是 (填化学式)。
②甲、乙、丙中, 是饱和溶液。
③溶质的质量分数:甲 丙(填“>”、“<”或“=”)。
(基础篇)2022-2023学年下学期
初中化学鲁教版九年级
第8单元练习卷
参考答案与试题解析
一.选择题(共10小题)
1.海洋是人类宝贵的自然资源。下列说法错误的是( )
A.海水淡化——利用物质的溶解度不同进行蒸馏分离
B.海水晒盐——利用太阳能和风能蒸发水分得到粗盐
C.海水制镁——利用碱将镁元素富集,提纯后电解
D.海水“制碱”——利用氨碱法以食盐等原料制取纯碱
【解答】解:A、蒸馏是利用物质的沸点不同将混合物分离,故A符合题意;
B、海水晒盐是利用风能,太阳能将海水蒸发得到粗盐,故B不符合题意;
C、海水中氯化镁的浓度很小,所以“海水制镁”实现了镁元素的富集提纯,提纯后将氯化镁电解,故C不符合题意;
D、海水制碱利用氨碱法以食盐等原料制取纯碱,故D不符合题意。
故选:A。
2.海洋是人类巨大的资源宝库,海洋资源开发前景十分广阔。下列说法正确的是( )
A.“可燃冰”是指可燃烧的冰
B.“晒盐”过程中氯化钠的质量增加
C.锰结核中含多种金属元素
D.可利用海水提取的铝盐制取金属铝
【解答】解:A、“可燃冰”的主要成分是甲烷的水合物,不是指可燃烧的冰,故选项说法错误。
B、“晒盐”采用的是蒸发结晶的方法,“晒盐”过程中氯化钠结晶析出,氯化钠的质量减少,故选项说法错误。
C、锰结核是含有锰、铁、铜等金属的矿物,含有多种金属元素,故选项说法正确。
D、海水中铝元素含量很少,不能利用海水提取的铝盐制取金属铝,故选项说法错误。
故选:C。
3.利用如图装置研究铜绿的性质实验(无水硫酸铜遇水变蓝)。下列说法不正确的是( )
A.装置①中固体由绿色变为黑色
B.装置②中固体变蓝,证明有H2O生成
C.装置③中石蕊试液变为蓝色
D.实验结束后先拆除装置③,再熄灭酒精灯,目的是防止溶液倒吸
【解答】解:A、碱式碳酸铜为绿色固体,受热分解生成氧化铜、水和二氧化碳,氧化铜为黑色固体,装置①中固体由绿色变为黑色,故选项说法正确。
B、无水硫酸铜是白色固体,遇水变蓝,装置②中固体变蓝,证明有H2O生成,故选项说法正确。
C、碱式碳酸铜受热分解生成氧化铜、水和二氧化碳,二氧化碳与水反应生成碳酸,碳酸使石蕊试液变为红色,故选项说法错误。
D、实验结束后如果先熄灭酒精灯,试管内压强减小,装置③中的溶液会倒吸,故选项说法正确。
故选:C。
4.下列说法中,不正确的是( )
A.化学反应前后各物质的质量总和不变,是因为反应前后分子和原子的种类保持不变
B.当其它条件一样时,可燃物与氧气接触面积越大燃烧就越剧烈
C.化学反应时不但物质发生改变,还伴随着能量的变化
D.同一溶质的饱和溶液与不饱和溶液在一定条件下可以相互转化
【解答】解:A、化学反应前后各物质的质量总和不变,是因为反应前后原子的种类保持不变,分子的种类发生了改变,故选项说法错误。
B、当其它条件一样时,可燃物与氧气接触面积越大燃烧就越剧烈,故选项说法正确。
C、化学反应时不但物质发生改变,还伴随着能量的变化,故选项说法正确。
D、同一溶质的饱和溶液与不饱和溶液在一定条件下可以相互转化,故选项说法正确。
故选:A。
5.下列物质都是初中化学中常见的物质:①氧气、②氧化铜、③铁、④硫酸、⑤碳酸钠溶液、⑥氢氧化钠溶液、⑦二氧化碳、⑧碳、⑨氯化钡溶液、⑩硝酸钾溶液,十种物质中两两间能发生的复分解反应的个数是( )
A.4 个 B.8个 C.7个 D.5个
【解答】解:氧化铜能与硫酸相互交换成分生成硫酸铜和水;硫酸能与碳酸钠反应生成硫酸钠、水和二氧化碳;硫酸能与氢氧化钠溶液反应生成硫酸钠和水;硫酸能与氯化钡溶液反应生成硫酸钡沉淀和盐酸;碳酸钠能与氯化钡溶液反应生成碳酸钡沉淀和氯化钠;十种物质中两两间能发生的复分解反应的个数是5个。
故选:D。
6.下列各组物质中,能发生复分解反应且反应前后溶液总质量变大的是( )
A.氢氧化铁和稀硫酸
B.锌和硫酸铜溶液
C.氯化钠溶液和碳酸钾溶液
D.硫酸钠溶液和氯化钡溶液
【解答】解:A、氢氧化铁和稀硫酸反应生成硫酸铁和水,属于复分解反应,反应物氧化铁是固体,则反应前后溶液总质量增加,故选项正确。
B、锌和硫酸铜溶液反应生成硫酸锌溶液和铜,属于置换反应,故选项错误。
C、氯化钠溶液和碳酸钾溶液交换成分没有沉淀或气体或水生成,不能发生复分解反应,故选项错误。
D、硫酸钠溶液和氯化钡溶液反应生成硫酸钡沉淀和氯化钠,属于复分解反应,由于生成了沉淀,则溶液的总质量会变小,故选项错误。
故选:A。
7.对于复分解反应:X+2NaOH=2Y+Cu(OH)2↓,下列分析中正确的是( )
A.X不一定是CuCl2 B.Y的化学式一定是NaCl
C.Y可能是H2O D.Y可能是Na2SO4
【解答】解:A、当X是硝酸铜时,硝酸铜和氢氧化钠反应生成氢氧化铜蓝色沉淀和硝酸钠,能反应,正确;
B、由A可知Y可以是硝酸钠,错误;
C、碱不能和其他物质反应生成碱和水,错误;
D、若Y是硫酸钠,根据化学反应前后钠原子个数不变,可得Y前面没有系数2,错误。
故选:A。
8.粗盐提纯的实验中,相关说法正确的是( )
A.为加快溶解速度,溶解时用多些水
B.过滤时用玻璃棒搅拌
C.过滤可以除去粗盐中的所有杂质
D.蒸发至大量固体出现熄灭酒精灯
【解答】解:A、溶解时用多些水,会造成蒸发的时间过长,故选项说法错误。
B、过滤时不能用玻璃棒搅拌,以防止损坏滤纸,故选项说法错误。
C、过滤只能除去粗盐中的不溶性杂质,不能除去粗盐中的所有杂质,故选项说法错误。
D、蒸发时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余水分蒸干,故选项说法正确。
故选:D。
9.下列有关“粗盐中难溶性杂质的去除”实验的说法,正确的是( )
A.称量时托盘天平上可以不垫称量纸
B.溶解时加入的水越多越好
C.过滤时需用玻璃棒不断搅拌
D.蒸发时出现较多固体时,停止加热
【解答】解:A、称量时托盘天平上要垫称量纸,故选项说法错误。
B、溶解时加入的水不是越多越好,水的量太多,最后蒸发时要消耗更多的能源和时间,故选项说法错误。
C、过滤液体时,要注意“一贴、二低、三靠”的原则,玻璃棒的作用是引流,故选项说法错误。
D、蒸发时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余水分蒸干,故选项说法正确。
故选:D。
10.下列关于氯化钠(NaCl)的说法正确的是( )
A.氯化钠是由氯化钠离子构成的
B.中和反应生成的盐一定是氯化钠
C.粗盐提纯的主要步骤是溶解、过滤、蒸发
D.波尔多液是硫酸铜与氯化钠的混合物
【解答】解:A、氯化钠是由钠离子与氯离子构成的,故选项说法错误。
B、氯化钠是盐的一种,盐是一类物质,中和反应生成的盐是指盐这一类物质,故选项说法错误。
C、粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(氯化钠从溶液中分离出来得到食盐)得到精盐的过程,故选项说法正确。
D、农业上可用石灰乳与硫酸铜等配制成具有杀菌作用的波尔多液,故选项说法错误。
故选:C。
二.填空题(共1小题)
11.A、B、C三种物质的溶解度曲线如图所示,回答下列问题:
(1)N点对应的是物质A的 不饱和 (“饱和”或“不饱和”)溶液。
(2)加热C的饱和溶液,出现浑浊现象,其原因是 C溶液随温度升高溶解度下降,升温之后为过饱和溶液,所以会有晶体析出来 。
(3)除去A中少量的B,步骤是:加水溶解,蒸发浓缩, 冷却结晶 ,过滤,洗涤,干燥。
(4)t1℃时,向三只盛有100g水的烧杯中,分别加入A、B、C三种物质,至不再溶解为止,所得的三种溶液中溶质的质量分数分别为w(A)、w(B)、w(C),则三者的大小关系是 w(A)=w(B)>w(C) 。
【解答】解:(1)N点对应的是物质A的不饱和溶液,因为在溶解度曲线的下方,还未达到饱和;
(2)加热C的饱和溶液,出现浑浊现象,其原因是C溶液随温度升高溶解度下降,升温之后为过饱和溶液,所以会有晶体析出来;
(3)除去A中少量的B,因为A的溶解度随温度变化比较大,所以步骤是:加水溶解,蒸发浓缩,冷却结晶,过滤,洗涤,干燥;
(4)t1℃时,向三只盛有100g水的烧杯中,分别加入A、B、C三种物质,至不再溶解为止,因为此温度下A、B两物质溶解度相同且大于C,所以所得的三种溶液中溶质的质量分数大小关系是w(A)=w(B)>w(C)。
故答案为:(1)不饱和;
(2)C溶液随温度升高溶解度下降,升温之后为过饱和溶液,所以会有晶体析出来;
(3)冷却结晶;
(4)w(A)=w(B)>w(C)
12.甲、乙、丙三种固体物质的溶解度曲线如图所示。回答下列问题:
(1)a3℃时,三种物质的溶解度由小到大的顺序是
(2)a1℃时, 和 的溶解度大小相等;
(3)三种物质中,的溶解度受温度的影响最大 。
解:(1)由溶解度曲线可知:a3℃时,三种物质的溶解度由小到大的顺序是乙<丙<甲;
(2)两种曲线的交点是指该温度下,两种物质的溶解度相等,所以a1℃时,甲和乙的溶解度相等;
(3)由溶解度曲线可知:三种物质中,甲的溶解度受温度的影响最大。
故答案为:(1)乙<丙<甲;
(2)甲;乙;
(3)甲.
13溶液与人类的生活息息相关。
(1)下列物质属于溶液的是( AC ) (填字母)。
A.医用酒精
B.植物油和水的混合物
C.生理盐水
D.面粉和水的混合物
(2)KNO3和NaNO3的溶解度曲线如图所示。①t3℃时,KNO3的溶解度为 90g。
②t2℃时,将30gKNO3固体加入到50g水中,充分溶解,所得溶液的质量为75g。
(3)已知固体R是这两种物质中的一种,现用R进行如图所示实验。
①R是 NaNO3(填化学式)。
②甲、乙、丙中,乙、丙是饱和溶液。
③溶质的质量分数: 甲<丙 (填“>”、“<”或“=”)。
解:(1)溶液是一种或几种物质溶解到另一种物质中,形成的均一稳定的混合物;
A、医用酒精属于溶液,符合题意;
B、植物油和水的混合物形成不均一、不稳定的乳浊液,不符合题意;
C、生理盐水是均一、稳定的混合物,属于溶液,符合题意;
D、面粉与水混合形成不均一、不稳定的悬浊液,不符合题意;
(2)①由溶解度曲线可知:t3℃时,KNO3的溶解度为90g;
②t2℃时,KNO3的溶解度是50g,即在该温度下,100g水中最多溶解50g,则50g水中最多溶解25g,t2℃时,将30gKNO3固体加入到50g水中,充分溶解,所得溶液的质量为:25g+50g=75g;
(3)①200g水中蒸发100g水,还剩100g水,该物质的溶液降温到t2℃时,析出晶体,说明该物质的溶解度在t2℃时小于50g,所以该物质是硝酸钠;
②硝酸钠在t1℃时溶解度大于30g小于50g,即在该温度下,100g水中最多溶解30g,则200g水中最多溶解60g多,甲中是200g水溶解了50g溶质,属于不饱和溶液,乙中是t3℃时硝酸钠溶液,且溶解了50g,溶剂是100g,t3℃时硝酸钠的溶解度是50g,即在该温度下,100g水中最多溶解50g,所以乙溶液刚好饱和,丙溶液有晶体不溶解,说明是饱和溶液;
③甲中溶质质量分数:
50g
250g
×100%=20%;由溶解度曲线可知硝酸钠在t2℃时溶解度大于t1℃时溶解度,丙溶液是t2℃时硝酸钠的饱和溶液,溶质质量分数大于t1℃时硝酸钠的饱和溶液的溶质质量分数,而t1℃时硝酸钠的饱和溶液的溶质质量分数一定大于20%,所以溶质的质量分数:甲<丙。
故答案为:(1)AC;
(2)①90;②75;
(3)①NaNO3;②乙、丙;③<。
初中化学鲁教版九年级
第8单元练习卷
一.选择题(共10小题)
1.海洋是人类宝贵的自然资源。下列说法错误的是( )
A.海水淡化——利用物质的溶解度不同进行蒸馏分离
B.海水晒盐——利用太阳能和风能蒸发水分得到粗盐
C.海水制镁——利用碱将镁元素富集,提纯后电解
D.海水“制碱”——利用氨碱法以食盐等原料制取纯碱
2.海洋是人类巨大的资源宝库,海洋资源开发前景十分广阔。下列说法正确的是( )
A.“可燃冰”是指可燃烧的冰
B.“晒盐”过程中氯化钠的质量增加
C.锰结核中含多种金属元素
D.可利用海水提取的铝盐制取金属铝
3.利用如图装置研究铜绿的性质实验(无水硫酸铜遇水变蓝)。下列说法不正确的是( )
A.装置①中固体由绿色变为黑色
B.装置②中固体变蓝,证明有H2O生成
C.装置③中石蕊试液变为蓝色
D.实验结束后先拆除装置③,再熄灭酒精灯,目的是防止溶液倒吸
4.下列说法中,不正确的是( )
A.化学反应前后各物质的质量总和不变,是因为反应前后分子和原子的种类保持不变
B.当其它条件一样时,可燃物与氧气接触面积越大燃烧就越剧烈
C.化学反应时不但物质发生改变,还伴随着能量的变化
D.同一溶质的饱和溶液与不饱和溶液在一定条件下可以相互转化
5.下列物质都是初中化学中常见的物质:①氧气、②氧化铜、③铁、④硫酸、⑤碳酸钠溶液、⑥氢氧化钠溶液、⑦二氧化碳、⑧碳、⑨氯化钡溶液、⑩硝酸钾溶液,十种物质中两两间能发生的复分解反应的个数是( )
A.4 个 B.8个 C.7个 D.5个
6.下列各组物质中,能发生复分解反应且反应前后溶液总质量变大的是( )
A.氢氧化铁和稀硫酸
B.锌和硫酸铜溶液
C.氯化钠溶液和碳酸钾溶液
D.硫酸钠溶液和氯化钡溶液
7.对于复分解反应:X+2NaOH=2Y+Cu(OH)2↓,下列分析中正确的是( )
A.X不一定是CuCl2 B.Y的化学式一定是NaCl
C.Y可能是H2O D.Y可能是Na2SO4
8.粗盐提纯的实验中,相关说法正确的是( )
A.为加快溶解速度,溶解时用多些水
B.过滤时用玻璃棒搅拌
C.过滤可以除去粗盐中的所有杂质
D.蒸发至大量固体出现熄灭酒精灯
9.下列有关“粗盐中难溶性杂质的去除”实验的说法,正确的是( )
A.称量时托盘天平上可以不垫称量纸
B.溶解时加入的水越多越好
C.过滤时需用玻璃棒不断搅拌
D.蒸发时出现较多固体时,停止加热
10.下列关于氯化钠(NaCl)的说法正确的是( )
A.氯化钠是由氯化钠离子构成的
B.中和反应生成的盐一定是氯化钠
C.粗盐提纯的主要步骤是溶解、过滤、蒸发
D.波尔多液是硫酸铜与氯化钠的混合物
二.填空题(共1小题)
11.A、B、C三种物质的溶解度曲线如图所示,回答下列问题:
(1)N点对应的是物质A的 (“饱和”或“不饱和”)溶液。
(2)加热C的饱和溶液,出现浑浊现象,其原因是 。
(3)除去A中少量的B,步骤是:加水溶解,蒸发浓缩, ,过滤,洗涤,干燥。
(4)t1℃时,向三只盛有100g水的烧杯中,分别加入A、B、C三种物质,至不再溶解为止,所得的三种溶液中溶质的质量分数分别为w(A)、w(B)、w(C),则三者的大小关系是 。
甲、乙、丙三种固体物质的溶解度曲线如图所示。回答下列问题: (1)a3℃时,三种物质的溶解度由小到大的顺序是
(2)a1℃时, 和 的溶解度大小相等;
(3)三种物质中,的溶解度受温度的影响最大 。
13溶液与人类的生活息息相关。
(1)下列物质属于溶液的是( ) (填字母)。
A.医用酒精
B.植物油和水的混合物
C.生理盐水
D.面粉和水的混合物
(2)KNO3和NaNO3的溶解度曲线如图所示。①t3℃时,KNO3的溶解度为 g。
②t2℃时,将30gKNO3固体加入到50g水中,充分溶解,所得溶液的质量为 g。
(3)已知固体R是这两种物质中的一种,现用R进行如图所示实验。
①R是 (填化学式)。
②甲、乙、丙中, 是饱和溶液。
③溶质的质量分数:甲 丙(填“>”、“<”或“=”)。
(基础篇)2022-2023学年下学期
初中化学鲁教版九年级
第8单元练习卷
参考答案与试题解析
一.选择题(共10小题)
1.海洋是人类宝贵的自然资源。下列说法错误的是( )
A.海水淡化——利用物质的溶解度不同进行蒸馏分离
B.海水晒盐——利用太阳能和风能蒸发水分得到粗盐
C.海水制镁——利用碱将镁元素富集,提纯后电解
D.海水“制碱”——利用氨碱法以食盐等原料制取纯碱
【解答】解:A、蒸馏是利用物质的沸点不同将混合物分离,故A符合题意;
B、海水晒盐是利用风能,太阳能将海水蒸发得到粗盐,故B不符合题意;
C、海水中氯化镁的浓度很小,所以“海水制镁”实现了镁元素的富集提纯,提纯后将氯化镁电解,故C不符合题意;
D、海水制碱利用氨碱法以食盐等原料制取纯碱,故D不符合题意。
故选:A。
2.海洋是人类巨大的资源宝库,海洋资源开发前景十分广阔。下列说法正确的是( )
A.“可燃冰”是指可燃烧的冰
B.“晒盐”过程中氯化钠的质量增加
C.锰结核中含多种金属元素
D.可利用海水提取的铝盐制取金属铝
【解答】解:A、“可燃冰”的主要成分是甲烷的水合物,不是指可燃烧的冰,故选项说法错误。
B、“晒盐”采用的是蒸发结晶的方法,“晒盐”过程中氯化钠结晶析出,氯化钠的质量减少,故选项说法错误。
C、锰结核是含有锰、铁、铜等金属的矿物,含有多种金属元素,故选项说法正确。
D、海水中铝元素含量很少,不能利用海水提取的铝盐制取金属铝,故选项说法错误。
故选:C。
3.利用如图装置研究铜绿的性质实验(无水硫酸铜遇水变蓝)。下列说法不正确的是( )
A.装置①中固体由绿色变为黑色
B.装置②中固体变蓝,证明有H2O生成
C.装置③中石蕊试液变为蓝色
D.实验结束后先拆除装置③,再熄灭酒精灯,目的是防止溶液倒吸
【解答】解:A、碱式碳酸铜为绿色固体,受热分解生成氧化铜、水和二氧化碳,氧化铜为黑色固体,装置①中固体由绿色变为黑色,故选项说法正确。
B、无水硫酸铜是白色固体,遇水变蓝,装置②中固体变蓝,证明有H2O生成,故选项说法正确。
C、碱式碳酸铜受热分解生成氧化铜、水和二氧化碳,二氧化碳与水反应生成碳酸,碳酸使石蕊试液变为红色,故选项说法错误。
D、实验结束后如果先熄灭酒精灯,试管内压强减小,装置③中的溶液会倒吸,故选项说法正确。
故选:C。
4.下列说法中,不正确的是( )
A.化学反应前后各物质的质量总和不变,是因为反应前后分子和原子的种类保持不变
B.当其它条件一样时,可燃物与氧气接触面积越大燃烧就越剧烈
C.化学反应时不但物质发生改变,还伴随着能量的变化
D.同一溶质的饱和溶液与不饱和溶液在一定条件下可以相互转化
【解答】解:A、化学反应前后各物质的质量总和不变,是因为反应前后原子的种类保持不变,分子的种类发生了改变,故选项说法错误。
B、当其它条件一样时,可燃物与氧气接触面积越大燃烧就越剧烈,故选项说法正确。
C、化学反应时不但物质发生改变,还伴随着能量的变化,故选项说法正确。
D、同一溶质的饱和溶液与不饱和溶液在一定条件下可以相互转化,故选项说法正确。
故选:A。
5.下列物质都是初中化学中常见的物质:①氧气、②氧化铜、③铁、④硫酸、⑤碳酸钠溶液、⑥氢氧化钠溶液、⑦二氧化碳、⑧碳、⑨氯化钡溶液、⑩硝酸钾溶液,十种物质中两两间能发生的复分解反应的个数是( )
A.4 个 B.8个 C.7个 D.5个
【解答】解:氧化铜能与硫酸相互交换成分生成硫酸铜和水;硫酸能与碳酸钠反应生成硫酸钠、水和二氧化碳;硫酸能与氢氧化钠溶液反应生成硫酸钠和水;硫酸能与氯化钡溶液反应生成硫酸钡沉淀和盐酸;碳酸钠能与氯化钡溶液反应生成碳酸钡沉淀和氯化钠;十种物质中两两间能发生的复分解反应的个数是5个。
故选:D。
6.下列各组物质中,能发生复分解反应且反应前后溶液总质量变大的是( )
A.氢氧化铁和稀硫酸
B.锌和硫酸铜溶液
C.氯化钠溶液和碳酸钾溶液
D.硫酸钠溶液和氯化钡溶液
【解答】解:A、氢氧化铁和稀硫酸反应生成硫酸铁和水,属于复分解反应,反应物氧化铁是固体,则反应前后溶液总质量增加,故选项正确。
B、锌和硫酸铜溶液反应生成硫酸锌溶液和铜,属于置换反应,故选项错误。
C、氯化钠溶液和碳酸钾溶液交换成分没有沉淀或气体或水生成,不能发生复分解反应,故选项错误。
D、硫酸钠溶液和氯化钡溶液反应生成硫酸钡沉淀和氯化钠,属于复分解反应,由于生成了沉淀,则溶液的总质量会变小,故选项错误。
故选:A。
7.对于复分解反应:X+2NaOH=2Y+Cu(OH)2↓,下列分析中正确的是( )
A.X不一定是CuCl2 B.Y的化学式一定是NaCl
C.Y可能是H2O D.Y可能是Na2SO4
【解答】解:A、当X是硝酸铜时,硝酸铜和氢氧化钠反应生成氢氧化铜蓝色沉淀和硝酸钠,能反应,正确;
B、由A可知Y可以是硝酸钠,错误;
C、碱不能和其他物质反应生成碱和水,错误;
D、若Y是硫酸钠,根据化学反应前后钠原子个数不变,可得Y前面没有系数2,错误。
故选:A。
8.粗盐提纯的实验中,相关说法正确的是( )
A.为加快溶解速度,溶解时用多些水
B.过滤时用玻璃棒搅拌
C.过滤可以除去粗盐中的所有杂质
D.蒸发至大量固体出现熄灭酒精灯
【解答】解:A、溶解时用多些水,会造成蒸发的时间过长,故选项说法错误。
B、过滤时不能用玻璃棒搅拌,以防止损坏滤纸,故选项说法错误。
C、过滤只能除去粗盐中的不溶性杂质,不能除去粗盐中的所有杂质,故选项说法错误。
D、蒸发时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余水分蒸干,故选项说法正确。
故选:D。
9.下列有关“粗盐中难溶性杂质的去除”实验的说法,正确的是( )
A.称量时托盘天平上可以不垫称量纸
B.溶解时加入的水越多越好
C.过滤时需用玻璃棒不断搅拌
D.蒸发时出现较多固体时,停止加热
【解答】解:A、称量时托盘天平上要垫称量纸,故选项说法错误。
B、溶解时加入的水不是越多越好,水的量太多,最后蒸发时要消耗更多的能源和时间,故选项说法错误。
C、过滤液体时,要注意“一贴、二低、三靠”的原则,玻璃棒的作用是引流,故选项说法错误。
D、蒸发时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余水分蒸干,故选项说法正确。
故选:D。
10.下列关于氯化钠(NaCl)的说法正确的是( )
A.氯化钠是由氯化钠离子构成的
B.中和反应生成的盐一定是氯化钠
C.粗盐提纯的主要步骤是溶解、过滤、蒸发
D.波尔多液是硫酸铜与氯化钠的混合物
【解答】解:A、氯化钠是由钠离子与氯离子构成的,故选项说法错误。
B、氯化钠是盐的一种,盐是一类物质,中和反应生成的盐是指盐这一类物质,故选项说法错误。
C、粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(氯化钠从溶液中分离出来得到食盐)得到精盐的过程,故选项说法正确。
D、农业上可用石灰乳与硫酸铜等配制成具有杀菌作用的波尔多液,故选项说法错误。
故选:C。
二.填空题(共1小题)
11.A、B、C三种物质的溶解度曲线如图所示,回答下列问题:
(1)N点对应的是物质A的 不饱和 (“饱和”或“不饱和”)溶液。
(2)加热C的饱和溶液,出现浑浊现象,其原因是 C溶液随温度升高溶解度下降,升温之后为过饱和溶液,所以会有晶体析出来 。
(3)除去A中少量的B,步骤是:加水溶解,蒸发浓缩, 冷却结晶 ,过滤,洗涤,干燥。
(4)t1℃时,向三只盛有100g水的烧杯中,分别加入A、B、C三种物质,至不再溶解为止,所得的三种溶液中溶质的质量分数分别为w(A)、w(B)、w(C),则三者的大小关系是 w(A)=w(B)>w(C) 。
【解答】解:(1)N点对应的是物质A的不饱和溶液,因为在溶解度曲线的下方,还未达到饱和;
(2)加热C的饱和溶液,出现浑浊现象,其原因是C溶液随温度升高溶解度下降,升温之后为过饱和溶液,所以会有晶体析出来;
(3)除去A中少量的B,因为A的溶解度随温度变化比较大,所以步骤是:加水溶解,蒸发浓缩,冷却结晶,过滤,洗涤,干燥;
(4)t1℃时,向三只盛有100g水的烧杯中,分别加入A、B、C三种物质,至不再溶解为止,因为此温度下A、B两物质溶解度相同且大于C,所以所得的三种溶液中溶质的质量分数大小关系是w(A)=w(B)>w(C)。
故答案为:(1)不饱和;
(2)C溶液随温度升高溶解度下降,升温之后为过饱和溶液,所以会有晶体析出来;
(3)冷却结晶;
(4)w(A)=w(B)>w(C)
12.甲、乙、丙三种固体物质的溶解度曲线如图所示。回答下列问题:
(1)a3℃时,三种物质的溶解度由小到大的顺序是
(2)a1℃时, 和 的溶解度大小相等;
(3)三种物质中,的溶解度受温度的影响最大 。
解:(1)由溶解度曲线可知:a3℃时,三种物质的溶解度由小到大的顺序是乙<丙<甲;
(2)两种曲线的交点是指该温度下,两种物质的溶解度相等,所以a1℃时,甲和乙的溶解度相等;
(3)由溶解度曲线可知:三种物质中,甲的溶解度受温度的影响最大。
故答案为:(1)乙<丙<甲;
(2)甲;乙;
(3)甲.
13溶液与人类的生活息息相关。
(1)下列物质属于溶液的是( AC ) (填字母)。
A.医用酒精
B.植物油和水的混合物
C.生理盐水
D.面粉和水的混合物
(2)KNO3和NaNO3的溶解度曲线如图所示。①t3℃时,KNO3的溶解度为 90g。
②t2℃时,将30gKNO3固体加入到50g水中,充分溶解,所得溶液的质量为75g。
(3)已知固体R是这两种物质中的一种,现用R进行如图所示实验。
①R是 NaNO3(填化学式)。
②甲、乙、丙中,乙、丙是饱和溶液。
③溶质的质量分数: 甲<丙 (填“>”、“<”或“=”)。
解:(1)溶液是一种或几种物质溶解到另一种物质中,形成的均一稳定的混合物;
A、医用酒精属于溶液,符合题意;
B、植物油和水的混合物形成不均一、不稳定的乳浊液,不符合题意;
C、生理盐水是均一、稳定的混合物,属于溶液,符合题意;
D、面粉与水混合形成不均一、不稳定的悬浊液,不符合题意;
(2)①由溶解度曲线可知:t3℃时,KNO3的溶解度为90g;
②t2℃时,KNO3的溶解度是50g,即在该温度下,100g水中最多溶解50g,则50g水中最多溶解25g,t2℃时,将30gKNO3固体加入到50g水中,充分溶解,所得溶液的质量为:25g+50g=75g;
(3)①200g水中蒸发100g水,还剩100g水,该物质的溶液降温到t2℃时,析出晶体,说明该物质的溶解度在t2℃时小于50g,所以该物质是硝酸钠;
②硝酸钠在t1℃时溶解度大于30g小于50g,即在该温度下,100g水中最多溶解30g,则200g水中最多溶解60g多,甲中是200g水溶解了50g溶质,属于不饱和溶液,乙中是t3℃时硝酸钠溶液,且溶解了50g,溶剂是100g,t3℃时硝酸钠的溶解度是50g,即在该温度下,100g水中最多溶解50g,所以乙溶液刚好饱和,丙溶液有晶体不溶解,说明是饱和溶液;
③甲中溶质质量分数:
50g
250g
×100%=20%;由溶解度曲线可知硝酸钠在t2℃时溶解度大于t1℃时溶解度,丙溶液是t2℃时硝酸钠的饱和溶液,溶质质量分数大于t1℃时硝酸钠的饱和溶液的溶质质量分数,而t1℃时硝酸钠的饱和溶液的溶质质量分数一定大于20%,所以溶质的质量分数:甲<丙。
故答案为:(1)AC;
(2)①90;②75;
(3)①NaNO3;②乙、丙;③<。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
