天津大学附属中学2022-2023学年高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 天津大学附属中学2022-2023学年高二上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 295.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-22 14:14:59 | ||
图片预览




文档简介
天津大学附属中学2022-2023学年高二上学期期末考试
化学试题
第Ⅰ卷
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1. 下列说法正确的是
A. 在所有元素中,氟的第一电离能最大
B. 处于最低能量的原子叫做基态原子
C. 原子半径最小的氢元素的电负性最大
D. 最外层电子数为8的都是稀有气体元素的原子
2. 科学家通过观察金星的酸性云层,分析出金星存在磷化氢气体,从而推测金星可能存在生命的迹象。下列关于P元素的说法中,不正确的是
A. 第一电离能:PC. 非金属性:P3. 对碳原子核外两个未成对电子的描述,正确的是( )
A. 电子云形状不同 B. 自旋方向相同
C. 能量不同 D. 在同一轨道
4. 下列事实能用勒夏特列原理解释的是
A. 用排饱和食盐水的方法收集氯气
B. 500℃左右比室温更有利于工业合成NH3的反应
C. 加入催化剂有利于SO2的氧化反应
D. 对2HI(g)H2(g) + I2(g),减小容器体积,气体颜色变深
5. 滴有酚酞试液的下列溶液,按下列操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量水
6. A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:
①原子半径A<B;②离子半径A>B;③原子序数A>B;④原子最外层电子数A离能大于B的第一电离能。其中正确的组合是( )
A. ③⑤ B. ①②⑦ C. ③④⑥ D. ③④⑤⑥⑦
7. 用石墨作电极,电解1mol/L的下列物质的溶液,溶液的pH减小的是
A. NaCl B. NaOH C. D.
8. 向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法不正确的是( )
A. 反应(aq)+H+(aq)═CO2(g)+H2O(l) △H>0
B. (aq)+2H+(aq)═CO2(g)+H2O(l) △H=△H1+△H2+△H3
C. △H1>△H2,△H2<△H3
D. H2CO3(aq)═CO2(g)+H2O(l),若使用催化剂,则△H3不变
9. 已知:2H2(g) +O2(g)=2H2O(g) ΔH =-483.6 kJ mol 1
下列说法不正确的是
A. 该反应可作为氢氧燃料电池的反应原理
B. 破坏1 mol H-O键需要的能量是463.4 kJ
C. H2的燃烧热ΔH<-241.8 kJ·mol 1
D. H2(g)中的H-H键比H2O(g)中的H-O键牢固
10. 反应 (a>0),一定温度下,在恒容的密闭容器中,加入1molX和2molY发生反应,下列说法正确的是
A. 充分反应后,放出的热量为akJ
B. 当Y与W的物质的量浓度之比为1∶1时,表明该反应一定已达到平衡状态
C. 当容器内气体压强不再改变时,表明该反应一定已达到平衡
D. 当达到平衡状态时,向容器中加入X,平衡不移动
11. 室温时纯水中存在电离平衡:H2O H++ OH-。下列叙述正确的是
A. 升高温度,水的电离程度增大,c(H+)增大,pH<7,溶液显酸性
B. 向水中加入少量氨水,平衡逆向移动,抑制水的电离,c(OH-)降低
C. 向水中加入少量硫酸,c(H+)增大,由水电离出的 c(H+)>1×10-7 mol/L
D. 向水中加入少量 NH4Cl 固体,结合水电离出的 OH-,由水电离出的c(H+)>1×10-7 mol/L
12. 某同学研究浓度对化学平衡影响,下列说法正确的是
待试管b中颜色不变后与试管a比较,溶液颜色变浅。滴加浓硫酸,试管c温度略有升高,溶液颜色与试管a相比变深。
已知:(橙色)(黄色)
A. 该反应为吸热反应,但不是氧化还原反应
B. 待试管b中溶液颜色不变的目的是使完全反应
C. 试管c中现象说明影响平衡的主要因素是温度
D. 该实验能证明减小生成物浓度平衡正向移动
13. 下列有关电池的说法不正确的是
A. 外加电流法是把被保护的钢铁设备作为阴极保护起来
B. 手机上用的锂离子电池属于二次电池
C. 甲醇燃料电池可以把化学能转化为电能
D. 铅酸蓄电池中,是负极
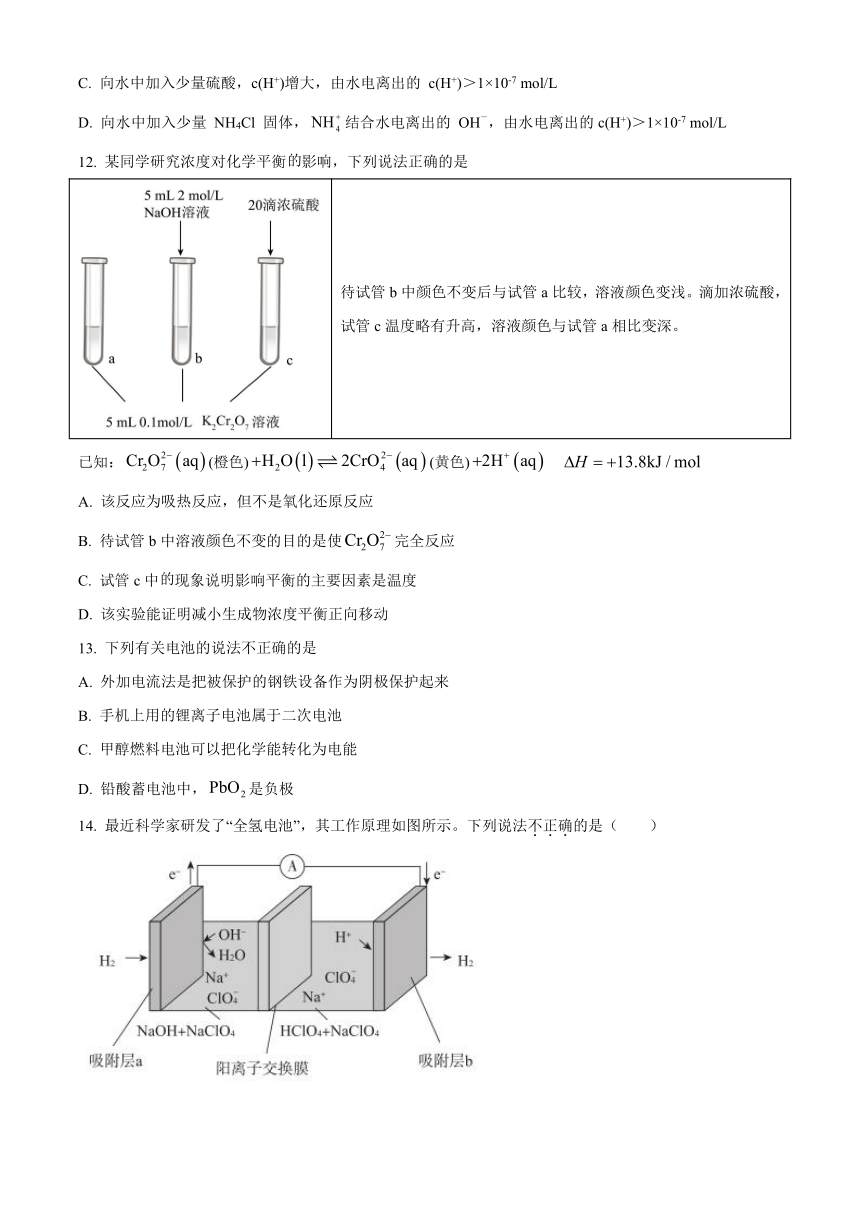
14. 最近科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )
A. 吸附层b为电池的正极
B. “全氢电池”的总反应为:H++OH-=H2O
C. NaClO4的作用是传导离子并参与电极反应
D. Na+在装置中从左侧透过阳离子交换膜向右侧移动
15. 25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LCH3COOH溶液,溶液的pH随加入NaOH溶液体积的变化如图所示。下列说法不正确的是
A. 0.1mol/LCH3COOH溶液中,由水电离出的c(H+)=1×10-11mol/L
B. V1<20
C. 二者等体积混合时,c(Na+)D. M点溶液中粒子浓度由大到小的顺序为c(CH3COOH)>c(Na+)>c(H+)>c(OH-)
第Ⅱ卷 (非选择题,共55分)
二、填空题
16. 按照要求回答下列问题:
(1)已知:①
②
请写出C与反应生成CO的热化学方程式:_______。
(2)已知 ,该反应的熵如何变化?_______(填“增大”、“减小”或“不变”),该反应在什么温度下可以自发进行?_______(填“低温”、“高温”或“任何温度”)。
(3)盐碱地(含较多、NaCl)不利于植物生长,盐碱地产生碱性的原因:_______(用离子方程式表示);农业上用石膏降低其碱性的反应原理:_______(用化学方程式表示)。
(4)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m_______n(填“>”、“<”或“=”)。
17. 氢能是一种极具发展潜力的清洁能源,以下反应是目前大规模制取氢气的重要方法之一
回答下列问题:
(1)欲提高CO的平衡转化率,理论上可以采取的措施为_______。
a.通入过量CO b.升高温度 c.加入催化剂 d.通入过量水蒸气
(2)800℃时,该反应的平衡常数,在容积为1L的密闭容器中进行反应,测得某一时刻混合物中CO、、、的物质的量分别为1mol、3mol、1mol、1mol。
①写出该反应的平衡常数表达式_______。
②该时刻反应的进行方向为_______(填“正向进行”、“逆向进行”或“已达平衡”)。
(3)830℃时,该反应的平衡常数,在容积为1L的密闭容器中,将2molCO与2mol混合加热到830℃。反应达平衡时CO的转化率为_______。
(4)下图表示不同温度条件下,CO平衡转化率随着的变化趋势。判断、的大小关系:_______,判断理由为_______。
(5)以乙醇为燃料的乙醇燃料电池,碱性电解质溶液时,负极反应式为_______。
18. 化学是一门以实验为基础的学科。回答下列问题:
Ⅰ.中和反应反应热的测定。
测定50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液中和反应时放出的热量。
(1)采用稍过量的NaOH溶液的原因是_______。
(2)若两种溶液的密度均为,反应后生成溶液的比热容,反应过程中测得体系温度升高4℃,则该反应放出_______kJ热量。
Ⅱ.简易原电池反应。
(3)培养皿内装有含NaCl饱和溶液的琼脂,再滴入5~6滴酚酞溶液和溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生蓝色的_______(填化学式)沉淀;铜丝周围的现象是_______,发生的电极反应式为_______。
Ⅲ.已知某烧碱样品中含有NaCl杂质,为测定样品中NaOH的质量分数,进行如下步骤实验:
①称量1.0g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.10mol/L的盐酸标准溶液滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 待测液体积(mL) 所消耗盐酸标准液的体积(mL)
滴定前 滴定后
1 25.00 0.50 2160
2 25.00 6.00 27.00
3 25.00 1.10 22.00
请回答:
(4)观察滴定到终点时溶液颜色的变化为_______。
(5)烧碱样品的纯度为_______。
(6)若出现下列情况,测定结果偏低的是_______。
a.滴定前用待测液冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.盛装标准液的滴定管水洗后未用标准液再润洗
19. 在25℃时对氨水进行如下操作。回答下列问题:
(1)向0.1mol/L 20mL氨水中逐滴加入0.1mol/L VmL盐酸
①若使氨水恰好被中和,则所得溶液的pH_______7(填“>”、“<”或“=”),用离子方程式表示其原因:_______。
②若所得溶液pH=7,则此时加入盐酸的体积V_______20mL(填“>”、“<”或“=”),溶液中、、、的大小关系为_______。
③若加入盐酸的体积,则此时溶液中_______mol/L。
(2)铜元素的价电子轨道表示式为_______,向溶液中滴加氨水产生蓝色沉淀,若所得溶液,已知,则溶液中_______mol/L。
天津大学附属中学2022-2023学年高二上学期期末考试
化学试题 答案
第Ⅰ卷
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意)
【1题答案】
【答案】B
【2题答案】
【答案】A
【3题答案】
【答案】B
【4题答案】
【答案】A
【5题答案】
【答案】B
【6题答案】
【答案】C
【7题答案】
【答案】D
【8题答案】
【答案】C
【9题答案】
【答案】D
【10题答案】
【答案】D
【11题答案】
【答案】D
【12题答案】
【答案】A
【13题答案】
【答案】D
【14题答案】
【答案】C
【15题答案】
【答案】D
第Ⅱ卷 (非选择题,共55分)
二、填空题
【16题答案】
【答案】(1)
(2) ①. 减小 ②. 低温
(3) ①. 、 ②.
(4)<
【17题答案】
【答案】(1)d (2) ①. ②. 逆向进行
(3)50% (4) ①. > ②. 该反应是放热反应,升高温度,平衡逆向移动,CO的转化率减小
(5)C2H6O-12e-+16OH-═2CO+11H2O
【18题答案】
【答案】(1)确保定量的HCl反应完全
(2)1.672 (3) ①. Fe3[Fe(CN)6]2 ②. 变红 ③. O2+4e-+2H2O=4OH-
(4)锥形瓶中溶液由浅红色变为无色,且半分钟内不恢复原色
(5)84% (6)b
【19题答案】
【答案】(1) ①. < ②. +H2ONH3·H2O+H+ ③. < ④. c(Cl-)= c()>c(H+)=c(OH-) ⑤. 0.1
(2) ①. ②. 2.2×10-12
化学试题
第Ⅰ卷
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1. 下列说法正确的是
A. 在所有元素中,氟的第一电离能最大
B. 处于最低能量的原子叫做基态原子
C. 原子半径最小的氢元素的电负性最大
D. 最外层电子数为8的都是稀有气体元素的原子
2. 科学家通过观察金星的酸性云层,分析出金星存在磷化氢气体,从而推测金星可能存在生命的迹象。下列关于P元素的说法中,不正确的是
A. 第一电离能:P
A. 电子云形状不同 B. 自旋方向相同
C. 能量不同 D. 在同一轨道
4. 下列事实能用勒夏特列原理解释的是
A. 用排饱和食盐水的方法收集氯气
B. 500℃左右比室温更有利于工业合成NH3的反应
C. 加入催化剂有利于SO2的氧化反应
D. 对2HI(g)H2(g) + I2(g),减小容器体积,气体颜色变深
5. 滴有酚酞试液的下列溶液,按下列操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量水
6. A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:
①原子半径A<B;②离子半径A>B;③原子序数A>B;④原子最外层电子数A
A. ③⑤ B. ①②⑦ C. ③④⑥ D. ③④⑤⑥⑦
7. 用石墨作电极,电解1mol/L的下列物质的溶液,溶液的pH减小的是
A. NaCl B. NaOH C. D.
8. 向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法不正确的是( )
A. 反应(aq)+H+(aq)═CO2(g)+H2O(l) △H>0
B. (aq)+2H+(aq)═CO2(g)+H2O(l) △H=△H1+△H2+△H3
C. △H1>△H2,△H2<△H3
D. H2CO3(aq)═CO2(g)+H2O(l),若使用催化剂,则△H3不变
9. 已知:2H2(g) +O2(g)=2H2O(g) ΔH =-483.6 kJ mol 1
下列说法不正确的是
A. 该反应可作为氢氧燃料电池的反应原理
B. 破坏1 mol H-O键需要的能量是463.4 kJ
C. H2的燃烧热ΔH<-241.8 kJ·mol 1
D. H2(g)中的H-H键比H2O(g)中的H-O键牢固
10. 反应 (a>0),一定温度下,在恒容的密闭容器中,加入1molX和2molY发生反应,下列说法正确的是
A. 充分反应后,放出的热量为akJ
B. 当Y与W的物质的量浓度之比为1∶1时,表明该反应一定已达到平衡状态
C. 当容器内气体压强不再改变时,表明该反应一定已达到平衡
D. 当达到平衡状态时,向容器中加入X,平衡不移动
11. 室温时纯水中存在电离平衡:H2O H++ OH-。下列叙述正确的是
A. 升高温度,水的电离程度增大,c(H+)增大,pH<7,溶液显酸性
B. 向水中加入少量氨水,平衡逆向移动,抑制水的电离,c(OH-)降低
C. 向水中加入少量硫酸,c(H+)增大,由水电离出的 c(H+)>1×10-7 mol/L
D. 向水中加入少量 NH4Cl 固体,结合水电离出的 OH-,由水电离出的c(H+)>1×10-7 mol/L
12. 某同学研究浓度对化学平衡影响,下列说法正确的是
待试管b中颜色不变后与试管a比较,溶液颜色变浅。滴加浓硫酸,试管c温度略有升高,溶液颜色与试管a相比变深。
已知:(橙色)(黄色)
A. 该反应为吸热反应,但不是氧化还原反应
B. 待试管b中溶液颜色不变的目的是使完全反应
C. 试管c中现象说明影响平衡的主要因素是温度
D. 该实验能证明减小生成物浓度平衡正向移动
13. 下列有关电池的说法不正确的是
A. 外加电流法是把被保护的钢铁设备作为阴极保护起来
B. 手机上用的锂离子电池属于二次电池
C. 甲醇燃料电池可以把化学能转化为电能
D. 铅酸蓄电池中,是负极
14. 最近科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )
A. 吸附层b为电池的正极
B. “全氢电池”的总反应为:H++OH-=H2O
C. NaClO4的作用是传导离子并参与电极反应
D. Na+在装置中从左侧透过阳离子交换膜向右侧移动
15. 25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LCH3COOH溶液,溶液的pH随加入NaOH溶液体积的变化如图所示。下列说法不正确的是
A. 0.1mol/LCH3COOH溶液中,由水电离出的c(H+)=1×10-11mol/L
B. V1<20
C. 二者等体积混合时,c(Na+)
第Ⅱ卷 (非选择题,共55分)
二、填空题
16. 按照要求回答下列问题:
(1)已知:①
②
请写出C与反应生成CO的热化学方程式:_______。
(2)已知 ,该反应的熵如何变化?_______(填“增大”、“减小”或“不变”),该反应在什么温度下可以自发进行?_______(填“低温”、“高温”或“任何温度”)。
(3)盐碱地(含较多、NaCl)不利于植物生长,盐碱地产生碱性的原因:_______(用离子方程式表示);农业上用石膏降低其碱性的反应原理:_______(用化学方程式表示)。
(4)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m_______n(填“>”、“<”或“=”)。
17. 氢能是一种极具发展潜力的清洁能源,以下反应是目前大规模制取氢气的重要方法之一
回答下列问题:
(1)欲提高CO的平衡转化率,理论上可以采取的措施为_______。
a.通入过量CO b.升高温度 c.加入催化剂 d.通入过量水蒸气
(2)800℃时,该反应的平衡常数,在容积为1L的密闭容器中进行反应,测得某一时刻混合物中CO、、、的物质的量分别为1mol、3mol、1mol、1mol。
①写出该反应的平衡常数表达式_______。
②该时刻反应的进行方向为_______(填“正向进行”、“逆向进行”或“已达平衡”)。
(3)830℃时,该反应的平衡常数,在容积为1L的密闭容器中,将2molCO与2mol混合加热到830℃。反应达平衡时CO的转化率为_______。
(4)下图表示不同温度条件下,CO平衡转化率随着的变化趋势。判断、的大小关系:_______,判断理由为_______。
(5)以乙醇为燃料的乙醇燃料电池,碱性电解质溶液时,负极反应式为_______。
18. 化学是一门以实验为基础的学科。回答下列问题:
Ⅰ.中和反应反应热的测定。
测定50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液中和反应时放出的热量。
(1)采用稍过量的NaOH溶液的原因是_______。
(2)若两种溶液的密度均为,反应后生成溶液的比热容,反应过程中测得体系温度升高4℃,则该反应放出_______kJ热量。
Ⅱ.简易原电池反应。
(3)培养皿内装有含NaCl饱和溶液的琼脂,再滴入5~6滴酚酞溶液和溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生蓝色的_______(填化学式)沉淀;铜丝周围的现象是_______,发生的电极反应式为_______。
Ⅲ.已知某烧碱样品中含有NaCl杂质,为测定样品中NaOH的质量分数,进行如下步骤实验:
①称量1.0g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.10mol/L的盐酸标准溶液滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 待测液体积(mL) 所消耗盐酸标准液的体积(mL)
滴定前 滴定后
1 25.00 0.50 2160
2 25.00 6.00 27.00
3 25.00 1.10 22.00
请回答:
(4)观察滴定到终点时溶液颜色的变化为_______。
(5)烧碱样品的纯度为_______。
(6)若出现下列情况,测定结果偏低的是_______。
a.滴定前用待测液冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.盛装标准液的滴定管水洗后未用标准液再润洗
19. 在25℃时对氨水进行如下操作。回答下列问题:
(1)向0.1mol/L 20mL氨水中逐滴加入0.1mol/L VmL盐酸
①若使氨水恰好被中和,则所得溶液的pH_______7(填“>”、“<”或“=”),用离子方程式表示其原因:_______。
②若所得溶液pH=7,则此时加入盐酸的体积V_______20mL(填“>”、“<”或“=”),溶液中、、、的大小关系为_______。
③若加入盐酸的体积,则此时溶液中_______mol/L。
(2)铜元素的价电子轨道表示式为_______,向溶液中滴加氨水产生蓝色沉淀,若所得溶液,已知,则溶液中_______mol/L。
天津大学附属中学2022-2023学年高二上学期期末考试
化学试题 答案
第Ⅰ卷
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意)
【1题答案】
【答案】B
【2题答案】
【答案】A
【3题答案】
【答案】B
【4题答案】
【答案】A
【5题答案】
【答案】B
【6题答案】
【答案】C
【7题答案】
【答案】D
【8题答案】
【答案】C
【9题答案】
【答案】D
【10题答案】
【答案】D
【11题答案】
【答案】D
【12题答案】
【答案】A
【13题答案】
【答案】D
【14题答案】
【答案】C
【15题答案】
【答案】D
第Ⅱ卷 (非选择题,共55分)
二、填空题
【16题答案】
【答案】(1)
(2) ①. 减小 ②. 低温
(3) ①. 、 ②.
(4)<
【17题答案】
【答案】(1)d (2) ①. ②. 逆向进行
(3)50% (4) ①. > ②. 该反应是放热反应,升高温度,平衡逆向移动,CO的转化率减小
(5)C2H6O-12e-+16OH-═2CO+11H2O
【18题答案】
【答案】(1)确保定量的HCl反应完全
(2)1.672 (3) ①. Fe3[Fe(CN)6]2 ②. 变红 ③. O2+4e-+2H2O=4OH-
(4)锥形瓶中溶液由浅红色变为无色,且半分钟内不恢复原色
(5)84% (6)b
【19题答案】
【答案】(1) ①. < ②. +H2ONH3·H2O+H+ ③. < ④. c(Cl-)= c()>c(H+)=c(OH-) ⑤. 0.1
(2) ①. ②. 2.2×10-12
同课章节目录
