第三单元 课题3 元素(含解析)—2022-2023学年九年级化学上册最新命题导向假期培优
文档属性
| 名称 | 第三单元 课题3 元素(含解析)—2022-2023学年九年级化学上册最新命题导向假期培优 |  | |
| 格式 | zip | ||
| 文件大小 | 118.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-24 20:02:02 | ||
图片预览



文档简介
第三单元 物质构成的奥秘
课题3 元素
一、单选题
1.“化学”一词最早出于清朝的《化学鉴原》一书,该书把地壳中含量第二的元素翻译成“矽(xi)”,如今把这种“矽”元素命名为 ( )
A.硅-Si B.硒-Se C.铝-Al D.锡-Sn
2.天然气的主要成分是甲烷,甲烷由碳、氢两种元素组成,这两种元素的本质区别是 ( )
A.质子数不同 B.电子数不同 C.中子数不同 D.最外层电子数不同
3.钯是航天、航空等高科技领域的关键材料。钯元素相关信息如图所示,下列有关说法正确的是 ( )
A.属于非金属元素 B.钯原子的中子数为46
C.“2Pd”表示2个钯原子 D.“钯原子与Pd3+的质量几乎一样”这句话是错误的
4.图示法是学习化学的重要方法,下列下列有关图示正确的是 ( )
A. B.化合反应与分解反应关
C.地壳中元素含量 D.构成物质的微粒
5.如图是一种钟表式元素周期表模型,下列有关说法中错误的是 ( )
A.7:35对应的元素是空气中含量最多的元素
B.12∶00对应的元素的离子结构示意图为
C.2∶10和10∶50对应元素组成的物质不与任何物质发生反应
D.4∶20、5∶25和6∶30对应的元素的原子序数依次增加
6.如图①是铬元素在元素周期表中的信息,②、③为两种原子的结构示意图,④为元素周期表中的部分信息,下列说法正确的是 ( )
A.铬原子的核外电子数为52
B.图②是氮原子的结构示意图,它与图④中S原子的电子层数相同
C.图③中x=11,该元素与图④中氯元素组成的化合物是由离子构成的
D.图④中甲、乙对应的原子的最外层电子数相同,均为8
7.如图为碘元素在元素周期表的部分信息及其原子结构示意图。下列说法错误的是 ( )
A.碘属于非金属元素 B.碘原子的质子数为53
C.碘元素位于元素周期表中的第四周期 D.碘原子在化学反应中易获得电子
8.硬铝常用于制造火箭、飞机的外壳,铝元素的相关信息和铝原子的结构示意图如图所示,下列说法正确的是 ( )
A.铝的元素符号为AL B.铝原子的中子数为26.98
C.铝原子在反应中易失去电子 D.铝是地壳中含量最多的元素
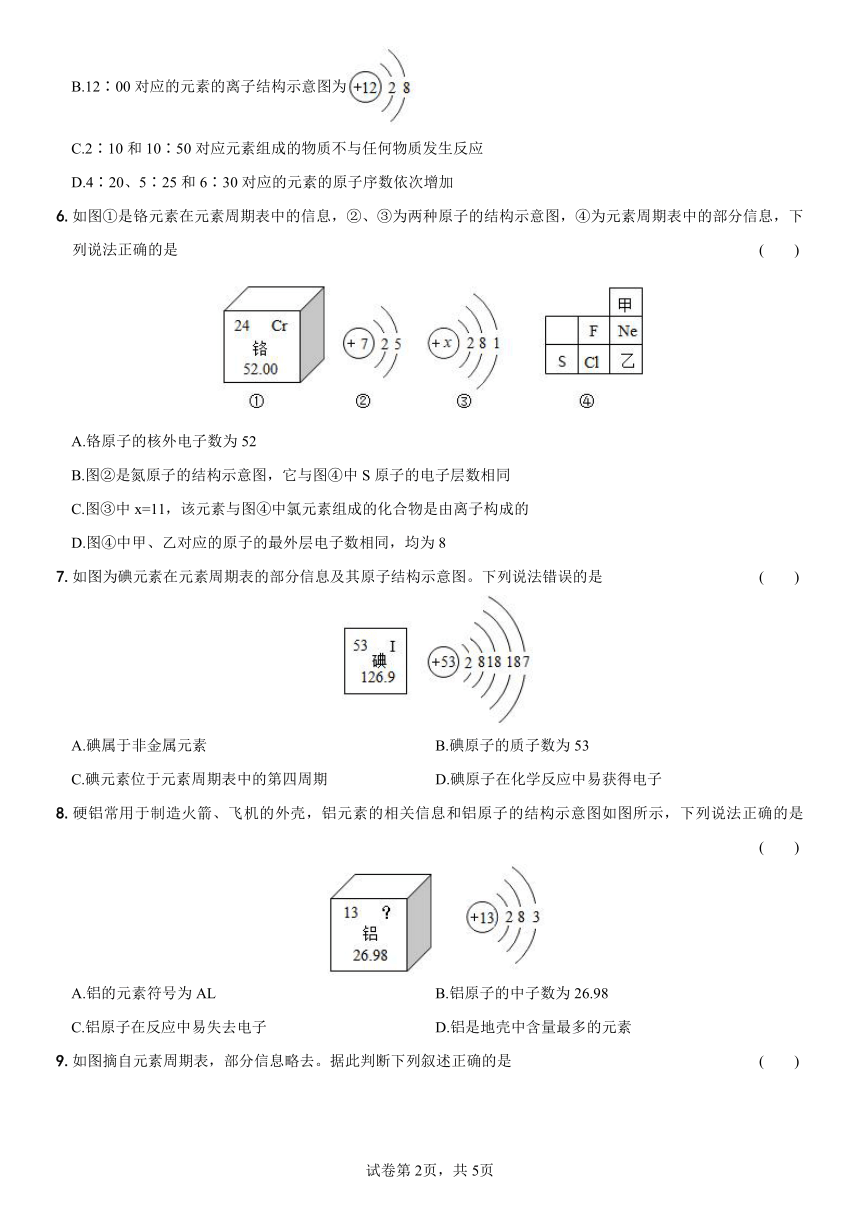
9.如图摘自元素周期表,部分信息略去。据此判断下列叙述正确的是 ( )
A.P原子质量是30.97 B.Cl表示一个氟原子
C.三种元素都是金属元素 D.三种元素在周期表中属于同一周期
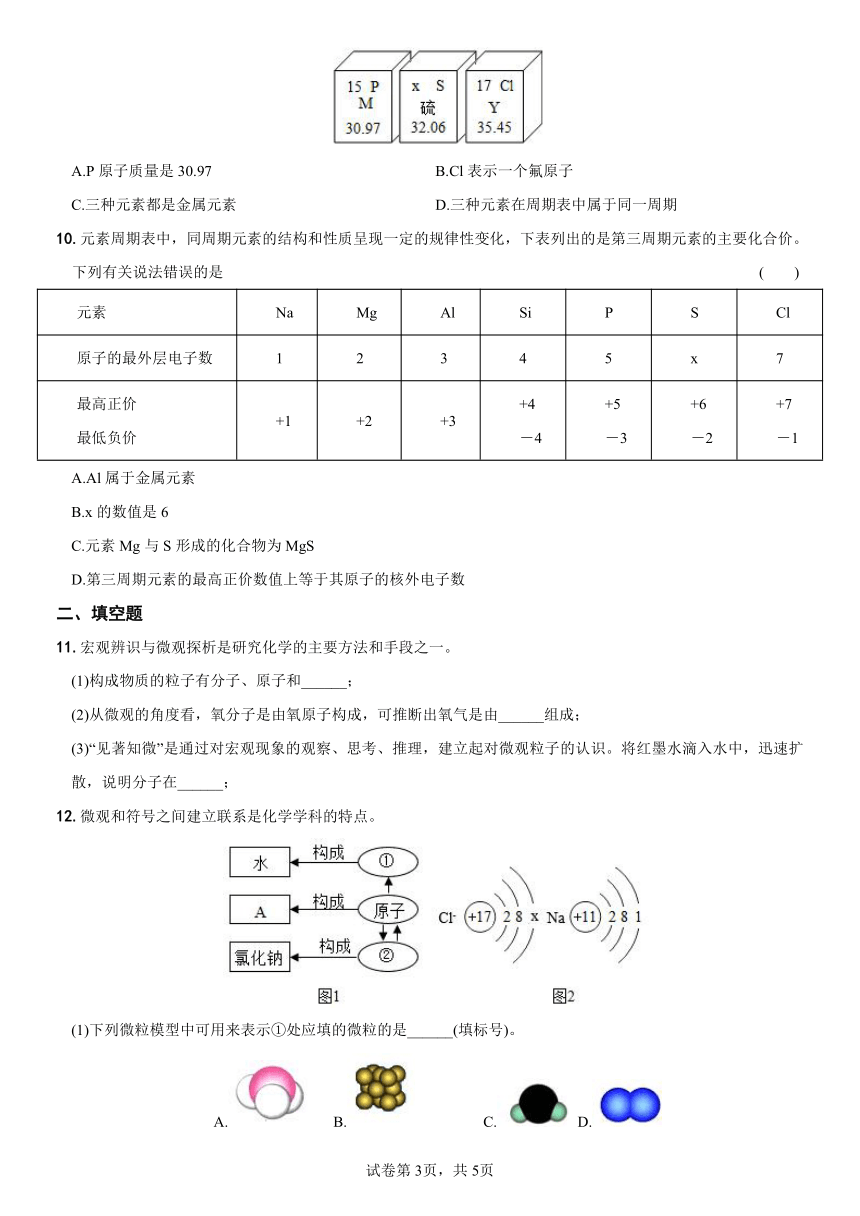
10.元素周期表中,同周期元素的结构和性质呈现一定的规律性变化,下表列出的是第三周期元素的主要化合价。下列有关说法错误的是 ( )
元素 Na Mg Al Si P S Cl
原子的最外层电子数 1 2 3 4 5 x 7
最高正价 最低负价 +1 +2 +3 +4 -4 +5 -3 +6 -2 +7 -1
A.Al属于金属元素
B.x的数值是6
C.元素Mg与S形成的化合物为MgS
D.第三周期元素的最高正价数值上等于其原子的核外电子数
二、填空题
11.宏观辨识与微观探析是研究化学的主要方法和手段之一。
(1)构成物质的粒子有分子、原子和______;
(2)从微观的角度看,氧分子是由氧原子构成,可推断出氧气是由______组成;
(3)“见著知微”是通过对宏观现象的观察、思考、推理,建立起对微观粒子的认识。将红墨水滴入水中,迅速扩散,说明分子在______;
12.微观和符号之间建立联系是化学学科的特点。
(1)下列微粒模型中可用来表示①处应填的微粒的是______(填标号)。
A. B. C. D.
(2)图1中②表示的是______,写出一种符合要求的A物质名称______。
(3)图2是氯、钠两种元素的微粒结构示意图。
①图2中氯离子的结构示意图中x的数值是______。②图2中钠原子的质子数为______,反应中易______(填得到或失去)电子。
③请将图中钠元素在元素周期表中的信息补齐______。
13.在“宏观一微观一符号”之间建立联系,是化学学科独有的思维方式。请回答下列问题:
(1)从宏观角度看,氯化钠由_____组成:从微观角度看,钠、氨气、氯化钠三种物质中,由原子直接构成的物质是_______。
(2)如下图是几种微粒的结构示意图。
①微粒D在化学反应中易_______(填“失去”或“得到”)电子。②2021年2月27日,嫦娥五号采集的月壤样品在中国国家博物馆正式展出。月壤中存在着大量的氦-3(氦-3是含有2个质子和1个中子的氦原子),其原子结构示意图为图上中的______(填字母序号)。
三、简答题
14.如图中的①、②元素在元素周期表中的信息,A、B、C是三种粒子的结构示意图。
试回答下列问题:
(1)钠元素的原子序数为___________,画出它的原子结构示意图___________;
(2)A、B、C中属于阴离子的粒子是___________;
(3)___________两种粒子具有相似的化学性质;
(4)钠原子和氯原子反应所形成的氯化钠是由___________(填“分子”、“原子”、“离子”)构成的。
15.请认真回忆物质与其构成粒子之间的关系,回答下列问题:
(1)金属铁是由______________构成的,氯化钠是由______________ 构成的,二氧化碳是由______________构成的。(填“原子”、“分子”或“离子”)
(2)原子得到或失去电子后形成离子,某粒子的结构示意图为
①a=______________时,该粒子是原子,该原子的原子序数为______________。②当a=8时,该粒子是______________(填“原子”、“阳离子”或“阴离子”)。
试卷第4页,共5页
试卷第5页,共5页
【参考答案及解析】
1.A
【详解】地壳中元素含量由多到少依次为:氧、硅、铝、铁,地壳中含量第二的元素是硅,翻译成“矽(xi)”,如今把这种“矽”元素命名为硅;
故选:A。
2.A
【详解】元素就是具有相同的核电荷数(即质子数)的同一类原子的总称,这两种元素的本质区别是质子数不同。
故选A。
3.C
【详解】A、钯为“钅”字旁,属于金属元素,该选项说法不正确;
B、元素周期表单元格中,左上角的数字表示原子序数,最下方的数字表示相对原子质量,原子的质子数=原子序数,相对原子质量≈质子数+中子数,则钯原子的中子数为106-46=60,该选项说法不正确;
C、元素符号前的数字表示原子个数,则“2Pd”表示2个钯原子,该选项说法正确;
D、原子中电子的质量很小,可忽略不计,则钯原子与Pd3+的质量几乎一样,该选项说法不正确。
故选C。
4.A
【详解】A.氧气具有氧化性,可以发生像燃烧一样的剧烈氧化反应,也可以发生像铁生锈一样的缓慢氧化反应,正确;
B.化合反应与分解反应属于并列关系,选项错误;
C.地壳中元素含量 前五:氧>硅>铝>铁>钙,选项错误;
D.氢气由氢气分子构成,氯化钠由钠离子和氯离子构成,选项错误。
故选:A。
5.C
【详解】A、7:35分针指向N元素,空气中含量最多的气体是氮气,占空气体积的78%,所以空气中含量最多的元素是氮元素,正确;
B、12∶00时针和分针都指向Mg,是12号元素。原子中质子数=核外电子数=原子序数,则每原子核外电子排布为2、8、2,容易失去最外层2个电子形成镁离子,结构示意图为 。正确。
C、2∶10分针指向He、10∶50分针指向Ne,都是稀有气体元素,组成的物质是稀有气体,化学性质稳定。但一定条件下可以和某些物质发生反应,错误;
D、4∶20、5∶25和6∶30分针分别指向Be、B、C,分别是4号元素、5号元素和6号元素,对应的元素的原子序数依次增加,正确。
故选C。
6.C
【详解】A、原子中原子序数=质子数=核外电子数。从①铬元素在元素周期表中的信息左上角数字可知,铬元素的原子序数为24,则铬原子的核外电子数为24,错误;
B、质子数=原子序数,原子中质子数=核外电子数,所以②是氮原子的结构示意图,有2个电子层。原子核外电子层上第一层最多排2个电子,第二层最多排8个电子,最外层最多排8个电子。硫是16号元素,核外电子排布为2、8、6,有3个电子层。电子层数不同,错误;
C、原子中质子数=核外电子数,11号元素为钠元素,与氯元素组成的化合物氯化钠是由钠离子和氯离子构成的,正确;
D、甲是2号元素氦元素,氦原子核外只有1层电子,最外层电子数为2。乙是18号元素氩元素,氩原子核外有3层电子,最外层电子数为8。错误。
故选C。
7.C
【详解】A、碘带“石”字旁,属于固态非金属元素,故选项说法正确;
B、根据元素周期表中的一格可知,左上角的数字为53,表示原子序数为53;根据原子中原子序数=核电荷数=质子数=核外电子数,则碘原子的核内质子数为53,故选项说法正确;
C、周期数=原子核外电子层数,碘元素的原子核外有5个电子层,则在元素周期表中,碘元素位于第5周期,故选项说法错误;
D、碘原子最外层电子数是7,在化学反应中易得到1个电子而形成阴离子,故选项说法正确。
故选C。
8.C
【详解】A、铝的元素符号为Al,故选项说法错误。
B、根据元素周期表中铝一小格的信息,最下方为相对原子质量,即铝的相对原子质量为26.98,故选项说法错误。
C、铝原子最外层有3个电子,易失去3个电子形成8电子的稳定结构,故在反应中铝易失去电子,故选项说法正确。
D、地壳中元素的含量(前四位)由多到少的顺序为氧、硅、铝、铁,地壳中含量最多的元素为氧,故选项说法错误。
故选:C。
9.D
【详解】A.P原子的相对质量是30.97,相对原子质量是原子的实际质量与一个碳原子质量的十二分之一,选项错误;
B.Cl表示一个氯原子,表示氯元素,选项错误;
C.磷、硫、氯三种元素都不是金属元素,选项错误;
D.三种元素在周期表中属于同一周期,都是第三周期的元素,选项正确。
故选:D。
10.D
【详解】A、Al属于金属元素,故A正确;
B、元素周期表中,同周期元素的结构和性质呈现一定的规律性变化,由表格分析可知,原子的最外层电子数依次增大,则x值应为6,故B正确;
C、Mg元素通常显+2价,S元素的最低负价为-2价,则元素Mg与S形成的化合物为MgS,故C正确;
D、Na~Cl元素原子的最外层电子数依次为1~7,与对应元素的最高正价数值相同,因此第三周期元素的最高正价数值上等于其原子的最外层电子数,而不是核外电子数,故D错误;
故选D。
11.(1)离子
(2)氧元素
(3)不断运动
【详解】(1)构成物质的三大粒子是分子、原子和离子;
(2)由于氧分子是由氧原子构成的,氧气中只含有氧元素,所以说氧气是由氧元素组成的;
(3)将红墨水滴入水中,迅速扩散,说明分子在不断运动。
12.(1)C
(2) 离子 铜(合理即可)
(3) 8 11 失去
【详解】(1)水是由水分子构成的,因此图甲中①处应填的微粒的是水分子,每个水分子是由两个氢原子与一个氧原子构成的,图示为C,故填:C;
(2)氯化钠是由钠离子与氯离子构成的,因此图甲中②表示的是离子;金属单质、稀有气体单质以及某些固态非金属单质是由原子直接构成的,如铜、氦气、金刚石等,故填:离子;铜(合理即可);
(3)①氯原子的最外层有7个电子,在化学反应中易得到1个电子而形成氯离子,氯离子的最外层有8个电子,即x=8,故填:8;
②由钠原子结构示意图可知,钠原子的质子数为11,最外层有1个电子,小于4,在化学反应中易失去最外层电子,形成阳离子,故填:11;失去;
③根据元素周期表的信息可知,左上角的数字表示原子序数,钠的原子序数为11,右上角的字母表示元素符号,钠的元素符号为Na,具体如图所示,故填:。
13.(1) 钠元素和氯元素 钠
(2) 得到 A
【详解】(1)宏观上,物质由元素组成的,故氯化钠由钠元素和氯元素组成;
微观上,物质由微粒构成的,构成物质的微粒有分子、原子、离子;水和大多数气体由分子构成,稀有气体除外;金属、稀有气体、金刚石、石墨等由原子构成;大多数酸碱盐类物质由离子构成;故从微观角度看,钠、氨气、氯化钠三种物质中,由原子直接构成的物质是钠;
(2)在化学反应中,当原子最外层电子数小于4时易失去电子,大于4时易得到电子,微粒D最外层7个电子,在化学反应中易得到电子;
在原子结构示意图中,原子核内的数字表示该原子的质子数,氦-3是含有2个质子和1个中子的氦原子,故其其原子结构示意图为A。
14.(1) 11
(2)C
(3)A或B
(4)离子
【解析】(1)
在元素周期表中,元素名称左上角的数字表示原子序数,故钠元素的原子序数为11;在原子中,质子数=原子序数=核外电子数,故钠原子核外第一层有2个电子,第二层有8个电子,第三层有1个电子,故钠原子结构示意图为: ;
故填:11;;
(2)
A、质子数=核外电子数,表示原子;B、质子数=核外电子数,表示原子;C、质子数小于核外电子数,表示阴离子,故属于阴离子的粒子是C。故填:C;
(3)
A和B的最外层电子数相同,化学性质相似;故填:AB;
(4)
氯元素最外层电子数为7,易得到一个电子,带一个单位的负电荷;钠元素最外层电子数为1,易失去1个电子,带一个单位的正电荷,氯化钠是由钠离子和氯离子构成;故填:离子。
15.(1) 原子 离子 分子
(2) 10 10 阴离子
【详解】(1)构成物质的微粒有分子、原子和离子,金属铁是由原子构成的,氯化钠是由离子构成的,二氧化碳是由分子构成的;
(2)由微粒的结构符号示意图和等量关系,在原子中,核电荷数=质子数=电子数,可得①a=10时,该粒子是氖原子,该原子核电荷数为10;②当a=8时,质子数<电子数,微粒带负电,是阴离子。
课题3 元素
一、单选题
1.“化学”一词最早出于清朝的《化学鉴原》一书,该书把地壳中含量第二的元素翻译成“矽(xi)”,如今把这种“矽”元素命名为 ( )
A.硅-Si B.硒-Se C.铝-Al D.锡-Sn
2.天然气的主要成分是甲烷,甲烷由碳、氢两种元素组成,这两种元素的本质区别是 ( )
A.质子数不同 B.电子数不同 C.中子数不同 D.最外层电子数不同
3.钯是航天、航空等高科技领域的关键材料。钯元素相关信息如图所示,下列有关说法正确的是 ( )
A.属于非金属元素 B.钯原子的中子数为46
C.“2Pd”表示2个钯原子 D.“钯原子与Pd3+的质量几乎一样”这句话是错误的
4.图示法是学习化学的重要方法,下列下列有关图示正确的是 ( )
A. B.化合反应与分解反应关
C.地壳中元素含量 D.构成物质的微粒
5.如图是一种钟表式元素周期表模型,下列有关说法中错误的是 ( )
A.7:35对应的元素是空气中含量最多的元素
B.12∶00对应的元素的离子结构示意图为
C.2∶10和10∶50对应元素组成的物质不与任何物质发生反应
D.4∶20、5∶25和6∶30对应的元素的原子序数依次增加
6.如图①是铬元素在元素周期表中的信息,②、③为两种原子的结构示意图,④为元素周期表中的部分信息,下列说法正确的是 ( )
A.铬原子的核外电子数为52
B.图②是氮原子的结构示意图,它与图④中S原子的电子层数相同
C.图③中x=11,该元素与图④中氯元素组成的化合物是由离子构成的
D.图④中甲、乙对应的原子的最外层电子数相同,均为8
7.如图为碘元素在元素周期表的部分信息及其原子结构示意图。下列说法错误的是 ( )
A.碘属于非金属元素 B.碘原子的质子数为53
C.碘元素位于元素周期表中的第四周期 D.碘原子在化学反应中易获得电子
8.硬铝常用于制造火箭、飞机的外壳,铝元素的相关信息和铝原子的结构示意图如图所示,下列说法正确的是 ( )
A.铝的元素符号为AL B.铝原子的中子数为26.98
C.铝原子在反应中易失去电子 D.铝是地壳中含量最多的元素
9.如图摘自元素周期表,部分信息略去。据此判断下列叙述正确的是 ( )
A.P原子质量是30.97 B.Cl表示一个氟原子
C.三种元素都是金属元素 D.三种元素在周期表中属于同一周期
10.元素周期表中,同周期元素的结构和性质呈现一定的规律性变化,下表列出的是第三周期元素的主要化合价。下列有关说法错误的是 ( )
元素 Na Mg Al Si P S Cl
原子的最外层电子数 1 2 3 4 5 x 7
最高正价 最低负价 +1 +2 +3 +4 -4 +5 -3 +6 -2 +7 -1
A.Al属于金属元素
B.x的数值是6
C.元素Mg与S形成的化合物为MgS
D.第三周期元素的最高正价数值上等于其原子的核外电子数
二、填空题
11.宏观辨识与微观探析是研究化学的主要方法和手段之一。
(1)构成物质的粒子有分子、原子和______;
(2)从微观的角度看,氧分子是由氧原子构成,可推断出氧气是由______组成;
(3)“见著知微”是通过对宏观现象的观察、思考、推理,建立起对微观粒子的认识。将红墨水滴入水中,迅速扩散,说明分子在______;
12.微观和符号之间建立联系是化学学科的特点。
(1)下列微粒模型中可用来表示①处应填的微粒的是______(填标号)。
A. B. C. D.
(2)图1中②表示的是______,写出一种符合要求的A物质名称______。
(3)图2是氯、钠两种元素的微粒结构示意图。
①图2中氯离子的结构示意图中x的数值是______。②图2中钠原子的质子数为______,反应中易______(填得到或失去)电子。
③请将图中钠元素在元素周期表中的信息补齐______。
13.在“宏观一微观一符号”之间建立联系,是化学学科独有的思维方式。请回答下列问题:
(1)从宏观角度看,氯化钠由_____组成:从微观角度看,钠、氨气、氯化钠三种物质中,由原子直接构成的物质是_______。
(2)如下图是几种微粒的结构示意图。
①微粒D在化学反应中易_______(填“失去”或“得到”)电子。②2021年2月27日,嫦娥五号采集的月壤样品在中国国家博物馆正式展出。月壤中存在着大量的氦-3(氦-3是含有2个质子和1个中子的氦原子),其原子结构示意图为图上中的______(填字母序号)。
三、简答题
14.如图中的①、②元素在元素周期表中的信息,A、B、C是三种粒子的结构示意图。
试回答下列问题:
(1)钠元素的原子序数为___________,画出它的原子结构示意图___________;
(2)A、B、C中属于阴离子的粒子是___________;
(3)___________两种粒子具有相似的化学性质;
(4)钠原子和氯原子反应所形成的氯化钠是由___________(填“分子”、“原子”、“离子”)构成的。
15.请认真回忆物质与其构成粒子之间的关系,回答下列问题:
(1)金属铁是由______________构成的,氯化钠是由______________ 构成的,二氧化碳是由______________构成的。(填“原子”、“分子”或“离子”)
(2)原子得到或失去电子后形成离子,某粒子的结构示意图为
①a=______________时,该粒子是原子,该原子的原子序数为______________。②当a=8时,该粒子是______________(填“原子”、“阳离子”或“阴离子”)。
试卷第4页,共5页
试卷第5页,共5页
【参考答案及解析】
1.A
【详解】地壳中元素含量由多到少依次为:氧、硅、铝、铁,地壳中含量第二的元素是硅,翻译成“矽(xi)”,如今把这种“矽”元素命名为硅;
故选:A。
2.A
【详解】元素就是具有相同的核电荷数(即质子数)的同一类原子的总称,这两种元素的本质区别是质子数不同。
故选A。
3.C
【详解】A、钯为“钅”字旁,属于金属元素,该选项说法不正确;
B、元素周期表单元格中,左上角的数字表示原子序数,最下方的数字表示相对原子质量,原子的质子数=原子序数,相对原子质量≈质子数+中子数,则钯原子的中子数为106-46=60,该选项说法不正确;
C、元素符号前的数字表示原子个数,则“2Pd”表示2个钯原子,该选项说法正确;
D、原子中电子的质量很小,可忽略不计,则钯原子与Pd3+的质量几乎一样,该选项说法不正确。
故选C。
4.A
【详解】A.氧气具有氧化性,可以发生像燃烧一样的剧烈氧化反应,也可以发生像铁生锈一样的缓慢氧化反应,正确;
B.化合反应与分解反应属于并列关系,选项错误;
C.地壳中元素含量 前五:氧>硅>铝>铁>钙,选项错误;
D.氢气由氢气分子构成,氯化钠由钠离子和氯离子构成,选项错误。
故选:A。
5.C
【详解】A、7:35分针指向N元素,空气中含量最多的气体是氮气,占空气体积的78%,所以空气中含量最多的元素是氮元素,正确;
B、12∶00时针和分针都指向Mg,是12号元素。原子中质子数=核外电子数=原子序数,则每原子核外电子排布为2、8、2,容易失去最外层2个电子形成镁离子,结构示意图为 。正确。
C、2∶10分针指向He、10∶50分针指向Ne,都是稀有气体元素,组成的物质是稀有气体,化学性质稳定。但一定条件下可以和某些物质发生反应,错误;
D、4∶20、5∶25和6∶30分针分别指向Be、B、C,分别是4号元素、5号元素和6号元素,对应的元素的原子序数依次增加,正确。
故选C。
6.C
【详解】A、原子中原子序数=质子数=核外电子数。从①铬元素在元素周期表中的信息左上角数字可知,铬元素的原子序数为24,则铬原子的核外电子数为24,错误;
B、质子数=原子序数,原子中质子数=核外电子数,所以②是氮原子的结构示意图,有2个电子层。原子核外电子层上第一层最多排2个电子,第二层最多排8个电子,最外层最多排8个电子。硫是16号元素,核外电子排布为2、8、6,有3个电子层。电子层数不同,错误;
C、原子中质子数=核外电子数,11号元素为钠元素,与氯元素组成的化合物氯化钠是由钠离子和氯离子构成的,正确;
D、甲是2号元素氦元素,氦原子核外只有1层电子,最外层电子数为2。乙是18号元素氩元素,氩原子核外有3层电子,最外层电子数为8。错误。
故选C。
7.C
【详解】A、碘带“石”字旁,属于固态非金属元素,故选项说法正确;
B、根据元素周期表中的一格可知,左上角的数字为53,表示原子序数为53;根据原子中原子序数=核电荷数=质子数=核外电子数,则碘原子的核内质子数为53,故选项说法正确;
C、周期数=原子核外电子层数,碘元素的原子核外有5个电子层,则在元素周期表中,碘元素位于第5周期,故选项说法错误;
D、碘原子最外层电子数是7,在化学反应中易得到1个电子而形成阴离子,故选项说法正确。
故选C。
8.C
【详解】A、铝的元素符号为Al,故选项说法错误。
B、根据元素周期表中铝一小格的信息,最下方为相对原子质量,即铝的相对原子质量为26.98,故选项说法错误。
C、铝原子最外层有3个电子,易失去3个电子形成8电子的稳定结构,故在反应中铝易失去电子,故选项说法正确。
D、地壳中元素的含量(前四位)由多到少的顺序为氧、硅、铝、铁,地壳中含量最多的元素为氧,故选项说法错误。
故选:C。
9.D
【详解】A.P原子的相对质量是30.97,相对原子质量是原子的实际质量与一个碳原子质量的十二分之一,选项错误;
B.Cl表示一个氯原子,表示氯元素,选项错误;
C.磷、硫、氯三种元素都不是金属元素,选项错误;
D.三种元素在周期表中属于同一周期,都是第三周期的元素,选项正确。
故选:D。
10.D
【详解】A、Al属于金属元素,故A正确;
B、元素周期表中,同周期元素的结构和性质呈现一定的规律性变化,由表格分析可知,原子的最外层电子数依次增大,则x值应为6,故B正确;
C、Mg元素通常显+2价,S元素的最低负价为-2价,则元素Mg与S形成的化合物为MgS,故C正确;
D、Na~Cl元素原子的最外层电子数依次为1~7,与对应元素的最高正价数值相同,因此第三周期元素的最高正价数值上等于其原子的最外层电子数,而不是核外电子数,故D错误;
故选D。
11.(1)离子
(2)氧元素
(3)不断运动
【详解】(1)构成物质的三大粒子是分子、原子和离子;
(2)由于氧分子是由氧原子构成的,氧气中只含有氧元素,所以说氧气是由氧元素组成的;
(3)将红墨水滴入水中,迅速扩散,说明分子在不断运动。
12.(1)C
(2) 离子 铜(合理即可)
(3) 8 11 失去
【详解】(1)水是由水分子构成的,因此图甲中①处应填的微粒的是水分子,每个水分子是由两个氢原子与一个氧原子构成的,图示为C,故填:C;
(2)氯化钠是由钠离子与氯离子构成的,因此图甲中②表示的是离子;金属单质、稀有气体单质以及某些固态非金属单质是由原子直接构成的,如铜、氦气、金刚石等,故填:离子;铜(合理即可);
(3)①氯原子的最外层有7个电子,在化学反应中易得到1个电子而形成氯离子,氯离子的最外层有8个电子,即x=8,故填:8;
②由钠原子结构示意图可知,钠原子的质子数为11,最外层有1个电子,小于4,在化学反应中易失去最外层电子,形成阳离子,故填:11;失去;
③根据元素周期表的信息可知,左上角的数字表示原子序数,钠的原子序数为11,右上角的字母表示元素符号,钠的元素符号为Na,具体如图所示,故填:。
13.(1) 钠元素和氯元素 钠
(2) 得到 A
【详解】(1)宏观上,物质由元素组成的,故氯化钠由钠元素和氯元素组成;
微观上,物质由微粒构成的,构成物质的微粒有分子、原子、离子;水和大多数气体由分子构成,稀有气体除外;金属、稀有气体、金刚石、石墨等由原子构成;大多数酸碱盐类物质由离子构成;故从微观角度看,钠、氨气、氯化钠三种物质中,由原子直接构成的物质是钠;
(2)在化学反应中,当原子最外层电子数小于4时易失去电子,大于4时易得到电子,微粒D最外层7个电子,在化学反应中易得到电子;
在原子结构示意图中,原子核内的数字表示该原子的质子数,氦-3是含有2个质子和1个中子的氦原子,故其其原子结构示意图为A。
14.(1) 11
(2)C
(3)A或B
(4)离子
【解析】(1)
在元素周期表中,元素名称左上角的数字表示原子序数,故钠元素的原子序数为11;在原子中,质子数=原子序数=核外电子数,故钠原子核外第一层有2个电子,第二层有8个电子,第三层有1个电子,故钠原子结构示意图为: ;
故填:11;;
(2)
A、质子数=核外电子数,表示原子;B、质子数=核外电子数,表示原子;C、质子数小于核外电子数,表示阴离子,故属于阴离子的粒子是C。故填:C;
(3)
A和B的最外层电子数相同,化学性质相似;故填:AB;
(4)
氯元素最外层电子数为7,易得到一个电子,带一个单位的负电荷;钠元素最外层电子数为1,易失去1个电子,带一个单位的正电荷,氯化钠是由钠离子和氯离子构成;故填:离子。
15.(1) 原子 离子 分子
(2) 10 10 阴离子
【详解】(1)构成物质的微粒有分子、原子和离子,金属铁是由原子构成的,氯化钠是由离子构成的,二氧化碳是由分子构成的;
(2)由微粒的结构符号示意图和等量关系,在原子中,核电荷数=质子数=电子数,可得①a=10时,该粒子是氖原子,该原子核电荷数为10;②当a=8时,质子数<电子数,微粒带负电,是阴离子。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
