化学人教版(2019)必修第二册6.1.1化学反应与热能(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.1.1化学反应与热能(共31张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 731.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-27 00:00:00 | ||
图片预览









文档简介
(共31张PPT)
第 六 章 化学反应与能量
化学反应总是伴随着各种能量的变化,而其中最常见的是以热量的形式吸收和释放。
第一节 化学反应与能量变化
第一课时 化学反应与热能
1.了解放热反应和吸热反应的概念以及吸热、放热反应
过程中物质能量的变化。
2.理解化学键与化学反应中能量变化之间的关系
目标导航:
化学键、物质的能量与化学反应中能量变化的关系。
重 点:
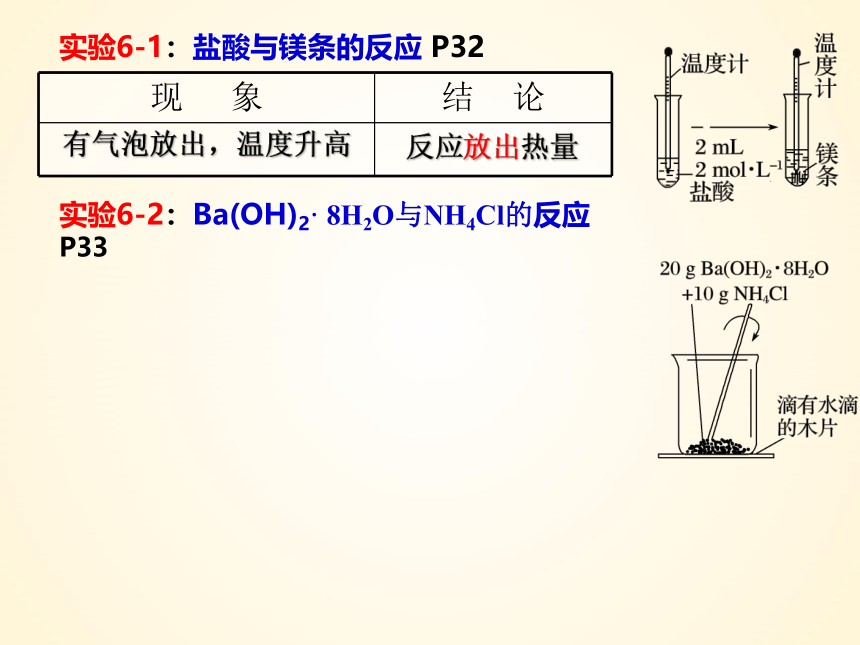
实验6-1:盐酸与镁条的反应 P32
实验6-2:Ba(OH)2· 8H2O与NH4Cl的反应 P33
现 象 结 论
反应放出热量
有气泡放出,温度升高
现 象 结 论
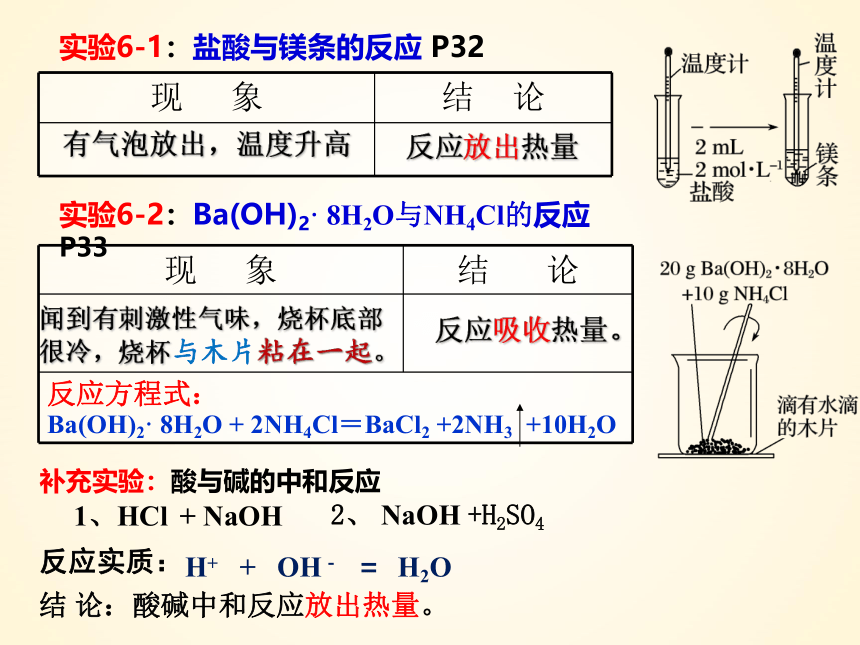
反应方程式: 实验6-1:盐酸与镁条的反应 P32
实验6-2:Ba(OH)2· 8H2O与NH4Cl的反应 P33
现 象 结 论
反应放出热量
有气泡放出,温度升高
闻到有刺激性气味,烧杯底部很冷,烧杯与木片粘在一起。
反应吸收热量。
Ba(OH)2· 8H2O + 2NH4Cl=BaCl2 +2NH3 +10H2O
补充实验:酸与碱的中和反应
1、HCl + NaOH
结 论:酸碱中和反应放出热量。
2、 NaOH +H2SO4
H+ + OH- = H2O
反应实质:
放出热量的化学反应叫做放热反应。
吸收热量的化学反应叫做吸热反应。
一.化学反应与热能
1.化学反应的分类:放热反应和吸热反应
浓硫酸的稀释,NaOH晶体溶于水均放热,它们是放热反应吗?
问题:
NH4NO3晶体溶于水吸热,属于吸热反应吗?
不是,它们都不是化学反应中的能量变化
那么,哪些类型的反应往往是放热?哪些是吸热呢?
从能量的角度
常见的
放热反应
(1)所有燃烧反应
(3)铝热反应
(2)活泼金属跟水或酸反应
(4)酸碱中和反应
常见的
吸热反应
(1)Ba(OH)2· 8H2O与NH4Cl的反应
(2)需要持续 或高温的反应
记住它们吧!
CaCO3 == CaO + CO2
高温
例如:用C . H2做还原剂的氧化还原反应
C + CO2 == 2CO
H2+ CuO == Cu + H2O
C + H2O == CO + H2
△
△
问:吸热反应一定要加热?而放热反应一定不加热吗?
不一定,反应的放热、吸热与是否加热无必然联系
(包括物质的自燃和缓慢氧化)
△
NaHCO3与HCl的反应
1.下列说法正确的是( )
A.Fe与S在加热条件下才能发生反应,所以该反应属于吸热反应
B.HNO3、H2SO4分别与NaOH溶液反应都放出热量
C.分解反应都是吸热反应,化合反应都是放热反应
D.合成氨的反应是放热反应,所以N2与其他物质的反应也是放热反应
B
迁移练习:
一个化学反应吸收能量还是放出能量是由什么决定的呢?
质疑
请大家阅读课本P33,
从以下两个角度分析理解化学反应过程中的能量变化
1、化学键的角度
2、化学能的角度
反应物的总能量与生成物的总能量的相对大小(宏观)
一个化学反应是放出能量还是吸收能量:
断开旧键所吸收能量与形成新键所放出能量的相对大小(微观)
决定于
化学反应的本质:
就是旧化学键的断裂和新化学键的形成的过程。
吸收能量
放出能量
一个化学反应是放热还是吸热取决于:
断开旧键所吸收能量与形成新键所放出能量的相对大小
E吸E吸>E放: 反应吸热
二. 化学键、化学能与化学反应中能量变化的关系
1、化学键与化学反应中能量的变化
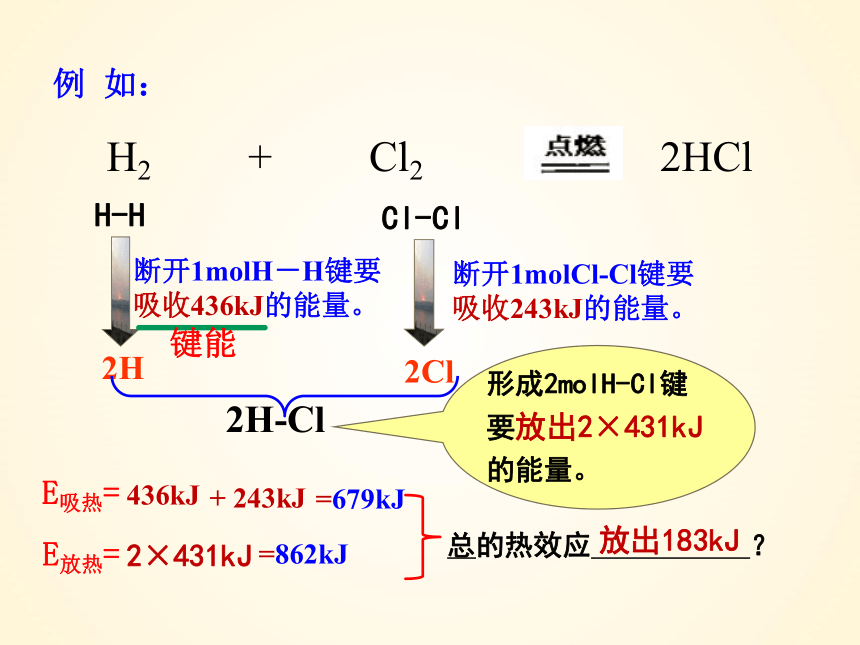
2H
H-H
Cl-Cl
H2 + Cl2 2HCl
断开1molH-H键要吸收436kJ的能量。
断开1molCl-Cl键要吸收243kJ的能量。
2Cl
2H-Cl
形成2molH-Cl键要放出2×431kJ的能量。
键能
E吸热=
436kJ
+ 243kJ
=679kJ
E放热=
2×431kJ
=862kJ
总的热效应 ?
放出183kJ
例 如:
资料卡
我们把拆开1mol化学键吸收的能
量,或生成1mol化学键释放的能量称为该化学键的键能。 例如:H-H键的键能是 436.4KJ/mol,即拆开1molH-H键需要吸收能量436.4KJ;也可以表示生成1molH-H键就会放出436.4KJ的能量.
物质键能越大越稳定 !
几个需要了解的观点:
1)两条基本的自然定律
质量守恒定律:自然界的物质可以发生相互转化,但反应前后质量保持不变。
能量守恒定律:一种形式的能量可以转化为另一种(或多种形式)的能量,
但体系的总能量保持不变。
2)各种物质都储存有“化学能”。
不同的物质不仅组成不同、结构不同,所包含的化学能也不同。
3)物质所含能量越低,越稳定
因此,根据能量守恒定律,一个化学反应放热还是吸热,宏观上,取决于反应物的总能量与生成物的总能量相对大小
类似:
每个人自身都蕴含着不同的能量,吃饱了能量就高,表现的比较活跃;饿了,能量低,就提不起劲
2、化学能与化学反应中能量的变化
反应物的总能量高
生成物的总能量低
能量
﹢
放热反应
2、化学能与化学反应中能量的变化
反应物的总能量=生成物的总能量+放出的热量
生成物的总能量高
反应物的总能量低
﹢
能量
吸热反应
2、化学能与化学反应中能量的变化
生成物的总能量=反应物的总能量+吸收的热量
断键吸热
成键
放热
反应物
生成物
能量
反应过程
吸热
放热
反应物
生成物
能量
反应过程
反应物总能量(E反)>生成物总能量(E生)
放热反应
吸热反应
反应物总键能(E吸)<生成物总键能(E放)
放热反应:
反应物断键吸收的热量____生成物成键放出的总热量
<
吸热反应:
反应物断键吸收的热量____生成物成键放出的总热量
>
小结:化学反应中的能量变化原因
1.下列反应中,属于氧化还原反应且反应前后能量变化如图所示的是( )
B
迁移练习:
A.生石灰溶于水
B.在人体组织里葡萄糖转化为CO2和H2O
C.高温条件下炭粉与二氧化碳的反应
D.Ba(OH)2·8H2O晶体与NH4Cl固体的反应
2.在太空中发现迄今已知最大钻石直径4 000千米。
已知C(石墨)=C(金刚石),在该反应过程中其能量变化如图所示,有关该反应的描述正确的是( )
B
迁移练习:
A.该反应为放出热量的反应
B.石墨比金刚石稳定
C.该反应为氧化还原反应
D.等物质的量的石墨和金刚石完全燃烧释放的热量相同
键能越大,物质越稳定
注 意:
注意区别物质所含的化学能和键能是两回事
物质所含化学能越低,越稳定
3.某反应由两步反应A→B→C构成,它的反应能量曲线如图所示,下列叙述正确的是( )
AD
迁移练习:
A.三种化合物中C最稳定
B.两步反应均为吸热反应
C.A与C的能量差为E4
D.A→B反应,反应条件不一定要加热
4.生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其储存能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 N≡N F—F N—F
键能/(kJ/mol) 946 160 283
下列说法中正确的是( )
A.过程N2(g)―→2N(g)放出能量
B.过程N(g)+3F(g)―→NF2(g)放出能量
C.反应N2(g)+3F2(g)===2NF3(g)是吸热反应
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
B
1.人类对化学反应中热能的利用——燃烧
发现
早期
现代
始于______的发现
以 为主要能源
始于____、____、_______为主要能源
火
树枝、杂草
煤
石油
天然气
(阅读课本P34最后1段-P35)
三、人类对能源的利用及能源现状
利用热量进行生活、生产和科研。
利用热能使很多化学反应得以发生。
2、人类利用能源的三个阶段
(1)柴草时期
中国古代制陶图
(2)化石能源时期
(3)多能源结构时期
3.化石燃料利用过程中面临两方面亟待解决的问题:
(1)能源短缺问题日益突出。
(2)燃烧排放的粉尘、SO2、NOx、CO等造成了大气污染。
4.节能减排,寻找清洁的新能源
(1)节能:主要是充分有效地利用能源。
如在燃料利用的过程中,节能的主要环节有两个:
一是燃料燃烧阶段,提高燃料的燃烧效率;
二是能量利用阶段,提高能源利用率。
(2)理想的新能源应具有资源丰富、可以再生、对环境无污染的特点。
如太阳能、风能、地热能、海洋能和氢能等。
1.下列关于能源利用的说法正确的是( )
A.贮氢合金在使用时,氢气分子被吸收在合金表面分解变成氢原子,同时放出热量
B.使用化石燃料不会引起环境污染
C.将城市废弃物处理后封闭式焚烧,利用产生的热能供暖和发电
D.通过电解水产生的氢气作为燃料的优点之一是成本低
C
【巩固练习】
2.有专家提出,如果利用太阳能将燃料CH4、CH3OH、NH3等燃烧后的产物如CO2、H2O、N2等组合,使之重新变成CH4、CH3OH、NH3等的构思(如图所示)能够实现,那么在很大程度上可以缓解能源危机,在此过程中太阳能最终转化为( )
A.化学能 B.生物质能
C.热能 D.电能
C
3.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )
B
A.1mol N2(g)和NA个O2(g)反应放出的能量为180kJ
B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.需要加热才能发生的反应一定是吸热反应
4.随着人们生活节奏的加快,市场上出现了多种类型的“即食饭盒”等快速给食物加热的产品。
下面让我们探究它们的工作原理。
(1)有一“自热米饭”的广告播得很火,它介绍在食用时,将一无色液体加入一白色固体中,放上装米饭的盒子,过几分钟米饭就热气腾腾,可以食用了,非常方便。请你推测其白色固体和无色液体可能是如下哪个组合____
A.硝酸铵和水 B.浓硫酸和水
C.氧化钙和水 D.固体酒精和水
C
(2)目前市面上有一种新型饭盒“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物。使用时打开隔离层,即发生以下反应:Mg+2H2O = X+H2↑。
4.随着人们生活节奏的加快,市场上出现了多种类型的“即食饭盒”等快速给食物加热的产品。
下面让我们探究它们的工作原理。
请根据以上信息回答下列各题:
①该饭盒底部“即热”存在什么能量之间的转化?
化学能转化为热能
②已知X是一种碱,则X的化学式什么?你推断X的化学式的依据是?
Mg(OH)2
质量守恒定律
③上述化学反应属于哪种基本反应类型?由该反应可知化学反应发生时都伴随什么变化?
置换反应
物质的变化和能量的变化
第 六 章 化学反应与能量
化学反应总是伴随着各种能量的变化,而其中最常见的是以热量的形式吸收和释放。
第一节 化学反应与能量变化
第一课时 化学反应与热能
1.了解放热反应和吸热反应的概念以及吸热、放热反应
过程中物质能量的变化。
2.理解化学键与化学反应中能量变化之间的关系
目标导航:
化学键、物质的能量与化学反应中能量变化的关系。
重 点:
实验6-1:盐酸与镁条的反应 P32
实验6-2:Ba(OH)2· 8H2O与NH4Cl的反应 P33
现 象 结 论
反应放出热量
有气泡放出,温度升高
现 象 结 论
反应方程式: 实验6-1:盐酸与镁条的反应 P32
实验6-2:Ba(OH)2· 8H2O与NH4Cl的反应 P33
现 象 结 论
反应放出热量
有气泡放出,温度升高
闻到有刺激性气味,烧杯底部很冷,烧杯与木片粘在一起。
反应吸收热量。
Ba(OH)2· 8H2O + 2NH4Cl=BaCl2 +2NH3 +10H2O
补充实验:酸与碱的中和反应
1、HCl + NaOH
结 论:酸碱中和反应放出热量。
2、 NaOH +H2SO4
H+ + OH- = H2O
反应实质:
放出热量的化学反应叫做放热反应。
吸收热量的化学反应叫做吸热反应。
一.化学反应与热能
1.化学反应的分类:放热反应和吸热反应
浓硫酸的稀释,NaOH晶体溶于水均放热,它们是放热反应吗?
问题:
NH4NO3晶体溶于水吸热,属于吸热反应吗?
不是,它们都不是化学反应中的能量变化
那么,哪些类型的反应往往是放热?哪些是吸热呢?
从能量的角度
常见的
放热反应
(1)所有燃烧反应
(3)铝热反应
(2)活泼金属跟水或酸反应
(4)酸碱中和反应
常见的
吸热反应
(1)Ba(OH)2· 8H2O与NH4Cl的反应
(2)需要持续 或高温的反应
记住它们吧!
CaCO3 == CaO + CO2
高温
例如:用C . H2做还原剂的氧化还原反应
C + CO2 == 2CO
H2+ CuO == Cu + H2O
C + H2O == CO + H2
△
△
问:吸热反应一定要加热?而放热反应一定不加热吗?
不一定,反应的放热、吸热与是否加热无必然联系
(包括物质的自燃和缓慢氧化)
△
NaHCO3与HCl的反应
1.下列说法正确的是( )
A.Fe与S在加热条件下才能发生反应,所以该反应属于吸热反应
B.HNO3、H2SO4分别与NaOH溶液反应都放出热量
C.分解反应都是吸热反应,化合反应都是放热反应
D.合成氨的反应是放热反应,所以N2与其他物质的反应也是放热反应
B
迁移练习:
一个化学反应吸收能量还是放出能量是由什么决定的呢?
质疑
请大家阅读课本P33,
从以下两个角度分析理解化学反应过程中的能量变化
1、化学键的角度
2、化学能的角度
反应物的总能量与生成物的总能量的相对大小(宏观)
一个化学反应是放出能量还是吸收能量:
断开旧键所吸收能量与形成新键所放出能量的相对大小(微观)
决定于
化学反应的本质:
就是旧化学键的断裂和新化学键的形成的过程。
吸收能量
放出能量
一个化学反应是放热还是吸热取决于:
断开旧键所吸收能量与形成新键所放出能量的相对大小
E吸
二. 化学键、化学能与化学反应中能量变化的关系
1、化学键与化学反应中能量的变化
2H
H-H
Cl-Cl
H2 + Cl2 2HCl
断开1molH-H键要吸收436kJ的能量。
断开1molCl-Cl键要吸收243kJ的能量。
2Cl
2H-Cl
形成2molH-Cl键要放出2×431kJ的能量。
键能
E吸热=
436kJ
+ 243kJ
=679kJ
E放热=
2×431kJ
=862kJ
总的热效应 ?
放出183kJ
例 如:
资料卡
我们把拆开1mol化学键吸收的能
量,或生成1mol化学键释放的能量称为该化学键的键能。 例如:H-H键的键能是 436.4KJ/mol,即拆开1molH-H键需要吸收能量436.4KJ;也可以表示生成1molH-H键就会放出436.4KJ的能量.
物质键能越大越稳定 !
几个需要了解的观点:
1)两条基本的自然定律
质量守恒定律:自然界的物质可以发生相互转化,但反应前后质量保持不变。
能量守恒定律:一种形式的能量可以转化为另一种(或多种形式)的能量,
但体系的总能量保持不变。
2)各种物质都储存有“化学能”。
不同的物质不仅组成不同、结构不同,所包含的化学能也不同。
3)物质所含能量越低,越稳定
因此,根据能量守恒定律,一个化学反应放热还是吸热,宏观上,取决于反应物的总能量与生成物的总能量相对大小
类似:
每个人自身都蕴含着不同的能量,吃饱了能量就高,表现的比较活跃;饿了,能量低,就提不起劲
2、化学能与化学反应中能量的变化
反应物的总能量高
生成物的总能量低
能量
﹢
放热反应
2、化学能与化学反应中能量的变化
反应物的总能量=生成物的总能量+放出的热量
生成物的总能量高
反应物的总能量低
﹢
能量
吸热反应
2、化学能与化学反应中能量的变化
生成物的总能量=反应物的总能量+吸收的热量
断键吸热
成键
放热
反应物
生成物
能量
反应过程
吸热
放热
反应物
生成物
能量
反应过程
反应物总能量(E反)>生成物总能量(E生)
放热反应
吸热反应
反应物总键能(E吸)<生成物总键能(E放)
放热反应:
反应物断键吸收的热量____生成物成键放出的总热量
<
吸热反应:
反应物断键吸收的热量____生成物成键放出的总热量
>
小结:化学反应中的能量变化原因
1.下列反应中,属于氧化还原反应且反应前后能量变化如图所示的是( )
B
迁移练习:
A.生石灰溶于水
B.在人体组织里葡萄糖转化为CO2和H2O
C.高温条件下炭粉与二氧化碳的反应
D.Ba(OH)2·8H2O晶体与NH4Cl固体的反应
2.在太空中发现迄今已知最大钻石直径4 000千米。
已知C(石墨)=C(金刚石),在该反应过程中其能量变化如图所示,有关该反应的描述正确的是( )
B
迁移练习:
A.该反应为放出热量的反应
B.石墨比金刚石稳定
C.该反应为氧化还原反应
D.等物质的量的石墨和金刚石完全燃烧释放的热量相同
键能越大,物质越稳定
注 意:
注意区别物质所含的化学能和键能是两回事
物质所含化学能越低,越稳定
3.某反应由两步反应A→B→C构成,它的反应能量曲线如图所示,下列叙述正确的是( )
AD
迁移练习:
A.三种化合物中C最稳定
B.两步反应均为吸热反应
C.A与C的能量差为E4
D.A→B反应,反应条件不一定要加热
4.生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其储存能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 N≡N F—F N—F
键能/(kJ/mol) 946 160 283
下列说法中正确的是( )
A.过程N2(g)―→2N(g)放出能量
B.过程N(g)+3F(g)―→NF2(g)放出能量
C.反应N2(g)+3F2(g)===2NF3(g)是吸热反应
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
B
1.人类对化学反应中热能的利用——燃烧
发现
早期
现代
始于______的发现
以 为主要能源
始于____、____、_______为主要能源
火
树枝、杂草
煤
石油
天然气
(阅读课本P34最后1段-P35)
三、人类对能源的利用及能源现状
利用热量进行生活、生产和科研。
利用热能使很多化学反应得以发生。
2、人类利用能源的三个阶段
(1)柴草时期
中国古代制陶图
(2)化石能源时期
(3)多能源结构时期
3.化石燃料利用过程中面临两方面亟待解决的问题:
(1)能源短缺问题日益突出。
(2)燃烧排放的粉尘、SO2、NOx、CO等造成了大气污染。
4.节能减排,寻找清洁的新能源
(1)节能:主要是充分有效地利用能源。
如在燃料利用的过程中,节能的主要环节有两个:
一是燃料燃烧阶段,提高燃料的燃烧效率;
二是能量利用阶段,提高能源利用率。
(2)理想的新能源应具有资源丰富、可以再生、对环境无污染的特点。
如太阳能、风能、地热能、海洋能和氢能等。
1.下列关于能源利用的说法正确的是( )
A.贮氢合金在使用时,氢气分子被吸收在合金表面分解变成氢原子,同时放出热量
B.使用化石燃料不会引起环境污染
C.将城市废弃物处理后封闭式焚烧,利用产生的热能供暖和发电
D.通过电解水产生的氢气作为燃料的优点之一是成本低
C
【巩固练习】
2.有专家提出,如果利用太阳能将燃料CH4、CH3OH、NH3等燃烧后的产物如CO2、H2O、N2等组合,使之重新变成CH4、CH3OH、NH3等的构思(如图所示)能够实现,那么在很大程度上可以缓解能源危机,在此过程中太阳能最终转化为( )
A.化学能 B.生物质能
C.热能 D.电能
C
3.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )
B
A.1mol N2(g)和NA个O2(g)反应放出的能量为180kJ
B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.需要加热才能发生的反应一定是吸热反应
4.随着人们生活节奏的加快,市场上出现了多种类型的“即食饭盒”等快速给食物加热的产品。
下面让我们探究它们的工作原理。
(1)有一“自热米饭”的广告播得很火,它介绍在食用时,将一无色液体加入一白色固体中,放上装米饭的盒子,过几分钟米饭就热气腾腾,可以食用了,非常方便。请你推测其白色固体和无色液体可能是如下哪个组合____
A.硝酸铵和水 B.浓硫酸和水
C.氧化钙和水 D.固体酒精和水
C
(2)目前市面上有一种新型饭盒“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物。使用时打开隔离层,即发生以下反应:Mg+2H2O = X+H2↑。
4.随着人们生活节奏的加快,市场上出现了多种类型的“即食饭盒”等快速给食物加热的产品。
下面让我们探究它们的工作原理。
请根据以上信息回答下列各题:
①该饭盒底部“即热”存在什么能量之间的转化?
化学能转化为热能
②已知X是一种碱,则X的化学式什么?你推断X的化学式的依据是?
Mg(OH)2
质量守恒定律
③上述化学反应属于哪种基本反应类型?由该反应可知化学反应发生时都伴随什么变化?
置换反应
物质的变化和能量的变化
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
