化学人教版(2019)必修第二册6.1.2化学反应与电能(共49张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.1.2化学反应与电能(共49张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 21.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-27 10:19:15 | ||
图片预览








文档简介
(共49张PPT)
第一节 化学反应与能量变化
二、化学反应与电能
第1课时 原电池
学习目标:
1.理解原电池的工作原理。
2.掌握原电池的构成条件
3.掌握简单电极反应式的书写。
引言:
1、我们的学习、生活需要电,有了电很方便
2、电力是二次能源:
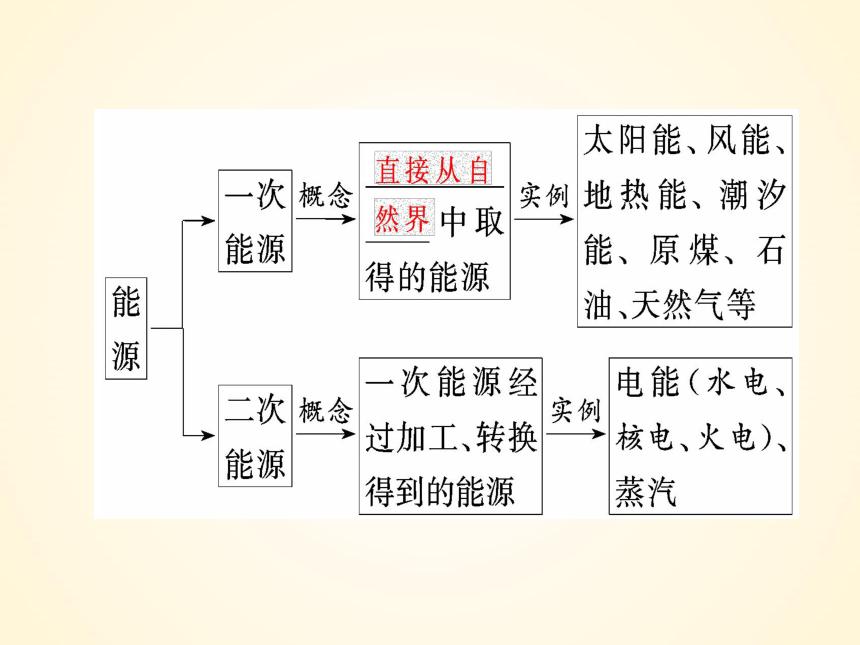
直接从自然界取得的能源称为一次能源
电能是现代社会中应用最广泛、使用最方便、直接污染最小的一种二次能源,又称为电力。
一次能源
加工、转换
能源
(称为二次能源)
一次能源:直接从自然界取得的能源
水电站
水能
风能
石油
天然气
原煤
火电站
二次能源:一次能源经加工、转换得到的能源
电能
蒸汽
我国2019年发电总量构成
你知道,可以通过哪些途径获取电?
水电站
火电站
火力发电占据绝大部分
什么是火力发电?
火电站的工作原理如何
估计在2050年火电仍居首位
火力发电中能量是如何转化的呢?(看书P36页)
燃烧
发电机
化学能
热能
机械能
电能
蒸汽
思考:能不能将化学能直接转变成电能
【化石燃料】
缺 点:
1.煤炭是不可再生能源 2.排出大量的温室气体
3.可能导致酸雨(H2SO4) 4.能量转化效率低。
一、化学能转化为电能
在氧化剂与还原剂之间架设桥梁,使电子发生定向移动,形成电流
产生电流
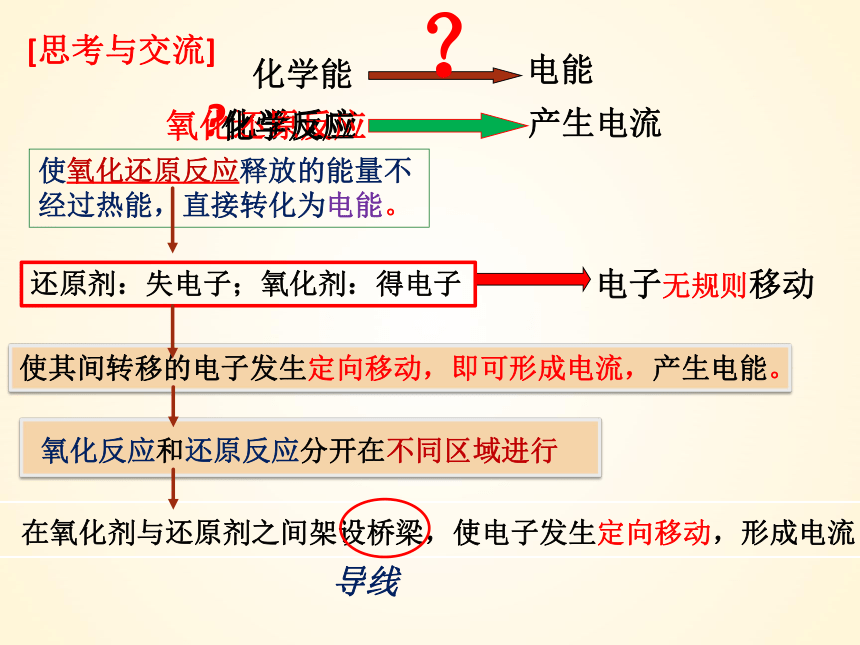
[思考与交流]
化学能
电能
化学反应
氧化还原反应
化学反应
电子无规则移动
?
使氧化还原反应释放的能量不经过热能,直接转化为电能。
还原剂:失电子;氧化剂:得电子
使其间转移的电子发生定向移动,即可形成电流,产生电能。
氧化反应和还原反应分开在不同区域进行
导线
(1)
(2)
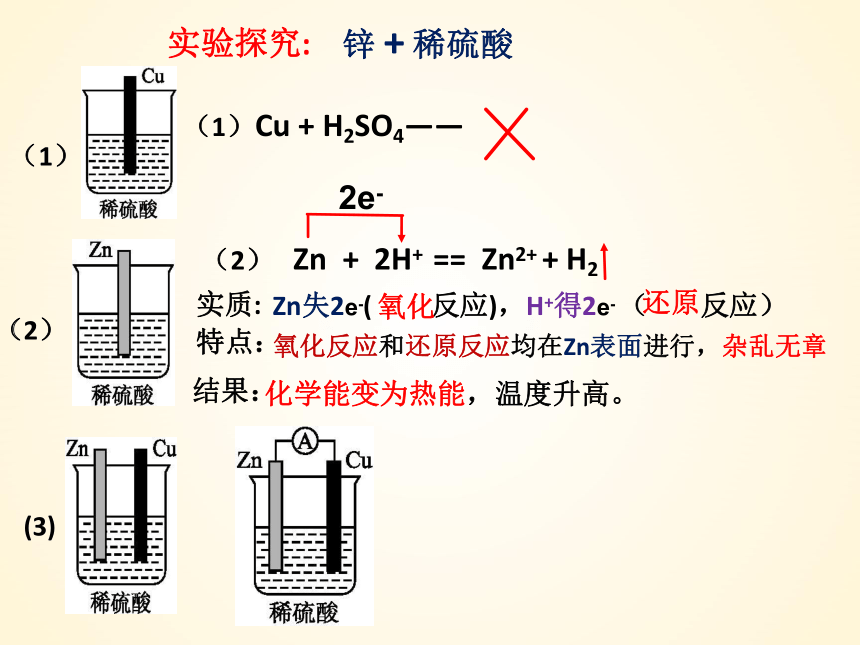
(1)Cu + H2SO4——
Zn失2e-( 反应),H+得2e- ( 反应)
特点:
氧化反应和还原反应均在Zn表面进行,杂乱无章
结果:
化学能变为热能,温度升高。
实质:
(2) Zn + 2H+ == Zn2+ + H2
实验探究:
氧化
还原
锌 + 稀硫酸
(3)
2e-
(3)
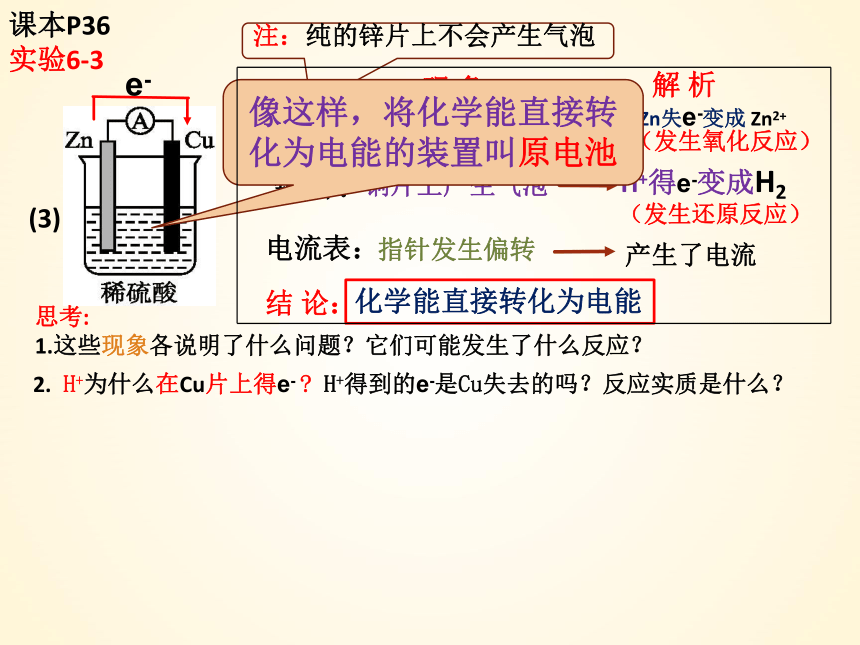
课本P36
实验6-3
现 象:
(3)
锌 片:
注:纯的锌片上不会产生气泡
指针发生偏转
铜片上产生气泡
铜 片:
锌片部分溶解
电流表:
课本P36
实验6-3
思考:
1.这些现象各说明了什么问题?它们可能发生了什么反应?
解 析
Zn失e-变成 Zn2+
H+得e-变成H2
产生了电流
化学能直接转化为电能
(发生氧化反应)
(发生还原反应)
结 论:
2. H+为什么在Cu片上得e- H+得到的e-是Cu失去的吗?反应实质是什么?
像这样,将化学能直接转化为电能的装置叫原电池
e-
锌铜原电池原理解析
现 象:
(3)
锌 片:
注:纯的锌片上不会产生气泡
指针发生偏转
铜片上产生气泡
铜 片:
锌片部分溶解
电流表:
课本P36
实验6-3
思考:
1.这些现象各说明了什么问题?它们可能发生了什么反应?
解 析
Zn失e-变成 Zn2+
H+得e-变成H2
产生了电流
化学能直接转化为电能
(发生氧化反应)
(发生还原反应)
结 论:
2. H+为什么在Cu片上得e- H+得到的e-是Cu失去的吗?反应实质是什么?
反应的实质:
Zn + 2H+ == Zn2+ + H2
反应的特点:
电子定向移动形成了电流,反应中的化学能转化为电能。
反应有序:氧化反应和还原反应分别在两个不同区域内完成。
像这样,将化学能直接转化为电能的装置叫原电池
Cu起传导e-的作用
Zn失e- , e-沿导线转移到Cu片,H+在Cu片上得e-生成H2
e-
归纳整理
1. 原电池
2.由物理中电学知识判断,以锌铜原电池为例,
分析原电池的正、负极
借助氧化还原反应将化学能转变为电能的装置
归纳整理
1. 原电池
2.由物理中电学知识判断,以锌铜原电池为例,
分析原电池的正、负极。
(—)
(+)
借助氧化还原反应将化学能转变为电能的装置
正极:电子流入的一极,发生还原反应
负极:电子流出的一极,发生氧化反应
e-
e-
e-
归纳整理
1. 原电池
2.由物理中电学知识判断,以锌铜原电池为例,
分析原电池的正、负极。
(—)
(+)
6.正、负极的电极反应式?
3.电子的流向:
4.电流的流向:
5.电解质溶液中阴、阳离子的流动方向?
借助氧化还原反应将化学能转变为电能的装置
正极:电子流入的一极,发生还原反应
负极:电子流出的一极,发生氧化反应
由负极
沿导线
正极
(与电子流向相反)
正 正,负 负
Zn-2e-= Zn2+
2H++ 2e-= H2↑
(—)
(+)
(发生氧化反应)
(发生还原反应)
e-
H+
SO42—
原电池
必发生
失电子
的
氧化反应
必发生
得电子
的
还原反应
铜锌电池的工作原理
内电路:正正,负负
外电路:“负极出电子,电子回正极”
小常识:
早在1799年意大利的物理学家伏打捕捉到这一现象并加以研究,发明了世界上第一个电池——伏打电池,即原电池。
付打发现在用银质手术刀触碰放在铁盘上的青蛙的时候,无意间发现青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激.如果只用一种金属器械去触动青蛙,就无此种反应
将一个能自发进行的氧化还原反应设计成一个原电池,构成这个原电池的必要条件有哪些?
问题探究
CuSO4溶液
√
√
√
√
要有两个活性不同的电极
要有电解质溶液
必须形成闭合回路
一、原电池原理
(2)两个活性不同的电极
(3)电解质溶液
(4)形成闭合回路
(1)有能自发进行的氧化还原反应
(即,外电路用导线连接或直接接触)
NaOH + HCl == NaCl + H2O
负极材料:较活泼金属
正极材料:较不活泼金属(或能导电的非金属如:石墨等)
(自身失电子,被损耗)
只起传导电子作用
实质上,负极金属材料通常能和电解质溶液发生氧化还原反应
两极一液成回路
7、构成原电池的条件有哪些?
A
B
C
D
E
√
下列哪些装置能构成原电池?
√
F
√
稀硫酸
Ag
Cu
A
硫酸铜
Zn
Cu
√
Zn
H2SO4溶液
G
苹果汁
Zn
Fe
AgNO3溶液
Ag
Fe
C
酒精
J
Zn
Zn
HCl 溶液
I
Zn
Pb
CH3COOH溶液K
√
写出各原电池的半极反应式和总反应式
(—)
(—)
(—)
(—)
(—)
(+)
(+)
(+)
(+)
(+)
B.负极(Zn) :Zn-2e- = Zn2+
正极(Cu): Cu2++2e- = Cu
总反应: Zn+ Cu2++ =Zn2++Cu
K.负极(Zn): Zn-2e- = Zn2+
正极(Pb): 2CH3COOH+ 2e- =2CH3COO—+ H2↑
总反应式: Zn+2CH3COOH =(CH3COO)2Zn+H2↑
C.负极(Zn) :Zn-2e- = Zn2+
正极 (C): 2H+ + 2e- = H2↑
总反应式:Zn + H2SO4 = ZnSO4 + H2↑
D.负极(Cu): Cu-2e- = Cu2+
正极(Ag): 2Ag++2e- = 2Ag
总反应:Cu+2Ag+ = Cu2+ + 2Ag
F.负极(Zn) :Zn-2e- = Zn2+
正极 (Fe): 2H+ + 2e- = H2↑
总反应式:Zn + 2H+ = Zn2+ + H2↑
1、电解质溶液为稀硫酸
2、电解质溶液为NaOH(aq)
NaOH(aq)
Mg棒
(—)
(—)
(+)
(+)
Al棒
Al棒
Mg棒
2Al +8OH- - 6e- = 2AlO2-+4H2O
6H2O + 6e- = 6OH- +3H2↑
2Al +2OH- +6H2O= 2AlO2- + 3H2↑ +4H2O
Mg — 2e- == Mg 2+
2H+ + 2e-= H2
Al
Mg
A
稀硫酸
(+)
(—)
(+)
(—)
注意一:
正、负极的判断受电解质溶液的影响,
“较活泼金属”不一定做负极
练习1: 写出下列装置的电极反应及总反应式。
1、稀硫酸
Al
Cu
A
1、电解质溶液为稀硫酸
2、电解质溶液为浓硝酸
2、浓硝酸
(—)
(+)
Al棒
Cu棒
2Al — 6e- == 2Al3+
6H+ + 6e-= 3H2
(—)
(+)
Al棒
Cu棒
Cu — 2e- == Cu2+
2NO3- + 2e- + 4 H+ = 2NO2 + 2H2O
Cu +2NO3- + 4 H+ = Cu2+ + 2NO2 + 2H2O
正、负极材料的判断受电解质溶液的影响
Fe
(负极)
(正极)
负极反应:
正极反应:
总反应:
注意二:形成闭合回路的方式有多种。
FeCl3溶液
Fe
C
FeCl3溶液
Fe
C
FeCl3溶液
C
Fe
Fe
C
FeCl3溶液
Fe -2e-== Fe 2+
2Fe3++2e-==2Fe2+
2Fe3+ + Fe = 3 Fe 2+
石墨、Pt、Au等称为惰性电极
练习2:思考下列装置是否构成原电池,
能构成则写出其中的电极反应及总反应式。
Fe
练习2:思考下列装置是否构成原电池,
能构成则写出其中的电极反应及总反应式。
Fe
C
FeCl3溶液
NaCl溶液
负极:
正极:
总反应: 2 Fe+ O2 + 2H2O = 2Fe(OH) 2
注意三:在中性或碱性溶液中,若无电解质溶液中的阳离子得e-, 则正极通常考虑溶液中的O2得e-变OH—
正极:O2 + 4e- + 2H2O = 4OH-
Fe – 2e- = Fe2+
2H2O + O2 + 4e- = 4OH-
2 4 2
石墨、Pt、Au等称为惰性电极
负极反应:
正极反应:
总反应:
Fe -2e-== Fe 2+
2Fe3++2e-==2Fe2+
2Fe3+ + Fe = 3 Fe 2+
(负极)
(正极)
负极:
正极:
负极:
正极:
钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀
应用:钢铁的腐蚀
(1)当水膜溶液为强酸性时
钢铁的析氢腐蚀
总反应: 2 Fe+ O2 + 2H2O = Fe(OH) 2
随反应进行,溶液酸性减弱,碱性增强,逐渐产生Fe(OH) 2
4Fe(OH) 2 + O2 + 2H2O =4 Fe(OH) 3
Fe2O 3.XH2O
铁 锈
(2)当水膜溶液为弱酸性或中性时
钢铁的吸氧腐蚀
4Fe(OH) 2 + O2 + 2H2O =4 Fe(OH) 3
Fe2O 3.XH2O
铁 锈
水 膜
Fe – 2e- = Fe2+
2H+ + 2e- = H2↑
2H2O + O2 + 4e- = 4OH-
Fe – 2e- = Fe2+
2 4 2
归纳整理1:
原电池的注意点
注意一:
正、负极的判断受电解质溶液的影响,
“较活波金属”不一定做负极
注意二:形成闭合回路的方式有多种。
注意三:在中性或碱性溶液中,若无电解质溶液中的阳离子得e-,
则正极通常考虑溶液中的O2得e-变OH—
知识提升:
有的电池产生的电流大,可以对外做功;
但有的原电池,电极上发生的反应很慢,产生的电流极其微弱,不能对外做功。
如,钢铁生锈发生的电化学腐蚀
1. 书写方法
①找出两极放电的物质或离子
②分析得、失电子情况,写出放电后的产物
③如原子不能守恒,一般可两边添加H+、H2O 或 OH-、H2O
注意:电极反应产物是否与电解质溶液发生反应
归纳整理2:
电极反应式
2. 书写注意事项:
原 则:遵循质量守恒、电子守恒、电荷守恒定律。
注意点:
当两个半反应同时写出时,应得、失电子数相等
记住吧!
归纳整理2:
电极反应式
③总反应是正、负极反应式相加而得,如果产物离子能形成
弱酸、弱碱时,应把离子合写成弱酸、弱碱。
②反应中产生气体,用“ ”,但产生沉淀,不用“ ”。
原电池电极的判断方法
1、两极材料的活泼性判断
较活泼
较不活泼(非金属)
2、电流方向或电子流向判断
电子流出
电流流出
3、电解质溶液中离子移动方向判断
阳离子移向
5、现象判断
阴离子移向
发生氧化
发生还原
4、两极发生的反应判断
溶解
增重或有气泡放出
归纳整理3
—负极
—正极
—正极
—负极
—正极
—负极
—负极
—正极
——负极
——正极
1、课本P37 探究 简易电池的设计与制作
发光二极管与小灯泡的区别:发光二极管有正、负极
原电池的设计
水果电池
【课堂练习】如图为番茄电池,下列说法正确的是( )
A.电子由铜电极通过导线流向锌电极
B.该装置是将电能转化为化学能的装置
C.锌电极发生氧化反应
D.电流由锌电极通过导线流向铜电极
c
原电池的设计
该氧化还原反应可拆分为如下两个半反应:
正极反应: 2Fe3++2e-==2Fe2+
负极反应: Cu-2e-==Cu2+
负极材料:
Cu
电解质溶液:
FeCl3
正极材料:
比Cu更不活泼的金属或石墨等
思 考 题
请根据反应 2Fe3+ + Fe = 3 Fe 2+设计原电池,你有哪些可行方案
(负极)Fe
Fe(NO3)3
Fe(SO4)3
Cu
Ag
Pt
负极反应: Fe -2e-== Fe 2+
正极反应: 2Fe3++2e-==2Fe2+
Fe
负极材料:
电解质溶液:
正极材料:
含Fe3+的盐溶液
比Fe更不活泼的金属或石墨等
1. 比较下列两个原电池输出电流的大小[电解质浓度相同]
物质的氧化性越强,原电池输出电能的能力越强。
问题探讨:
CuSO4
H2SO4
>
Cu2+ H+
氧化性:
>
结论一:其他条件相同时
原电池输出电能的能力
结论二:其他条件相同时
原电池输出电能的能力
2. 比较下列三个原电池输出电流的大小
CuSO4
Al
CuSO4
Fe
问题探讨:
CuSO4
Zn
还原性:
Al
Zn
Fe
> >
> >
物质的还原性越强,原电池输出电能的能力越强。
1、装置设计的合理性
归纳总结:影响原电池输出电能能力的因素:
2、组成原电池的反应物的氧化还原能力。
(1)比较金属活动性强弱
例1:
下列叙述中,可以说明金属甲比乙活泼性强的是
C.将甲乙与稀硫酸组成原电池时甲是负极;
A.甲和乙用导线连接插入稀盐酸溶液中,
乙溶解,甲 上有H2气放出;
B.在氧化–还原反应中,甲比乙失去的电子多;
D.同价态的阳离子,甲比乙的氧化性强;
原电池的主要应用:
C
(2)比较反应速率
例2:
下列制氢气的反应速率最快的是
粗锌和 1mol/L 盐酸;
B.
A.
纯锌和1mol/L 硫酸;
纯锌和18 mol/L 硫酸;
C.
粗锌和1mol/L硫酸的反应中加入几滴CuSO4溶液。
D.
D
原电池的主要应用:
(3)比较金属腐蚀的快慢
例3:
下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是
(4)
(2)
(1)
(3)
原电池的主要应用:
归纳总结:原电池原理的应用
④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。
制作干电池、铅蓄电池、新型高能电池
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
①制作化学电源:
②加快反应速率:
③判断金属活动性的强弱
例如:为防止轮船船体被海水腐蚀,常在船底贴一些锌板
Zn
Cu
H2SO4溶液
1.将铁片和银片用导线连接置于同一稀盐酸溶液中,经过一段时间后,下列各项叙述正确的是( )
A.负极有Cl2逸出,正极有H2逸出
B.负极附近Cl-的浓度减小
C.正极附近Cl-的浓度逐渐增大
D.溶液中Cl-的浓度基本不变
综合训练:
D
2.过量铁与少量稀硫酸反应,为了加快反应速率,但是又不影响生成氢气的总量,可以采取的措施是( )
A.加入适量NaCl溶液
B.加入适量的水
C.加入几滴硫酸铜溶液
D.再加入少量稀硫酸
综合训练:
C
3.如图所示电流表的指针发生偏转,同时A极的质量减小,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
C
综合训练:
A.B极为原电池的正极
B.A、B、C分别为Zn、Cu和稀盐酸
C.C中阳离子向A极移动
D.A极发生氧化反应
4.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
C
A.铜棒的质量 B.c(Zn2+)
C.c(H+) D.c(SO42-)
综合训练:
5.如图是用化学电源使LED灯发光的装置。下列说法错误的是( )
综合训练:
C
A.铜片表面有气泡生成
B.装置中存在“化学能→电能→光能”的转换
C.如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D.如果将锌片换成铁片,电路中的电流方向不变
6.将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液。请画出产生H2的体积V(L)与时间t(min)的关系图像。
一思两变
答案
①a中少量锌粉置换出铜,构成锌铜原电池,反应速率加快;
②由于与H+反应的锌粉减少,最终产生H2的量比b更少
改: 将过量的两份锌粉a、b分别加入定量的稀硫酸,同时向a中加入少量的CuSO4溶液,请画出产生H2的体积V(L)与时间t(min)的关系图像。
答案
第一节 化学反应与能量变化
二、化学反应与电能
第1课时 原电池
学习目标:
1.理解原电池的工作原理。
2.掌握原电池的构成条件
3.掌握简单电极反应式的书写。
引言:
1、我们的学习、生活需要电,有了电很方便
2、电力是二次能源:
直接从自然界取得的能源称为一次能源
电能是现代社会中应用最广泛、使用最方便、直接污染最小的一种二次能源,又称为电力。
一次能源
加工、转换
能源
(称为二次能源)
一次能源:直接从自然界取得的能源
水电站
水能
风能
石油
天然气
原煤
火电站
二次能源:一次能源经加工、转换得到的能源
电能
蒸汽
我国2019年发电总量构成
你知道,可以通过哪些途径获取电?
水电站
火电站
火力发电占据绝大部分
什么是火力发电?
火电站的工作原理如何
估计在2050年火电仍居首位
火力发电中能量是如何转化的呢?(看书P36页)
燃烧
发电机
化学能
热能
机械能
电能
蒸汽
思考:能不能将化学能直接转变成电能
【化石燃料】
缺 点:
1.煤炭是不可再生能源 2.排出大量的温室气体
3.可能导致酸雨(H2SO4) 4.能量转化效率低。
一、化学能转化为电能
在氧化剂与还原剂之间架设桥梁,使电子发生定向移动,形成电流
产生电流
[思考与交流]
化学能
电能
化学反应
氧化还原反应
化学反应
电子无规则移动
?
使氧化还原反应释放的能量不经过热能,直接转化为电能。
还原剂:失电子;氧化剂:得电子
使其间转移的电子发生定向移动,即可形成电流,产生电能。
氧化反应和还原反应分开在不同区域进行
导线
(1)
(2)
(1)Cu + H2SO4——
Zn失2e-( 反应),H+得2e- ( 反应)
特点:
氧化反应和还原反应均在Zn表面进行,杂乱无章
结果:
化学能变为热能,温度升高。
实质:
(2) Zn + 2H+ == Zn2+ + H2
实验探究:
氧化
还原
锌 + 稀硫酸
(3)
2e-
(3)
课本P36
实验6-3
现 象:
(3)
锌 片:
注:纯的锌片上不会产生气泡
指针发生偏转
铜片上产生气泡
铜 片:
锌片部分溶解
电流表:
课本P36
实验6-3
思考:
1.这些现象各说明了什么问题?它们可能发生了什么反应?
解 析
Zn失e-变成 Zn2+
H+得e-变成H2
产生了电流
化学能直接转化为电能
(发生氧化反应)
(发生还原反应)
结 论:
2. H+为什么在Cu片上得e- H+得到的e-是Cu失去的吗?反应实质是什么?
像这样,将化学能直接转化为电能的装置叫原电池
e-
锌铜原电池原理解析
现 象:
(3)
锌 片:
注:纯的锌片上不会产生气泡
指针发生偏转
铜片上产生气泡
铜 片:
锌片部分溶解
电流表:
课本P36
实验6-3
思考:
1.这些现象各说明了什么问题?它们可能发生了什么反应?
解 析
Zn失e-变成 Zn2+
H+得e-变成H2
产生了电流
化学能直接转化为电能
(发生氧化反应)
(发生还原反应)
结 论:
2. H+为什么在Cu片上得e- H+得到的e-是Cu失去的吗?反应实质是什么?
反应的实质:
Zn + 2H+ == Zn2+ + H2
反应的特点:
电子定向移动形成了电流,反应中的化学能转化为电能。
反应有序:氧化反应和还原反应分别在两个不同区域内完成。
像这样,将化学能直接转化为电能的装置叫原电池
Cu起传导e-的作用
Zn失e- , e-沿导线转移到Cu片,H+在Cu片上得e-生成H2
e-
归纳整理
1. 原电池
2.由物理中电学知识判断,以锌铜原电池为例,
分析原电池的正、负极
借助氧化还原反应将化学能转变为电能的装置
归纳整理
1. 原电池
2.由物理中电学知识判断,以锌铜原电池为例,
分析原电池的正、负极。
(—)
(+)
借助氧化还原反应将化学能转变为电能的装置
正极:电子流入的一极,发生还原反应
负极:电子流出的一极,发生氧化反应
e-
e-
e-
归纳整理
1. 原电池
2.由物理中电学知识判断,以锌铜原电池为例,
分析原电池的正、负极。
(—)
(+)
6.正、负极的电极反应式?
3.电子的流向:
4.电流的流向:
5.电解质溶液中阴、阳离子的流动方向?
借助氧化还原反应将化学能转变为电能的装置
正极:电子流入的一极,发生还原反应
负极:电子流出的一极,发生氧化反应
由负极
沿导线
正极
(与电子流向相反)
正 正,负 负
Zn-2e-= Zn2+
2H++ 2e-= H2↑
(—)
(+)
(发生氧化反应)
(发生还原反应)
e-
H+
SO42—
原电池
必发生
失电子
的
氧化反应
必发生
得电子
的
还原反应
铜锌电池的工作原理
内电路:正正,负负
外电路:“负极出电子,电子回正极”
小常识:
早在1799年意大利的物理学家伏打捕捉到这一现象并加以研究,发明了世界上第一个电池——伏打电池,即原电池。
付打发现在用银质手术刀触碰放在铁盘上的青蛙的时候,无意间发现青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激.如果只用一种金属器械去触动青蛙,就无此种反应
将一个能自发进行的氧化还原反应设计成一个原电池,构成这个原电池的必要条件有哪些?
问题探究
CuSO4溶液
√
√
√
√
要有两个活性不同的电极
要有电解质溶液
必须形成闭合回路
一、原电池原理
(2)两个活性不同的电极
(3)电解质溶液
(4)形成闭合回路
(1)有能自发进行的氧化还原反应
(即,外电路用导线连接或直接接触)
NaOH + HCl == NaCl + H2O
负极材料:较活泼金属
正极材料:较不活泼金属(或能导电的非金属如:石墨等)
(自身失电子,被损耗)
只起传导电子作用
实质上,负极金属材料通常能和电解质溶液发生氧化还原反应
两极一液成回路
7、构成原电池的条件有哪些?
A
B
C
D
E
√
下列哪些装置能构成原电池?
√
F
√
稀硫酸
Ag
Cu
A
硫酸铜
Zn
Cu
√
Zn
H2SO4溶液
G
苹果汁
Zn
Fe
AgNO3溶液
Ag
Fe
C
酒精
J
Zn
Zn
HCl 溶液
I
Zn
Pb
CH3COOH溶液K
√
写出各原电池的半极反应式和总反应式
(—)
(—)
(—)
(—)
(—)
(+)
(+)
(+)
(+)
(+)
B.负极(Zn) :Zn-2e- = Zn2+
正极(Cu): Cu2++2e- = Cu
总反应: Zn+ Cu2++ =Zn2++Cu
K.负极(Zn): Zn-2e- = Zn2+
正极(Pb): 2CH3COOH+ 2e- =2CH3COO—+ H2↑
总反应式: Zn+2CH3COOH =(CH3COO)2Zn+H2↑
C.负极(Zn) :Zn-2e- = Zn2+
正极 (C): 2H+ + 2e- = H2↑
总反应式:Zn + H2SO4 = ZnSO4 + H2↑
D.负极(Cu): Cu-2e- = Cu2+
正极(Ag): 2Ag++2e- = 2Ag
总反应:Cu+2Ag+ = Cu2+ + 2Ag
F.负极(Zn) :Zn-2e- = Zn2+
正极 (Fe): 2H+ + 2e- = H2↑
总反应式:Zn + 2H+ = Zn2+ + H2↑
1、电解质溶液为稀硫酸
2、电解质溶液为NaOH(aq)
NaOH(aq)
Mg棒
(—)
(—)
(+)
(+)
Al棒
Al棒
Mg棒
2Al +8OH- - 6e- = 2AlO2-+4H2O
6H2O + 6e- = 6OH- +3H2↑
2Al +2OH- +6H2O= 2AlO2- + 3H2↑ +4H2O
Mg — 2e- == Mg 2+
2H+ + 2e-= H2
Al
Mg
A
稀硫酸
(+)
(—)
(+)
(—)
注意一:
正、负极的判断受电解质溶液的影响,
“较活泼金属”不一定做负极
练习1: 写出下列装置的电极反应及总反应式。
1、稀硫酸
Al
Cu
A
1、电解质溶液为稀硫酸
2、电解质溶液为浓硝酸
2、浓硝酸
(—)
(+)
Al棒
Cu棒
2Al — 6e- == 2Al3+
6H+ + 6e-= 3H2
(—)
(+)
Al棒
Cu棒
Cu — 2e- == Cu2+
2NO3- + 2e- + 4 H+ = 2NO2 + 2H2O
Cu +2NO3- + 4 H+ = Cu2+ + 2NO2 + 2H2O
正、负极材料的判断受电解质溶液的影响
Fe
(负极)
(正极)
负极反应:
正极反应:
总反应:
注意二:形成闭合回路的方式有多种。
FeCl3溶液
Fe
C
FeCl3溶液
Fe
C
FeCl3溶液
C
Fe
Fe
C
FeCl3溶液
Fe -2e-== Fe 2+
2Fe3++2e-==2Fe2+
2Fe3+ + Fe = 3 Fe 2+
石墨、Pt、Au等称为惰性电极
练习2:思考下列装置是否构成原电池,
能构成则写出其中的电极反应及总反应式。
Fe
练习2:思考下列装置是否构成原电池,
能构成则写出其中的电极反应及总反应式。
Fe
C
FeCl3溶液
NaCl溶液
负极:
正极:
总反应: 2 Fe+ O2 + 2H2O = 2Fe(OH) 2
注意三:在中性或碱性溶液中,若无电解质溶液中的阳离子得e-, 则正极通常考虑溶液中的O2得e-变OH—
正极:O2 + 4e- + 2H2O = 4OH-
Fe – 2e- = Fe2+
2H2O + O2 + 4e- = 4OH-
2 4 2
石墨、Pt、Au等称为惰性电极
负极反应:
正极反应:
总反应:
Fe -2e-== Fe 2+
2Fe3++2e-==2Fe2+
2Fe3+ + Fe = 3 Fe 2+
(负极)
(正极)
负极:
正极:
负极:
正极:
钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀
应用:钢铁的腐蚀
(1)当水膜溶液为强酸性时
钢铁的析氢腐蚀
总反应: 2 Fe+ O2 + 2H2O = Fe(OH) 2
随反应进行,溶液酸性减弱,碱性增强,逐渐产生Fe(OH) 2
4Fe(OH) 2 + O2 + 2H2O =4 Fe(OH) 3
Fe2O 3.XH2O
铁 锈
(2)当水膜溶液为弱酸性或中性时
钢铁的吸氧腐蚀
4Fe(OH) 2 + O2 + 2H2O =4 Fe(OH) 3
Fe2O 3.XH2O
铁 锈
水 膜
Fe – 2e- = Fe2+
2H+ + 2e- = H2↑
2H2O + O2 + 4e- = 4OH-
Fe – 2e- = Fe2+
2 4 2
归纳整理1:
原电池的注意点
注意一:
正、负极的判断受电解质溶液的影响,
“较活波金属”不一定做负极
注意二:形成闭合回路的方式有多种。
注意三:在中性或碱性溶液中,若无电解质溶液中的阳离子得e-,
则正极通常考虑溶液中的O2得e-变OH—
知识提升:
有的电池产生的电流大,可以对外做功;
但有的原电池,电极上发生的反应很慢,产生的电流极其微弱,不能对外做功。
如,钢铁生锈发生的电化学腐蚀
1. 书写方法
①找出两极放电的物质或离子
②分析得、失电子情况,写出放电后的产物
③如原子不能守恒,一般可两边添加H+、H2O 或 OH-、H2O
注意:电极反应产物是否与电解质溶液发生反应
归纳整理2:
电极反应式
2. 书写注意事项:
原 则:遵循质量守恒、电子守恒、电荷守恒定律。
注意点:
当两个半反应同时写出时,应得、失电子数相等
记住吧!
归纳整理2:
电极反应式
③总反应是正、负极反应式相加而得,如果产物离子能形成
弱酸、弱碱时,应把离子合写成弱酸、弱碱。
②反应中产生气体,用“ ”,但产生沉淀,不用“ ”。
原电池电极的判断方法
1、两极材料的活泼性判断
较活泼
较不活泼(非金属)
2、电流方向或电子流向判断
电子流出
电流流出
3、电解质溶液中离子移动方向判断
阳离子移向
5、现象判断
阴离子移向
发生氧化
发生还原
4、两极发生的反应判断
溶解
增重或有气泡放出
归纳整理3
—负极
—正极
—正极
—负极
—正极
—负极
—负极
—正极
——负极
——正极
1、课本P37 探究 简易电池的设计与制作
发光二极管与小灯泡的区别:发光二极管有正、负极
原电池的设计
水果电池
【课堂练习】如图为番茄电池,下列说法正确的是( )
A.电子由铜电极通过导线流向锌电极
B.该装置是将电能转化为化学能的装置
C.锌电极发生氧化反应
D.电流由锌电极通过导线流向铜电极
c
原电池的设计
该氧化还原反应可拆分为如下两个半反应:
正极反应: 2Fe3++2e-==2Fe2+
负极反应: Cu-2e-==Cu2+
负极材料:
Cu
电解质溶液:
FeCl3
正极材料:
比Cu更不活泼的金属或石墨等
思 考 题
请根据反应 2Fe3+ + Fe = 3 Fe 2+设计原电池,你有哪些可行方案
(负极)Fe
Fe(NO3)3
Fe(SO4)3
Cu
Ag
Pt
负极反应: Fe -2e-== Fe 2+
正极反应: 2Fe3++2e-==2Fe2+
Fe
负极材料:
电解质溶液:
正极材料:
含Fe3+的盐溶液
比Fe更不活泼的金属或石墨等
1. 比较下列两个原电池输出电流的大小[电解质浓度相同]
物质的氧化性越强,原电池输出电能的能力越强。
问题探讨:
CuSO4
H2SO4
>
Cu2+ H+
氧化性:
>
结论一:其他条件相同时
原电池输出电能的能力
结论二:其他条件相同时
原电池输出电能的能力
2. 比较下列三个原电池输出电流的大小
CuSO4
Al
CuSO4
Fe
问题探讨:
CuSO4
Zn
还原性:
Al
Zn
Fe
> >
> >
物质的还原性越强,原电池输出电能的能力越强。
1、装置设计的合理性
归纳总结:影响原电池输出电能能力的因素:
2、组成原电池的反应物的氧化还原能力。
(1)比较金属活动性强弱
例1:
下列叙述中,可以说明金属甲比乙活泼性强的是
C.将甲乙与稀硫酸组成原电池时甲是负极;
A.甲和乙用导线连接插入稀盐酸溶液中,
乙溶解,甲 上有H2气放出;
B.在氧化–还原反应中,甲比乙失去的电子多;
D.同价态的阳离子,甲比乙的氧化性强;
原电池的主要应用:
C
(2)比较反应速率
例2:
下列制氢气的反应速率最快的是
粗锌和 1mol/L 盐酸;
B.
A.
纯锌和1mol/L 硫酸;
纯锌和18 mol/L 硫酸;
C.
粗锌和1mol/L硫酸的反应中加入几滴CuSO4溶液。
D.
D
原电池的主要应用:
(3)比较金属腐蚀的快慢
例3:
下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是
(4)
(2)
(1)
(3)
原电池的主要应用:
归纳总结:原电池原理的应用
④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。
制作干电池、铅蓄电池、新型高能电池
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
①制作化学电源:
②加快反应速率:
③判断金属活动性的强弱
例如:为防止轮船船体被海水腐蚀,常在船底贴一些锌板
Zn
Cu
H2SO4溶液
1.将铁片和银片用导线连接置于同一稀盐酸溶液中,经过一段时间后,下列各项叙述正确的是( )
A.负极有Cl2逸出,正极有H2逸出
B.负极附近Cl-的浓度减小
C.正极附近Cl-的浓度逐渐增大
D.溶液中Cl-的浓度基本不变
综合训练:
D
2.过量铁与少量稀硫酸反应,为了加快反应速率,但是又不影响生成氢气的总量,可以采取的措施是( )
A.加入适量NaCl溶液
B.加入适量的水
C.加入几滴硫酸铜溶液
D.再加入少量稀硫酸
综合训练:
C
3.如图所示电流表的指针发生偏转,同时A极的质量减小,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
C
综合训练:
A.B极为原电池的正极
B.A、B、C分别为Zn、Cu和稀盐酸
C.C中阳离子向A极移动
D.A极发生氧化反应
4.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
C
A.铜棒的质量 B.c(Zn2+)
C.c(H+) D.c(SO42-)
综合训练:
5.如图是用化学电源使LED灯发光的装置。下列说法错误的是( )
综合训练:
C
A.铜片表面有气泡生成
B.装置中存在“化学能→电能→光能”的转换
C.如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D.如果将锌片换成铁片,电路中的电流方向不变
6.将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液。请画出产生H2的体积V(L)与时间t(min)的关系图像。
一思两变
答案
①a中少量锌粉置换出铜,构成锌铜原电池,反应速率加快;
②由于与H+反应的锌粉减少,最终产生H2的量比b更少
改: 将过量的两份锌粉a、b分别加入定量的稀硫酸,同时向a中加入少量的CuSO4溶液,请画出产生H2的体积V(L)与时间t(min)的关系图像。
答案
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
