2023浙江中考科学一轮复习(基础版)物质科学(二)化学部分知识点整(课件 48张ppt)
文档属性
| 名称 | 2023浙江中考科学一轮复习(基础版)物质科学(二)化学部分知识点整(课件 48张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-01-26 19:03:59 | ||
图片预览









文档简介
(共48张PPT)
2023浙江中考科学一轮复习(基础版)
物质科学(二)化学部分
知识点整理
一、常见元素及原子团的化合价
1.常见元素的化合价
一价钾钠氯氢银
二价氧钙钡镁锌
三铝四硅五价磷
二三铁 二四碳
二四六硫都齐全
莫忘单质都为零
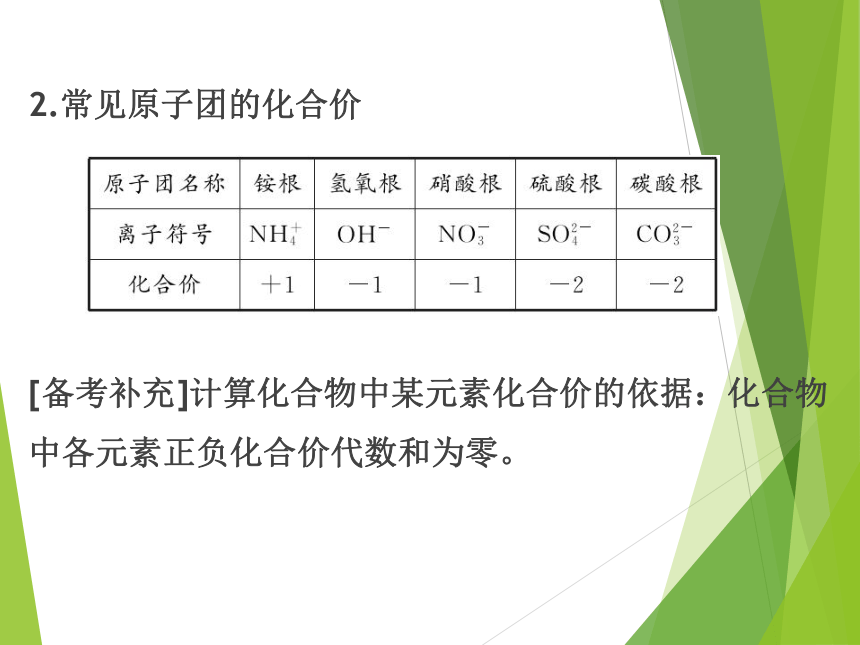
2.常见原子团的化合价
[备考补充]计算化合物中某元素化合价的依据:化合物中各元素正负化合价代数和为零。
二、金属活动性顺序
[记忆口诀]
三、pH与溶液的酸碱性
pH<7时,pH值越接近0,酸性越强;pH>7时,pH值越接近14,碱性越强;pH值越接近7,越接近中性。
四、酸碱指示剂
(1)紫色石蕊试液:遇酸变红,遇碱变蓝,中性显紫色。
(2)无色酚酞试液:遇碱变红,中性和酸性显无色。
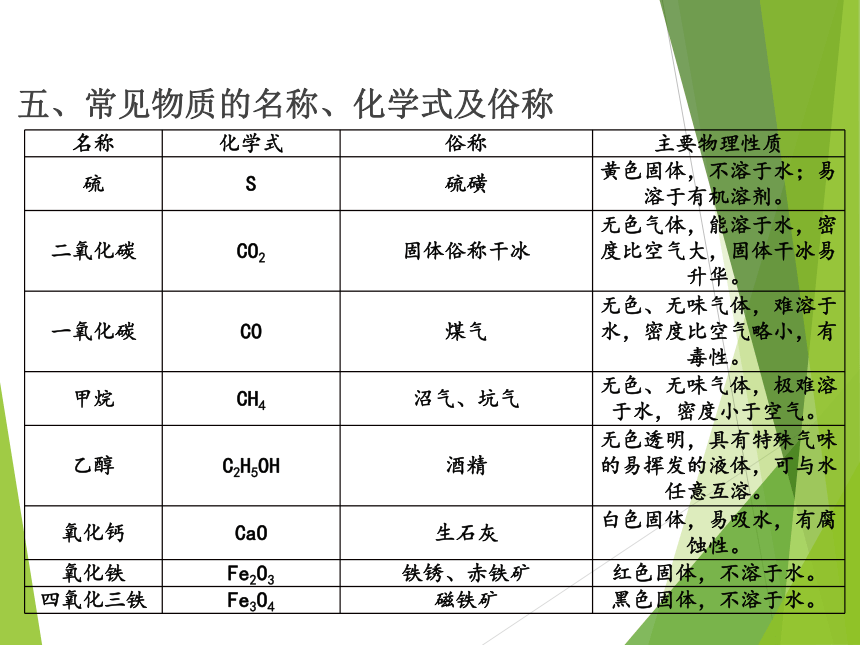
五、常见物质的名称、化学式及俗称
名称 化学式 俗称 主要物理性质
硫 S 硫磺 黄色固体,不溶于水;易溶于有机溶剂。
二氧化碳 CO2 固体俗称干冰 无色气体,能溶于水,密度比空气大,固体干冰易升华。
一氧化碳 CO 煤气 无色、无味气体,难溶于水,密度比空气略小,有毒性。
甲烷 CH4 沼气、坑气 无色、无味气体,极难溶于水,密度小于空气。
乙醇 C2H5OH 酒精 无色透明,具有特殊气味的易挥发的液体,可与水任意互溶。
氧化钙 CaO 生石灰 白色固体,易吸水,有腐蚀性。
氧化铁 Fe2O3 铁锈、赤铁矿 红色固体,不溶于水。
四氧化三铁 Fe3O4 磁铁矿 黑色固体,不溶于水。
氢氧化钠 NaOH 火碱、烧碱、苛性钠 白色固体,极易溶于水,易潮解,有强腐蚀性。
氢氧化钙 Ca(OH)2 熟石灰、消石灰、石灰水 白色粉末状固体,微溶于水,有腐蚀性。
碳酸钠 Na2CO3 纯碱、苏打 白色粉末状固体,易溶于水且吸湿结块。
碳酸钠晶体 Na2CO3·10H2O —— 无色晶体,易失水风化。
碳酸氢钠 NaHCO3 小苏打 白色晶体,易溶于水,但溶解度比Na2CO3小。
氯化钠 NaCl 食盐 ——
碳酸钙 CaCO3 石灰石、大理石 白色固体,不溶于水。
硫酸铜 CuSO4 —— 白色粉末状固体,溶于水,其水溶液为蓝色。
硫酸铜晶体 CuSO4·5H2O 蓝矾、胆矾 蓝色晶体。
高锰酸钾 KMnO4 灰锰氧 紫色有光泽晶体,溶于水,其水溶液为紫色。
氯化银 AgCl —— 新制得为白色凝乳状沉淀,不溶于稀硝酸。
硫酸钡 BaSO4 天然产称重晶石 白色固体,不溶于水,不溶于稀硝酸。
六、常见物质的颜色
1.固体的颜色
①白色固体:碳酸钠、氢氧化钠、氢氧化钙、碳酸钙、氧化钙、碳酸钡、氧化镁、硫酸钡、亚硫酸钡
②黑色固体:铁粉、木炭、氧化铜、二氧化锰、四氧化三铁、硫化铜、硫化亚铜
③红色固体:铜、氧化铁、红磷
④蓝色固体:氢氧化铜、含结晶水的硫酸铜晶体
⑤红褐色固体:氢氧化铁
⑥绿色固体:碱式碳酸铜
⑦紫黑的固体:高锰酸钾
⑧银白色固体:铁、银、铝等金属
2.液体颜色
①蓝色溶液:硫酸铜溶液、氯化铜溶液(含有铜离子)
②黄色溶液:硫酸铁溶液、氯化铁溶液(含有铁离子)
③紫红色溶液:高锰酸钾溶液
④紫色溶液:石蕊试液
⑤浅绿色溶液:硫酸亚铁溶液、氯化亚铁溶液(含有亚铁离子)
3.常见沉淀颜色
①白色:碳酸钙、硫酸钡、碳酸钡、氯化银、氢氧化亚铁
②红褐色:氢氧化铁
③蓝色:氢氧化铜
4.火焰颜色:
①蓝紫色:S(氧气中)
②淡蓝色:H2、S(空气中)
③蓝色:CO、CH4
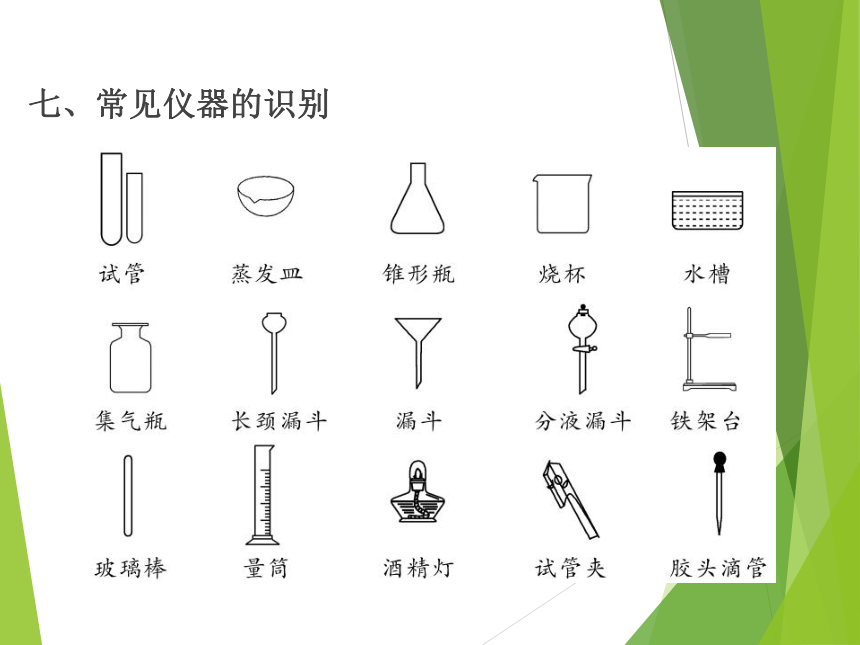
七、常见仪器的识别
八、基本实验操作
(1)药品取用的基本原则
①取用原则:“手不摸、嘴不尝、味扇闻”。
②节约原则:未指明用量时,液体取1~2 mL,固体只需盖满试管底部。
③防污染原则:用剩药品既不能放回原瓶,也不能随意丢弃,更不能带出实验室,应放在指定容器中。
④闻药品气味的方法。
2.固体药品的取用和称量
(1)固体药品的取用
固体药品通常保存在广口瓶里,取用固体药品一般用药匙。有些块状的药品(如石灰石等)可用镊子夹取。
(2)固体药品的称量(天平的使用)
3.液体药品的取用
(1)取用较多量:直接倾倒
(2)取用少量:胶头滴管滴加
[易错警示]
a.取液后的胶头滴管,应保持橡胶胶帽在上,不要平放或倒置,防止液体倒流,污染试剂或腐蚀橡胶胶帽;b.不要把胶头滴管放在实验台或其他地方,以免污染胶头滴管;c.用过的胶头滴管要立即用水冲洗干净(滴瓶上的胶头滴管不能用水冲洗),以备再用;d.严禁用未经清洗的胶头滴管再吸取其他试剂。
(3)取用一定量:量筒量取
首先向量筒内倾倒液体,在接近刻度时改用滴管滴加至刻度线。
4.物质的加热
(1)酒精灯的使用
(2)给固体加热
(3)给液体加热
5.仪器的连接
(1)连接玻璃管和橡胶塞/胶皮管:润湿、转动
(2)连接试管和橡胶塞:转动
6.检查装置气密性
将导管末端浸入水中,用手握住试管外壁,若导管末端有气泡产生,松开手后导管末端形成一段水柱并且不下降,则说明装置气密性良好
7.稀释浓硫酸
8.测定溶液pH
9.过滤
10.蒸发
九、气体的检验
1.二氧化碳:将气体通入澄清石灰水,若澄清石灰水变浑浊,则说明是二氧化碳。
2.氧气:将带火星的木条伸入集气瓶中,若木条复燃则说明是氧气。
3.水蒸气:将气体通过无水硫酸铜,若白色固体变蓝,则说明是水蒸气。
4.氢气:点燃气体,产生淡蓝色火焰,在火焰上方罩一个干冷的小烧杯,若观察到烧杯内壁有水珠出现,往烧杯中倒入少量澄清石灰水,若不变浑浊,则说明是氢气。
5.氨气:将湿润的红色石蕊试纸伸入瓶内,若试纸变蓝,则说明是氨气。
十、离子的检验
1.碳酸根离子:加CaCl2(或BaCl2)溶液产生白色沉淀,向沉淀中加酸,产生气泡,将生成的气体通入澄清石灰水,若澄清石灰水变浑浊,则存在碳酸根离子。
2.硫酸根离子:加入硝酸钡溶液和稀硝酸,若有白色沉淀产生,则存在硫酸根离子。
3.氯离子:加入硝酸银溶液和稀硝酸,若有白色沉淀产生,则存在氯离子。
4.铵根离子:加入氢氧化钠并加热,将湿润的红色石蕊试纸放在试管口,若有刺激性气味气体产生且试纸变蓝,则存在铵根离子。
5.氢离子:滴加紫色石蕊试液/加入活泼金属/加入碳酸盐,石蕊试液变红/产生气泡。
6.氢氧根离子:滴加无色酚酞试液/硫酸铜溶液,溶液变为红色/产生蓝色沉淀。
十一、化学中常见物质的除杂(括号内为杂质)
1.CO2(CO):通过灼热的氧化铜
2.CO(CO2):先通过足量的氢氧化钠溶液,然后再通过浓硫酸
3.H2(水蒸气):通过浓硫酸/通过氢氧化钠固体
4.CO2(HCl):通过足量的Na2CO3溶液,然后再通过浓硫酸
5.CuO(C):在空气中(或氧气流中)灼烧混合物
6.Cu(Fe):加入足量的稀硫酸、过滤
7.Cu(CuO):加入足量的稀硫酸、过滤
8.FeSO4溶液(CuSO4溶液):加入足量铁粉、过滤
9.NaCl(NaOH):加入足量稀盐酸、蒸发
10.NaCl(Na2CO3):加入足量稀盐酸、蒸发
11.NaCl溶液(Na2SO4溶液):加入适量的氯化钡溶液,过滤
12.NaCl溶液(CuSO4溶液):加入适量的氢氧化钡溶液,过滤
13.NaOH溶液(Na2CO3溶液):加入适量氢氧化钙溶液,过滤
14.NaNO3溶液(NaCl溶液):加入适量的硝酸银溶液,过滤
15.KNO3溶液(NaCl溶液):冷却热饱和溶液,过滤
十二、常用的化学计算公式
1.相对原子的质量
3.不纯物的质量×纯度=纯净物的质量
溶质质量=溶液质量×溶质质量分数,溶质质量=溶液质量-溶剂质量
5.稀释计算:溶质质量不变
m(浓溶液)×ω(浓溶液)=m(稀溶液)×ω(稀溶液)
溶液质量(g)=溶液体积(mL)×溶液密度(g/mL)
十三、常考化学方程式梳理
实验室制气类
1.过氧化氢制氧气
①二氧化锰作催化剂
2H2O2 2H2O+O2↑
②氯化铁作催化剂
2H2O2 2H2O+O2↑
2.高锰酸钾制氧气
2KMnO4 K2MnO4+MnO2+O2↑
3.氯酸钾分解制氧气
2KClO3 2KCl+3O2↑
4.碳酸钙与稀盐酸反应制取二氧化碳
CaCO3+2HCl===CaCl2+H2O+CO2↑
有氧气参加的反应
非金属单质与氧气的反应
1.碳在氧气中充分燃烧
C+O2 CO2
2.硫在空气中燃烧
S+O2 SO2
金属单质与氧气的反应
1.锂与氧气反应生成过氧化锂
2Li+O2===Li2O2
2.铁在氧气中燃烧
3Fe+2O2 Fe3O4
3.镁与氧气的反应
2Mg+O2 2MgO
化合物与氧气的反应
1.氨气与氧气在一定条件下反应生成氮气和水
4NH3+3O2 2N2+6H2O
2.甲烷在空气中完全燃烧
CH4+2O2 CO2+2H2O
电解水
电解水
2H2O 2H2↑+O2↑
有二氧化碳参加的反应
二氧化碳和水的反应
CO2+H2O===H2CO3
金属的冶炼
铁的冶炼
一氧化碳还原氧化铁
Fe2O3+3CO 2Fe+3CO2
铜的冶炼
1.一氧化碳还原氧化铜
CO+CuO Cu+CO2
2.氧化铜与碳反应
C+2CuO 2Cu+CO2↑
3.氢气还原氧化铜
CuO+H2 Cu+H2O
金属与酸的反应
通式:金属+酸―→盐+氢气
1.铁与稀硫酸反应
Fe+H2SO4===FeSO4+H2↑
2.铁与稀盐酸反应
Fe+2HCl===FeCl2+H2↑
3.铜与浓硫酸反应
Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑
4.铝与稀盐酸反应
2Al+6HCl===2AlCl3+3H2↑
5.锌粒与稀盐酸反应
Zn+2HCl===ZnCl2+H2↑
金属与盐的反应
通式:金属+盐(溶液)―→另一种金属+另一种盐
铁与硫酸铜
Fe+CuSO4===FeSO4+Cu
金属氧化物与酸的反应
通式:金属氧化物+酸―→盐+水
1.黑色氧化铜与硫酸
CuO+H2SO4===CuSO4+H2O
2.氧化铜与盐酸
CuO+2HCl===CuCl2+H2O
3.铁锈(氧化铁)与盐酸
Fe2O3+6HCl===2FeCl3+3H2O
非金属氧化物与碱的反应
通式:非金属氧化物+碱―→盐+水
1.二氧化硫与氢氧化钠的反应
SO2+2NaOH===Na2SO3+H2O
2.二氧化碳和氢氧化钡的反应
CO2+Ba(OH)2===BaCO3↓+H2O
3.二氧化碳和氢氧化钠的反应
2NaOH+CO2===Na2CO3+H2O
酸与碱的反应
通式:酸+碱―→盐+水
1.硫酸与氢氧化铜的反应
Cu(OH)2+H2SO4===CuSO4+2H2O
2.氢氧化钠和盐酸
NaOH+HCl===NaCl+H2O
3.盐酸与氢氧化钙的反应
Ca(OH)2+2HCl===CaCl2+2H2O
酸与盐的反应
通式:酸+盐―→另一种酸+另一种盐
1.碳酸钠与盐酸反应
Na2CO3+2HCl===2NaCl+H2O+CO2↑
2.碳酸钠与稀硫酸反应
Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
3.碳酸钡与稀硝酸反应
BaCO3+2HNO3===Ba(NO3)2+H2O+CO2↑
碱与盐的反应
通式:碱+盐―→另一种碱+另一种盐
氢氧化钙与碳酸钠反应
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
盐与盐的反应
通式:盐+盐―→两种新盐
氯化钠与硝酸银溶液反应
NaCl+AgNO3===AgCl↓+NaNO3
其他反应
1.硝酸见光分解
4HNO3 4NO2↑+2H2O+O2↑
2.氧化汞受热分解
2HgO 2Hg+O2↑
3.碳酸氢钠受热分解
2NaHCO3 Na2CO3+H2O+CO2↑
4.向饱和的氯化钠的溶液中通入氨气,再通入二氧化碳气体的反应
NaCl+NH3+CO2+H2O===NH4Cl+NaHCO3↓
5.钠与水反应
2Na+2H2O===2NaOH+H2↑
6.氯化镁通电分解生成镁和氯气
MgCl2 Mg+Cl2↑
7.氢氧化亚铁常温下与氧气、水反应
4Fe(OH)2+O2+2H2O===4Fe(OH)3
8.二氧化氮与一氧化碳在催化剂的作用下转化为氮气和二氧化碳
2NO2+4CO N2+4CO2
9.铝和氢氧化钠溶液反应
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
10.碳酸钙高温分解
CaCO3 CaO+CO2↑
11.氯气和碘化钠反应
Cl2+2NaI===I2+2NaCl
12.镁在高温条件下跟水反应生成氢氧化镁和氢气
Mg+2H2O Mg(OH)2+H2
13.碳和二氧化碳高温条件下反应生成一氧化碳
C+CO2 2CO
14.次氯酸钠与盐酸混合生成氯化钠、水及有毒的氯气
NaClO+2HCl===NaCl+H2O+Cl2↑
2023浙江中考科学一轮复习(基础版)
物质科学(二)化学部分
知识点整理
一、常见元素及原子团的化合价
1.常见元素的化合价
一价钾钠氯氢银
二价氧钙钡镁锌
三铝四硅五价磷
二三铁 二四碳
二四六硫都齐全
莫忘单质都为零
2.常见原子团的化合价
[备考补充]计算化合物中某元素化合价的依据:化合物中各元素正负化合价代数和为零。
二、金属活动性顺序
[记忆口诀]
三、pH与溶液的酸碱性
pH<7时,pH值越接近0,酸性越强;pH>7时,pH值越接近14,碱性越强;pH值越接近7,越接近中性。
四、酸碱指示剂
(1)紫色石蕊试液:遇酸变红,遇碱变蓝,中性显紫色。
(2)无色酚酞试液:遇碱变红,中性和酸性显无色。
五、常见物质的名称、化学式及俗称
名称 化学式 俗称 主要物理性质
硫 S 硫磺 黄色固体,不溶于水;易溶于有机溶剂。
二氧化碳 CO2 固体俗称干冰 无色气体,能溶于水,密度比空气大,固体干冰易升华。
一氧化碳 CO 煤气 无色、无味气体,难溶于水,密度比空气略小,有毒性。
甲烷 CH4 沼气、坑气 无色、无味气体,极难溶于水,密度小于空气。
乙醇 C2H5OH 酒精 无色透明,具有特殊气味的易挥发的液体,可与水任意互溶。
氧化钙 CaO 生石灰 白色固体,易吸水,有腐蚀性。
氧化铁 Fe2O3 铁锈、赤铁矿 红色固体,不溶于水。
四氧化三铁 Fe3O4 磁铁矿 黑色固体,不溶于水。
氢氧化钠 NaOH 火碱、烧碱、苛性钠 白色固体,极易溶于水,易潮解,有强腐蚀性。
氢氧化钙 Ca(OH)2 熟石灰、消石灰、石灰水 白色粉末状固体,微溶于水,有腐蚀性。
碳酸钠 Na2CO3 纯碱、苏打 白色粉末状固体,易溶于水且吸湿结块。
碳酸钠晶体 Na2CO3·10H2O —— 无色晶体,易失水风化。
碳酸氢钠 NaHCO3 小苏打 白色晶体,易溶于水,但溶解度比Na2CO3小。
氯化钠 NaCl 食盐 ——
碳酸钙 CaCO3 石灰石、大理石 白色固体,不溶于水。
硫酸铜 CuSO4 —— 白色粉末状固体,溶于水,其水溶液为蓝色。
硫酸铜晶体 CuSO4·5H2O 蓝矾、胆矾 蓝色晶体。
高锰酸钾 KMnO4 灰锰氧 紫色有光泽晶体,溶于水,其水溶液为紫色。
氯化银 AgCl —— 新制得为白色凝乳状沉淀,不溶于稀硝酸。
硫酸钡 BaSO4 天然产称重晶石 白色固体,不溶于水,不溶于稀硝酸。
六、常见物质的颜色
1.固体的颜色
①白色固体:碳酸钠、氢氧化钠、氢氧化钙、碳酸钙、氧化钙、碳酸钡、氧化镁、硫酸钡、亚硫酸钡
②黑色固体:铁粉、木炭、氧化铜、二氧化锰、四氧化三铁、硫化铜、硫化亚铜
③红色固体:铜、氧化铁、红磷
④蓝色固体:氢氧化铜、含结晶水的硫酸铜晶体
⑤红褐色固体:氢氧化铁
⑥绿色固体:碱式碳酸铜
⑦紫黑的固体:高锰酸钾
⑧银白色固体:铁、银、铝等金属
2.液体颜色
①蓝色溶液:硫酸铜溶液、氯化铜溶液(含有铜离子)
②黄色溶液:硫酸铁溶液、氯化铁溶液(含有铁离子)
③紫红色溶液:高锰酸钾溶液
④紫色溶液:石蕊试液
⑤浅绿色溶液:硫酸亚铁溶液、氯化亚铁溶液(含有亚铁离子)
3.常见沉淀颜色
①白色:碳酸钙、硫酸钡、碳酸钡、氯化银、氢氧化亚铁
②红褐色:氢氧化铁
③蓝色:氢氧化铜
4.火焰颜色:
①蓝紫色:S(氧气中)
②淡蓝色:H2、S(空气中)
③蓝色:CO、CH4
七、常见仪器的识别
八、基本实验操作
(1)药品取用的基本原则
①取用原则:“手不摸、嘴不尝、味扇闻”。
②节约原则:未指明用量时,液体取1~2 mL,固体只需盖满试管底部。
③防污染原则:用剩药品既不能放回原瓶,也不能随意丢弃,更不能带出实验室,应放在指定容器中。
④闻药品气味的方法。
2.固体药品的取用和称量
(1)固体药品的取用
固体药品通常保存在广口瓶里,取用固体药品一般用药匙。有些块状的药品(如石灰石等)可用镊子夹取。
(2)固体药品的称量(天平的使用)
3.液体药品的取用
(1)取用较多量:直接倾倒
(2)取用少量:胶头滴管滴加
[易错警示]
a.取液后的胶头滴管,应保持橡胶胶帽在上,不要平放或倒置,防止液体倒流,污染试剂或腐蚀橡胶胶帽;b.不要把胶头滴管放在实验台或其他地方,以免污染胶头滴管;c.用过的胶头滴管要立即用水冲洗干净(滴瓶上的胶头滴管不能用水冲洗),以备再用;d.严禁用未经清洗的胶头滴管再吸取其他试剂。
(3)取用一定量:量筒量取
首先向量筒内倾倒液体,在接近刻度时改用滴管滴加至刻度线。
4.物质的加热
(1)酒精灯的使用
(2)给固体加热
(3)给液体加热
5.仪器的连接
(1)连接玻璃管和橡胶塞/胶皮管:润湿、转动
(2)连接试管和橡胶塞:转动
6.检查装置气密性
将导管末端浸入水中,用手握住试管外壁,若导管末端有气泡产生,松开手后导管末端形成一段水柱并且不下降,则说明装置气密性良好
7.稀释浓硫酸
8.测定溶液pH
9.过滤
10.蒸发
九、气体的检验
1.二氧化碳:将气体通入澄清石灰水,若澄清石灰水变浑浊,则说明是二氧化碳。
2.氧气:将带火星的木条伸入集气瓶中,若木条复燃则说明是氧气。
3.水蒸气:将气体通过无水硫酸铜,若白色固体变蓝,则说明是水蒸气。
4.氢气:点燃气体,产生淡蓝色火焰,在火焰上方罩一个干冷的小烧杯,若观察到烧杯内壁有水珠出现,往烧杯中倒入少量澄清石灰水,若不变浑浊,则说明是氢气。
5.氨气:将湿润的红色石蕊试纸伸入瓶内,若试纸变蓝,则说明是氨气。
十、离子的检验
1.碳酸根离子:加CaCl2(或BaCl2)溶液产生白色沉淀,向沉淀中加酸,产生气泡,将生成的气体通入澄清石灰水,若澄清石灰水变浑浊,则存在碳酸根离子。
2.硫酸根离子:加入硝酸钡溶液和稀硝酸,若有白色沉淀产生,则存在硫酸根离子。
3.氯离子:加入硝酸银溶液和稀硝酸,若有白色沉淀产生,则存在氯离子。
4.铵根离子:加入氢氧化钠并加热,将湿润的红色石蕊试纸放在试管口,若有刺激性气味气体产生且试纸变蓝,则存在铵根离子。
5.氢离子:滴加紫色石蕊试液/加入活泼金属/加入碳酸盐,石蕊试液变红/产生气泡。
6.氢氧根离子:滴加无色酚酞试液/硫酸铜溶液,溶液变为红色/产生蓝色沉淀。
十一、化学中常见物质的除杂(括号内为杂质)
1.CO2(CO):通过灼热的氧化铜
2.CO(CO2):先通过足量的氢氧化钠溶液,然后再通过浓硫酸
3.H2(水蒸气):通过浓硫酸/通过氢氧化钠固体
4.CO2(HCl):通过足量的Na2CO3溶液,然后再通过浓硫酸
5.CuO(C):在空气中(或氧气流中)灼烧混合物
6.Cu(Fe):加入足量的稀硫酸、过滤
7.Cu(CuO):加入足量的稀硫酸、过滤
8.FeSO4溶液(CuSO4溶液):加入足量铁粉、过滤
9.NaCl(NaOH):加入足量稀盐酸、蒸发
10.NaCl(Na2CO3):加入足量稀盐酸、蒸发
11.NaCl溶液(Na2SO4溶液):加入适量的氯化钡溶液,过滤
12.NaCl溶液(CuSO4溶液):加入适量的氢氧化钡溶液,过滤
13.NaOH溶液(Na2CO3溶液):加入适量氢氧化钙溶液,过滤
14.NaNO3溶液(NaCl溶液):加入适量的硝酸银溶液,过滤
15.KNO3溶液(NaCl溶液):冷却热饱和溶液,过滤
十二、常用的化学计算公式
1.相对原子的质量
3.不纯物的质量×纯度=纯净物的质量
溶质质量=溶液质量×溶质质量分数,溶质质量=溶液质量-溶剂质量
5.稀释计算:溶质质量不变
m(浓溶液)×ω(浓溶液)=m(稀溶液)×ω(稀溶液)
溶液质量(g)=溶液体积(mL)×溶液密度(g/mL)
十三、常考化学方程式梳理
实验室制气类
1.过氧化氢制氧气
①二氧化锰作催化剂
2H2O2 2H2O+O2↑
②氯化铁作催化剂
2H2O2 2H2O+O2↑
2.高锰酸钾制氧气
2KMnO4 K2MnO4+MnO2+O2↑
3.氯酸钾分解制氧气
2KClO3 2KCl+3O2↑
4.碳酸钙与稀盐酸反应制取二氧化碳
CaCO3+2HCl===CaCl2+H2O+CO2↑
有氧气参加的反应
非金属单质与氧气的反应
1.碳在氧气中充分燃烧
C+O2 CO2
2.硫在空气中燃烧
S+O2 SO2
金属单质与氧气的反应
1.锂与氧气反应生成过氧化锂
2Li+O2===Li2O2
2.铁在氧气中燃烧
3Fe+2O2 Fe3O4
3.镁与氧气的反应
2Mg+O2 2MgO
化合物与氧气的反应
1.氨气与氧气在一定条件下反应生成氮气和水
4NH3+3O2 2N2+6H2O
2.甲烷在空气中完全燃烧
CH4+2O2 CO2+2H2O
电解水
电解水
2H2O 2H2↑+O2↑
有二氧化碳参加的反应
二氧化碳和水的反应
CO2+H2O===H2CO3
金属的冶炼
铁的冶炼
一氧化碳还原氧化铁
Fe2O3+3CO 2Fe+3CO2
铜的冶炼
1.一氧化碳还原氧化铜
CO+CuO Cu+CO2
2.氧化铜与碳反应
C+2CuO 2Cu+CO2↑
3.氢气还原氧化铜
CuO+H2 Cu+H2O
金属与酸的反应
通式:金属+酸―→盐+氢气
1.铁与稀硫酸反应
Fe+H2SO4===FeSO4+H2↑
2.铁与稀盐酸反应
Fe+2HCl===FeCl2+H2↑
3.铜与浓硫酸反应
Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑
4.铝与稀盐酸反应
2Al+6HCl===2AlCl3+3H2↑
5.锌粒与稀盐酸反应
Zn+2HCl===ZnCl2+H2↑
金属与盐的反应
通式:金属+盐(溶液)―→另一种金属+另一种盐
铁与硫酸铜
Fe+CuSO4===FeSO4+Cu
金属氧化物与酸的反应
通式:金属氧化物+酸―→盐+水
1.黑色氧化铜与硫酸
CuO+H2SO4===CuSO4+H2O
2.氧化铜与盐酸
CuO+2HCl===CuCl2+H2O
3.铁锈(氧化铁)与盐酸
Fe2O3+6HCl===2FeCl3+3H2O
非金属氧化物与碱的反应
通式:非金属氧化物+碱―→盐+水
1.二氧化硫与氢氧化钠的反应
SO2+2NaOH===Na2SO3+H2O
2.二氧化碳和氢氧化钡的反应
CO2+Ba(OH)2===BaCO3↓+H2O
3.二氧化碳和氢氧化钠的反应
2NaOH+CO2===Na2CO3+H2O
酸与碱的反应
通式:酸+碱―→盐+水
1.硫酸与氢氧化铜的反应
Cu(OH)2+H2SO4===CuSO4+2H2O
2.氢氧化钠和盐酸
NaOH+HCl===NaCl+H2O
3.盐酸与氢氧化钙的反应
Ca(OH)2+2HCl===CaCl2+2H2O
酸与盐的反应
通式:酸+盐―→另一种酸+另一种盐
1.碳酸钠与盐酸反应
Na2CO3+2HCl===2NaCl+H2O+CO2↑
2.碳酸钠与稀硫酸反应
Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
3.碳酸钡与稀硝酸反应
BaCO3+2HNO3===Ba(NO3)2+H2O+CO2↑
碱与盐的反应
通式:碱+盐―→另一种碱+另一种盐
氢氧化钙与碳酸钠反应
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
盐与盐的反应
通式:盐+盐―→两种新盐
氯化钠与硝酸银溶液反应
NaCl+AgNO3===AgCl↓+NaNO3
其他反应
1.硝酸见光分解
4HNO3 4NO2↑+2H2O+O2↑
2.氧化汞受热分解
2HgO 2Hg+O2↑
3.碳酸氢钠受热分解
2NaHCO3 Na2CO3+H2O+CO2↑
4.向饱和的氯化钠的溶液中通入氨气,再通入二氧化碳气体的反应
NaCl+NH3+CO2+H2O===NH4Cl+NaHCO3↓
5.钠与水反应
2Na+2H2O===2NaOH+H2↑
6.氯化镁通电分解生成镁和氯气
MgCl2 Mg+Cl2↑
7.氢氧化亚铁常温下与氧气、水反应
4Fe(OH)2+O2+2H2O===4Fe(OH)3
8.二氧化氮与一氧化碳在催化剂的作用下转化为氮气和二氧化碳
2NO2+4CO N2+4CO2
9.铝和氢氧化钠溶液反应
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
10.碳酸钙高温分解
CaCO3 CaO+CO2↑
11.氯气和碘化钠反应
Cl2+2NaI===I2+2NaCl
12.镁在高温条件下跟水反应生成氢氧化镁和氢气
Mg+2H2O Mg(OH)2+H2
13.碳和二氧化碳高温条件下反应生成一氧化碳
C+CO2 2CO
14.次氯酸钠与盐酸混合生成氯化钠、水及有毒的氯气
NaClO+2HCl===NaCl+H2O+Cl2↑
同课章节目录
