湖北省黄石市名校2022-2023学年高一上学期期末考试化学试卷(含答案)
文档属性
| 名称 | 湖北省黄石市名校2022-2023学年高一上学期期末考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-27 10:27:37 | ||
图片预览




文档简介
黄石市名校2022-2023学年高一上学期期末考试
化学试题
本试题卷共10页,20题。全卷满分100分。考试用时75分钟。
注意事项:
答卷前,考生务必将自己的姓名、淮考证号填写在答题卡上。
回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量: H-1 C-12 O-16 Na-23 Al-27 Cl-35.5 Fe-56 Cu-64
一、选择题:本题共15小题,每小题3分,共45分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 中国传统文化对人类文明贡献巨大。下列古代文献及诗句中涉及的化学研究成果,对其说明合理的是
A.李白诗句“日照香炉生紫烟,遥看瀑布挂前川”,“紫烟”指“香炉”中碘升华的现象
B.“墨滴无声入水惊,如烟袅袅幻形生”中的“墨滴”的分散质粒子直径在之间,具有
胶体的性质
C.“南朝四百八十寺,多少楼台烟雨中”中的“烟雨”指悬浮在空中的固体颗粒
D.《天工开物·五金》中记载:“若造熟铁,则生铁流出时,相连数尺内,众人柳棍疾搅,即时炒
成熟铁。”炒铁是为了降低铁水中的碳含量,且熟铁比生铁质地更硬,延展性稍差
下列有关物质性质的叙述错误的是
A.少量铁在足量氧气中燃烧可以得到Fe2O3固体
B.将工业废气通入FeCl2溶液中,可除去工业废气中的氯气
C.高温下将水蒸气通入铁粉中,固体质量增加
D.制备Fe(OH)2过程中应该注意隔绝空气
3. 下列叙述正确的是
A.常温下,5.6 g Fe与足量稀HNO3反应,转移0.2NA个电子
B.标准状况下,1.12 L 1H2和0.2 g 2H2均含有0.1NA个质子
C.在50 g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA
D.将CO2通过Na2O2使其增重a g,反应中转移的电子数为a·NA/14
4. 下列由实验现象所得结论错误的是
A.向SO2溶液中滴加氢硫酸,产生淡黄色沉淀,证明SO2具有氧化性
B.向酸性KMnO4溶液中加入少量Fe3O4粉末,紫色褪去,证明Fe3O4中含+2价Fe
C.向浓HNO3中插入红热的木炭,产生红棕色气体,证明木炭可与浓HNO3反应生成NO2
D.向H2O2溶液中滴加淀粉溶液,再滴加KI溶液,溶液变蓝色,证明氧化性H2O2强于I2
5. 下列离子方程式中正确的是
A.在浓度均为0.3mol/L的NaOH和的混合液中逐滴加入等体积的0.7mol/L稀盐酸:
B.溶液和适量溶液混合至生成的沉淀恰好完全溶解:
C.向的酸性溶液中通入足量:
D.溶液中通入至恰好完全被氧化:
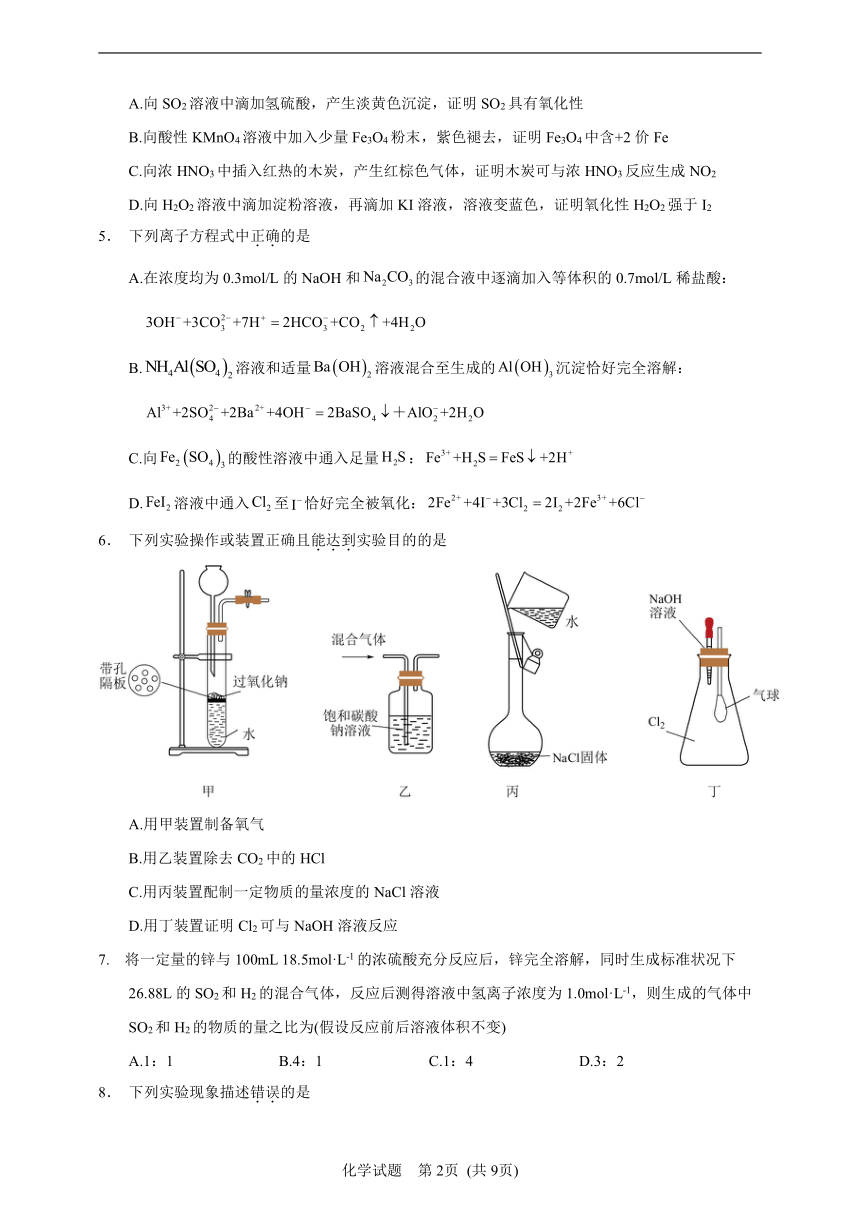
6. 下列实验操作或装置正确且能达到实验目的的是
A.用甲装置制备氧气
B.用乙装置除去CO2中的HCl
C.用丙装置配制一定物质的量浓度的NaCl溶液
D.用丁装置证明Cl2可与NaOH溶液反应
7. 将一定量的锌与100mL 18.5mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成标准状况下26.88L的SO2和H2的混合气体,反应后测得溶液中氢离子浓度为1.0mol·L-1,则生成的气体中SO2和H2的物质的量之比为(假设反应前后溶液体积不变)
A.1:1 B.4:1 C.1:4 D.3:2
下列实验现象描述错误的是
选项 实验 现象
A 加热放在坩埚中的钠 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体
B 在酒精灯上加热铝箔 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着
C 在Cl2中点燃铁丝 铁丝剧烈燃烧,并伴有棕黄色的烟
D 在空气中久置的铝条放入NaOH溶液中 立刻产生大量无色气体,铝条逐渐变细
A.A B.B C.C D.D
9. 物理量“物质的量”的引入,不仅可以建立微观与宏观的联系,还可以从定量的角度认识物质及其变化。下列有关表述正确的是
A.在标准状况下,VL氨气溶于1L水配成密度为的氨水,该氨水的物质的量浓度为
B.20℃,101KPa,等质量的和的体积比是9:22
C.实验室配制物质的量浓度为0.2mol/L的NaOH溶液480mL溶液,需要用托盘天平称量4.0g
D.物质的量浓度相同、体积相同的三种物质的溶液:、、,分别与相
同物质的量浓度的恰好反应,消耗溶液的体积比为3:1:1
10.下列有关浓硫酸的叙述正确的的项数是
①浓硫酸在常温下能够使金属铁、铝钝化
②浓硫酸与铜加热反应后,铜片有剩余,硫酸完全反应
③浓硫酸具有吸水性,因而能使蔗糖炭化
④浓硫酸与铜加热反应后,铜片有剩余,向反应后的溶液中再加入过量铁片,会有氢气生成
⑤浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
⑥浓硫酸与铁加热反应后,铁片有剩余,生成的气体除水蒸气外只有SO2
⑦浓硫酸具有强氧化性,常温下能与Cu发生剧烈反应
⑧浓硫酸具有强氧化性,SO2具有还原性,所以浓硫酸不能干燥SO2
⑨向的浓硫酸中加入足量Cu并加热使其充分反应,被还原的和生成的SO2
气体均小于
A.3 B.4 C.5 D.6
11.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与3.36LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol·L-1NaOH溶液至 Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60mL B.120mL C.240mL D.360mL
12.某酸性溶液中可能含有、、、、、、、和。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是
A.反应①发生反应的离子方程式为
B.溶液中至少有6种离子大量存在,其中一定存在,且
C.溶液中可能含有,一定含有,可取少量原溶液加入溶液检验
D.、、一定存在,、一定不存在
13.同一还原剂与多种氧化剂在一起时,先与氧化性强的粒子反应,待强的反应完后,再与氧化性弱的反应,称为反应先后规律。已知,且氧化性:,在溶有和的溶液中加入铁粉,下列说法中正确的是
A.若铁粉无剩余,且溶液中有,则溶液中一定无
B.若铁粉无剩余,且溶液中无,则溶液中一定有,也可能有
C.若铁粉有剩余,则不溶物中一定有铜
D.若铁粉有剩余,则溶液中的金属阳离子有和
14.某矿物X由Al2O3、Fe2O3、Cu2O、SiO2的一种或几种物质组成。现进行下图实验:
(已知:Cu2O+2H+=Cu+Cu2++H2O且每步反应都充分)下列说法正确的是
A.根据上述步骤可以判断矿物X中n(Cu2O)/n(Fe2O3)>1
B.步骤1中减少的固体一定是混合物
C.根据步骤2可以得出蓝色溶液中n(Cu2+)=0.02mol
D.根据步骤1、2可以判断出X中氧化铁的质量分数为50%
15.将9g铜和铁的混合物投入到100mL稀硝酸中,充分反应后得到标准状况下1.12LNO,剩余4.8g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12LNO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法不正确的是
A.原混合物中铜和铁各0.075mol
B.稀硝酸的物质的量浓度为2.0mol·L-1
C.第一次剩余4.8g金属为铜和铁
D.向反应后的溶液中再加入该稀硝酸100mL,又得到NO在标准状况下体积小于1.12L
二、非选择题:本题共5小题,共55分。
16.(11分)为保证家中所用器具与居住环境的洁净卫生,往往需使用各种各样的消毒剂,其中含氯
消毒剂是目前广泛使用的一类消毒剂。
(1)用下列两种方法制取氯气:①用含有146 g HCl的浓盐酸与足量的反应;②用87 g 与足量的浓盐酸反应,所得氯气__________(填标号)。
A.②比①多 B.①比②多 C.一样多 D.无法比较
(2)氯气通入淀粉-KI溶液后可观察到溶液变蓝,可得氧化性:__________(填“>”或“<”),已知氧化性,若将71g通入含1 mol 的溶液中,写出反应的离子方程式:_________
____________。
(3)是新型消毒剂,已知在酸性条件下可发生反应生成NaCl并释放出,该反应的离子方程式为_____________________。NaOH溶液吸收,生成物质的量之比为1:1的两种盐,其中一种为,写出该反应的离子方程式:_____________________。
(4)漂白粉的有效成分为__________(填化学式,下同),露置于空气中一段时间的漂白粉,加稀盐酸后产生的气体中除了可能有和HCl之外,还可能含有__________。在制备漂白粉的过程中,若温度控制不当,易生成,若向溶液中通入一定量的,已知制得的混合物中,则反应中被氧化和被还原的Cl的物质的量之比为__________。
17.(10分)森达斯特合金是一种优良的磁性合金材料,主要成分为Fe-Al-Si-Cu,某兴趣小组称取
mg几小块清洗干净的合金碎片,设计如下流程,制取溶液、硝酸铜晶体并测定铝的质量分数:
已知:Si不溶于盐酸、硫酸、硝酸。请回答下列问题:
(1)固体I中的主要成分为__________(填化学式)。
(2)溶液I加入NaOH溶液后,铝元素发生的离子反应为_____________________。
(3)操作I包括焙烧、冷却、__________;焙烧应在__________(填仪器名称)中进行,合金中铝元素的质量分数为__________(用含m、n的算式表示)。
(4)为完成操作II,某兴趣小组设计出以下三种反应途径:
反应途径①中,还原剂与氧化剂物质的量之比为__________,你认为最佳的反应途径为__________;
(5)欲从溶液III中尽可能多地析出晶体,其方法为:将溶液蒸发浓缩、__________(填操作方法)、__________、冰水洗涤、低温烘干即可获得。(相关物质的溶解度曲线如图所示)。
18.(9分)人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料生产,某化学兴趣小组利用如图装置制备氨气并探究相关性质。
(1)该实验中A装置制备NH3不能用的药品是__________。
A.Ca(OH)2和NH4Cl的固体混合物 B.NH4Cl固体 C.NH4HCO3固体
(2)D装置后接尾气吸收装置。下列能用来吸收尾气的装置是___________(填装置序号)。
(3)若将D与a相连,在E中产生白色沉淀,其化学式为:___________。若向a处分别通入___________(填下列气体编号),在E中也会产生白色沉淀。
A.Cl2 B.NO2 C.N2 D.CO2
(4)实验发现C中粉末完全变红,D中无水硫酸铜变蓝,还产生一种单质气体。
①若红色固体为单质,实验后将C中固体与浓硫酸混合加热,其化学方程式为:________________
_____;若充分反应后红色固体有剩余,再加入下列的___________试剂,固体又可以继续溶解。
A.稀H2SO4 B.FeCl3溶液 C.FeCl2溶液 D.KNO3溶液
②已知Cu2O也为红色固体,反应前C中CuO质量为8g,反应后C中红色固体质量为6.8g,则C中发生的总反应方程式为:_____________________。
19.(12分)氧化还原法、沉淀法等是常用于治理水体污染的重要化学方法。
(1)还原法处理含铬废水:铝粉可将废水中的还原为。如图1所示,废水的不同初始对去除效果有重要影响。
①酸性条件下,铝粉去除反应的离子方程式:_____________________。
②实验证明,若初始过低,的去除效果也不理想,其原因可能是_____________________。
(2)室温下向中逐滴加入。溶液中含碳元素微粒的物质的量随
变化的图像如下图2(因有逸出未画出)。
①在的过程中,反应的离子反应方程式为_____________________;B点溶液中
___________。
②配制溶液时,下列操作会导致溶液浓度偏低的是___________。
a、洗涤后容量瓶未干燥
b、将烧杯中的溶液沿玻璃棒注入容量瓶后立即加水定容
c、定容时俯视刻度线
d、摇匀后加水至液面与刻度线相切
③为确定试样的组成,某同学做如下实验:
A.取的试样,用酒精灯对其充分加热至恒重,冷却后称其质量为。残留在试管中的固体是___________(填化学式)。
B.另取质量为的试样加水溶解后配成溶液,逐滴加入,至时,消耗溶液,继续滴加至反应完全时,又消耗溶液,则试样中的质量分数为___________。
20.(13分)某研究性学习小组请你参与“研究铁与水蒸气反应所得固体物质的成分、性质及再利用”实验探究,并回答下列问题:
【查阅资料】含有Fe3+的盐溶液遇到KSCN溶液时变成红色,含有Fe2+的盐溶液遇到KSCN溶液时不变色。
探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略)。
(1)硬质玻璃管B中发生反应的化学方程式为_____________________。
(2)装置D的作用是_____________________。
探究二:设计如图实验方案确定反应后硬质玻璃管B中黑色固体的成分(已知酸性KMnO4溶液能与盐酸发生反应)。
(3)待硬质玻璃管B冷却后,取少许其中的固体继续进行如图实验:
①试剂B是___________,现象2为______________________。
②若现象1为溶液未变红色,请从硬质玻璃管B中固体物质的成分分析可能的原因:______________
________。
探究三:某学习小组设计用硬质玻璃管B中固体制备Fe3O4纳米材料的流程示意图如图:
已知:①浊液B中铁元素以FeOOH形式存在;
②在操作Ⅰ中,相同条件下测得Fe3O4的产率与R[R=]的关系如图所示。
(4)在滤液A转化为浊液B反应完成后需再加热一段时间除去剩余H2O2,目的是___________________。
(5)设浊液B中FeOOH的物质的量为amol,滤液A中的n(Fe)=bmol。为使Fe3O4的产率最高,则=___________。(填数值,保留3位有效数字)
化学试题 第1页 (共3页)
参考答案:
1.B
【详解】A. “日照香炉生紫烟,遥看瀑布挂前川”, “紫烟”是水产生的雾气,不是碘升华的现象,故A错误;
B.“墨滴”的分散质粒子直径在之间,形成胶体,具有胶体的性质,故B正确;
C.“南朝四百八十寺,多少楼台烟雨中”中的“烟雨”指悬浮在空中的小液滴,故C错误;
D.炒铁是为了降低铁水中的碳含量,熟铁比生铁质地更软,延展性更好,故D错误;
选B。
2.B
【详解】A.少量铁,氧气足量时,可以反应得到Fe2O3固体,故A正确;
B.氯气具有强氧化性,能氧化亚铁离子生成铁离子,铁离子能氧化Fe生成亚铁离子;所以去工业废气中的氯气,还需加入铁粉,故B错误;
C.高温下将水蒸气通入铁粉中,生成四氧化三铁,固体质量增加,故C正确;
D.二价Fe容易被氧化,所以制备Fe(OH)2过程中应该注意隔绝空气,故D正确;
故答案选B。
3.B
【详解】A.常温下,5.6 g Fe与足量稀HNO3反应生成硝酸铁,铁元素化合价由0升高为+3,转移0.3NA个电子,故A错误;
B.标准状况下,1.12 L 1H2含有质子数,0.2 g 2H2含有质子数,故B正确;
C.乙醇、水分子都含氢原子,在50 g质量分数为46%的乙醇水溶液中含有的氢原子总数为,故C错误;
D.CO2和Na2O2反应生成碳酸钠和氧气,反应方程式为2CO2+2Na2O2=O2+2Na2CO3,根据方程式可知,固体质量增加56g,转移2mol电子,将CO2通过Na2O2使其增重a g,反应中转移的电子数为,故D错误;
选B。
4.C
【详解】A.淡黄色沉淀是S,在反应过程中硫元素由SO2中的+4价降低到0价,发生还原反应,SO2体现氧化性,A项不符合题意;
B.酸性高锰酸钾溶液具有强氧化性,与还原性物质反应紫色才会褪去,所以可以证明Fe3O4中有还原性物质,即+2价Fe,B项不符合题意;
C.因为浓硝酸受热易分解,能生成NO2,所以产生红棕色气体,不能说明碳炭与浓HNO3反应生成了NO2,C项符合题意;
D.溶液变蓝色,证明有碘单质生成,证明氧化性H2O2强于I2,D项不符合题意;
故答案为:C。
5.A
【详解】A.在浓度均为 0.3mol/L 的 NaOH 和 Na2CO3 的混合液中逐滴加入等体积的 0.7mol/L 稀盐酸,盐酸先和NaOH再和Na2CO3反应,离子方程式为:,故A正确;
B.和反应过程中,Ba2+和SO反应生成硫酸钡沉淀,OH-先和Al3+反应生成氢氧化铝沉淀,再和NH反应,最后氢氧化铝沉淀再和NaOH反应生成偏铝酸钠,溶液和适量溶液混合至生成的沉淀恰好完全溶解的离子方程式为:,故B错误;
C.向的酸性溶液中通入足量,Fe3+和S2-会发生氧化还原反应,离子方程式为:2Fe3++H2S═2Fe2++S↓+2H+,故C错误;
D.由于的还原性强于Fe2+,溶液中通入至恰好完全被氧化时,Fe2+还没有被氧化,正确的离子方程式为:,故D不选;
故选A。
6.D
【详解】A.过氧化钠为粉末,与水接触后不能分离,不能利用开关控制反应,选项A错误;
B.可用饱和碳酸氢钠吸收CO2中的HCl,用饱和碳酸钠会与二氧化碳和HCl均反应,无法达到除杂目的,选项B错误;
C.不能直接在容量瓶中溶解固体,选项C错误;
D.Cl2可与NaOH反应,烧瓶内压强减小,形成内外压强差,气球膨胀,选项D正确;
答案选D。
7.A
【详解】生成标准状况下26.88L的SO2和H2的混合气体,得电子的物质的量为,根据得失电子守恒,反应消耗1.2molZn、生成1.2molZnSO4,根据S元素守恒,反应生成SO2的物质的量为;生成氢气的物质的量为,则生成的气体中SO2和H2的物质的量之比为1:1,故选A。
8.D
【详解】A.加热时钠受热熔化变为液态小球,熔化的钠燃烧生成淡黄色固体过氧化钠,由于钠元素焰色试验显黄色,因此燃烧时,火焰为黄色,燃烧后,生成淡黄色固体,A正确;
B.Al与氧气反应生成Al2O3,Al2O3的熔点高,铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着,B正确;
C.Fe与Cl2点燃时反应生成FeCl3,铁丝剧烈燃烧,并伴有棕黄色的烟,C正确;
D.Al表面的Al2O3与NaOH溶液反应产生NaAlO2、H2O,则开始无气体生成,D错误;
故合理选项是D。
9.C
【详解】A.标准状况下,VL氨气物质的量,VL氨气溶于1L水配成溶液体积不是(V+1)L,该氨水的物质的量浓度不是,应为,A错误;
B.同温同压下,同质量的不同气体,物质的量与摩尔质量成反比,但是20℃,101KPa,是液体,不是气体,不能由此计算等质量的和的体积比,B错误;
C.需要用500mL容量瓶配置溶液,,C正确;
D.物质的量浓度相同、体积相同的三种物质的溶液:、、中物质的量之比为1∶1∶3,分别与相同物质的量浓度的恰好反应,消耗溶液的体积比1∶1∶3,D错误;
故答案选C。
10.A
【详解】①浓硫酸具有强氧化性,在常温下能够使铁、铝等金属钝化,①正确;
②Cu和浓硫酸在加热条件下发生反应,随着反应的进行,浓硫酸逐渐变成稀硫酸,稀硫酸不与铜反应,因此硫酸未完全反应,②错误;
③浓硫酸具有脱水性,因而能使蔗糖炭化,③错误;
④Cu和浓硫酸在加热条件下发生反应,随着反应的进行,浓硫酸逐渐变成稀硫酸,稀硫酸不与铜反应,但能与铁反应放出H2,④正确;
⑤浓硫酸是一种干燥剂,能够干燥氢气等气体,氨气是碱性气体,和硫酸反应,不能用浓硫酸干燥,⑤错误;
⑥浓硫酸与铁加热,先发生反应生成硫酸铁和水和二氧化硫,然后铁与硫酸铁反应生成硫酸亚铁,最后铁和稀硫酸反应生成硫酸亚铁和氢气,即反应后,铁片有剩余,则生成的气体除水蒸气外还有氢气和SO2,⑥错误;
⑦浓硫酸具有强氧化性,常温下与Cu不反应,加热时才能反应,⑦错误;
⑧浓硫酸中的硫为+6价,二氧化疏中的硫为+4价,无中间价态,二者不反应,浓硫酸可以干燥SO2,⑧错误;
⑨浓硫酸变成稀硫酸后与Cu不再反应,被还原的H2SO4和生成的SO2均小于0.045mol,⑨正确;
答案选A。
11.B
【分析】Cu失去的电子全部转移给HNO3,生成了氮氧化物,而这些氮氧化物又全部将所得电子转移给了O2,生成了HNO3,相当于Cu失去的电子全部转移给了O2,故可以通过O2的量来计算参加反应的Cu的量,也可以计算出生成的Cu2+的量,从而计算得NaOH的体积。
【详解】Cu失去的电子全部转移给HNO3,生成了氮氧化物,而这些氮氧化物又全部将所得电子转移给了O2,生成了HNO3,相当于Cu失去的电子全部转移给了O2;n(O2)==0.15mol,则转移电子0.6mol,故可以有0.3mol Cu参加反应,即生成0.3mol Cu2+,则需要0.6mol NaOH形成沉淀,故V(NaOH)==0.12L=120mL,故选B。
12.B
【分析】酸性溶液中一定不存在、,加入硝酸钾反应生成气体,遇空气变为红棕色即NO2,该气体为NO,为、、H+反应生成,反应的离子方程式为3Fe2+++4H+=3Fe3++NO+2H2O,生成0.01molNO可知n(Fe3+)=0.03mol;加入过量NaOH溶液并加热反应生成气体即氨气,则含有0.01mol,产生红褐色沉淀即Fe(OH)3,灼烧得到3.2g固体是Fe2O3,物质的量为,n(Fe3+)=0.04mol,原溶液一定含有0.01mol Fe3+;滤液通过焰色反应观察有黄色火焰说明含Na+,由于加入NaOH也含有钠离子,因此不确定原溶液是否含Na+,通入足量二氧化碳无现象说明不含有,否则过量NaOH与反应生成,加入二氧化碳会生成Al(OH)3沉淀;加入足量氯化钡溶液生成难溶于盐酸的固体即BaSO4,4.66g BaSO4固体的物质的量为,说明含有0.02mol,即原溶液一定不含有:、、,一定含有:0.02mol、0.01mol、0.01mol、0.03mol、H+,根据电荷守恒一定含有Cl-,且n(Cl-)>2×0.03mol+3×0.01mol+1×0.01mol-2×0.02mol=0.06mol,可能存在;
【详解】A.反应①中、、H+反应生成Fe3+和NO,发生反应的离子方程式为3Fe2+++4H+=3Fe3++NO+2H2O,A错误;
B.根据分析,原溶液一定不含有:、、,一定含有:0.02mol、0.01mol、0.01mol、0.03mol、H+,根据电荷守恒一定含有Cl-,且n(Cl-)>2×0.03mol+3×0.01mol+1×0.01mol-2×0.02mol=0.06mol,B正确;
C.由3Fe2+++4H+=3Fe3++NO+2H2O可知生成0.01mol NO同时生成0.03mol Fe3+,由分析知灼烧得到3.2g固体是Fe2O3,物质的量为,则n(Fe3+)=0.04mol,则原溶液含0.01mol Fe3+,证明原溶液一定含、,C错误;
D.滤液通过焰色反应观察有黄色火焰说明含Na+,由于加入NaOH也含有钠离子,因此不确定原溶液是否含Na+,则不是一定存在Na+,D错误;
故选:B。
13.C
【分析】三价铁离子氧化性强于铜离子,加入铁粉,铁粉先与三价铁离子反应生成二价铁离子,剩余铁粉再与铜离子反应生成二价铁离子,据以上分析进行解答。
【详解】A.若铁粉无剩余,且溶液中有Cu2+,则可能有三种情况,一种为铜离子只反应一部分,则三价铁离子完全反应,一种为铜离子未反应,则三价铁离子恰好反应,一种为铜离子未反应,三价铁离子只反应一部分,溶液中含有三价铁离子,A错误;
B.若铁粉无剩余,且溶液中无Cu2+,因为三价铁离子先于铁粉反应,所以一定不含三价铁离子,一定含有二价铁离子,B错误;
C.若有铁粉剩余,则三价铁离子、铜离子完全反应,不溶物中一定含有铜,C正确;
D.若有铁粉剩余,则Fe3+、Cu2+完全反应,则溶液中的金属阳离子只有Fe2+,D错误;
故答案选C。
14.A
【分析】该矿物12.8g用过量NaOH溶液碱浸,得到10.4g固体,Al2O3 和SiO2能溶于NaOH溶液,则固体可能是Fe2O3、Cu2O,Fe2O3可溶于盐酸,将此固体用过量盐酸酸浸,得到Cu2+蓝色溶液和1.92g铜单质固体。
【详解】A.最终产物有铜单质固体,结合已知和 ,根据,则判断矿物X中n(Cu2O)/n(Fe2O3)>1,A正确;
B.Al2O3 和SiO2能溶于NaOH溶液,步骤1中减少的固体可能是Al2O3 和SiO2,或是其中一种,B错误;
C.根据Cu2O +2H+=Cu+Cu2++H2O,步骤2得到1.92g铜单质物质的量是0.03mol,又0.03mol的Cu2O质量4.32g,则步骤1得到10.4g固体肯定含有Fe2O3,因,现铜单质剩余,则蓝色溶液n(Cu2+)>0.03mol,C错误;
D.设步骤1得到10.4g固体中Fe2O3xmol、Cu2Oymol,则有等式①160x+144y=10.4,根据得到等式②y-x=0.03,联合①②,解得x=0.02,y=0.05,则Fe2O3的质量为0.02×160=3.2(g),可以判断出X中氧化铁的质量分数为,D错误;
故选A。
15.C
【详解】试题分析: 整个过程可以看作是9g铜和铁混合物与200mL硝酸反应生成0.1mol NO,金属完全溶解,向反应后的溶液中加入KSCN溶液,溶液不变红,说明生成硝酸亚铁、硝酸铜,且硝酸完全反应,发生的反应方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,设铁为x mol,铜为ymol,根据二者质量与生成NO的体积列方程,有:56x+64y=9、2/3(x+y)=0.1,联立方程,解得:x=0.075mol、y=0.075mol,A.由上述分析可知,原混合物中铜和铁各0.075mol,A正确;B.根据方程式可知,n(HNO3)=0.075mol×8/3=0.2mol,稀硝酸的物质的量浓度为0.2mol÷0.1L=2mol/L,B正确;C.9g混合物中含铁质量为0.075mol×56g/mol=4.2g,含铜质量为0.075mol×64g/mol=4.8g,第一次剩余金属4.8g为Cu的质量,C错误;D.再加入100mL该稀硝酸,亚铁离子与硝酸反应生成NO与硝酸铁,溶液中亚铁离子为0.075mol,根据电子转移守恒可知,亚铁离子完全反应,所以再加硝酸得NO为 (0.075mol×1)÷3=0.025mol,其体积为0.025mol×22.4L/mol=0.56L,D正确,答案选C。
考点:考查混合物的有关计算
16.(1)A
(2) > 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
(3) 5ClO+4H+=Cl-+4ClO2↑+2H2O 2ClO2+2OH-=ClO+ClO+H2O
(4) Ca(ClO)2 CO2 3:5
【详解】(1)①用含有146gHCl的浓盐酸即物质的量为4mol,与足量的MnO2反应,由于MnO2只能与浓盐酸反应,根据方程式MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O,生成的氯气小于1mol;②用87gMnO2即物质的量为1mol,与足量的浓盐酸反应,所得氯气为1mol;因此所得氯气②比①多;故答案为:A;
(2)氯气通入淀粉 KI溶液后可观察到溶液变蓝,说明氯气氧化碘离子变为碘单质,碘单质遇淀粉变蓝,因此可得氧化性:Cl2>I2;已知氧化性:Fe3+(3)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,还生成水和氯化钠,该反应的离子方程式为5ClO+4H+=Cl-+4ClO2↑+2H2O;NaOH溶液吸收ClO2,生成物质的量之比为1:1的两种盐,其中一种为NaClO3,ClO2中Cl化合价升高1个价态变为NaClO3,则另一种盐是化合价降低1个价态,应变为NaClO2,该反应的离子方程式:2ClO2+2OH-=ClO+ClO+H2O;故答案为:5ClO+4H+=Cl-+4ClO2↑+2H2O;2ClO2+2OH-=ClO+ClO+H2O;
(4)漂白粉的有效成分为Ca(ClO)2,露置于空气中一段时间的漂白粉,说明部分已经被空气中二氧化碳、水反应生成碳酸钙,加稀盐酸后产生的气体除了可能有O2和HCl外,还可能含有碳酸钙与盐酸反应生成的二氧化碳气体;在制备漂白粉的过程中,若温度控制不当,易生成Ca(ClO3)2,若向Ca(OH)2溶液中通入一定量的Cl2,制得的混合物中n(ClO-):n(ClO)=5:1,假设生成5mol ClO-和1mol ClO,则失去电子物质的量为5mol×1+1mol×5=10mol,得电子物质的量为10mol,说明有10molCl降低到Cl-,则反应中被氧化和被还原的Cl的物质的量之比为(5mol+1mol):10mol=3:5;故答案为:Ca(ClO)2;CO2;3:5。
17.(1)Cu,Si
(2)
(3) 称量 坩埚
(4) 3:2 ②
(5) 降温至温度略高于26.4℃结晶 (趁热)过滤
【分析】向主要成分为Fe-Al-Si-Cu的合金中加入过量盐酸,其中Fe、Al与盐酸反应生成可溶性的,得到溶液I;Si、Cu不与盐酸反应,得到固体I;向溶液I中加入过量NaOH溶液,在空气中与NaOH溶液反应生成,与过量NaOH溶液反应生成可溶的,过滤得到含的固体II和含的溶液II;向固体II加足量的盐酸得到溶液;向溶液II通入足量的,过滤得到固体,经焙烧等得到;固体I经操作II、过滤得到溶液,再经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到晶体。据此分析可得:
【详解】(1)Cu、Si都不和盐酸反应,所以固体I的主要成分为:Cu、Si,故答案为:Cu、Si;
(2)、分离,需加入过量的NaOH溶液,相应的离子反应有、、,所以铝元素发生的离子反应为,故答案为:;
(3)操作I是将在高温下焙烧得到,然后冷却,称量的到的质量;焙烧应在坩埚中进行;根据质量守恒,则有,则合金中铝元素的质量分数为,故答案为:;
(4)途径①反应为,参加反应的Cu与物质的量之比为3:8(有四分之一硝酸降低做氧化剂),因此还原剂Cu与氧化剂物质的量之比为3:2;途径①、③均有污染性气体产生,且硝酸的利用率低,因此途径②最理想,故答案为:3:2;②;
(5)从溶液中获得结晶水合物,通常操作为“蒸发浓缩、冷却结晶、过滤、洗涤、干燥”,但根据图象中结晶水合物的溶解度随温度变化曲线可判断,温度高于26.4℃从所得溶液Ⅲ中析出,故答案为:降温至温度略高于26.4℃结晶;(趁热)过滤。
18.(1)B
(2)②③
(3) BaSO3 AB
(4) Cu + 2H2SO4(浓) CuSO4 + SO2↑ + 2H2O BD 2NH3 + 4CuO2Cu + Cu2O + N2 + 3H2O
【分析】利用装置A制取氨气,装置B中的碱石灰可以干燥氨气,装置C中CuO和氨气反应,装置D中的无水硫酸铜用于检验反应是否有水生成。
(1)
装置A中是固体加热制取氨气,可以利用Ca(OH)2和NH4Cl的固体混合物加热制取氨气。若加热氯化铵,氯化铵可以分解为氨气和氯化氢,但氨气和氯化氢在温度稍低时会重新化合成氯化铵,氨气不能从试管中逸出。NH4HCO3固体受热能分解为氨气、水和二氧化碳,碳酸是弱酸,和氨气反应较微弱,氨气可以逸出。故选B。
(2)
①氨气极易溶于水,若将导管直接通入水中会发生倒吸,所以①不可用;②中用一倒扣于水面的漏斗可以防止氨气倒吸,可以用来吸收尾气;③用一个安全瓶,烧杯中的水回流到安全瓶中,不会回流到反应装置中,可以用来吸收尾气;④是一个密闭体系,容易由于气体压强过大而发生危险,不可用;综上所述,能用来吸收尾气的是②③。
(3)
将D与a相连,将氨气通入BaCl2溶液中,同时向BaCl2溶液中通入SO2,SO2和NH3反应生成(NH4)2SO3,和BaCl2反应生成BaSO3白色沉淀。若将氨气换成氯气或NO2,氯气有强氧化性,NO2溶于水生成的硝酸也有强氧化性,能将SO2氧化为,遇Ba2+能生成BaSO4沉淀;氮气和CO2不能氧化SO2,所以不能产生白色沉淀,故选AB。
(4)
C中粉末完全变红,可能为单质Cu,也可能为Cu2O,也可能为两者的混合物;D中无水硫酸铜变蓝,说明有水生成;还产生一种单质气体,根据元素守恒,该单质气体为N2。
①将铜与浓硫酸共热,生成硫酸铜、SO2和水,反应的化学方程式为:Cu + 2H2SO4(浓) CuSO4 + SO2↑ + 2H2O。只有浓硫酸能和铜反应,随着反应的进行,浓硫酸变为稀硫酸,反应就停止了,此时溶液中有H+,再加入KNO3溶液,酸性溶液中的有强氧化性,能将铜氧化为Cu2+,FeCl3中的Fe3+也能和铜反应:2Fe3++Cu=2Fe2++Cu2+,加入稀硫酸和FeCl2溶液不能和铜继续反应,故选BD。
②反应前C中CuO质量为8g,物质的量为0.1mol,若反应后全部转变为Cu,则0.1molCu的质量为6.4g,若反应后全部转化为Cu2O,则物质的量为0.05mol,质量为7.2g,所以反应后既有铜,也有Cu2O,设铜的物质的量为x,Cu2O的物质的量为y,则有64x+144y=6.8,x+2y=0.1,可求出x=0.05mol,y=0.025mol。则CuO、Cu、Cu2O的物质的量之比为4:2:1,若4molCuO参加反应,根据电子守恒,则有2molNH3参加反应,生成1molN2,则反应的化学方程式为:2NH3 + 4CuO2Cu + Cu2O + N2 + 3H2O。
19.(1) 氢离子浓度过大,氢离子和铝生成氢气和铝离子
(2) 0.001 bd
【分析】配制一定物质的量浓度的溶液,所需的步骤有计算、称量、溶解(冷却)、转移、洗涤、定容、摇匀、装瓶贴签;
【详解】(1)①铝粉可将废水中的还原为,则酸性条件下,铝粉去除反应生成和铝离子、水,;
②若初始过低,则氢离子浓度过大,氢离子和铝生成氢气和铝离子,导致的去除效果也不理想;
(2)①在的过程中,碳酸根离子和氢离子反应生成碳酸氢根离子,反应的离子反应方程式为;根据钠元素守恒可知,B点溶液中0.01L×0.1mol/L=0.001mol。
②a.洗涤后容量瓶未干燥,不影响溶液浓度,a错误;
b.将烧杯中的溶液沿玻璃棒注入容量瓶后立即加水定容,烧杯玻璃棒没有洗涤,导致溶质损失,浓度偏低,b正确;
c.定容时俯视刻度线,使得溶液体积偏小,浓度偏大,c错误;
d.摇匀后加水至液面与刻度线相切,使得水的量增加,浓度偏小,d正确;
故选bd;
③A.碳酸钠受热稳定,碳酸氢钠受热不稳定分解为碳酸钠、水、二氧化碳;故残留在试管中的固体是。
B.逐滴加入,至时,消耗溶液,此时溶质完全为碳酸氢钠;继续滴加至反应完全时,又消耗溶液;、,则试样中为0.2mol/L×(0.015L-0.010L)=0.001mol,则质量分数为。
20.(1)3Fe+4H2O(g)Fe3O4+4H2
(2)除去H2中的水蒸气,防止玻璃管E破裂
(3) KMnO4(铁氰化钾) 酸性KMnO4溶液褪色(或产生蓝色沉淀) B中固体可能为Fe3O4和Fe的混合物,Fe将Fe3+全部还原为Fe2+
(4)防止H2O2在后续步骤中继续氧化+2价铁元素
(5)0.636
【分析】探究一:A中制取水蒸气,B中Fe和水蒸气反应生成四氧化三铁和氢气,C收集氢气、D用于干燥氢气,E中氢气还原CuO;
(1)高温条件下,Fe和水蒸气发生氧化还原反应生成四氧化三铁和氢气;
(2)装置D有除去H2中的水蒸气,防止E的玻璃管破裂的作用。
探究二:(3)铁离子和KSCN反应生成络合物而使溶液呈血红色,亚铁离子和KSCN不反应;
亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化。
探究三:B中固体(主要成分为Fe3O4和少量Fe)与稀盐酸反应得到氯化铁、氯化亚铁、过量的稀盐酸,加入铁粉还原铁离子:2Fe3++Fe=3Fe2+,过滤过量的铁,滤液A的溶质为氯化亚铁,加入氢氧化钠溶液,生成Fe(OH)2浑浊液,向浑浊液中加入双氧水氧化:2Fe(OH)2+H2O2=2FeOOH+2H2O,反应完成后需再加热一段时间除去剩余H2O2,再与氯化亚铁加热搅拌发生反应:2FeOOH+Fe2++2OH-=Fe3O4+2H2O,过滤、洗涤、干燥得产品Fe3O4,据此分析解答。
(1)
高温条件下,Fe和水蒸气发生氧化还原反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)Fe3O4+4H2,
因此,本题正确答案是:3Fe+4H2O(g)Fe3O4+4H2;
(2)
装置D有除去H2中的水蒸气,防止E的玻璃管破裂的作用,
因此,本题正确答案是:除去H2中的水蒸气,防止E的玻璃管破裂。
(3)
铁离子和KSCN反应生成络合物而使溶液呈血红色,亚铁离子和KSCN不反应,向溶液中加入KSCN溶液呈红色,说明含有四氧化三铁,可能含有Fe;铁离子和Fe反应生成亚铁离子,不变红色说明固体中含有四氧化三铁和Fe,
①根据实验流程试剂A应是稀硫酸,亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化,所以可以用酸性高锰酸钾溶液检验亚铁离子,现象2为酸性KMnO4溶液褪色(或可以用铁氰化钾,与亚铁离子反应生成蓝色沉淀),
因此,本题正确答案是:KMnO4(铁氰化钾);酸性KMnO4溶液褪色(或产生蓝色沉淀)
②若现象1中溶液未变血红色,说明B中固体可能有Fe3O4和Fe,Fe将Fe3+全部还原为Fe2+,
因此,本题正确答案是:B中固体可能有Fe3O4和Fe,Fe将Fe3+全部还原为Fe2+;
(4)
步骤④中,浊液D中的氢氧化亚铁与过氧化氢反应生成FeOOH,反应为:2Fe(OH)2+H2O2=2FeOOH+2H2O;步骤④中,防止其在步骤⑤中继续氧化+2价铁元素,反应完成后需再加热一段时间除去剩余H2O2;
因此,本题正确答案是:防止H2O2在后续步骤中继续氧化+2价铁元素;
(5)
设浊液B中FeOOH的物质的量为amol,滤液A中的铁元素的物质的量为bmol。
则滤液A中与FeOOH反应的亚铁离子物质的量为(b-a)mol,由图可知=1.75时,Fe3O4的产率最高,则=1.75,解得:=0.636;
因此,本题正确答案是:0.636。
化学试题
本试题卷共10页,20题。全卷满分100分。考试用时75分钟。
注意事项:
答卷前,考生务必将自己的姓名、淮考证号填写在答题卡上。
回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量: H-1 C-12 O-16 Na-23 Al-27 Cl-35.5 Fe-56 Cu-64
一、选择题:本题共15小题,每小题3分,共45分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 中国传统文化对人类文明贡献巨大。下列古代文献及诗句中涉及的化学研究成果,对其说明合理的是
A.李白诗句“日照香炉生紫烟,遥看瀑布挂前川”,“紫烟”指“香炉”中碘升华的现象
B.“墨滴无声入水惊,如烟袅袅幻形生”中的“墨滴”的分散质粒子直径在之间,具有
胶体的性质
C.“南朝四百八十寺,多少楼台烟雨中”中的“烟雨”指悬浮在空中的固体颗粒
D.《天工开物·五金》中记载:“若造熟铁,则生铁流出时,相连数尺内,众人柳棍疾搅,即时炒
成熟铁。”炒铁是为了降低铁水中的碳含量,且熟铁比生铁质地更硬,延展性稍差
下列有关物质性质的叙述错误的是
A.少量铁在足量氧气中燃烧可以得到Fe2O3固体
B.将工业废气通入FeCl2溶液中,可除去工业废气中的氯气
C.高温下将水蒸气通入铁粉中,固体质量增加
D.制备Fe(OH)2过程中应该注意隔绝空气
3. 下列叙述正确的是
A.常温下,5.6 g Fe与足量稀HNO3反应,转移0.2NA个电子
B.标准状况下,1.12 L 1H2和0.2 g 2H2均含有0.1NA个质子
C.在50 g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA
D.将CO2通过Na2O2使其增重a g,反应中转移的电子数为a·NA/14
4. 下列由实验现象所得结论错误的是
A.向SO2溶液中滴加氢硫酸,产生淡黄色沉淀,证明SO2具有氧化性
B.向酸性KMnO4溶液中加入少量Fe3O4粉末,紫色褪去,证明Fe3O4中含+2价Fe
C.向浓HNO3中插入红热的木炭,产生红棕色气体,证明木炭可与浓HNO3反应生成NO2
D.向H2O2溶液中滴加淀粉溶液,再滴加KI溶液,溶液变蓝色,证明氧化性H2O2强于I2
5. 下列离子方程式中正确的是
A.在浓度均为0.3mol/L的NaOH和的混合液中逐滴加入等体积的0.7mol/L稀盐酸:
B.溶液和适量溶液混合至生成的沉淀恰好完全溶解:
C.向的酸性溶液中通入足量:
D.溶液中通入至恰好完全被氧化:
6. 下列实验操作或装置正确且能达到实验目的的是
A.用甲装置制备氧气
B.用乙装置除去CO2中的HCl
C.用丙装置配制一定物质的量浓度的NaCl溶液
D.用丁装置证明Cl2可与NaOH溶液反应
7. 将一定量的锌与100mL 18.5mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成标准状况下26.88L的SO2和H2的混合气体,反应后测得溶液中氢离子浓度为1.0mol·L-1,则生成的气体中SO2和H2的物质的量之比为(假设反应前后溶液体积不变)
A.1:1 B.4:1 C.1:4 D.3:2
下列实验现象描述错误的是
选项 实验 现象
A 加热放在坩埚中的钠 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体
B 在酒精灯上加热铝箔 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着
C 在Cl2中点燃铁丝 铁丝剧烈燃烧,并伴有棕黄色的烟
D 在空气中久置的铝条放入NaOH溶液中 立刻产生大量无色气体,铝条逐渐变细
A.A B.B C.C D.D
9. 物理量“物质的量”的引入,不仅可以建立微观与宏观的联系,还可以从定量的角度认识物质及其变化。下列有关表述正确的是
A.在标准状况下,VL氨气溶于1L水配成密度为的氨水,该氨水的物质的量浓度为
B.20℃,101KPa,等质量的和的体积比是9:22
C.实验室配制物质的量浓度为0.2mol/L的NaOH溶液480mL溶液,需要用托盘天平称量4.0g
D.物质的量浓度相同、体积相同的三种物质的溶液:、、,分别与相
同物质的量浓度的恰好反应,消耗溶液的体积比为3:1:1
10.下列有关浓硫酸的叙述正确的的项数是
①浓硫酸在常温下能够使金属铁、铝钝化
②浓硫酸与铜加热反应后,铜片有剩余,硫酸完全反应
③浓硫酸具有吸水性,因而能使蔗糖炭化
④浓硫酸与铜加热反应后,铜片有剩余,向反应后的溶液中再加入过量铁片,会有氢气生成
⑤浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
⑥浓硫酸与铁加热反应后,铁片有剩余,生成的气体除水蒸气外只有SO2
⑦浓硫酸具有强氧化性,常温下能与Cu发生剧烈反应
⑧浓硫酸具有强氧化性,SO2具有还原性,所以浓硫酸不能干燥SO2
⑨向的浓硫酸中加入足量Cu并加热使其充分反应,被还原的和生成的SO2
气体均小于
A.3 B.4 C.5 D.6
11.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与3.36LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol·L-1NaOH溶液至 Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60mL B.120mL C.240mL D.360mL
12.某酸性溶液中可能含有、、、、、、、和。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是
A.反应①发生反应的离子方程式为
B.溶液中至少有6种离子大量存在,其中一定存在,且
C.溶液中可能含有,一定含有,可取少量原溶液加入溶液检验
D.、、一定存在,、一定不存在
13.同一还原剂与多种氧化剂在一起时,先与氧化性强的粒子反应,待强的反应完后,再与氧化性弱的反应,称为反应先后规律。已知,且氧化性:,在溶有和的溶液中加入铁粉,下列说法中正确的是
A.若铁粉无剩余,且溶液中有,则溶液中一定无
B.若铁粉无剩余,且溶液中无,则溶液中一定有,也可能有
C.若铁粉有剩余,则不溶物中一定有铜
D.若铁粉有剩余,则溶液中的金属阳离子有和
14.某矿物X由Al2O3、Fe2O3、Cu2O、SiO2的一种或几种物质组成。现进行下图实验:
(已知:Cu2O+2H+=Cu+Cu2++H2O且每步反应都充分)下列说法正确的是
A.根据上述步骤可以判断矿物X中n(Cu2O)/n(Fe2O3)>1
B.步骤1中减少的固体一定是混合物
C.根据步骤2可以得出蓝色溶液中n(Cu2+)=0.02mol
D.根据步骤1、2可以判断出X中氧化铁的质量分数为50%
15.将9g铜和铁的混合物投入到100mL稀硝酸中,充分反应后得到标准状况下1.12LNO,剩余4.8g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12LNO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法不正确的是
A.原混合物中铜和铁各0.075mol
B.稀硝酸的物质的量浓度为2.0mol·L-1
C.第一次剩余4.8g金属为铜和铁
D.向反应后的溶液中再加入该稀硝酸100mL,又得到NO在标准状况下体积小于1.12L
二、非选择题:本题共5小题,共55分。
16.(11分)为保证家中所用器具与居住环境的洁净卫生,往往需使用各种各样的消毒剂,其中含氯
消毒剂是目前广泛使用的一类消毒剂。
(1)用下列两种方法制取氯气:①用含有146 g HCl的浓盐酸与足量的反应;②用87 g 与足量的浓盐酸反应,所得氯气__________(填标号)。
A.②比①多 B.①比②多 C.一样多 D.无法比较
(2)氯气通入淀粉-KI溶液后可观察到溶液变蓝,可得氧化性:__________(填“>”或“<”),已知氧化性,若将71g通入含1 mol 的溶液中,写出反应的离子方程式:_________
____________。
(3)是新型消毒剂,已知在酸性条件下可发生反应生成NaCl并释放出,该反应的离子方程式为_____________________。NaOH溶液吸收,生成物质的量之比为1:1的两种盐,其中一种为,写出该反应的离子方程式:_____________________。
(4)漂白粉的有效成分为__________(填化学式,下同),露置于空气中一段时间的漂白粉,加稀盐酸后产生的气体中除了可能有和HCl之外,还可能含有__________。在制备漂白粉的过程中,若温度控制不当,易生成,若向溶液中通入一定量的,已知制得的混合物中,则反应中被氧化和被还原的Cl的物质的量之比为__________。
17.(10分)森达斯特合金是一种优良的磁性合金材料,主要成分为Fe-Al-Si-Cu,某兴趣小组称取
mg几小块清洗干净的合金碎片,设计如下流程,制取溶液、硝酸铜晶体并测定铝的质量分数:
已知:Si不溶于盐酸、硫酸、硝酸。请回答下列问题:
(1)固体I中的主要成分为__________(填化学式)。
(2)溶液I加入NaOH溶液后,铝元素发生的离子反应为_____________________。
(3)操作I包括焙烧、冷却、__________;焙烧应在__________(填仪器名称)中进行,合金中铝元素的质量分数为__________(用含m、n的算式表示)。
(4)为完成操作II,某兴趣小组设计出以下三种反应途径:
反应途径①中,还原剂与氧化剂物质的量之比为__________,你认为最佳的反应途径为__________;
(5)欲从溶液III中尽可能多地析出晶体,其方法为:将溶液蒸发浓缩、__________(填操作方法)、__________、冰水洗涤、低温烘干即可获得。(相关物质的溶解度曲线如图所示)。
18.(9分)人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料生产,某化学兴趣小组利用如图装置制备氨气并探究相关性质。
(1)该实验中A装置制备NH3不能用的药品是__________。
A.Ca(OH)2和NH4Cl的固体混合物 B.NH4Cl固体 C.NH4HCO3固体
(2)D装置后接尾气吸收装置。下列能用来吸收尾气的装置是___________(填装置序号)。
(3)若将D与a相连,在E中产生白色沉淀,其化学式为:___________。若向a处分别通入___________(填下列气体编号),在E中也会产生白色沉淀。
A.Cl2 B.NO2 C.N2 D.CO2
(4)实验发现C中粉末完全变红,D中无水硫酸铜变蓝,还产生一种单质气体。
①若红色固体为单质,实验后将C中固体与浓硫酸混合加热,其化学方程式为:________________
_____;若充分反应后红色固体有剩余,再加入下列的___________试剂,固体又可以继续溶解。
A.稀H2SO4 B.FeCl3溶液 C.FeCl2溶液 D.KNO3溶液
②已知Cu2O也为红色固体,反应前C中CuO质量为8g,反应后C中红色固体质量为6.8g,则C中发生的总反应方程式为:_____________________。
19.(12分)氧化还原法、沉淀法等是常用于治理水体污染的重要化学方法。
(1)还原法处理含铬废水:铝粉可将废水中的还原为。如图1所示,废水的不同初始对去除效果有重要影响。
①酸性条件下,铝粉去除反应的离子方程式:_____________________。
②实验证明,若初始过低,的去除效果也不理想,其原因可能是_____________________。
(2)室温下向中逐滴加入。溶液中含碳元素微粒的物质的量随
变化的图像如下图2(因有逸出未画出)。
①在的过程中,反应的离子反应方程式为_____________________;B点溶液中
___________。
②配制溶液时,下列操作会导致溶液浓度偏低的是___________。
a、洗涤后容量瓶未干燥
b、将烧杯中的溶液沿玻璃棒注入容量瓶后立即加水定容
c、定容时俯视刻度线
d、摇匀后加水至液面与刻度线相切
③为确定试样的组成,某同学做如下实验:
A.取的试样,用酒精灯对其充分加热至恒重,冷却后称其质量为。残留在试管中的固体是___________(填化学式)。
B.另取质量为的试样加水溶解后配成溶液,逐滴加入,至时,消耗溶液,继续滴加至反应完全时,又消耗溶液,则试样中的质量分数为___________。
20.(13分)某研究性学习小组请你参与“研究铁与水蒸气反应所得固体物质的成分、性质及再利用”实验探究,并回答下列问题:
【查阅资料】含有Fe3+的盐溶液遇到KSCN溶液时变成红色,含有Fe2+的盐溶液遇到KSCN溶液时不变色。
探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略)。
(1)硬质玻璃管B中发生反应的化学方程式为_____________________。
(2)装置D的作用是_____________________。
探究二:设计如图实验方案确定反应后硬质玻璃管B中黑色固体的成分(已知酸性KMnO4溶液能与盐酸发生反应)。
(3)待硬质玻璃管B冷却后,取少许其中的固体继续进行如图实验:
①试剂B是___________,现象2为______________________。
②若现象1为溶液未变红色,请从硬质玻璃管B中固体物质的成分分析可能的原因:______________
________。
探究三:某学习小组设计用硬质玻璃管B中固体制备Fe3O4纳米材料的流程示意图如图:
已知:①浊液B中铁元素以FeOOH形式存在;
②在操作Ⅰ中,相同条件下测得Fe3O4的产率与R[R=]的关系如图所示。
(4)在滤液A转化为浊液B反应完成后需再加热一段时间除去剩余H2O2,目的是___________________。
(5)设浊液B中FeOOH的物质的量为amol,滤液A中的n(Fe)=bmol。为使Fe3O4的产率最高,则=___________。(填数值,保留3位有效数字)
化学试题 第1页 (共3页)
参考答案:
1.B
【详解】A. “日照香炉生紫烟,遥看瀑布挂前川”, “紫烟”是水产生的雾气,不是碘升华的现象,故A错误;
B.“墨滴”的分散质粒子直径在之间,形成胶体,具有胶体的性质,故B正确;
C.“南朝四百八十寺,多少楼台烟雨中”中的“烟雨”指悬浮在空中的小液滴,故C错误;
D.炒铁是为了降低铁水中的碳含量,熟铁比生铁质地更软,延展性更好,故D错误;
选B。
2.B
【详解】A.少量铁,氧气足量时,可以反应得到Fe2O3固体,故A正确;
B.氯气具有强氧化性,能氧化亚铁离子生成铁离子,铁离子能氧化Fe生成亚铁离子;所以去工业废气中的氯气,还需加入铁粉,故B错误;
C.高温下将水蒸气通入铁粉中,生成四氧化三铁,固体质量增加,故C正确;
D.二价Fe容易被氧化,所以制备Fe(OH)2过程中应该注意隔绝空气,故D正确;
故答案选B。
3.B
【详解】A.常温下,5.6 g Fe与足量稀HNO3反应生成硝酸铁,铁元素化合价由0升高为+3,转移0.3NA个电子,故A错误;
B.标准状况下,1.12 L 1H2含有质子数,0.2 g 2H2含有质子数,故B正确;
C.乙醇、水分子都含氢原子,在50 g质量分数为46%的乙醇水溶液中含有的氢原子总数为,故C错误;
D.CO2和Na2O2反应生成碳酸钠和氧气,反应方程式为2CO2+2Na2O2=O2+2Na2CO3,根据方程式可知,固体质量增加56g,转移2mol电子,将CO2通过Na2O2使其增重a g,反应中转移的电子数为,故D错误;
选B。
4.C
【详解】A.淡黄色沉淀是S,在反应过程中硫元素由SO2中的+4价降低到0价,发生还原反应,SO2体现氧化性,A项不符合题意;
B.酸性高锰酸钾溶液具有强氧化性,与还原性物质反应紫色才会褪去,所以可以证明Fe3O4中有还原性物质,即+2价Fe,B项不符合题意;
C.因为浓硝酸受热易分解,能生成NO2,所以产生红棕色气体,不能说明碳炭与浓HNO3反应生成了NO2,C项符合题意;
D.溶液变蓝色,证明有碘单质生成,证明氧化性H2O2强于I2,D项不符合题意;
故答案为:C。
5.A
【详解】A.在浓度均为 0.3mol/L 的 NaOH 和 Na2CO3 的混合液中逐滴加入等体积的 0.7mol/L 稀盐酸,盐酸先和NaOH再和Na2CO3反应,离子方程式为:,故A正确;
B.和反应过程中,Ba2+和SO反应生成硫酸钡沉淀,OH-先和Al3+反应生成氢氧化铝沉淀,再和NH反应,最后氢氧化铝沉淀再和NaOH反应生成偏铝酸钠,溶液和适量溶液混合至生成的沉淀恰好完全溶解的离子方程式为:,故B错误;
C.向的酸性溶液中通入足量,Fe3+和S2-会发生氧化还原反应,离子方程式为:2Fe3++H2S═2Fe2++S↓+2H+,故C错误;
D.由于的还原性强于Fe2+,溶液中通入至恰好完全被氧化时,Fe2+还没有被氧化,正确的离子方程式为:,故D不选;
故选A。
6.D
【详解】A.过氧化钠为粉末,与水接触后不能分离,不能利用开关控制反应,选项A错误;
B.可用饱和碳酸氢钠吸收CO2中的HCl,用饱和碳酸钠会与二氧化碳和HCl均反应,无法达到除杂目的,选项B错误;
C.不能直接在容量瓶中溶解固体,选项C错误;
D.Cl2可与NaOH反应,烧瓶内压强减小,形成内外压强差,气球膨胀,选项D正确;
答案选D。
7.A
【详解】生成标准状况下26.88L的SO2和H2的混合气体,得电子的物质的量为,根据得失电子守恒,反应消耗1.2molZn、生成1.2molZnSO4,根据S元素守恒,反应生成SO2的物质的量为;生成氢气的物质的量为,则生成的气体中SO2和H2的物质的量之比为1:1,故选A。
8.D
【详解】A.加热时钠受热熔化变为液态小球,熔化的钠燃烧生成淡黄色固体过氧化钠,由于钠元素焰色试验显黄色,因此燃烧时,火焰为黄色,燃烧后,生成淡黄色固体,A正确;
B.Al与氧气反应生成Al2O3,Al2O3的熔点高,铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着,B正确;
C.Fe与Cl2点燃时反应生成FeCl3,铁丝剧烈燃烧,并伴有棕黄色的烟,C正确;
D.Al表面的Al2O3与NaOH溶液反应产生NaAlO2、H2O,则开始无气体生成,D错误;
故合理选项是D。
9.C
【详解】A.标准状况下,VL氨气物质的量,VL氨气溶于1L水配成溶液体积不是(V+1)L,该氨水的物质的量浓度不是,应为,A错误;
B.同温同压下,同质量的不同气体,物质的量与摩尔质量成反比,但是20℃,101KPa,是液体,不是气体,不能由此计算等质量的和的体积比,B错误;
C.需要用500mL容量瓶配置溶液,,C正确;
D.物质的量浓度相同、体积相同的三种物质的溶液:、、中物质的量之比为1∶1∶3,分别与相同物质的量浓度的恰好反应,消耗溶液的体积比1∶1∶3,D错误;
故答案选C。
10.A
【详解】①浓硫酸具有强氧化性,在常温下能够使铁、铝等金属钝化,①正确;
②Cu和浓硫酸在加热条件下发生反应,随着反应的进行,浓硫酸逐渐变成稀硫酸,稀硫酸不与铜反应,因此硫酸未完全反应,②错误;
③浓硫酸具有脱水性,因而能使蔗糖炭化,③错误;
④Cu和浓硫酸在加热条件下发生反应,随着反应的进行,浓硫酸逐渐变成稀硫酸,稀硫酸不与铜反应,但能与铁反应放出H2,④正确;
⑤浓硫酸是一种干燥剂,能够干燥氢气等气体,氨气是碱性气体,和硫酸反应,不能用浓硫酸干燥,⑤错误;
⑥浓硫酸与铁加热,先发生反应生成硫酸铁和水和二氧化硫,然后铁与硫酸铁反应生成硫酸亚铁,最后铁和稀硫酸反应生成硫酸亚铁和氢气,即反应后,铁片有剩余,则生成的气体除水蒸气外还有氢气和SO2,⑥错误;
⑦浓硫酸具有强氧化性,常温下与Cu不反应,加热时才能反应,⑦错误;
⑧浓硫酸中的硫为+6价,二氧化疏中的硫为+4价,无中间价态,二者不反应,浓硫酸可以干燥SO2,⑧错误;
⑨浓硫酸变成稀硫酸后与Cu不再反应,被还原的H2SO4和生成的SO2均小于0.045mol,⑨正确;
答案选A。
11.B
【分析】Cu失去的电子全部转移给HNO3,生成了氮氧化物,而这些氮氧化物又全部将所得电子转移给了O2,生成了HNO3,相当于Cu失去的电子全部转移给了O2,故可以通过O2的量来计算参加反应的Cu的量,也可以计算出生成的Cu2+的量,从而计算得NaOH的体积。
【详解】Cu失去的电子全部转移给HNO3,生成了氮氧化物,而这些氮氧化物又全部将所得电子转移给了O2,生成了HNO3,相当于Cu失去的电子全部转移给了O2;n(O2)==0.15mol,则转移电子0.6mol,故可以有0.3mol Cu参加反应,即生成0.3mol Cu2+,则需要0.6mol NaOH形成沉淀,故V(NaOH)==0.12L=120mL,故选B。
12.B
【分析】酸性溶液中一定不存在、,加入硝酸钾反应生成气体,遇空气变为红棕色即NO2,该气体为NO,为、、H+反应生成,反应的离子方程式为3Fe2+++4H+=3Fe3++NO+2H2O,生成0.01molNO可知n(Fe3+)=0.03mol;加入过量NaOH溶液并加热反应生成气体即氨气,则含有0.01mol,产生红褐色沉淀即Fe(OH)3,灼烧得到3.2g固体是Fe2O3,物质的量为,n(Fe3+)=0.04mol,原溶液一定含有0.01mol Fe3+;滤液通过焰色反应观察有黄色火焰说明含Na+,由于加入NaOH也含有钠离子,因此不确定原溶液是否含Na+,通入足量二氧化碳无现象说明不含有,否则过量NaOH与反应生成,加入二氧化碳会生成Al(OH)3沉淀;加入足量氯化钡溶液生成难溶于盐酸的固体即BaSO4,4.66g BaSO4固体的物质的量为,说明含有0.02mol,即原溶液一定不含有:、、,一定含有:0.02mol、0.01mol、0.01mol、0.03mol、H+,根据电荷守恒一定含有Cl-,且n(Cl-)>2×0.03mol+3×0.01mol+1×0.01mol-2×0.02mol=0.06mol,可能存在;
【详解】A.反应①中、、H+反应生成Fe3+和NO,发生反应的离子方程式为3Fe2+++4H+=3Fe3++NO+2H2O,A错误;
B.根据分析,原溶液一定不含有:、、,一定含有:0.02mol、0.01mol、0.01mol、0.03mol、H+,根据电荷守恒一定含有Cl-,且n(Cl-)>2×0.03mol+3×0.01mol+1×0.01mol-2×0.02mol=0.06mol,B正确;
C.由3Fe2+++4H+=3Fe3++NO+2H2O可知生成0.01mol NO同时生成0.03mol Fe3+,由分析知灼烧得到3.2g固体是Fe2O3,物质的量为,则n(Fe3+)=0.04mol,则原溶液含0.01mol Fe3+,证明原溶液一定含、,C错误;
D.滤液通过焰色反应观察有黄色火焰说明含Na+,由于加入NaOH也含有钠离子,因此不确定原溶液是否含Na+,则不是一定存在Na+,D错误;
故选:B。
13.C
【分析】三价铁离子氧化性强于铜离子,加入铁粉,铁粉先与三价铁离子反应生成二价铁离子,剩余铁粉再与铜离子反应生成二价铁离子,据以上分析进行解答。
【详解】A.若铁粉无剩余,且溶液中有Cu2+,则可能有三种情况,一种为铜离子只反应一部分,则三价铁离子完全反应,一种为铜离子未反应,则三价铁离子恰好反应,一种为铜离子未反应,三价铁离子只反应一部分,溶液中含有三价铁离子,A错误;
B.若铁粉无剩余,且溶液中无Cu2+,因为三价铁离子先于铁粉反应,所以一定不含三价铁离子,一定含有二价铁离子,B错误;
C.若有铁粉剩余,则三价铁离子、铜离子完全反应,不溶物中一定含有铜,C正确;
D.若有铁粉剩余,则Fe3+、Cu2+完全反应,则溶液中的金属阳离子只有Fe2+,D错误;
故答案选C。
14.A
【分析】该矿物12.8g用过量NaOH溶液碱浸,得到10.4g固体,Al2O3 和SiO2能溶于NaOH溶液,则固体可能是Fe2O3、Cu2O,Fe2O3可溶于盐酸,将此固体用过量盐酸酸浸,得到Cu2+蓝色溶液和1.92g铜单质固体。
【详解】A.最终产物有铜单质固体,结合已知和 ,根据,则判断矿物X中n(Cu2O)/n(Fe2O3)>1,A正确;
B.Al2O3 和SiO2能溶于NaOH溶液,步骤1中减少的固体可能是Al2O3 和SiO2,或是其中一种,B错误;
C.根据Cu2O +2H+=Cu+Cu2++H2O,步骤2得到1.92g铜单质物质的量是0.03mol,又0.03mol的Cu2O质量4.32g,则步骤1得到10.4g固体肯定含有Fe2O3,因,现铜单质剩余,则蓝色溶液n(Cu2+)>0.03mol,C错误;
D.设步骤1得到10.4g固体中Fe2O3xmol、Cu2Oymol,则有等式①160x+144y=10.4,根据得到等式②y-x=0.03,联合①②,解得x=0.02,y=0.05,则Fe2O3的质量为0.02×160=3.2(g),可以判断出X中氧化铁的质量分数为,D错误;
故选A。
15.C
【详解】试题分析: 整个过程可以看作是9g铜和铁混合物与200mL硝酸反应生成0.1mol NO,金属完全溶解,向反应后的溶液中加入KSCN溶液,溶液不变红,说明生成硝酸亚铁、硝酸铜,且硝酸完全反应,发生的反应方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,设铁为x mol,铜为ymol,根据二者质量与生成NO的体积列方程,有:56x+64y=9、2/3(x+y)=0.1,联立方程,解得:x=0.075mol、y=0.075mol,A.由上述分析可知,原混合物中铜和铁各0.075mol,A正确;B.根据方程式可知,n(HNO3)=0.075mol×8/3=0.2mol,稀硝酸的物质的量浓度为0.2mol÷0.1L=2mol/L,B正确;C.9g混合物中含铁质量为0.075mol×56g/mol=4.2g,含铜质量为0.075mol×64g/mol=4.8g,第一次剩余金属4.8g为Cu的质量,C错误;D.再加入100mL该稀硝酸,亚铁离子与硝酸反应生成NO与硝酸铁,溶液中亚铁离子为0.075mol,根据电子转移守恒可知,亚铁离子完全反应,所以再加硝酸得NO为 (0.075mol×1)÷3=0.025mol,其体积为0.025mol×22.4L/mol=0.56L,D正确,答案选C。
考点:考查混合物的有关计算
16.(1)A
(2) > 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
(3) 5ClO+4H+=Cl-+4ClO2↑+2H2O 2ClO2+2OH-=ClO+ClO+H2O
(4) Ca(ClO)2 CO2 3:5
【详解】(1)①用含有146gHCl的浓盐酸即物质的量为4mol,与足量的MnO2反应,由于MnO2只能与浓盐酸反应,根据方程式MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O,生成的氯气小于1mol;②用87gMnO2即物质的量为1mol,与足量的浓盐酸反应,所得氯气为1mol;因此所得氯气②比①多;故答案为:A;
(2)氯气通入淀粉 KI溶液后可观察到溶液变蓝,说明氯气氧化碘离子变为碘单质,碘单质遇淀粉变蓝,因此可得氧化性:Cl2>I2;已知氧化性:Fe3+
(4)漂白粉的有效成分为Ca(ClO)2,露置于空气中一段时间的漂白粉,说明部分已经被空气中二氧化碳、水反应生成碳酸钙,加稀盐酸后产生的气体除了可能有O2和HCl外,还可能含有碳酸钙与盐酸反应生成的二氧化碳气体;在制备漂白粉的过程中,若温度控制不当,易生成Ca(ClO3)2,若向Ca(OH)2溶液中通入一定量的Cl2,制得的混合物中n(ClO-):n(ClO)=5:1,假设生成5mol ClO-和1mol ClO,则失去电子物质的量为5mol×1+1mol×5=10mol,得电子物质的量为10mol,说明有10molCl降低到Cl-,则反应中被氧化和被还原的Cl的物质的量之比为(5mol+1mol):10mol=3:5;故答案为:Ca(ClO)2;CO2;3:5。
17.(1)Cu,Si
(2)
(3) 称量 坩埚
(4) 3:2 ②
(5) 降温至温度略高于26.4℃结晶 (趁热)过滤
【分析】向主要成分为Fe-Al-Si-Cu的合金中加入过量盐酸,其中Fe、Al与盐酸反应生成可溶性的,得到溶液I;Si、Cu不与盐酸反应,得到固体I;向溶液I中加入过量NaOH溶液,在空气中与NaOH溶液反应生成,与过量NaOH溶液反应生成可溶的,过滤得到含的固体II和含的溶液II;向固体II加足量的盐酸得到溶液;向溶液II通入足量的,过滤得到固体,经焙烧等得到;固体I经操作II、过滤得到溶液,再经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到晶体。据此分析可得:
【详解】(1)Cu、Si都不和盐酸反应,所以固体I的主要成分为:Cu、Si,故答案为:Cu、Si;
(2)、分离,需加入过量的NaOH溶液,相应的离子反应有、、,所以铝元素发生的离子反应为,故答案为:;
(3)操作I是将在高温下焙烧得到,然后冷却,称量的到的质量;焙烧应在坩埚中进行;根据质量守恒,则有,则合金中铝元素的质量分数为,故答案为:;
(4)途径①反应为,参加反应的Cu与物质的量之比为3:8(有四分之一硝酸降低做氧化剂),因此还原剂Cu与氧化剂物质的量之比为3:2;途径①、③均有污染性气体产生,且硝酸的利用率低,因此途径②最理想,故答案为:3:2;②;
(5)从溶液中获得结晶水合物,通常操作为“蒸发浓缩、冷却结晶、过滤、洗涤、干燥”,但根据图象中结晶水合物的溶解度随温度变化曲线可判断,温度高于26.4℃从所得溶液Ⅲ中析出,故答案为:降温至温度略高于26.4℃结晶;(趁热)过滤。
18.(1)B
(2)②③
(3) BaSO3 AB
(4) Cu + 2H2SO4(浓) CuSO4 + SO2↑ + 2H2O BD 2NH3 + 4CuO2Cu + Cu2O + N2 + 3H2O
【分析】利用装置A制取氨气,装置B中的碱石灰可以干燥氨气,装置C中CuO和氨气反应,装置D中的无水硫酸铜用于检验反应是否有水生成。
(1)
装置A中是固体加热制取氨气,可以利用Ca(OH)2和NH4Cl的固体混合物加热制取氨气。若加热氯化铵,氯化铵可以分解为氨气和氯化氢,但氨气和氯化氢在温度稍低时会重新化合成氯化铵,氨气不能从试管中逸出。NH4HCO3固体受热能分解为氨气、水和二氧化碳,碳酸是弱酸,和氨气反应较微弱,氨气可以逸出。故选B。
(2)
①氨气极易溶于水,若将导管直接通入水中会发生倒吸,所以①不可用;②中用一倒扣于水面的漏斗可以防止氨气倒吸,可以用来吸收尾气;③用一个安全瓶,烧杯中的水回流到安全瓶中,不会回流到反应装置中,可以用来吸收尾气;④是一个密闭体系,容易由于气体压强过大而发生危险,不可用;综上所述,能用来吸收尾气的是②③。
(3)
将D与a相连,将氨气通入BaCl2溶液中,同时向BaCl2溶液中通入SO2,SO2和NH3反应生成(NH4)2SO3,和BaCl2反应生成BaSO3白色沉淀。若将氨气换成氯气或NO2,氯气有强氧化性,NO2溶于水生成的硝酸也有强氧化性,能将SO2氧化为,遇Ba2+能生成BaSO4沉淀;氮气和CO2不能氧化SO2,所以不能产生白色沉淀,故选AB。
(4)
C中粉末完全变红,可能为单质Cu,也可能为Cu2O,也可能为两者的混合物;D中无水硫酸铜变蓝,说明有水生成;还产生一种单质气体,根据元素守恒,该单质气体为N2。
①将铜与浓硫酸共热,生成硫酸铜、SO2和水,反应的化学方程式为:Cu + 2H2SO4(浓) CuSO4 + SO2↑ + 2H2O。只有浓硫酸能和铜反应,随着反应的进行,浓硫酸变为稀硫酸,反应就停止了,此时溶液中有H+,再加入KNO3溶液,酸性溶液中的有强氧化性,能将铜氧化为Cu2+,FeCl3中的Fe3+也能和铜反应:2Fe3++Cu=2Fe2++Cu2+,加入稀硫酸和FeCl2溶液不能和铜继续反应,故选BD。
②反应前C中CuO质量为8g,物质的量为0.1mol,若反应后全部转变为Cu,则0.1molCu的质量为6.4g,若反应后全部转化为Cu2O,则物质的量为0.05mol,质量为7.2g,所以反应后既有铜,也有Cu2O,设铜的物质的量为x,Cu2O的物质的量为y,则有64x+144y=6.8,x+2y=0.1,可求出x=0.05mol,y=0.025mol。则CuO、Cu、Cu2O的物质的量之比为4:2:1,若4molCuO参加反应,根据电子守恒,则有2molNH3参加反应,生成1molN2,则反应的化学方程式为:2NH3 + 4CuO2Cu + Cu2O + N2 + 3H2O。
19.(1) 氢离子浓度过大,氢离子和铝生成氢气和铝离子
(2) 0.001 bd
【分析】配制一定物质的量浓度的溶液,所需的步骤有计算、称量、溶解(冷却)、转移、洗涤、定容、摇匀、装瓶贴签;
【详解】(1)①铝粉可将废水中的还原为,则酸性条件下,铝粉去除反应生成和铝离子、水,;
②若初始过低,则氢离子浓度过大,氢离子和铝生成氢气和铝离子,导致的去除效果也不理想;
(2)①在的过程中,碳酸根离子和氢离子反应生成碳酸氢根离子,反应的离子反应方程式为;根据钠元素守恒可知,B点溶液中0.01L×0.1mol/L=0.001mol。
②a.洗涤后容量瓶未干燥,不影响溶液浓度,a错误;
b.将烧杯中的溶液沿玻璃棒注入容量瓶后立即加水定容,烧杯玻璃棒没有洗涤,导致溶质损失,浓度偏低,b正确;
c.定容时俯视刻度线,使得溶液体积偏小,浓度偏大,c错误;
d.摇匀后加水至液面与刻度线相切,使得水的量增加,浓度偏小,d正确;
故选bd;
③A.碳酸钠受热稳定,碳酸氢钠受热不稳定分解为碳酸钠、水、二氧化碳;故残留在试管中的固体是。
B.逐滴加入,至时,消耗溶液,此时溶质完全为碳酸氢钠;继续滴加至反应完全时,又消耗溶液;、,则试样中为0.2mol/L×(0.015L-0.010L)=0.001mol,则质量分数为。
20.(1)3Fe+4H2O(g)Fe3O4+4H2
(2)除去H2中的水蒸气,防止玻璃管E破裂
(3) KMnO4(铁氰化钾) 酸性KMnO4溶液褪色(或产生蓝色沉淀) B中固体可能为Fe3O4和Fe的混合物,Fe将Fe3+全部还原为Fe2+
(4)防止H2O2在后续步骤中继续氧化+2价铁元素
(5)0.636
【分析】探究一:A中制取水蒸气,B中Fe和水蒸气反应生成四氧化三铁和氢气,C收集氢气、D用于干燥氢气,E中氢气还原CuO;
(1)高温条件下,Fe和水蒸气发生氧化还原反应生成四氧化三铁和氢气;
(2)装置D有除去H2中的水蒸气,防止E的玻璃管破裂的作用。
探究二:(3)铁离子和KSCN反应生成络合物而使溶液呈血红色,亚铁离子和KSCN不反应;
亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化。
探究三:B中固体(主要成分为Fe3O4和少量Fe)与稀盐酸反应得到氯化铁、氯化亚铁、过量的稀盐酸,加入铁粉还原铁离子:2Fe3++Fe=3Fe2+,过滤过量的铁,滤液A的溶质为氯化亚铁,加入氢氧化钠溶液,生成Fe(OH)2浑浊液,向浑浊液中加入双氧水氧化:2Fe(OH)2+H2O2=2FeOOH+2H2O,反应完成后需再加热一段时间除去剩余H2O2,再与氯化亚铁加热搅拌发生反应:2FeOOH+Fe2++2OH-=Fe3O4+2H2O,过滤、洗涤、干燥得产品Fe3O4,据此分析解答。
(1)
高温条件下,Fe和水蒸气发生氧化还原反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)Fe3O4+4H2,
因此,本题正确答案是:3Fe+4H2O(g)Fe3O4+4H2;
(2)
装置D有除去H2中的水蒸气,防止E的玻璃管破裂的作用,
因此,本题正确答案是:除去H2中的水蒸气,防止E的玻璃管破裂。
(3)
铁离子和KSCN反应生成络合物而使溶液呈血红色,亚铁离子和KSCN不反应,向溶液中加入KSCN溶液呈红色,说明含有四氧化三铁,可能含有Fe;铁离子和Fe反应生成亚铁离子,不变红色说明固体中含有四氧化三铁和Fe,
①根据实验流程试剂A应是稀硫酸,亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化,所以可以用酸性高锰酸钾溶液检验亚铁离子,现象2为酸性KMnO4溶液褪色(或可以用铁氰化钾,与亚铁离子反应生成蓝色沉淀),
因此,本题正确答案是:KMnO4(铁氰化钾);酸性KMnO4溶液褪色(或产生蓝色沉淀)
②若现象1中溶液未变血红色,说明B中固体可能有Fe3O4和Fe,Fe将Fe3+全部还原为Fe2+,
因此,本题正确答案是:B中固体可能有Fe3O4和Fe,Fe将Fe3+全部还原为Fe2+;
(4)
步骤④中,浊液D中的氢氧化亚铁与过氧化氢反应生成FeOOH,反应为:2Fe(OH)2+H2O2=2FeOOH+2H2O;步骤④中,防止其在步骤⑤中继续氧化+2价铁元素,反应完成后需再加热一段时间除去剩余H2O2;
因此,本题正确答案是:防止H2O2在后续步骤中继续氧化+2价铁元素;
(5)
设浊液B中FeOOH的物质的量为amol,滤液A中的铁元素的物质的量为bmol。
则滤液A中与FeOOH反应的亚铁离子物质的量为(b-a)mol,由图可知=1.75时,Fe3O4的产率最高,则=1.75,解得:=0.636;
因此,本题正确答案是:0.636。
同课章节目录
