1.1物质结构研究的内容(18张ppt)
文档属性
| 名称 | 1.1物质结构研究的内容(18张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 8.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-27 10:30:47 | ||
图片预览



文档简介
(共18张PPT)
1.1物质结构研究的内容
一、认识物质的特征结构
物质的性质和变化
物质组成和结构
思考
元素的原子结构是如何决定元素性质的呢?
元素的原子结构与元素的金属性和非金属性的强弱之间有什么关系?
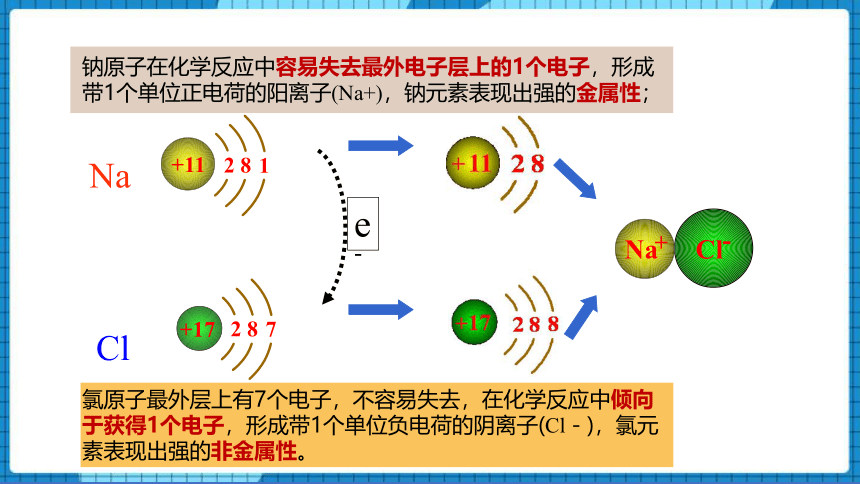
原子最外电子层上发生的变化
e-
Na
Cl
钠原子在化学反应中容易失去最外电子层上的1个电子,形成带1个单位正电荷的阳离子(Na+),钠元素表现出强的金属性;
氯原子最外层上有7个电子,不容易失去,在化学反应中倾向于获得1个电子,形成带1个单位负电荷的阴离子(Cl-),氯元素表现出强的非金属性。
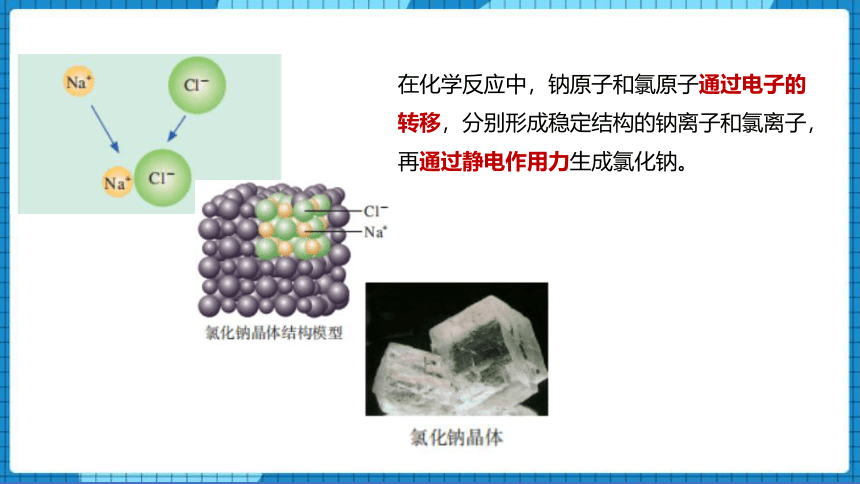
在化学反应中,钠原子和氯原子通过电子的转移,分别形成稳定结构的钠离子和氯离子,再通过静电作用力生成氯化钠。
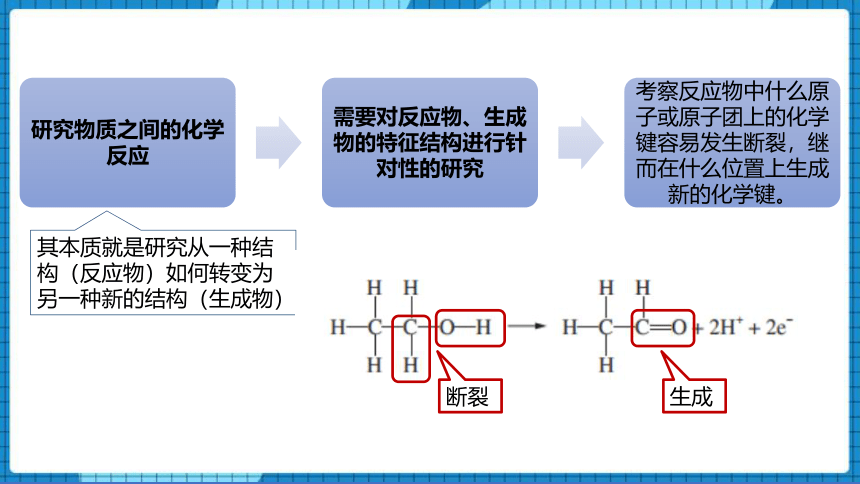
其本质就是研究从一种结构(反应物)如何转变为另一种新的结构(生成物)
断裂
生成
点击添加文本
点击添加文本
点击添加文本
点击添加文本
研究物质的特征结构需思考的问题
为什么分子具有一定的空间构型?
同一元素或不同种元素的原子之间为什么能彼此结合?
为什么元素原子之间所形成的化学键类型不同?
为什么不同晶体中的微粒可以是原子、分子或离子?
为什么有些元素能形成几种同素异形体?为什么有机化
合物有同分异构体现象?
分子中各原子的连接顺序、连接方式以及原子在分子中的空间相对位置是怎样确定的?
思考
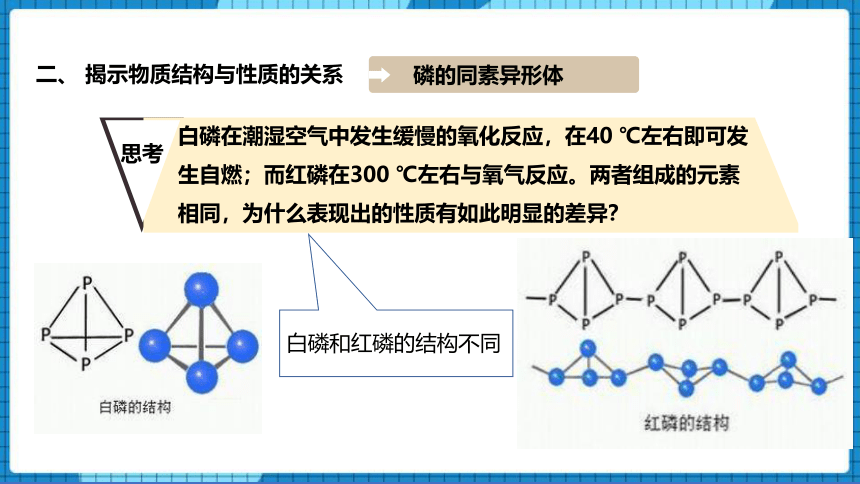
白磷在潮湿空气中发生缓慢的氧化反应,在40 ℃左右即可发生自燃;而红磷在300 ℃左右与氧气反应。两者组成的元素相同,为什么表现出的性质有如此明显的差异?
白磷和红磷的结构不同
二、 揭示物质结构与性质的关系
磷的同素异形体
二、 揭示物质结构与性质的关系
白磷晶体是由白磷分子(P4)组成的分子晶体,分子呈正四面体结构,分子中P—P键键长是221 pm,键角∠PPP是60°。因其中的P—P键弯曲而具有较大的张力,其键能较小,易断裂,所以白磷在常温、常压下就有很高的反应活性。
红磷的链状结构比较稳定,室温下不与氧气反应。
磷的同素异形体
金刚石
碳原子间结合牢固。
金刚石也是自然界中天然存在的最坚硬的物质,可用于切割金属。
二、揭示物质结构与性质的关系
碳的同素异形体
石墨
碳原子呈六边形结合成网状并层层重叠,层与层之间引力微弱,可以滑动。
常用作润滑剂。
二、揭示物质结构与性质的关系
碳的同素异形体
木炭
碳原子不规则结合,又称无定型碳。
二、揭示物质结构与性质的关系
碳的同素异形体
富勒烯结构
碳原子结合形状呈中空足球状,其中空部分可以填入其他原子或分子。
二、揭示物质结构与性质的关系
碳的同素异形体
碳纳米管结构
中空管状的富勒烯又称碳纳米管,它强度高、弹性佳,应用前景广泛。
二、揭示物质结构与性质的关系
碳的同素异形体
思考
为什么分子组成都是C2H6O的乙醇和二甲醚在性质上差异很大?例如,乙醇能与金属钠反应放出氢气而二甲醚却不能,乙醇易溶于水而二甲醚却不溶于水。
二者属同分异构体。
乙醇结构中含-OH,-OH能和金属钠反应放出氢气,-OH能和水分子之间形成氢键,故乙醇易溶于水。
思考
许多磷的化合物的结构与P4的正四面体有关,如白磷在空气中燃烧,生成的产物之一是P4O10。试从结构上对该反应进行解释。
白磷中P—P键弯曲而具有较大的张力,其键能较小,易断裂。
一个白磷分子共有六个P—P键,可结合六个氢原子,所以生成的产物之一是P4O10。
课堂小结
揭示物质结构与性质的关系
认识物质的特征结构
物质结构研究的内容
课堂练习
1.下列说法正确的是 ( )
A.红磷转化为白磷,属于物理变化
B.石墨导电,金刚石不导电,故二者不是同素异形体
C.氧气和臭氧分子式不同,性质相同
D.硫有S2、S4、S6等单质,他们都是硫的同素异形体
D
2、金刚石和石墨无性质存在较大差异,原因是( )
A、它们由不同种元素组成
B、它们各自的原子排列方式不同
C、它们具有不同的几何外形
D、石墨能导电而金刚石不能
B
1.1物质结构研究的内容
一、认识物质的特征结构
物质的性质和变化
物质组成和结构
思考
元素的原子结构是如何决定元素性质的呢?
元素的原子结构与元素的金属性和非金属性的强弱之间有什么关系?
原子最外电子层上发生的变化
e-
Na
Cl
钠原子在化学反应中容易失去最外电子层上的1个电子,形成带1个单位正电荷的阳离子(Na+),钠元素表现出强的金属性;
氯原子最外层上有7个电子,不容易失去,在化学反应中倾向于获得1个电子,形成带1个单位负电荷的阴离子(Cl-),氯元素表现出强的非金属性。
在化学反应中,钠原子和氯原子通过电子的转移,分别形成稳定结构的钠离子和氯离子,再通过静电作用力生成氯化钠。
其本质就是研究从一种结构(反应物)如何转变为另一种新的结构(生成物)
断裂
生成
点击添加文本
点击添加文本
点击添加文本
点击添加文本
研究物质的特征结构需思考的问题
为什么分子具有一定的空间构型?
同一元素或不同种元素的原子之间为什么能彼此结合?
为什么元素原子之间所形成的化学键类型不同?
为什么不同晶体中的微粒可以是原子、分子或离子?
为什么有些元素能形成几种同素异形体?为什么有机化
合物有同分异构体现象?
分子中各原子的连接顺序、连接方式以及原子在分子中的空间相对位置是怎样确定的?
思考
白磷在潮湿空气中发生缓慢的氧化反应,在40 ℃左右即可发生自燃;而红磷在300 ℃左右与氧气反应。两者组成的元素相同,为什么表现出的性质有如此明显的差异?
白磷和红磷的结构不同
二、 揭示物质结构与性质的关系
磷的同素异形体
二、 揭示物质结构与性质的关系
白磷晶体是由白磷分子(P4)组成的分子晶体,分子呈正四面体结构,分子中P—P键键长是221 pm,键角∠PPP是60°。因其中的P—P键弯曲而具有较大的张力,其键能较小,易断裂,所以白磷在常温、常压下就有很高的反应活性。
红磷的链状结构比较稳定,室温下不与氧气反应。
磷的同素异形体
金刚石
碳原子间结合牢固。
金刚石也是自然界中天然存在的最坚硬的物质,可用于切割金属。
二、揭示物质结构与性质的关系
碳的同素异形体
石墨
碳原子呈六边形结合成网状并层层重叠,层与层之间引力微弱,可以滑动。
常用作润滑剂。
二、揭示物质结构与性质的关系
碳的同素异形体
木炭
碳原子不规则结合,又称无定型碳。
二、揭示物质结构与性质的关系
碳的同素异形体
富勒烯结构
碳原子结合形状呈中空足球状,其中空部分可以填入其他原子或分子。
二、揭示物质结构与性质的关系
碳的同素异形体
碳纳米管结构
中空管状的富勒烯又称碳纳米管,它强度高、弹性佳,应用前景广泛。
二、揭示物质结构与性质的关系
碳的同素异形体
思考
为什么分子组成都是C2H6O的乙醇和二甲醚在性质上差异很大?例如,乙醇能与金属钠反应放出氢气而二甲醚却不能,乙醇易溶于水而二甲醚却不溶于水。
二者属同分异构体。
乙醇结构中含-OH,-OH能和金属钠反应放出氢气,-OH能和水分子之间形成氢键,故乙醇易溶于水。
思考
许多磷的化合物的结构与P4的正四面体有关,如白磷在空气中燃烧,生成的产物之一是P4O10。试从结构上对该反应进行解释。
白磷中P—P键弯曲而具有较大的张力,其键能较小,易断裂。
一个白磷分子共有六个P—P键,可结合六个氢原子,所以生成的产物之一是P4O10。
课堂小结
揭示物质结构与性质的关系
认识物质的特征结构
物质结构研究的内容
课堂练习
1.下列说法正确的是 ( )
A.红磷转化为白磷,属于物理变化
B.石墨导电,金刚石不导电,故二者不是同素异形体
C.氧气和臭氧分子式不同,性质相同
D.硫有S2、S4、S6等单质,他们都是硫的同素异形体
D
2、金刚石和石墨无性质存在较大差异,原因是( )
A、它们由不同种元素组成
B、它们各自的原子排列方式不同
C、它们具有不同的几何外形
D、石墨能导电而金刚石不能
B
