(培优篇)2022-2023学年下学期初中化学人教新版九年级第8章练习卷(含解析)
文档属性
| 名称 | (培优篇)2022-2023学年下学期初中化学人教新版九年级第8章练习卷(含解析) |

|
|
| 格式 | doc | ||
| 文件大小 | 260.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-27 00:00:00 | ||
图片预览



文档简介
(培优篇)2022-2023学年下学期
初中化学人教版九年级
第8章练习卷
一.选择题(共9小题)
1.现将一定量的铁粉加入盛有 Cu(NO3)2、AgNO3混合溶液的烧杯中,充分反应后加入稀盐酸,烧杯中没有气泡产生,但出现了白色沉淀,则加入盐酸前的烧杯中一定含有( )
A.Fe、Cu(NO3)2、AgNO3、Fe(NO3)2
B.Cu、Cu (NO3)2、AgNO3、Fe(NO3)2
C.Ag、Cu(NO3)2、AgNO3、Fe(NO3)2
D.Cu、Ag、AgNO3、Cu (NO3)2
2.向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一些铁粉,待完全反应后,再过滤。下列情况不可能存在的是( )
A.滤纸上有Ag、Cu,滤液中有Ag+、Fe2+、Mg2+
B.滤纸上有Ag、Cu,滤液中有Fe2+、Mg2+
C.滤纸上有Ag、Cu、Fe,滤液中有Fe2+、Mg2+
D.滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+、Mg2+
3.如图所示,倾斜锥形瓶使试管内的稀盐酸流入瓶中与固体发生反应,利用数字化设备采集瓶内气压与时间关系如曲线所示(瓶内温度变化忽略不计),以下说法错误的是( )
A.此实验的目的是探究反应物的接触面积对反应速率的影响
B.对比a和b两点可得知两反应的速率不同
C.对比c和d两点可得知两反应最终生成的气体质量不同
D.a、b和d三点处瓶内的溶质成分相同
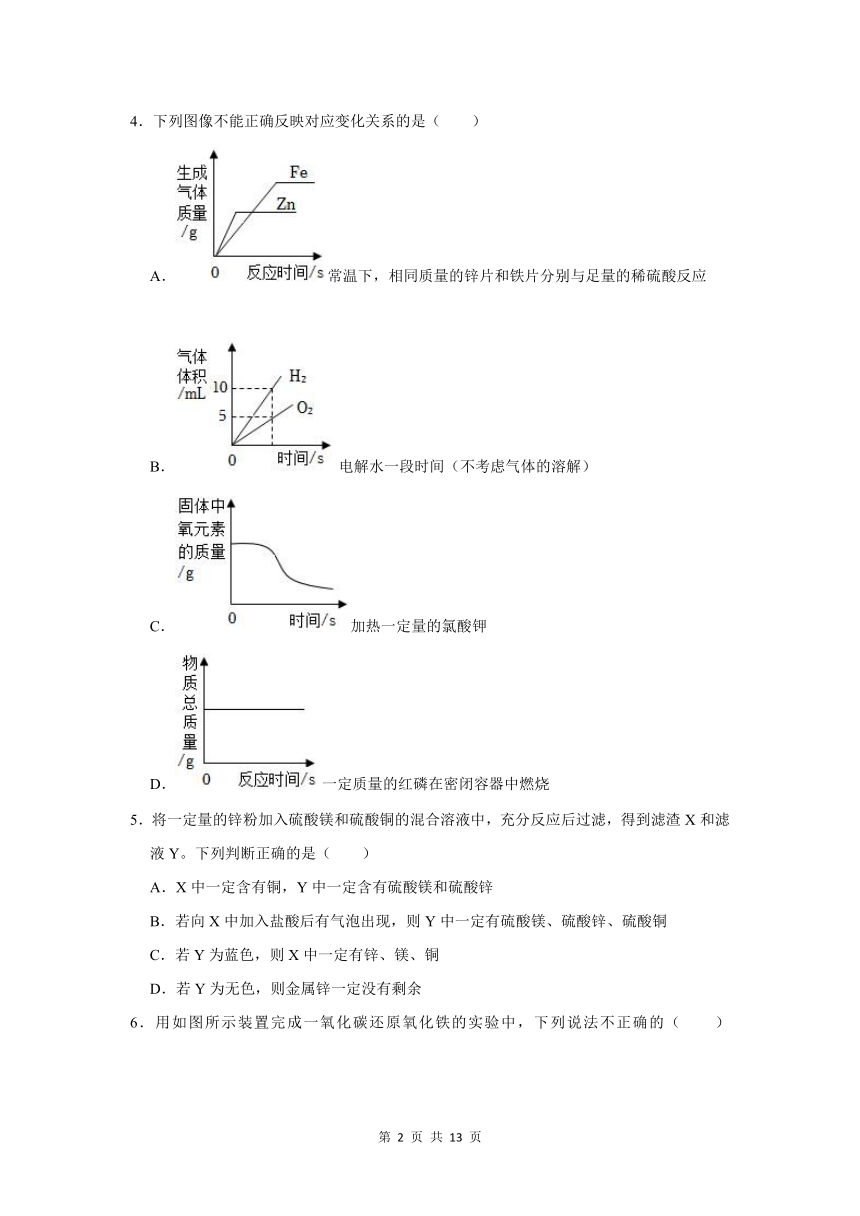
4.下列图像不能正确反映对应变化关系的是( )
A.常温下,相同质量的锌片和铁片分别与足量的稀硫酸反应
B.电解水一段时间(不考虑气体的溶解)
C.加热一定量的氯酸钾
D.一定质量的红磷在密闭容器中燃烧
5.将一定量的锌粉加入硫酸镁和硫酸铜的混合溶液中,充分反应后过滤,得到滤渣X和滤液Y。下列判断正确的是( )
A.X中一定含有铜,Y中一定含有硫酸镁和硫酸锌
B.若向X中加入盐酸后有气泡出现,则Y中一定有硫酸镁、硫酸锌、硫酸铜
C.若Y为蓝色,则X中一定有锌、镁、铜
D.若Y为无色,则金属锌一定没有剩余
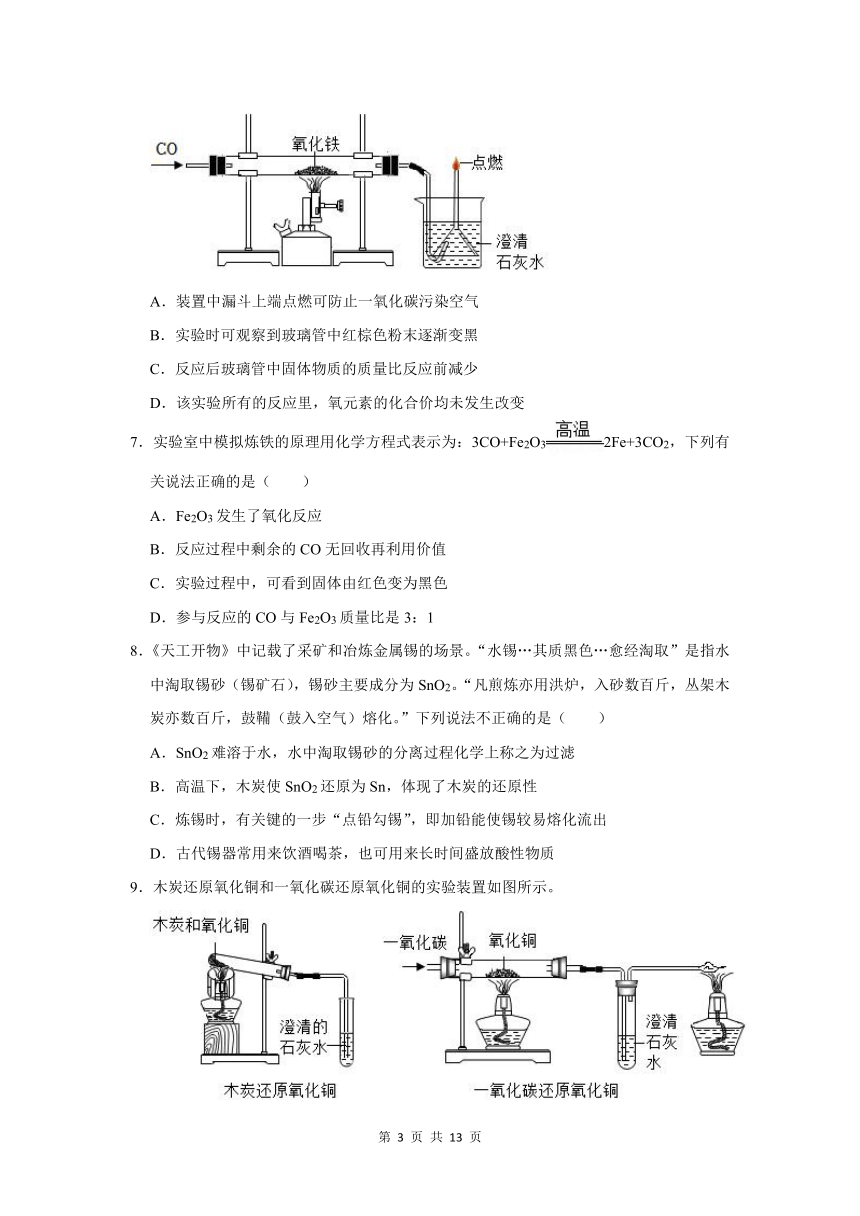
6.用如图所示装置完成一氧化碳还原氧化铁的实验中,下列说法不正确的( )
A.装置中漏斗上端点燃可防止一氧化碳污染空气
B.实验时可观察到玻璃管中红棕色粉末逐渐变黑
C.反应后玻璃管中固体物质的质量比反应前减少
D.该实验所有的反应里,氧元素的化合价均未发生改变
7.实验室中模拟炼铁的原理用化学方程式表示为:3CO+Fe2O32Fe+3CO2,下列有关说法正确的是( )
A.Fe2O3发生了氧化反应
B.反应过程中剩余的CO无回收再利用价值
C.实验过程中,可看到固体由红色变为黑色
D.参与反应的CO与Fe2O3质量比是3:1
8.《天工开物》中记载了采矿和冶炼金属锡的场景。“水锡…其质黑色…愈经淘取”是指水中淘取锡砂(锡矿石),锡砂主要成分为SnO2。“凡煎炼亦用洪炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(鼓入空气)熔化。”下列说法不正确的是( )
A.SnO2难溶于水,水中淘取锡砂的分离过程化学上称之为过滤
B.高温下,木炭使SnO2还原为Sn,体现了木炭的还原性
C.炼锡时,有关键的一步“点铅勾锡”,即加铅能使锡较易熔化流出
D.古代锡器常用来饮酒喝茶,也可用来长时间盛放酸性物质
9.木炭还原氧化铜和一氧化碳还原氧化铜的实验装置如图所示。
下列说法正确的是( )
A.木炭与氧化铜的反应中酒精灯加网罩的目的是隔绝氧气
B.两个实验的相关反应中,只有碳元素的化合价发生改变
C.两个实验中都可观察到红色固体变黑
D.一氧化碳和氧化铜反应中右侧酒精灯的作用是点燃有毒的一氧化碳防止污染空气
二.填空题(共1小题)
10.化学改变世界,科技改变生活。
(1)现在疫情还没有完全结束,放学后各学校会对教室喷洒“84”来消毒,其主要成分是次氯酸钠,制取它的化学方程式为Cl2+2NaOH═X+NaClO+H2O,则X的化学式为 。
(2)我国对石墨烯技术的研究居世界领先地位。石墨烯性能优良,用途独特,比如作太阳能电池的电极,这主要是利用了它的 性。
(3)我国自主研发的复兴号动车组列车,领跑世界,其制造材料有铝合金等,下列金属制品中,利用金属导热性的是 (填序号)。
三.实验题(共1小题)
11.人类的生活和生产离不开金属。了解金属的性质对科学的利用金属材料是十分重要的。
(1)使用铜制导线是利用铜的延展性和 。
(2)为探究铁、铜、锰(Mn)的金属活动性顺序,某同学进行了如下三个实验(金属片均已打磨且形状、大小相同,试管中所用5%的盐酸体积相同)。
实验一 实验二 实验三
实验操作
实验现象 立即产生气泡,速率较慢 立即产生气泡,速率较快
实验结论 实验一反应的化学方程式为 铁、铜、锰的金属活动性顺序(由强到弱)为
四.计算题(共1小题)
12.某钢铁厂每天需消耗2000t含Fe2O380%的赤铁矿石,请按要求进行计算:
(1)Fe2O3中铁元素与氧元素的原子个数比是 。
(2)日产纯铁的质量是 t;
(3)日产含Fe 90%的生铁的质量是 t(计算结果精确至0.1t)。
(培优篇)2022-2023学年下学期初中化学人教版九年级第8章练习卷
参考答案与试题解析
一.选择题(共9小题)
1.现将一定量的铁粉加入盛有 Cu(NO3)2、AgNO3混合溶液的烧杯中,充分反应后加入稀盐酸,烧杯中没有气泡产生,但出现了白色沉淀,则加入盐酸前的烧杯中一定含有( )
A.Fe、Cu(NO3)2、AgNO3、Fe(NO3)2
B.Cu、Cu (NO3)2、AgNO3、Fe(NO3)2
C.Ag、Cu(NO3)2、AgNO3、Fe(NO3)2
D.Cu、Ag、AgNO3、Cu (NO3)2
【解答】解:铁的金属活动性比银、铜强,将一定量的铁粉加入盛有 Cu(NO3)2、AgNO3混合溶液的烧杯中,铁先与AgNO3反应生成硝酸亚铁和银,AgNO3反应完,若还有铁粉,铁才能与Cu(NO3)2反应生成硝酸亚铁和铜;充分反应后加入稀盐酸,烧杯中没有气泡产生,说明烧杯中不含铁;但出现了白色沉淀,说明烧杯中含有硝酸银溶液,即硝酸银溶液有剩余,则硝酸铜没有参加反应,加入盐酸前的烧杯中一定含有银、Cu(NO3)2、AgNO3、Fe(NO3)2。
故选:C。
2.向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一些铁粉,待完全反应后,再过滤。下列情况不可能存在的是( )
A.滤纸上有Ag、Cu,滤液中有Ag+、Fe2+、Mg2+
B.滤纸上有Ag、Cu,滤液中有Fe2+、Mg2+
C.滤纸上有Ag、Cu、Fe,滤液中有Fe2+、Mg2+
D.滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+、Mg2+
【解答】解:A、滤纸上有Ag、Cu,说明硝酸银溶液已完全反应,所以滤液中不可能含有银离子,故A错误;
B、滤纸上有Ag、Cu,说明加入的铁可能刚好反应,则滤液中有Fe2+、Mg2+,故B正确;
C、滤纸上有Ag、Cu、Fe,说明加入的铁是过量的,则滤液中有Fe2+、Mg2+,故C正确;
D、滤纸上有Ag,硝酸银溶液可能前恰好完全反应,也可能有剩余,则滤液中可能有Ag+、Cu2+、Fe2+、Mg2+,故D正确。
故选:A。
3.如图所示,倾斜锥形瓶使试管内的稀盐酸流入瓶中与固体发生反应,利用数字化设备采集瓶内气压与时间关系如曲线所示(瓶内温度变化忽略不计),以下说法错误的是( )
A.此实验的目的是探究反应物的接触面积对反应速率的影响
B.对比a和b两点可得知两反应的速率不同
C.对比c和d两点可得知两反应最终生成的气体质量不同
D.a、b和d三点处瓶内的溶质成分相同
【解答】解:A、实验是等质量的锌粒和锌粉分别与等量的稀盐酸反应,由利用数字化设备采集瓶内气压与时间关系的曲线,此实验的目的是探究反应物的接触面积对反应速率的影响,故选项说法正确。
B、a、b两点,反应时间不同、气压相同,说明两反应的速率不同,故选项说法正确。
C、对比分析c、d点可知,相同的时间时,c的气压大,此时产生的氢气的质量多;由图示可知,两反应最终生成的气体质量相同,故选项说法错误。
D、a、b、d点时溶质是氯化锌、氯化氢,a、b、d三点处的溶质成分氯化锌、氯化氢,故选项说法正确。
故选:C。
4.下列图像不能正确反映对应变化关系的是( )
A.常温下,相同质量的锌片和铁片分别与足量的稀硫酸反应
B.电解水一段时间(不考虑气体的溶解)
C.加热一定量的氯酸钾
D.一定质量的红磷在密闭容器中燃烧
【解答】解:A、锌的活动性比铁强,反应速率快,至完全反应所需时间短;相同质量的锌片和铁片分别与足量的稀硫酸反应,铁生成氢气的质量比锌多,故选项图像正确。
B、通电分解水,生成氢气和氧气的体积之比为2:1,故选项图像正确。
C、氯酸钾在加热条件下生成氯化钾和氧气,加热到一定温度,氯酸钾才能分解,随着反应的进行,氧气逸出,剩余固体中氧元素的质量逐渐减少,至完全反应减少至0,故选项图像错误。
D、一定质量的红磷在密闭容器中燃烧,物质的总质量不变,故选项图像正确。
故选:C。
5.将一定量的锌粉加入硫酸镁和硫酸铜的混合溶液中,充分反应后过滤,得到滤渣X和滤液Y。下列判断正确的是( )
A.X中一定含有铜,Y中一定含有硫酸镁和硫酸锌
B.若向X中加入盐酸后有气泡出现,则Y中一定有硫酸镁、硫酸锌、硫酸铜
C.若Y为蓝色,则X中一定有锌、镁、铜
D.若Y为无色,则金属锌一定没有剩余
【解答】解:A、金属活动性Mg>Zn>Cu,如果将一定量锌粉加入硫酸镁和硫酸铜的混合溶液中,锌与硫酸镁不反应,锌与硫酸铜反应生成硫酸锌和铜。因为锌一定能与硫酸铜溶液反应(生成硫酸锌和铜)、一定不能与硫酸镁溶液反应,显然滤渣中一定含有铜,滤液中一定含有硫酸镁和硫酸锌,该选项正确。
B、若向滤渣中加入盐酸有气泡产生,说明滤渣中有锌,即硫酸铜已反应完,因此滤液中一定有硫酸镁、硫酸锌,一定没有硫酸铜,该选项不正确。
C、若滤液为蓝色,说明硫酸铜有剩余,即锌已经反应完,因此滤渣中一定有铜,一定没有锌和镁,该选项不正确。
D、如果滤液无色,说明硫酸铜已经反应完,而金属锌可能恰好完全反应,也可能有剩余,该选项不正确。
故选:A。
6.用如图所示装置完成一氧化碳还原氧化铁的实验中,下列说法不正确的( )
A.装置中漏斗上端点燃可防止一氧化碳污染空气
B.实验时可观察到玻璃管中红棕色粉末逐渐变黑
C.反应后玻璃管中固体物质的质量比反应前减少
D.该实验所有的反应里,氧元素的化合价均未发生改变
【解答】解:A、一氧化碳和氧气在点燃的条件下生成二氧化碳,装置中漏斗上端点燃可防止一氧化碳污染空气,故A正确;
B、实验时可观察到玻璃管中红棕色粉末逐渐变黑,故B正确;
C、反应后玻璃管中固体物质的质量比反应前减少,故C正确;
D、该实验所有的反应里,一氧化碳和氧气在点燃的条件下生成二氧化碳,氧气中的氧元素的化合价为0,生成的二氧化碳中,氧元素为﹣2价,化合价降低,故D错误。
故选:D。
7.实验室中模拟炼铁的原理用化学方程式表示为:3CO+Fe2O32Fe+3CO2,下列有关说法正确的是( )
A.Fe2O3发生了氧化反应
B.反应过程中剩余的CO无回收再利用价值
C.实验过程中,可看到固体由红色变为黑色
D.参与反应的CO与Fe2O3质量比是3:1
【解答】解:A、在该反应中,氧化铁失去氧,属于氧化剂,发生了还原反应,该选项不正确。
B、一氧化碳具有还原性,可用于冶炼金属,反应过程中剩余的一氧化碳可回收再利用,该选项不正确。
C、一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,现象为:红棕色固体逐渐变为黑色,该选项正确。
D、该反应中,参加反应的一氧化碳与氧化铁的质量比为:(28×3):160=21:40,该选项不正确。
故选:C。
8.《天工开物》中记载了采矿和冶炼金属锡的场景。“水锡…其质黑色…愈经淘取”是指水中淘取锡砂(锡矿石),锡砂主要成分为SnO2。“凡煎炼亦用洪炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(鼓入空气)熔化。”下列说法不正确的是( )
A.SnO2难溶于水,水中淘取锡砂的分离过程化学上称之为过滤
B.高温下,木炭使SnO2还原为Sn,体现了木炭的还原性
C.炼锡时,有关键的一步“点铅勾锡”,即加铅能使锡较易熔化流出
D.古代锡器常用来饮酒喝茶,也可用来长时间盛放酸性物质
【解答】解:A、过滤能将固体与液体分离,SnO2难溶于水,水中淘取锡砂的分离过程化学上称之为过滤,故A正确;
B、高温下,木炭使SnO2还原为Sn,木炭得到了氧,体现了木炭的还原性,故B正确;
C、炼锡时,有关键的一步“点铅勾锡”,即加铅能形成合金,为熔点降低,使锡较易熔化流出,故C正确;
D、在金属活动顺序中,锡的活动性排在氢之前,能与酸发生置换反应,不可用来长时间盛放酸性物质,故D错误。
故选:D。
9.木炭还原氧化铜和一氧化碳还原氧化铜的实验装置如图所示。
下列说法正确的是( )
A.木炭与氧化铜的反应中酒精灯加网罩的目的是隔绝氧气
B.两个实验的相关反应中,只有碳元素的化合价发生改变
C.两个实验中都可观察到红色固体变黑
D.一氧化碳和氧化铜反应中右侧酒精灯的作用是点燃有毒的一氧化碳防止污染空气
【解答】解:A、木炭与氧化铜的反应中酒精灯加网罩的目的是使火焰集中,提高温度,故A错误;
B、两个实验的相关反应中,C、Cu元素的化合价都发生改变,氧元素化合价不变,故B错误;
C、两个实验中都可观察到黑色固体变红,故C错误;
D、一氧化碳和氧气在点燃的条件下生成二氧化碳,所以一氧化碳和氧化铜反应中右侧酒精灯的作用是点燃有毒的一氧化碳防止污染空气,故D正确。
故选:D。
二.填空题(共1小题)
10.化学改变世界,科技改变生活。
(1)现在疫情还没有完全结束,放学后各学校会对教室喷洒“84”来消毒,其主要成分是次氯酸钠,制取它的化学方程式为Cl2+2NaOH═X+NaClO+H2O,则X的化学式为 NaCl 。
(2)我国对石墨烯技术的研究居世界领先地位。石墨烯性能优良,用途独特,比如作太阳能电池的电极,这主要是利用了它的 导电 性。
(3)我国自主研发的复兴号动车组列车,领跑世界,其制造材料有铝合金等,下列金属制品中,利用金属导热性的是 C (填序号)。
【解答】解:(1)根据反应的化学方程式2NaOH+Cl2═NaClO+X+H2O,反应物中钠、氢、氧、氯原子个数分别为2、2、2、2,反应后的生成物中钠、氢、氯、氧原子个数分别为1、2、1、2,根据反应前后原子种类、数目不变,则X分子中含有1个氯原子和1个钠原子,则物质X的化学式为NaCl;故填:NaCl;
(2)石墨烯性能优良,用途独特,比如作太阳能电池的电极,这主要是利用了它的导电性;故填:导电;
(3)黄金制成饰品是利用了黄金的价格昂贵、颜色高贵;铜制成导线是利用了铜的导电性;铁制成铁炒锅是利用了铁的导热性;故填:C。
三.实验题(共1小题)
11.人类的生活和生产离不开金属。了解金属的性质对科学的利用金属材料是十分重要的。
(1)使用铜制导线是利用铜的延展性和 导电性 。
(2)为探究铁、铜、锰(Mn)的金属活动性顺序,某同学进行了如下三个实验(金属片均已打磨且形状、大小相同,试管中所用5%的盐酸体积相同)。
实验一 实验二 实验三
实验操作
实验现象 立即产生气泡,速率较慢 无明显现象 立即产生气泡,速率较快
实验结论 实验一反应的化学方程式为 Fe+2HCl=FeCl2+H2↑ 铁、铜、锰的金属活动性顺序(由强到弱)为 Mn>Fe>Cu
【解答】解:(1)高铁电路多用铜制导线,这是利用铜的延展性和导电性。
(2)铜在金属活动性顺序表中位于氢后,铜与盐酸不反应;铁与盐酸反应生成氯化亚铁和氢气,化学方程式为Fe+2HCl=FeCl2+H2↑;铁表面产生气泡的速度慢、铜表面无明显现象、锰表面产生气泡的速度快,说明三种金属活泼性由强到弱的顺序为锰>铁>铜。
故答案为:(1)导电性;
(2)无明显现象;Fe+2HCl=FeCl2+H2↑;Mn>Fe>Cu。
四.计算题(共1小题)
12.某钢铁厂每天需消耗2000t含Fe2O380%的赤铁矿石,请按要求进行计算:
(1)Fe2O3中铁元素与氧元素的原子个数比是 2:3 。
(2)日产纯铁的质量是 1120 t;
(3)日产含Fe 90%的生铁的质量是 1244.4 t(计算结果精确至0.1t)。
【解答】解:(1)Fe2O3中铁元素与氧元素的原子个数比为2:3;
(2)设日产纯铁的质量为x.
Fe2O3+3CO2Fe+3CO2
160 112
2000t×80% x
x=1120g
答:日产纯铁的质量是1120t。
(3)日产含Fe 90%的生铁的质量是≈1244.4t。
故答案为:(1)2:3;
(2)1120t;
(3)1244.4t
初中化学人教版九年级
第8章练习卷
一.选择题(共9小题)
1.现将一定量的铁粉加入盛有 Cu(NO3)2、AgNO3混合溶液的烧杯中,充分反应后加入稀盐酸,烧杯中没有气泡产生,但出现了白色沉淀,则加入盐酸前的烧杯中一定含有( )
A.Fe、Cu(NO3)2、AgNO3、Fe(NO3)2
B.Cu、Cu (NO3)2、AgNO3、Fe(NO3)2
C.Ag、Cu(NO3)2、AgNO3、Fe(NO3)2
D.Cu、Ag、AgNO3、Cu (NO3)2
2.向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一些铁粉,待完全反应后,再过滤。下列情况不可能存在的是( )
A.滤纸上有Ag、Cu,滤液中有Ag+、Fe2+、Mg2+
B.滤纸上有Ag、Cu,滤液中有Fe2+、Mg2+
C.滤纸上有Ag、Cu、Fe,滤液中有Fe2+、Mg2+
D.滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+、Mg2+
3.如图所示,倾斜锥形瓶使试管内的稀盐酸流入瓶中与固体发生反应,利用数字化设备采集瓶内气压与时间关系如曲线所示(瓶内温度变化忽略不计),以下说法错误的是( )
A.此实验的目的是探究反应物的接触面积对反应速率的影响
B.对比a和b两点可得知两反应的速率不同
C.对比c和d两点可得知两反应最终生成的气体质量不同
D.a、b和d三点处瓶内的溶质成分相同
4.下列图像不能正确反映对应变化关系的是( )
A.常温下,相同质量的锌片和铁片分别与足量的稀硫酸反应
B.电解水一段时间(不考虑气体的溶解)
C.加热一定量的氯酸钾
D.一定质量的红磷在密闭容器中燃烧
5.将一定量的锌粉加入硫酸镁和硫酸铜的混合溶液中,充分反应后过滤,得到滤渣X和滤液Y。下列判断正确的是( )
A.X中一定含有铜,Y中一定含有硫酸镁和硫酸锌
B.若向X中加入盐酸后有气泡出现,则Y中一定有硫酸镁、硫酸锌、硫酸铜
C.若Y为蓝色,则X中一定有锌、镁、铜
D.若Y为无色,则金属锌一定没有剩余
6.用如图所示装置完成一氧化碳还原氧化铁的实验中,下列说法不正确的( )
A.装置中漏斗上端点燃可防止一氧化碳污染空气
B.实验时可观察到玻璃管中红棕色粉末逐渐变黑
C.反应后玻璃管中固体物质的质量比反应前减少
D.该实验所有的反应里,氧元素的化合价均未发生改变
7.实验室中模拟炼铁的原理用化学方程式表示为:3CO+Fe2O32Fe+3CO2,下列有关说法正确的是( )
A.Fe2O3发生了氧化反应
B.反应过程中剩余的CO无回收再利用价值
C.实验过程中,可看到固体由红色变为黑色
D.参与反应的CO与Fe2O3质量比是3:1
8.《天工开物》中记载了采矿和冶炼金属锡的场景。“水锡…其质黑色…愈经淘取”是指水中淘取锡砂(锡矿石),锡砂主要成分为SnO2。“凡煎炼亦用洪炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(鼓入空气)熔化。”下列说法不正确的是( )
A.SnO2难溶于水,水中淘取锡砂的分离过程化学上称之为过滤
B.高温下,木炭使SnO2还原为Sn,体现了木炭的还原性
C.炼锡时,有关键的一步“点铅勾锡”,即加铅能使锡较易熔化流出
D.古代锡器常用来饮酒喝茶,也可用来长时间盛放酸性物质
9.木炭还原氧化铜和一氧化碳还原氧化铜的实验装置如图所示。
下列说法正确的是( )
A.木炭与氧化铜的反应中酒精灯加网罩的目的是隔绝氧气
B.两个实验的相关反应中,只有碳元素的化合价发生改变
C.两个实验中都可观察到红色固体变黑
D.一氧化碳和氧化铜反应中右侧酒精灯的作用是点燃有毒的一氧化碳防止污染空气
二.填空题(共1小题)
10.化学改变世界,科技改变生活。
(1)现在疫情还没有完全结束,放学后各学校会对教室喷洒“84”来消毒,其主要成分是次氯酸钠,制取它的化学方程式为Cl2+2NaOH═X+NaClO+H2O,则X的化学式为 。
(2)我国对石墨烯技术的研究居世界领先地位。石墨烯性能优良,用途独特,比如作太阳能电池的电极,这主要是利用了它的 性。
(3)我国自主研发的复兴号动车组列车,领跑世界,其制造材料有铝合金等,下列金属制品中,利用金属导热性的是 (填序号)。
三.实验题(共1小题)
11.人类的生活和生产离不开金属。了解金属的性质对科学的利用金属材料是十分重要的。
(1)使用铜制导线是利用铜的延展性和 。
(2)为探究铁、铜、锰(Mn)的金属活动性顺序,某同学进行了如下三个实验(金属片均已打磨且形状、大小相同,试管中所用5%的盐酸体积相同)。
实验一 实验二 实验三
实验操作
实验现象 立即产生气泡,速率较慢 立即产生气泡,速率较快
实验结论 实验一反应的化学方程式为 铁、铜、锰的金属活动性顺序(由强到弱)为
四.计算题(共1小题)
12.某钢铁厂每天需消耗2000t含Fe2O380%的赤铁矿石,请按要求进行计算:
(1)Fe2O3中铁元素与氧元素的原子个数比是 。
(2)日产纯铁的质量是 t;
(3)日产含Fe 90%的生铁的质量是 t(计算结果精确至0.1t)。
(培优篇)2022-2023学年下学期初中化学人教版九年级第8章练习卷
参考答案与试题解析
一.选择题(共9小题)
1.现将一定量的铁粉加入盛有 Cu(NO3)2、AgNO3混合溶液的烧杯中,充分反应后加入稀盐酸,烧杯中没有气泡产生,但出现了白色沉淀,则加入盐酸前的烧杯中一定含有( )
A.Fe、Cu(NO3)2、AgNO3、Fe(NO3)2
B.Cu、Cu (NO3)2、AgNO3、Fe(NO3)2
C.Ag、Cu(NO3)2、AgNO3、Fe(NO3)2
D.Cu、Ag、AgNO3、Cu (NO3)2
【解答】解:铁的金属活动性比银、铜强,将一定量的铁粉加入盛有 Cu(NO3)2、AgNO3混合溶液的烧杯中,铁先与AgNO3反应生成硝酸亚铁和银,AgNO3反应完,若还有铁粉,铁才能与Cu(NO3)2反应生成硝酸亚铁和铜;充分反应后加入稀盐酸,烧杯中没有气泡产生,说明烧杯中不含铁;但出现了白色沉淀,说明烧杯中含有硝酸银溶液,即硝酸银溶液有剩余,则硝酸铜没有参加反应,加入盐酸前的烧杯中一定含有银、Cu(NO3)2、AgNO3、Fe(NO3)2。
故选:C。
2.向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一些铁粉,待完全反应后,再过滤。下列情况不可能存在的是( )
A.滤纸上有Ag、Cu,滤液中有Ag+、Fe2+、Mg2+
B.滤纸上有Ag、Cu,滤液中有Fe2+、Mg2+
C.滤纸上有Ag、Cu、Fe,滤液中有Fe2+、Mg2+
D.滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+、Mg2+
【解答】解:A、滤纸上有Ag、Cu,说明硝酸银溶液已完全反应,所以滤液中不可能含有银离子,故A错误;
B、滤纸上有Ag、Cu,说明加入的铁可能刚好反应,则滤液中有Fe2+、Mg2+,故B正确;
C、滤纸上有Ag、Cu、Fe,说明加入的铁是过量的,则滤液中有Fe2+、Mg2+,故C正确;
D、滤纸上有Ag,硝酸银溶液可能前恰好完全反应,也可能有剩余,则滤液中可能有Ag+、Cu2+、Fe2+、Mg2+,故D正确。
故选:A。
3.如图所示,倾斜锥形瓶使试管内的稀盐酸流入瓶中与固体发生反应,利用数字化设备采集瓶内气压与时间关系如曲线所示(瓶内温度变化忽略不计),以下说法错误的是( )
A.此实验的目的是探究反应物的接触面积对反应速率的影响
B.对比a和b两点可得知两反应的速率不同
C.对比c和d两点可得知两反应最终生成的气体质量不同
D.a、b和d三点处瓶内的溶质成分相同
【解答】解:A、实验是等质量的锌粒和锌粉分别与等量的稀盐酸反应,由利用数字化设备采集瓶内气压与时间关系的曲线,此实验的目的是探究反应物的接触面积对反应速率的影响,故选项说法正确。
B、a、b两点,反应时间不同、气压相同,说明两反应的速率不同,故选项说法正确。
C、对比分析c、d点可知,相同的时间时,c的气压大,此时产生的氢气的质量多;由图示可知,两反应最终生成的气体质量相同,故选项说法错误。
D、a、b、d点时溶质是氯化锌、氯化氢,a、b、d三点处的溶质成分氯化锌、氯化氢,故选项说法正确。
故选:C。
4.下列图像不能正确反映对应变化关系的是( )
A.常温下,相同质量的锌片和铁片分别与足量的稀硫酸反应
B.电解水一段时间(不考虑气体的溶解)
C.加热一定量的氯酸钾
D.一定质量的红磷在密闭容器中燃烧
【解答】解:A、锌的活动性比铁强,反应速率快,至完全反应所需时间短;相同质量的锌片和铁片分别与足量的稀硫酸反应,铁生成氢气的质量比锌多,故选项图像正确。
B、通电分解水,生成氢气和氧气的体积之比为2:1,故选项图像正确。
C、氯酸钾在加热条件下生成氯化钾和氧气,加热到一定温度,氯酸钾才能分解,随着反应的进行,氧气逸出,剩余固体中氧元素的质量逐渐减少,至完全反应减少至0,故选项图像错误。
D、一定质量的红磷在密闭容器中燃烧,物质的总质量不变,故选项图像正确。
故选:C。
5.将一定量的锌粉加入硫酸镁和硫酸铜的混合溶液中,充分反应后过滤,得到滤渣X和滤液Y。下列判断正确的是( )
A.X中一定含有铜,Y中一定含有硫酸镁和硫酸锌
B.若向X中加入盐酸后有气泡出现,则Y中一定有硫酸镁、硫酸锌、硫酸铜
C.若Y为蓝色,则X中一定有锌、镁、铜
D.若Y为无色,则金属锌一定没有剩余
【解答】解:A、金属活动性Mg>Zn>Cu,如果将一定量锌粉加入硫酸镁和硫酸铜的混合溶液中,锌与硫酸镁不反应,锌与硫酸铜反应生成硫酸锌和铜。因为锌一定能与硫酸铜溶液反应(生成硫酸锌和铜)、一定不能与硫酸镁溶液反应,显然滤渣中一定含有铜,滤液中一定含有硫酸镁和硫酸锌,该选项正确。
B、若向滤渣中加入盐酸有气泡产生,说明滤渣中有锌,即硫酸铜已反应完,因此滤液中一定有硫酸镁、硫酸锌,一定没有硫酸铜,该选项不正确。
C、若滤液为蓝色,说明硫酸铜有剩余,即锌已经反应完,因此滤渣中一定有铜,一定没有锌和镁,该选项不正确。
D、如果滤液无色,说明硫酸铜已经反应完,而金属锌可能恰好完全反应,也可能有剩余,该选项不正确。
故选:A。
6.用如图所示装置完成一氧化碳还原氧化铁的实验中,下列说法不正确的( )
A.装置中漏斗上端点燃可防止一氧化碳污染空气
B.实验时可观察到玻璃管中红棕色粉末逐渐变黑
C.反应后玻璃管中固体物质的质量比反应前减少
D.该实验所有的反应里,氧元素的化合价均未发生改变
【解答】解:A、一氧化碳和氧气在点燃的条件下生成二氧化碳,装置中漏斗上端点燃可防止一氧化碳污染空气,故A正确;
B、实验时可观察到玻璃管中红棕色粉末逐渐变黑,故B正确;
C、反应后玻璃管中固体物质的质量比反应前减少,故C正确;
D、该实验所有的反应里,一氧化碳和氧气在点燃的条件下生成二氧化碳,氧气中的氧元素的化合价为0,生成的二氧化碳中,氧元素为﹣2价,化合价降低,故D错误。
故选:D。
7.实验室中模拟炼铁的原理用化学方程式表示为:3CO+Fe2O32Fe+3CO2,下列有关说法正确的是( )
A.Fe2O3发生了氧化反应
B.反应过程中剩余的CO无回收再利用价值
C.实验过程中,可看到固体由红色变为黑色
D.参与反应的CO与Fe2O3质量比是3:1
【解答】解:A、在该反应中,氧化铁失去氧,属于氧化剂,发生了还原反应,该选项不正确。
B、一氧化碳具有还原性,可用于冶炼金属,反应过程中剩余的一氧化碳可回收再利用,该选项不正确。
C、一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,现象为:红棕色固体逐渐变为黑色,该选项正确。
D、该反应中,参加反应的一氧化碳与氧化铁的质量比为:(28×3):160=21:40,该选项不正确。
故选:C。
8.《天工开物》中记载了采矿和冶炼金属锡的场景。“水锡…其质黑色…愈经淘取”是指水中淘取锡砂(锡矿石),锡砂主要成分为SnO2。“凡煎炼亦用洪炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(鼓入空气)熔化。”下列说法不正确的是( )
A.SnO2难溶于水,水中淘取锡砂的分离过程化学上称之为过滤
B.高温下,木炭使SnO2还原为Sn,体现了木炭的还原性
C.炼锡时,有关键的一步“点铅勾锡”,即加铅能使锡较易熔化流出
D.古代锡器常用来饮酒喝茶,也可用来长时间盛放酸性物质
【解答】解:A、过滤能将固体与液体分离,SnO2难溶于水,水中淘取锡砂的分离过程化学上称之为过滤,故A正确;
B、高温下,木炭使SnO2还原为Sn,木炭得到了氧,体现了木炭的还原性,故B正确;
C、炼锡时,有关键的一步“点铅勾锡”,即加铅能形成合金,为熔点降低,使锡较易熔化流出,故C正确;
D、在金属活动顺序中,锡的活动性排在氢之前,能与酸发生置换反应,不可用来长时间盛放酸性物质,故D错误。
故选:D。
9.木炭还原氧化铜和一氧化碳还原氧化铜的实验装置如图所示。
下列说法正确的是( )
A.木炭与氧化铜的反应中酒精灯加网罩的目的是隔绝氧气
B.两个实验的相关反应中,只有碳元素的化合价发生改变
C.两个实验中都可观察到红色固体变黑
D.一氧化碳和氧化铜反应中右侧酒精灯的作用是点燃有毒的一氧化碳防止污染空气
【解答】解:A、木炭与氧化铜的反应中酒精灯加网罩的目的是使火焰集中,提高温度,故A错误;
B、两个实验的相关反应中,C、Cu元素的化合价都发生改变,氧元素化合价不变,故B错误;
C、两个实验中都可观察到黑色固体变红,故C错误;
D、一氧化碳和氧气在点燃的条件下生成二氧化碳,所以一氧化碳和氧化铜反应中右侧酒精灯的作用是点燃有毒的一氧化碳防止污染空气,故D正确。
故选:D。
二.填空题(共1小题)
10.化学改变世界,科技改变生活。
(1)现在疫情还没有完全结束,放学后各学校会对教室喷洒“84”来消毒,其主要成分是次氯酸钠,制取它的化学方程式为Cl2+2NaOH═X+NaClO+H2O,则X的化学式为 NaCl 。
(2)我国对石墨烯技术的研究居世界领先地位。石墨烯性能优良,用途独特,比如作太阳能电池的电极,这主要是利用了它的 导电 性。
(3)我国自主研发的复兴号动车组列车,领跑世界,其制造材料有铝合金等,下列金属制品中,利用金属导热性的是 C (填序号)。
【解答】解:(1)根据反应的化学方程式2NaOH+Cl2═NaClO+X+H2O,反应物中钠、氢、氧、氯原子个数分别为2、2、2、2,反应后的生成物中钠、氢、氯、氧原子个数分别为1、2、1、2,根据反应前后原子种类、数目不变,则X分子中含有1个氯原子和1个钠原子,则物质X的化学式为NaCl;故填:NaCl;
(2)石墨烯性能优良,用途独特,比如作太阳能电池的电极,这主要是利用了它的导电性;故填:导电;
(3)黄金制成饰品是利用了黄金的价格昂贵、颜色高贵;铜制成导线是利用了铜的导电性;铁制成铁炒锅是利用了铁的导热性;故填:C。
三.实验题(共1小题)
11.人类的生活和生产离不开金属。了解金属的性质对科学的利用金属材料是十分重要的。
(1)使用铜制导线是利用铜的延展性和 导电性 。
(2)为探究铁、铜、锰(Mn)的金属活动性顺序,某同学进行了如下三个实验(金属片均已打磨且形状、大小相同,试管中所用5%的盐酸体积相同)。
实验一 实验二 实验三
实验操作
实验现象 立即产生气泡,速率较慢 无明显现象 立即产生气泡,速率较快
实验结论 实验一反应的化学方程式为 Fe+2HCl=FeCl2+H2↑ 铁、铜、锰的金属活动性顺序(由强到弱)为 Mn>Fe>Cu
【解答】解:(1)高铁电路多用铜制导线,这是利用铜的延展性和导电性。
(2)铜在金属活动性顺序表中位于氢后,铜与盐酸不反应;铁与盐酸反应生成氯化亚铁和氢气,化学方程式为Fe+2HCl=FeCl2+H2↑;铁表面产生气泡的速度慢、铜表面无明显现象、锰表面产生气泡的速度快,说明三种金属活泼性由强到弱的顺序为锰>铁>铜。
故答案为:(1)导电性;
(2)无明显现象;Fe+2HCl=FeCl2+H2↑;Mn>Fe>Cu。
四.计算题(共1小题)
12.某钢铁厂每天需消耗2000t含Fe2O380%的赤铁矿石,请按要求进行计算:
(1)Fe2O3中铁元素与氧元素的原子个数比是 2:3 。
(2)日产纯铁的质量是 1120 t;
(3)日产含Fe 90%的生铁的质量是 1244.4 t(计算结果精确至0.1t)。
【解答】解:(1)Fe2O3中铁元素与氧元素的原子个数比为2:3;
(2)设日产纯铁的质量为x.
Fe2O3+3CO2Fe+3CO2
160 112
2000t×80% x
x=1120g
答:日产纯铁的质量是1120t。
(3)日产含Fe 90%的生铁的质量是≈1244.4t。
故答案为:(1)2:3;
(2)1120t;
(3)1244.4t
同课章节目录
