第五单元 课题2 如何正确书写化学方程式(含解析)—2022-2023学年九年级化学上册最新命题导向假期培优
文档属性
| 名称 | 第五单元 课题2 如何正确书写化学方程式(含解析)—2022-2023学年九年级化学上册最新命题导向假期培优 |  | |
| 格式 | zip | ||
| 文件大小 | 165.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-27 09:51:34 | ||
图片预览


文档简介
第五单元 化学方程式
课题2 如何正确书写化学方程式
一、单选题
1.在催化剂作用下,二氧化碳与氢气能高效转化为甲醇(CH3OH),下列说法正确的是 ( )
A.反应前后原子、分子种类没有发生改变
B.反应前后氢元素的化合价未改变
C.该反应的四种物质中有两种氧化物
D.参加反应的甲和乙的个数比为1:1
2.可灭杀新型冠状病毒的甲、乙物质有如图转化。下列说法错误的是 ( )
A.甲物质应在干燥环境中,避光、密封保存
B.转化②是分解反应
C.转化②生成丙、丁两物质的分子数之比为1:1
D.转化①②过程中均有元素化合价变化
3.下列化学方程式书写正确的是 ( )
A.H2CO3=H2O + CO2
B.S+O2SO2↑
C.3Fe+2O2= Fe3O4
D.H2+CuO H2O+Cu
4.物质X是一种重要的阻燃剂。用三氧化二锑(Sb2O3)生产X的化学方程式为Sb2O3 + 2H2O2=X + 2H2O。X的化学式为 ( )
A.SbO2 B.Sb2O5 C.HSbO3 D.H3SbO4
5.碳铵(化学式为NH4HCO3)是一种固态氮肥,与熟石灰发生的反应为,则X的化学式为
A.H2O2 B.H2O C.CO2 D.H2
6.下列化学方程式书写不正确的是 ( )
A.C+O2CO2 B.2P+5O2P2O5
C.CH4+2O22H2O+CO2 D.CO2+Ca(OH)2=CaCO3↓+H2O
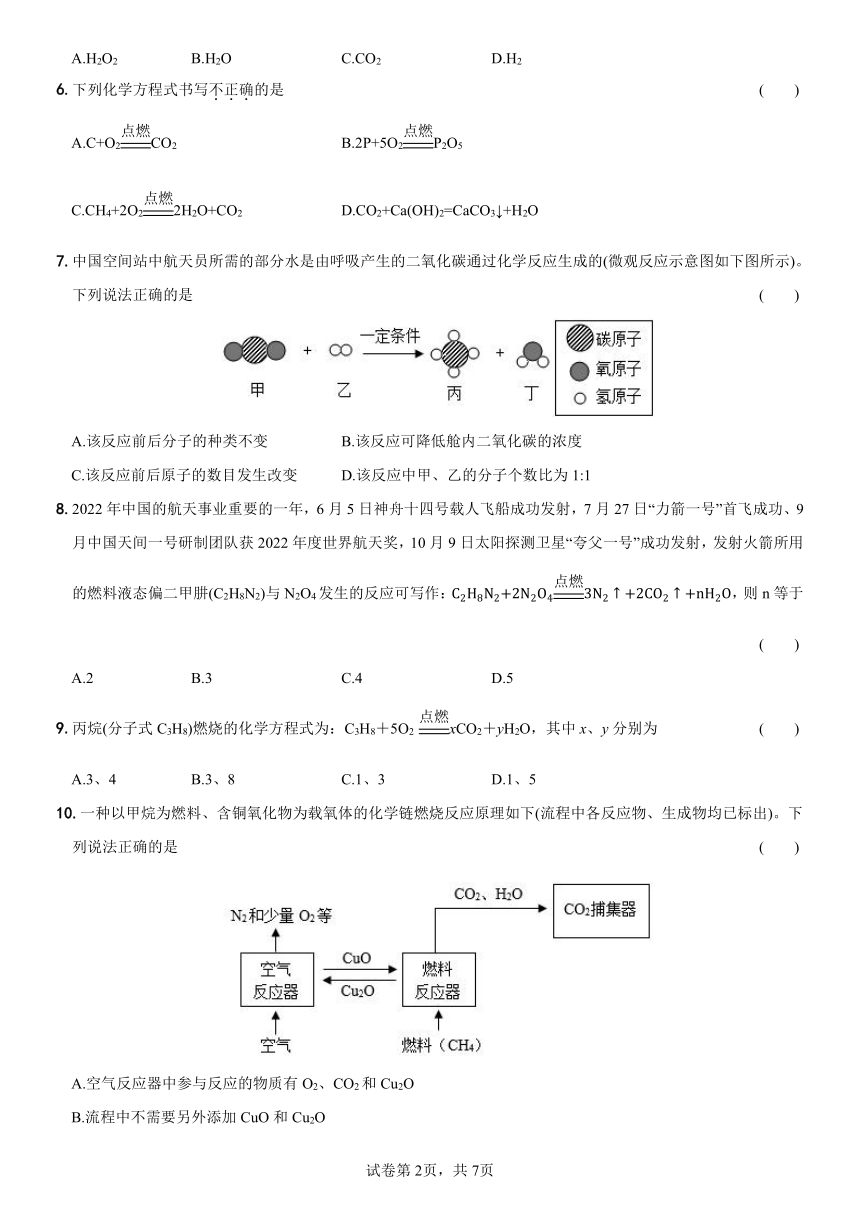
7.中国空间站中航天员所需的部分水是由呼吸产生的二氧化碳通过化学反应生成的(微观反应示意图如下图所示)。下列说法正确的是 ( )
A.该反应前后分子的种类不变 B.该反应可降低舱内二氧化碳的浓度
C.该反应前后原子的数目发生改变 D.该反应中甲、乙的分子个数比为1:1
8.2022年中国的航天事业重要的一年,6月5日神舟十四号载人飞船成功发射,7月27日“力箭一号”首飞成功、9月中国天间一号研制团队获2022年度世界航天奖,10月9日太阳探测卫星“夸父一号”成功发射,发射火箭所用的燃料液态偏二甲肼(C2H8N2)与N2O4发生的反应可写作:,则n等于 ( )
A.2 B.3 C.4 D.5
9.丙烷(分子式C3H8)燃烧的化学方程式为:C3H8+5O2 xCO2+yH2O,其中x、y分别为 ( )
A.3、4 B.3、8 C.1、3 D.1、5
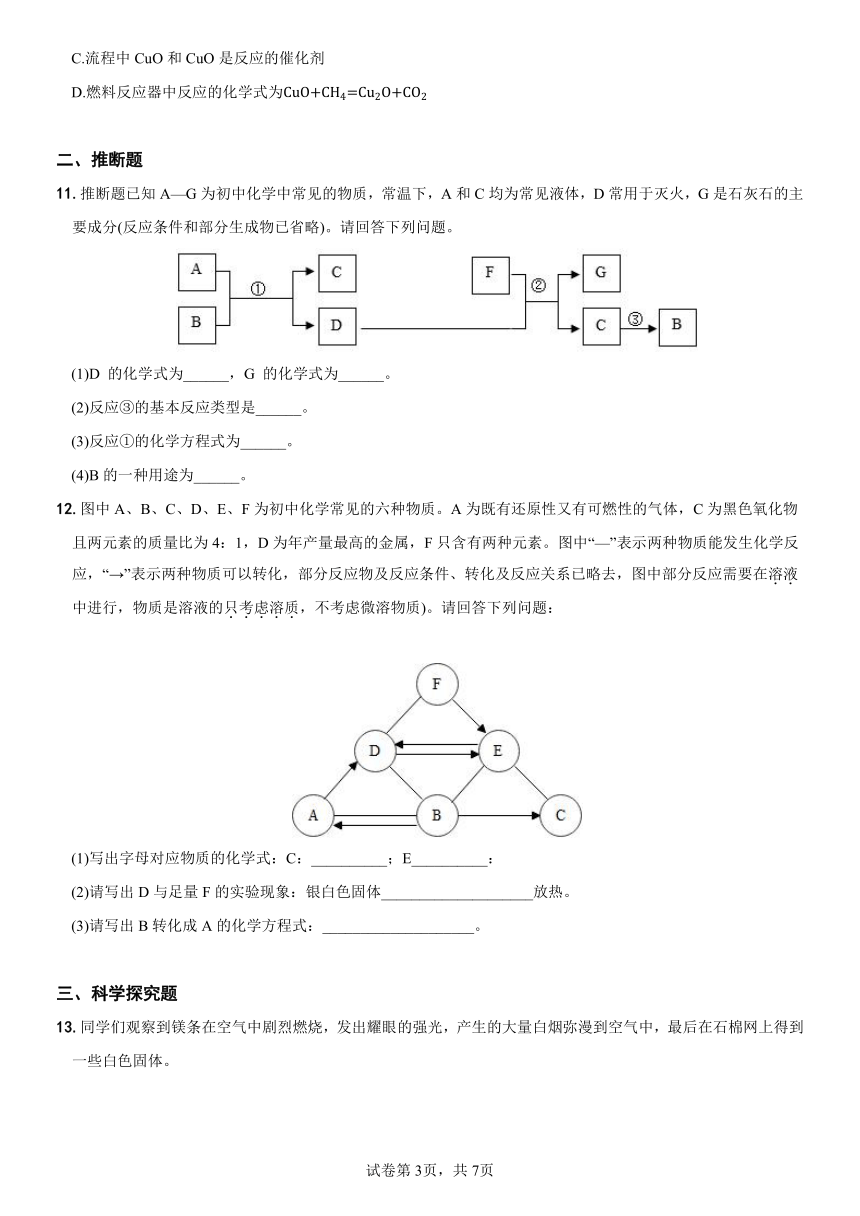
10.一种以甲烷为燃料、含铜氧化物为载氧体的化学链燃烧反应原理如下(流程中各反应物、生成物均已标出)。下列说法正确的是 ( )
A.空气反应器中参与反应的物质有O2、CO2和Cu2O
B.流程中不需要另外添加CuO和Cu2O
C.流程中CuO和CuO是反应的催化剂
D.燃料反应器中反应的化学式为
二、推断题
11.推断题已知A—G为初中化学中常见的物质,常温下,A和C均为常见液体,D常用于灭火,G是石灰石的主要成分(反应条件和部分生成物已省略)。请回答下列问题。
(1)D 的化学式为______,G 的化学式为______。
(2)反应③的基本反应类型是______。
(3)反应①的化学方程式为______。
(4)B的一种用途为______。
12.图中A、B、C、D、E、F为初中化学常见的六种物质。A为既有还原性又有可燃性的气体,C为黑色氧化物且两元素的质量比为4:1,D为年产量最高的金属,F只含有两种元素。图中“—”表示两种物质能发生化学反应,“→”表示两种物质可以转化,部分反应物及反应条件、转化及反应关系已略去,图中部分反应需要在溶液中进行,物质是溶液的只考虑溶质,不考虑微溶物质)。请回答下列问题:
(1)写出字母对应物质的化学式:C:__________;E__________:
(2)请写出D与足量F的实验现象:银白色固体____________________放热。
(3)请写出B转化成A的化学方程式:____________________。
三、科学探究题
13.同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
(1)同学们通过称量发现:在陶土网上收集到产物的质量小于镁条的质量,你认为这个反应_______(填“遵守”或“不遵守”)质量守恒定律。
(2)小红按图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气剧烈反应产生黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2。
【实验探究】
实验操作 实验现象 实验结论
取少量黄色固体于试管中,加入适量水,把湿润的红色石蕊试纸放在试管口 _______ 黄色固体是Mg3N2
【反思与交流】写出氮气和镁反应的化学方程式:_______
(3)载人航天器中处理CO2的一种方法是将CO2与氢气反应,反应前后分子种类变化的微观示意图如下:
写出该反应的化学方程式_______。
(4)若用镁代替红磷测空气中氧气的含量,实验所测得氧气的体积分数____1/5(填:“大于”“等于”“小于”)
将7.2g镁放在足量气体中(只有氮气和氧气)中燃烧,充分反应后,生成物的取值范围是_____。
14.白糖是生活中常见的物质,其主要成分为蔗糖,蔗糖是我们经常接触的一种食品。某兴趣小组对“蔗糖的组成”进行探究。
【提出问题】蔗糖中含有哪些元素?
【进行猜想】生活中,我们偶尔会看见蔗糖因为在锅里加热时间过长而变黑,因此猜想蔗糖中含有碳元素,或许还有具他元素。
【查阅资料】
(1)有机化合物都含有碳元素。蔗糖的化学式为C12H22O11,属于有机化合物。有机化合物一般可以燃烧,受热容易分解,这些都属于有机化合物的_________性质(填“物理”或“化学”)。
【设计实验】我们设计了以下两个实验方案来验证蔗糖的元素组成:
方案一:将蔗糖在空气中点燃,分别用干燥的玻璃片和有澄清石灰水的玻璃片置于火焰上方,观察现象。
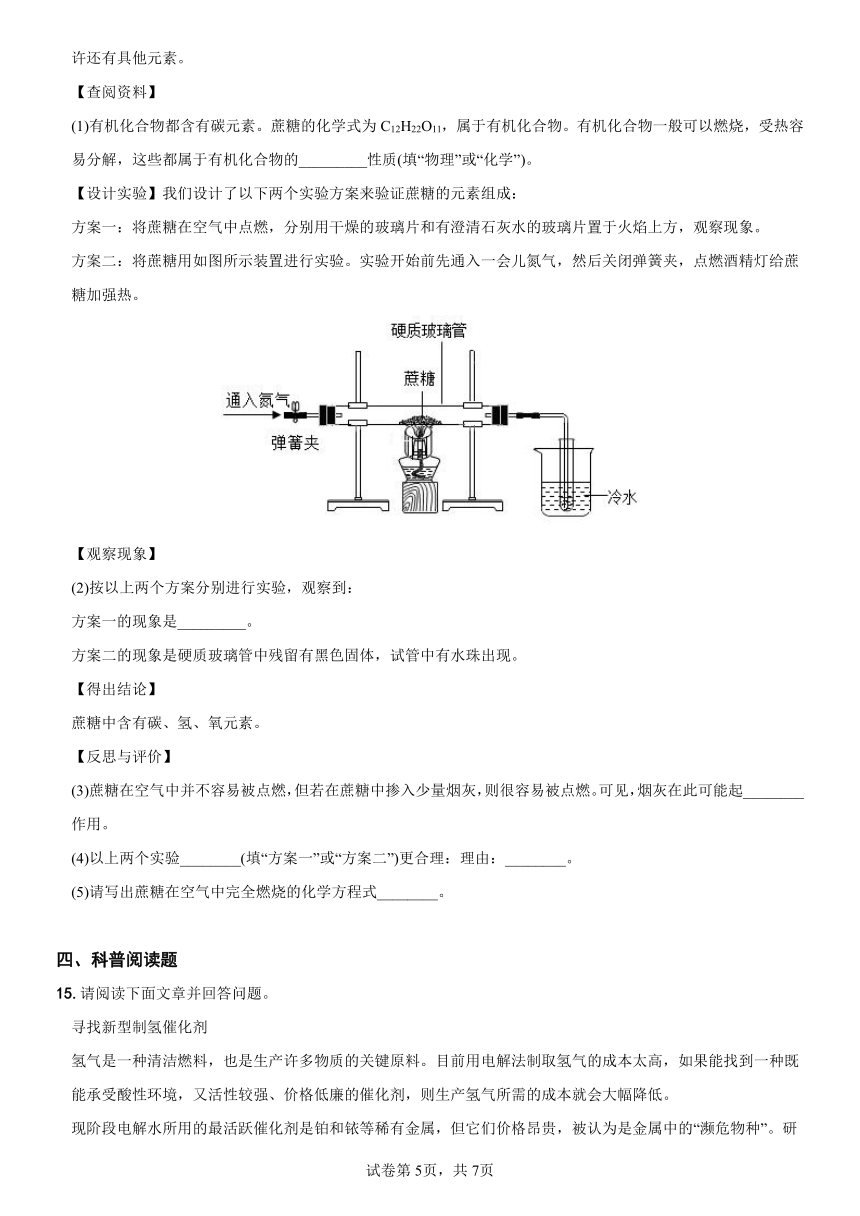
方案二:将蔗糖用如图所示装置进行实验。实验开始前先通入一会儿氮气,然后关闭弹簧夹,点燃酒精灯给蔗糖加强热。
【观察现象】
(2)按以上两个方案分别进行实验,观察到:
方案一的现象是_________。
方案二的现象是硬质玻璃管中残留有黑色固体,试管中有水珠出现。
【得出结论】
蔗糖中含有碳、氢、氧元素。
【反思与评价】
(3)蔗糖在空气中并不容易被点燃,但若在蔗糖中掺入少量烟灰,则很容易被点燃。可见,烟灰在此可能起________作用。
(4)以上两个实验________(填“方案一”或“方案二”)更合理:理由:________。
(5)请写出蔗糖在空气中完全燃烧的化学方程式________。
四、科普阅读题
15.请阅读下面文章并回答问题。
寻找新型制氢催化剂
氢气是一种清洁燃料,也是生产许多物质的关键原料。目前用电解法制取氢气的成本太高,如果能找到一种既能承受酸性环境,又活性较强、价格低廉的催化剂,则生产氢气所需的成本就会大幅降低。
现阶段电解水所用的最活跃催化剂是铂和铱等稀有金属,但它们价格昂贵,被认为是金属中的“濒危物种”。研究人员研究了钴和锰的混合氧化物。氧化钴虽然具有活性,但在酸性环境中很快被腐蚀。锰的氧化物比较稳定,但活性不够。研究人员尝试将它们结合起来,利用它们的特性互补,但这种混合氧化物在大规模生产氢气时,需要将电流升高10~100倍。目前人们发现了一种活性较强,且性质比较稳定的新型催化剂-Co2MnO4,其活化水平接近于最先进的氧化铱。此外,它对电流的要求也大大降低。相信在不久的将来,氢气将会以很低的成本走入人们的日常生活。
阅读短文,回答以下问题。
(1)目前氢气作为燃料还没有被广泛使用的原因是__________。
(2)短文里制取氢气的环境中含有哪种离子______;人们正在研究的制氢催化剂应具备什么优点__________。
(3)现阶段大规模生产氢气为什么不用钴和锰的混合氧化物作为催化剂__________。
(4)在新型催化剂的作用下,生产氢气的化学方程式________;此反应前后催化剂的质量有变化吗__________。
16.阅读下面科普短文。
神奇的氮气
氮气(N2)是空气中含量丰富的一种组分,N2是一种宝贵的自然资源。
N2与食品行业。N2作为保护气,广泛应用于食品行业。在大型粮仓(如图)内充入N2,既能使仓内噬食粮食的小动物窒息死亡,又能抑制粮食本身的呼吸作用,延长其保存期。在一定程度上,还具有防止火灾的作用。N2与农业生产。氮元素是植物生长所需的营养元素之一、民间俗语“雷雨发庄稼”,是指在雷电环境下空气中的N2能转变为含氮的化学肥料,其主要过程示意图如图:
N2与光伏新材料。高纯N2被离子化后,通过氮离子束溅射技术,以高纯石墨为靶材可以沉积出光伏材料氮化碳薄膜,氮化碳薄膜中碳、氮元素的质量分数与氮离子束能量的关系如图所示。
N2与合成氨工业。氮气是一种重要的工业原料,用氮气和氢气合成氨(NH3)是人类科学技术上的一项重大突破,合成氨工艺的流程如图。
N2与环境治理。化石燃料中通常含有氮元素,直接燃烧会产生大量氮氧化合物。氮氧化合物不仅能形成酸雨从而严重危害人体健康和生态环境,而且能与碳氢化合物在一定条件下反应生成有毒的光化学烟雾。利用N2合成氨可有效吸收氮氧化合物,从而实现无污染排放。随着科技的进步,N2的用途将更加广泛。
依据文章内容回答下列问题。
(1)N2应用于食品行业作保护气,体现了N2的性质为_______。
(2)雷电环境下N2转变为化学肥料的过程中,涉及到的氧化物有H2O和_______。
(3)氮化碳薄膜中氮元素质量分数与氮离子束能量的关系为_______。
(4)合成氨生产中,合成塔中的反应在高温、高压、催化剂条件下进行,反应的化学方程式是_______。
(5)下列说法正确的是 (填序号)。
A.N2是空气中含量最多的气体 B.大型粮仓内也可以充入O2作保护气
C.N2可用于制备光伏材料氮化碳薄膜 D.氮氧化合物转变为光化学烟雾的过程属于物理变化
试卷第6页,共7页
试卷第7页,共7页
【参考答案及解析】
1.C
【分析】由图可知,A为CO2、乙为H2、丙为CH3OH、丁为H2O,反应的化学方程式为。
【详解】A、化学反应的实质为分子分成原子,原子重新组合成新的分子,即反应前后原子种类没有改变,分子种类发生改变,该选项说法不正确;
B、反应前氢气中氢元素的化合价为0价,反应后氢元素的化合价为+1价,则反应前后氢元素的化合价发生改变,该选项说法不正确;
C、氧化物中含有两种元素,且一种元素属于氧元素,该反应中属于氧化物的为CO2和H2O,该选项说法正确;
D、由化学式可知,参加反应的甲和乙的个数比为1:3,该选项说法不正确。
故选C。
2.C
【分析】为氯原子,为氧原子,为氢原子。根据微观示意图,可知甲为:二氧化氯(ClO2);乙为:次氯酸(HClO);丙为:氯化氢(HCl);丁为:氧气(O2)。
【详解】A、甲为二氧化氯(ClO2),应在干燥环境中,避光、密封保存。故对。
B、乙为次氯酸(HClO),次氯酸光照分解生成氯化氢和氧气,一种物质反应生成两种物质,属于分解反应。故对。
C、转化②为次氯酸光照分解生成氯化氢和氧气,其化学方程式为:,生成丙、丁两物质的分子数之比为2:1。故错。
D、转化①中二氧化氯中氯元素为+4价,生成物次氯酸中的氯为+1价;②过程次氯酸中的氧为-2价,生成物氧气为0价,故均有元素化合价变化。故对。
故选C。
3.D
【详解】A. CO2是气体,反应物中无气体, CO2化学式后需标气体符号,正确的化学方程式为:,故A错误;
B.该反应的反应物中有气体,SO2化学式后不标气体符号,正确的化学方程式为:,故B错误;
C.该方程式缺条件,正确的化学方程式为:,故C错误;
D.氢气和氧化铜在加热的条件下生成水和铜,该方程式正确,故D正确。
故选:D。
4.B
【详解】根据质量守恒定律,反应前后原子的种类、数目不变,反应前Sb、H、O的原子个数分别为2、4、7,反应后Sb、H、O的原子个数分别为0、4、2,X中含有2个Sb原子和5个氧原子,X的化学式为Sb2O5;故选B。
5.B
【详解】根据质量守恒定律可知,反应前后原子的种类和个数不变,由该反应的化学方程式,反应前,N、Ca、C、7H、5O;反应后,N、Ca、C、3H、3O,可得2X中含有4H、2O,则X的化学式为H2O。故选B。
6.B
【详解】A、碳在氧气中点燃生成二氧化碳,该化学方程式书写完全正确,故A正确;
B、该化学方程式没有配平,正确的化学方程式应为,故B不正确;
C、甲烷和氧气在点燃条件下生成水和二氧化碳,该化学方程式书写完全正确,故C正确;
D、二氧化碳和氢氧化钙反应生成碳酸钙和水,该化学方程式书写完全正确,故D正确。
故选B。
7.B
【详解】A.化学变化是有新物质生成的变化,该反应实质是分子分解为原子,原子重新组合成新物质的分子,所以该反应前后分子的种类一定发生改变,故A错误;
B.由微观反应示图可知,该反应是二氧化碳和氢气在一定条件下生成甲烷和水,消耗了二氧化碳,所以该反应可降低舱内二氧化碳的浓度,故B正确;
C.根据质量守恒定律,在化学变化中,反应前后原子种类和数目不变、原子质量不变,故C错误;
D.由微观反应示意图可知,反应物甲是CO2,乙是H2,生成物丙是CH4,丁是H2O,该反应的化学方程式为:,所以该反应中甲、乙的分子个数比为1:4,故D错误。
故选:B。
8.C
【详解】根据质量守恒定律可知,化学反应前后原子种类和数目保持不变。根据化学方程式可知,反应前的原子为C、H、N、O,数目分别为2、8、6、8;反应后的原子为C、H、N、O,数目分别为2、2n、6、n+4,所以有2n=8(或n+4=8),解得n=4,即水的化学计量数为4。故选C。
9.A
【详解】根据质量守恒定律,化学反应前后原子的种类和数量不变,反应前有3个碳原子、8个氢原子、10个氧原子,反应后有x个碳原子、2y个氢原子、2x+y个氧原子,则有x=3,2y=8,2x+y=10,故x=3,y=4;故选A。
10.B
【详解】A、根据质量守恒定律和流程图可知,空气反应器中生成物不含碳元素,所以参与反应的物质中没有CO2,该选项错误;
B、根据质量守恒定律和流程图可知,CuO和Cu2O可循环应用,不需要添加,该选项正确;
C、由流程图可知,CuO是空气反应器中的生成物以及燃料反应器中的反应物,Cu2O是燃料反应器中的生成物以及空气反应器中的反应物,不是催化剂,该选项错误;
D、由流程图可知,燃料反应器中氧化铜和甲烷反应,生成氧化亚铜、二氧化碳和水,其化学方程式为:,该选项错误。
故选B。
11.(1) CO2 CaCO3
(2)分解反应
(3)
(4)炼钢
【分析】已知A—G为初中化学中常见的物质,常温下,A和C均为常见液体,D常用于灭火,则D为二氧化碳,G是石灰石的主要成分,则G为碳酸钙,氢氧化钙和二氧化碳反应可以生成碳酸钙和水,则F应为氢氧化钙,C为水,A为常见液体,和B反应生成水和二氧化碳,则A应为乙醇,B应为氧气;
【详解】(1)分析可得:D为二氧化碳,化学式为CO2;G为碳酸钙,化学式为CaCO3;
(2)水在通电条件下反应生成水和二氧化碳,该反应符合“一变多”的特征,故反应③的基本反应类型是分解反应;
(3)乙醇和氧气在点燃条件下反应生成二氧化碳和水,反应的化学方程式为:;
(4)氧气具有支持燃烧的性质,可用于炼钢。
12.(1) CuO H2
(2)固体逐渐减少至消失,固体表面产生气泡,溶液由无色变为浅绿色
(3)
【解析】(1)
A为既有还原性又有可燃性的气体,故A为H2或CO;C为黑色氧化物且两元素的质量比为4:1,故C为CuO;为了B能与A、C都可以反应,故B为O2;D为年产量最高的金属,故D为Fe;E、F、D三者能相互转化,联想金属的性质,同时联系能与CuO反应的物质,如酸,故E为还原性气体氢气H2,F为酸类物质,如HCl,故A只能为CO;
故C为CuO;E为H2;
(2)由上述分析可知D为Fe,F为酸类物质如HCl,故现象:银白色固体固体逐渐减少至消失,固体表面产生气泡,溶液由无色变为浅绿色;
(3)由上述分析可知B为O2,A为CO,故转化的化学方程式为。
13. 遵守 产生气泡、湿润的红色石蕊试纸变蓝色
大于 10g~12g
【详解】(1)镁在空气中燃烧生成氧化镁,有新物质生成,属于化学变化,遵守质量守恒定律,在陶土网上收集到产物的质量小于镁条的质量,是因为产生的白烟部分散逸到了空气中;
(2)实验探究:结论为黄色固体是氮化镁,氮化镁可与水反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝,故取少量黄色固体于试管中,加入适量水,把湿润的红色石蕊试纸放在试管口,现象为:产生气泡、湿润的红色石蕊试纸变蓝色;
反思与交流:镁和氮气在点燃的条件下反应生成氮化镁,该反应的化学方程式为:;
(3)由图可知,该反应为二氧化碳和氢气在一定条件下反应生成甲烷和水,该反应的化学方程式为:;
(4)若用镁代替红磷测空气中氧气的含量,镁即消耗氧气,也会消耗氮气,则装置内减少的气体的体积大于空气体积的,所以实验所测得氧气的体积分数大于;
若镁只有氧气反应,设生成的氧化镁的质量为x
x=12g
若镁只和氮气反应,设生成的氮化镁的质量为y
y=10g
所以生成物的取值范围是10g~12g。
14.(1)化学
(2)干燥的玻璃片上有水珠,澄清的石灰水变浑浊;
(3)催化
(4) 方案二 方案一只能推断出蔗糖中含有碳氢元素,不能确定其是否含有氧元素
(5)
【详解】(1)能燃烧和受热易分解都需要化学变化来体现,都属于化学性质,故填:化学;
(2)实验结论为蔗糖含有碳氢氧三种元素,蔗糖燃烧会产生二氧化碳和水,水蒸气遇冷变为液态水珠,二氧化碳可使澄清的石灰水变浑浊,则方案一的现象是干燥的玻璃片上有水珠,澄清的石灰水变浑浊,故填:干燥的玻璃片上有水珠,澄清的石灰水变浑浊;
(3)烟灰不可燃,蔗糖的着火点也不能改变,则烟灰可能是对蔗糖燃烧有催化作用,加快反应速率,故填:催化;
(4)方案一中蔗糖在空气中与氧气在点燃的条件下产生二氧化碳和水,根据质量守恒定律,化学反应前后元素的种类不变,可推断出蔗糖中含有碳氢元素,不能确定其是否含有氧元素;方案二中玻璃管中黑色固体为炭黑,试管中有水珠,蔗糖加热可分解成炭和水,可催断出其肯定含有碳氢氧三种元素,故填:方案二;方案一只能推断出蔗糖中含有碳氢元素,不能确定其是否含有氧元素;
(5)蔗糖和氧气在点燃的条件下产生二氧化碳和水,化学方程式为,故填:。
15.(1)用电解法制取氢气的成本太高
(2) 活性较强,且性质比较稳定
(3)混合氧化物在大规模生产氢气时,需要将电流升高10~100倍
(4) 不变
【解析】(1)根据短文内容,氢气作为燃料还没有被广泛使用的原因是:用电解法制取氢气的成本太高;
(2)根据短文内容,氧化钴虽然具有活性,但在酸性环境中很快被腐蚀,则制取氢气的环境中含有的离子是:;制氢催化剂应具备:活性较强,且性质比较稳定;
(3)根据短文内容,混合氧化物在大规模生产氢气时,需要将电流升高10~100倍,故现阶段大规模生产氢气不用钴和锰的混合氧化物作为催化剂;
(4)在新型催化剂的作用下,生产氢气的化学方程式是:;催化剂在化学反应前后质量和化学性质不变,故填:不变。
16.(1)化学性质稳定
(2)NO、NO2
(3)在720-911ev范围内,氮离子束能量越大,氮化碳薄膜中氮元素质量分数越小
(4)
(5)AC
【详解】(1)N2应用于食品行业作保护气,体现了N2的化学性质稳定。
(2)由图可知雷电环境下N2转变为化学肥料的过程中为:N2和O2转变为NO,NO和O2转变为NO2,NO2和H2O转变为HNO3,涉及到的氧化物有H2O、NO和NO2。
(3)由图示可知,氮化碳薄膜中氮元素质量分数与氮离子束能量的关系为在720-911ev范围内,氮离子束能量越大,氮化碳薄膜中氮元素质量分数越小。
(4)合成塔中发生的反应为氮气和氢气在高温、高压、催化剂条件下生成氨气,反应的化学方程式为:
(5)A、N2体积分数约占空气78%,是空气中含量最多的气体,说法正确;
B、氧气具有氧化性,大型粮仓内不能充入O2作保护气,说法错误;
C、高纯N2被离子化后,通过氮离子束溅射技术,以高纯石墨为靶材可以沉积出光伏材料氮化碳薄膜,因此N2可用于制备光伏材料氮化碳薄膜,说法正确;
D、氮氧化合物转变为光化学烟雾的过程中有新物质生成,属于化学变化,说法错误。
故填:AC。
课题2 如何正确书写化学方程式
一、单选题
1.在催化剂作用下,二氧化碳与氢气能高效转化为甲醇(CH3OH),下列说法正确的是 ( )
A.反应前后原子、分子种类没有发生改变
B.反应前后氢元素的化合价未改变
C.该反应的四种物质中有两种氧化物
D.参加反应的甲和乙的个数比为1:1
2.可灭杀新型冠状病毒的甲、乙物质有如图转化。下列说法错误的是 ( )
A.甲物质应在干燥环境中,避光、密封保存
B.转化②是分解反应
C.转化②生成丙、丁两物质的分子数之比为1:1
D.转化①②过程中均有元素化合价变化
3.下列化学方程式书写正确的是 ( )
A.H2CO3=H2O + CO2
B.S+O2SO2↑
C.3Fe+2O2= Fe3O4
D.H2+CuO H2O+Cu
4.物质X是一种重要的阻燃剂。用三氧化二锑(Sb2O3)生产X的化学方程式为Sb2O3 + 2H2O2=X + 2H2O。X的化学式为 ( )
A.SbO2 B.Sb2O5 C.HSbO3 D.H3SbO4
5.碳铵(化学式为NH4HCO3)是一种固态氮肥,与熟石灰发生的反应为,则X的化学式为
A.H2O2 B.H2O C.CO2 D.H2
6.下列化学方程式书写不正确的是 ( )
A.C+O2CO2 B.2P+5O2P2O5
C.CH4+2O22H2O+CO2 D.CO2+Ca(OH)2=CaCO3↓+H2O
7.中国空间站中航天员所需的部分水是由呼吸产生的二氧化碳通过化学反应生成的(微观反应示意图如下图所示)。下列说法正确的是 ( )
A.该反应前后分子的种类不变 B.该反应可降低舱内二氧化碳的浓度
C.该反应前后原子的数目发生改变 D.该反应中甲、乙的分子个数比为1:1
8.2022年中国的航天事业重要的一年,6月5日神舟十四号载人飞船成功发射,7月27日“力箭一号”首飞成功、9月中国天间一号研制团队获2022年度世界航天奖,10月9日太阳探测卫星“夸父一号”成功发射,发射火箭所用的燃料液态偏二甲肼(C2H8N2)与N2O4发生的反应可写作:,则n等于 ( )
A.2 B.3 C.4 D.5
9.丙烷(分子式C3H8)燃烧的化学方程式为:C3H8+5O2 xCO2+yH2O,其中x、y分别为 ( )
A.3、4 B.3、8 C.1、3 D.1、5
10.一种以甲烷为燃料、含铜氧化物为载氧体的化学链燃烧反应原理如下(流程中各反应物、生成物均已标出)。下列说法正确的是 ( )
A.空气反应器中参与反应的物质有O2、CO2和Cu2O
B.流程中不需要另外添加CuO和Cu2O
C.流程中CuO和CuO是反应的催化剂
D.燃料反应器中反应的化学式为
二、推断题
11.推断题已知A—G为初中化学中常见的物质,常温下,A和C均为常见液体,D常用于灭火,G是石灰石的主要成分(反应条件和部分生成物已省略)。请回答下列问题。
(1)D 的化学式为______,G 的化学式为______。
(2)反应③的基本反应类型是______。
(3)反应①的化学方程式为______。
(4)B的一种用途为______。
12.图中A、B、C、D、E、F为初中化学常见的六种物质。A为既有还原性又有可燃性的气体,C为黑色氧化物且两元素的质量比为4:1,D为年产量最高的金属,F只含有两种元素。图中“—”表示两种物质能发生化学反应,“→”表示两种物质可以转化,部分反应物及反应条件、转化及反应关系已略去,图中部分反应需要在溶液中进行,物质是溶液的只考虑溶质,不考虑微溶物质)。请回答下列问题:
(1)写出字母对应物质的化学式:C:__________;E__________:
(2)请写出D与足量F的实验现象:银白色固体____________________放热。
(3)请写出B转化成A的化学方程式:____________________。
三、科学探究题
13.同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
(1)同学们通过称量发现:在陶土网上收集到产物的质量小于镁条的质量,你认为这个反应_______(填“遵守”或“不遵守”)质量守恒定律。
(2)小红按图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气剧烈反应产生黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2。
【实验探究】
实验操作 实验现象 实验结论
取少量黄色固体于试管中,加入适量水,把湿润的红色石蕊试纸放在试管口 _______ 黄色固体是Mg3N2
【反思与交流】写出氮气和镁反应的化学方程式:_______
(3)载人航天器中处理CO2的一种方法是将CO2与氢气反应,反应前后分子种类变化的微观示意图如下:
写出该反应的化学方程式_______。
(4)若用镁代替红磷测空气中氧气的含量,实验所测得氧气的体积分数____1/5(填:“大于”“等于”“小于”)
将7.2g镁放在足量气体中(只有氮气和氧气)中燃烧,充分反应后,生成物的取值范围是_____。
14.白糖是生活中常见的物质,其主要成分为蔗糖,蔗糖是我们经常接触的一种食品。某兴趣小组对“蔗糖的组成”进行探究。
【提出问题】蔗糖中含有哪些元素?
【进行猜想】生活中,我们偶尔会看见蔗糖因为在锅里加热时间过长而变黑,因此猜想蔗糖中含有碳元素,或许还有具他元素。
【查阅资料】
(1)有机化合物都含有碳元素。蔗糖的化学式为C12H22O11,属于有机化合物。有机化合物一般可以燃烧,受热容易分解,这些都属于有机化合物的_________性质(填“物理”或“化学”)。
【设计实验】我们设计了以下两个实验方案来验证蔗糖的元素组成:
方案一:将蔗糖在空气中点燃,分别用干燥的玻璃片和有澄清石灰水的玻璃片置于火焰上方,观察现象。
方案二:将蔗糖用如图所示装置进行实验。实验开始前先通入一会儿氮气,然后关闭弹簧夹,点燃酒精灯给蔗糖加强热。
【观察现象】
(2)按以上两个方案分别进行实验,观察到:
方案一的现象是_________。
方案二的现象是硬质玻璃管中残留有黑色固体,试管中有水珠出现。
【得出结论】
蔗糖中含有碳、氢、氧元素。
【反思与评价】
(3)蔗糖在空气中并不容易被点燃,但若在蔗糖中掺入少量烟灰,则很容易被点燃。可见,烟灰在此可能起________作用。
(4)以上两个实验________(填“方案一”或“方案二”)更合理:理由:________。
(5)请写出蔗糖在空气中完全燃烧的化学方程式________。
四、科普阅读题
15.请阅读下面文章并回答问题。
寻找新型制氢催化剂
氢气是一种清洁燃料,也是生产许多物质的关键原料。目前用电解法制取氢气的成本太高,如果能找到一种既能承受酸性环境,又活性较强、价格低廉的催化剂,则生产氢气所需的成本就会大幅降低。
现阶段电解水所用的最活跃催化剂是铂和铱等稀有金属,但它们价格昂贵,被认为是金属中的“濒危物种”。研究人员研究了钴和锰的混合氧化物。氧化钴虽然具有活性,但在酸性环境中很快被腐蚀。锰的氧化物比较稳定,但活性不够。研究人员尝试将它们结合起来,利用它们的特性互补,但这种混合氧化物在大规模生产氢气时,需要将电流升高10~100倍。目前人们发现了一种活性较强,且性质比较稳定的新型催化剂-Co2MnO4,其活化水平接近于最先进的氧化铱。此外,它对电流的要求也大大降低。相信在不久的将来,氢气将会以很低的成本走入人们的日常生活。
阅读短文,回答以下问题。
(1)目前氢气作为燃料还没有被广泛使用的原因是__________。
(2)短文里制取氢气的环境中含有哪种离子______;人们正在研究的制氢催化剂应具备什么优点__________。
(3)现阶段大规模生产氢气为什么不用钴和锰的混合氧化物作为催化剂__________。
(4)在新型催化剂的作用下,生产氢气的化学方程式________;此反应前后催化剂的质量有变化吗__________。
16.阅读下面科普短文。
神奇的氮气
氮气(N2)是空气中含量丰富的一种组分,N2是一种宝贵的自然资源。
N2与食品行业。N2作为保护气,广泛应用于食品行业。在大型粮仓(如图)内充入N2,既能使仓内噬食粮食的小动物窒息死亡,又能抑制粮食本身的呼吸作用,延长其保存期。在一定程度上,还具有防止火灾的作用。N2与农业生产。氮元素是植物生长所需的营养元素之一、民间俗语“雷雨发庄稼”,是指在雷电环境下空气中的N2能转变为含氮的化学肥料,其主要过程示意图如图:
N2与光伏新材料。高纯N2被离子化后,通过氮离子束溅射技术,以高纯石墨为靶材可以沉积出光伏材料氮化碳薄膜,氮化碳薄膜中碳、氮元素的质量分数与氮离子束能量的关系如图所示。
N2与合成氨工业。氮气是一种重要的工业原料,用氮气和氢气合成氨(NH3)是人类科学技术上的一项重大突破,合成氨工艺的流程如图。
N2与环境治理。化石燃料中通常含有氮元素,直接燃烧会产生大量氮氧化合物。氮氧化合物不仅能形成酸雨从而严重危害人体健康和生态环境,而且能与碳氢化合物在一定条件下反应生成有毒的光化学烟雾。利用N2合成氨可有效吸收氮氧化合物,从而实现无污染排放。随着科技的进步,N2的用途将更加广泛。
依据文章内容回答下列问题。
(1)N2应用于食品行业作保护气,体现了N2的性质为_______。
(2)雷电环境下N2转变为化学肥料的过程中,涉及到的氧化物有H2O和_______。
(3)氮化碳薄膜中氮元素质量分数与氮离子束能量的关系为_______。
(4)合成氨生产中,合成塔中的反应在高温、高压、催化剂条件下进行,反应的化学方程式是_______。
(5)下列说法正确的是 (填序号)。
A.N2是空气中含量最多的气体 B.大型粮仓内也可以充入O2作保护气
C.N2可用于制备光伏材料氮化碳薄膜 D.氮氧化合物转变为光化学烟雾的过程属于物理变化
试卷第6页,共7页
试卷第7页,共7页
【参考答案及解析】
1.C
【分析】由图可知,A为CO2、乙为H2、丙为CH3OH、丁为H2O,反应的化学方程式为。
【详解】A、化学反应的实质为分子分成原子,原子重新组合成新的分子,即反应前后原子种类没有改变,分子种类发生改变,该选项说法不正确;
B、反应前氢气中氢元素的化合价为0价,反应后氢元素的化合价为+1价,则反应前后氢元素的化合价发生改变,该选项说法不正确;
C、氧化物中含有两种元素,且一种元素属于氧元素,该反应中属于氧化物的为CO2和H2O,该选项说法正确;
D、由化学式可知,参加反应的甲和乙的个数比为1:3,该选项说法不正确。
故选C。
2.C
【分析】为氯原子,为氧原子,为氢原子。根据微观示意图,可知甲为:二氧化氯(ClO2);乙为:次氯酸(HClO);丙为:氯化氢(HCl);丁为:氧气(O2)。
【详解】A、甲为二氧化氯(ClO2),应在干燥环境中,避光、密封保存。故对。
B、乙为次氯酸(HClO),次氯酸光照分解生成氯化氢和氧气,一种物质反应生成两种物质,属于分解反应。故对。
C、转化②为次氯酸光照分解生成氯化氢和氧气,其化学方程式为:,生成丙、丁两物质的分子数之比为2:1。故错。
D、转化①中二氧化氯中氯元素为+4价,生成物次氯酸中的氯为+1价;②过程次氯酸中的氧为-2价,生成物氧气为0价,故均有元素化合价变化。故对。
故选C。
3.D
【详解】A. CO2是气体,反应物中无气体, CO2化学式后需标气体符号,正确的化学方程式为:,故A错误;
B.该反应的反应物中有气体,SO2化学式后不标气体符号,正确的化学方程式为:,故B错误;
C.该方程式缺条件,正确的化学方程式为:,故C错误;
D.氢气和氧化铜在加热的条件下生成水和铜,该方程式正确,故D正确。
故选:D。
4.B
【详解】根据质量守恒定律,反应前后原子的种类、数目不变,反应前Sb、H、O的原子个数分别为2、4、7,反应后Sb、H、O的原子个数分别为0、4、2,X中含有2个Sb原子和5个氧原子,X的化学式为Sb2O5;故选B。
5.B
【详解】根据质量守恒定律可知,反应前后原子的种类和个数不变,由该反应的化学方程式,反应前,N、Ca、C、7H、5O;反应后,N、Ca、C、3H、3O,可得2X中含有4H、2O,则X的化学式为H2O。故选B。
6.B
【详解】A、碳在氧气中点燃生成二氧化碳,该化学方程式书写完全正确,故A正确;
B、该化学方程式没有配平,正确的化学方程式应为,故B不正确;
C、甲烷和氧气在点燃条件下生成水和二氧化碳,该化学方程式书写完全正确,故C正确;
D、二氧化碳和氢氧化钙反应生成碳酸钙和水,该化学方程式书写完全正确,故D正确。
故选B。
7.B
【详解】A.化学变化是有新物质生成的变化,该反应实质是分子分解为原子,原子重新组合成新物质的分子,所以该反应前后分子的种类一定发生改变,故A错误;
B.由微观反应示图可知,该反应是二氧化碳和氢气在一定条件下生成甲烷和水,消耗了二氧化碳,所以该反应可降低舱内二氧化碳的浓度,故B正确;
C.根据质量守恒定律,在化学变化中,反应前后原子种类和数目不变、原子质量不变,故C错误;
D.由微观反应示意图可知,反应物甲是CO2,乙是H2,生成物丙是CH4,丁是H2O,该反应的化学方程式为:,所以该反应中甲、乙的分子个数比为1:4,故D错误。
故选:B。
8.C
【详解】根据质量守恒定律可知,化学反应前后原子种类和数目保持不变。根据化学方程式可知,反应前的原子为C、H、N、O,数目分别为2、8、6、8;反应后的原子为C、H、N、O,数目分别为2、2n、6、n+4,所以有2n=8(或n+4=8),解得n=4,即水的化学计量数为4。故选C。
9.A
【详解】根据质量守恒定律,化学反应前后原子的种类和数量不变,反应前有3个碳原子、8个氢原子、10个氧原子,反应后有x个碳原子、2y个氢原子、2x+y个氧原子,则有x=3,2y=8,2x+y=10,故x=3,y=4;故选A。
10.B
【详解】A、根据质量守恒定律和流程图可知,空气反应器中生成物不含碳元素,所以参与反应的物质中没有CO2,该选项错误;
B、根据质量守恒定律和流程图可知,CuO和Cu2O可循环应用,不需要添加,该选项正确;
C、由流程图可知,CuO是空气反应器中的生成物以及燃料反应器中的反应物,Cu2O是燃料反应器中的生成物以及空气反应器中的反应物,不是催化剂,该选项错误;
D、由流程图可知,燃料反应器中氧化铜和甲烷反应,生成氧化亚铜、二氧化碳和水,其化学方程式为:,该选项错误。
故选B。
11.(1) CO2 CaCO3
(2)分解反应
(3)
(4)炼钢
【分析】已知A—G为初中化学中常见的物质,常温下,A和C均为常见液体,D常用于灭火,则D为二氧化碳,G是石灰石的主要成分,则G为碳酸钙,氢氧化钙和二氧化碳反应可以生成碳酸钙和水,则F应为氢氧化钙,C为水,A为常见液体,和B反应生成水和二氧化碳,则A应为乙醇,B应为氧气;
【详解】(1)分析可得:D为二氧化碳,化学式为CO2;G为碳酸钙,化学式为CaCO3;
(2)水在通电条件下反应生成水和二氧化碳,该反应符合“一变多”的特征,故反应③的基本反应类型是分解反应;
(3)乙醇和氧气在点燃条件下反应生成二氧化碳和水,反应的化学方程式为:;
(4)氧气具有支持燃烧的性质,可用于炼钢。
12.(1) CuO H2
(2)固体逐渐减少至消失,固体表面产生气泡,溶液由无色变为浅绿色
(3)
【解析】(1)
A为既有还原性又有可燃性的气体,故A为H2或CO;C为黑色氧化物且两元素的质量比为4:1,故C为CuO;为了B能与A、C都可以反应,故B为O2;D为年产量最高的金属,故D为Fe;E、F、D三者能相互转化,联想金属的性质,同时联系能与CuO反应的物质,如酸,故E为还原性气体氢气H2,F为酸类物质,如HCl,故A只能为CO;
故C为CuO;E为H2;
(2)由上述分析可知D为Fe,F为酸类物质如HCl,故现象:银白色固体固体逐渐减少至消失,固体表面产生气泡,溶液由无色变为浅绿色;
(3)由上述分析可知B为O2,A为CO,故转化的化学方程式为。
13. 遵守 产生气泡、湿润的红色石蕊试纸变蓝色
大于 10g~12g
【详解】(1)镁在空气中燃烧生成氧化镁,有新物质生成,属于化学变化,遵守质量守恒定律,在陶土网上收集到产物的质量小于镁条的质量,是因为产生的白烟部分散逸到了空气中;
(2)实验探究:结论为黄色固体是氮化镁,氮化镁可与水反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝,故取少量黄色固体于试管中,加入适量水,把湿润的红色石蕊试纸放在试管口,现象为:产生气泡、湿润的红色石蕊试纸变蓝色;
反思与交流:镁和氮气在点燃的条件下反应生成氮化镁,该反应的化学方程式为:;
(3)由图可知,该反应为二氧化碳和氢气在一定条件下反应生成甲烷和水,该反应的化学方程式为:;
(4)若用镁代替红磷测空气中氧气的含量,镁即消耗氧气,也会消耗氮气,则装置内减少的气体的体积大于空气体积的,所以实验所测得氧气的体积分数大于;
若镁只有氧气反应,设生成的氧化镁的质量为x
x=12g
若镁只和氮气反应,设生成的氮化镁的质量为y
y=10g
所以生成物的取值范围是10g~12g。
14.(1)化学
(2)干燥的玻璃片上有水珠,澄清的石灰水变浑浊;
(3)催化
(4) 方案二 方案一只能推断出蔗糖中含有碳氢元素,不能确定其是否含有氧元素
(5)
【详解】(1)能燃烧和受热易分解都需要化学变化来体现,都属于化学性质,故填:化学;
(2)实验结论为蔗糖含有碳氢氧三种元素,蔗糖燃烧会产生二氧化碳和水,水蒸气遇冷变为液态水珠,二氧化碳可使澄清的石灰水变浑浊,则方案一的现象是干燥的玻璃片上有水珠,澄清的石灰水变浑浊,故填:干燥的玻璃片上有水珠,澄清的石灰水变浑浊;
(3)烟灰不可燃,蔗糖的着火点也不能改变,则烟灰可能是对蔗糖燃烧有催化作用,加快反应速率,故填:催化;
(4)方案一中蔗糖在空气中与氧气在点燃的条件下产生二氧化碳和水,根据质量守恒定律,化学反应前后元素的种类不变,可推断出蔗糖中含有碳氢元素,不能确定其是否含有氧元素;方案二中玻璃管中黑色固体为炭黑,试管中有水珠,蔗糖加热可分解成炭和水,可催断出其肯定含有碳氢氧三种元素,故填:方案二;方案一只能推断出蔗糖中含有碳氢元素,不能确定其是否含有氧元素;
(5)蔗糖和氧气在点燃的条件下产生二氧化碳和水,化学方程式为,故填:。
15.(1)用电解法制取氢气的成本太高
(2) 活性较强,且性质比较稳定
(3)混合氧化物在大规模生产氢气时,需要将电流升高10~100倍
(4) 不变
【解析】(1)根据短文内容,氢气作为燃料还没有被广泛使用的原因是:用电解法制取氢气的成本太高;
(2)根据短文内容,氧化钴虽然具有活性,但在酸性环境中很快被腐蚀,则制取氢气的环境中含有的离子是:;制氢催化剂应具备:活性较强,且性质比较稳定;
(3)根据短文内容,混合氧化物在大规模生产氢气时,需要将电流升高10~100倍,故现阶段大规模生产氢气不用钴和锰的混合氧化物作为催化剂;
(4)在新型催化剂的作用下,生产氢气的化学方程式是:;催化剂在化学反应前后质量和化学性质不变,故填:不变。
16.(1)化学性质稳定
(2)NO、NO2
(3)在720-911ev范围内,氮离子束能量越大,氮化碳薄膜中氮元素质量分数越小
(4)
(5)AC
【详解】(1)N2应用于食品行业作保护气,体现了N2的化学性质稳定。
(2)由图可知雷电环境下N2转变为化学肥料的过程中为:N2和O2转变为NO,NO和O2转变为NO2,NO2和H2O转变为HNO3,涉及到的氧化物有H2O、NO和NO2。
(3)由图示可知,氮化碳薄膜中氮元素质量分数与氮离子束能量的关系为在720-911ev范围内,氮离子束能量越大,氮化碳薄膜中氮元素质量分数越小。
(4)合成塔中发生的反应为氮气和氢气在高温、高压、催化剂条件下生成氨气,反应的化学方程式为:
(5)A、N2体积分数约占空气78%,是空气中含量最多的气体,说法正确;
B、氧气具有氧化性,大型粮仓内不能充入O2作保护气,说法错误;
C、高纯N2被离子化后,通过氮离子束溅射技术,以高纯石墨为靶材可以沉积出光伏材料氮化碳薄膜,因此N2可用于制备光伏材料氮化碳薄膜,说法正确;
D、氮氧化合物转变为光化学烟雾的过程中有新物质生成,属于化学变化,说法错误。
故填:AC。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
