2022—2023学年化学人教版九年级下册第九单元 溶液 素质形成题(含答案)
文档属性
| 名称 | 2022—2023学年化学人教版九年级下册第九单元 溶液 素质形成题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 401.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-27 09:58:11 | ||
图片预览




文档简介
2022—2023学年化学人教版九年级下册第九单元 溶液 素质形成题含答案
人教第九单元 溶液
一、选择题。
1、下列关于溶液颜色的判断不正确的是( )
A.氯化亚铁溶液是黄色的 B.高锰酸钾溶液是紫红色的
C.硫酸铜溶液是蓝色的 D.葡萄糖水是无色的
2、把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
3、下列“水”中,属于纯净物的是( )
A.清纯的井水 B.淡化的海水
C.净化的河水 D.实验室配制试剂用的蒸馏水
4、配制溶液时,下列溶剂中最常用的是( )
A.酒精 B.植物油 C.汽油 D.水
5、室温时,有两瓶硝酸钾溶液,已知一瓶为饱和溶液,另一瓶为不饱和溶液,分别取样(如图),则一定无法区分这两种溶液的实验操作是( )
A.加一定量的水 B.加入少量该晶体
C.略降低温度 D.恒温蒸发少量水
6、20 ℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入四个盛有50 g水的烧杯中,充分溶解,其溶解情况如下表。下列说法正确的是( )
物质 甲 乙 丙 丁
未溶解固体的质量/g 4.2 2 0 9.2
A.所得四杯溶液一定都是饱和溶液
B.丁溶液的质量最大
C.20 ℃时四种物质溶解度的关系:丙>乙>甲>丁
D.四杯溶液中溶剂的质量大小:丙溶液>乙溶液>甲溶液>丁溶液
7、下列判断正确的是( )
A.合金至少有两种金属熔合而成
B.不同种元素最本质的区别是质子数不同
C.饱和溶液变为不饱和溶液,其溶质质量分数一定变小
D.两种化合物相互作用生成另外两种化合物的反应一定是复分解反应
8、20℃时,取四份一定质量的饱和硝酸钾溶液分别进行如下实验后,所得结论正确的是( )
A. 保持温度不变,减少10g溶剂后,溶液中溶质的质量分数增大
B. 保持温度不变,加入10g溶质后,溶液中溶质的质量分数增大
C. 保持温度不变,减少10g溶剂后,溶质的溶解度减小
D. 降低至10℃后,溶质的溶解度减小
9、用氯化钠固体和水配制50 g质量分数为6%的氯化钠溶液,下列实验操作正确的是( )
A.用托盘天平称量3.0 g氯化钠
B.用烧杯量取所需的水
C.未等氯化钠固体完全溶解就将溶液转移到试剂瓶中
D.将只写药品名称的标签贴在试剂瓶上
10、下列有关水的认识错误的是( )
A.水是一种常见的溶剂
B.自然界中的水过滤后变成纯水
C.水的蒸馏是物理变化
D.硬水和软水可用肥皂水鉴别
11、如图所示是甲、乙两种物质的溶解度曲线,下列说法不正确的是( )
A.t1℃时,甲、乙两种物质的溶解度相等
B.甲物质的溶解度随温度的升高而增大
C.将t2℃时甲、乙两种物质的饱和溶液降温到t1℃,溶液仍然饱和
D.t1℃时,将50g甲物质加入100g水中,充分搅拌,能得到甲物质的饱和溶液
12、下列实验符合如图所示变化趋势的是( )
序号 实验 横坐标 纵坐标
A 向一定量氢氧化钠溶液中滴加稀硫酸 稀硫酸的质量 水的质量
B 加热一定量高锰酸钾固体 加热时间 剩余固体中氧元素的质量
C 向一定量饱和硝酸钾溶液中加水 加水的质量 溶质的质量分数
D 向一定量锌粒中加入稀盐酸 稀盐酸的质量 锌粒的质量
A.A B.B C.C D.D
13、实验室用氯化钠固体配制50 g 溶质质量分数为10%的氯化钠溶液。下列描述错误的是( )
A.用50 mL的量筒量取45 mL蒸馏水
B.溶解时用到的玻璃仪器有烧杯、玻璃棒
C.实验的主要步骤为计算、称量、量取、溶解、装瓶贴标签
D.配制好的氯化钠溶液装入刚清洗过还未干燥的试剂瓶中保存
14、下列关于常见氧化物的叙述,不正确的是( )
A.H2O是最常用的溶剂,能溶解所有的物质
B.CO极易与血液中的血红蛋白结合,造成生物体内缺氧
C.固态CO2叫做“干冰”,可用于人工降雨
D.磁铁矿的主要成分是Fe3O4,有磁性,可用于炼铁
15、许多化学反应都是在溶液中进行的,关于溶液理解正确的是( )
A.通过加热蒸发的方法提高75%酒精的浓度
B.将氧化钙溶于水,可以形成氧化钙溶液
C. 5gCuSO4 5H2O溶于95g水中配制CuSO4溶液,此溶液溶质的质量分数小于5%
D.将50℃下的饱和KNO3溶液冷却至室温,硝酸钾固体析出,过滤后可得纯水和硝酸钾固体
二、填空题。
16、请举出符合下列要求的溶液。
(1)溶质是固体,溶剂是液体:____________________________________。
(2)溶质是液体,溶剂是液体:____________________________________。
(3)有颜色的溶液:_____________________________________________。
(4)溶质由分子构成的溶液:_____________________________________。
(5)溶质由离子构成的溶液:_____________________________________。
(6)溶剂不是水的溶液:_________________________________________。
17、(1)现有H、O、Na、Mg、P五种元素,请根据下列要求写出由所给元素组成的物质(写化学式):
属于金属氧化物的是________(写出两种即可)
(2)A、B、C三种物质的溶解度曲线如图所示,请回答:
①对于物质A而言,点P的含义为________。
②t3℃时,A、B、C三种饱和溶液中,溶质质量分数由大到小的排列为________。
③若A、B、C三种物质中有一种是易溶于水的气体,则其溶解度曲线是________。
④烧杯中有t2℃时20%的A溶液50 g,要将该溶液变为同温度下的饱和溶液,至少需向烧杯中加入A物质________g。
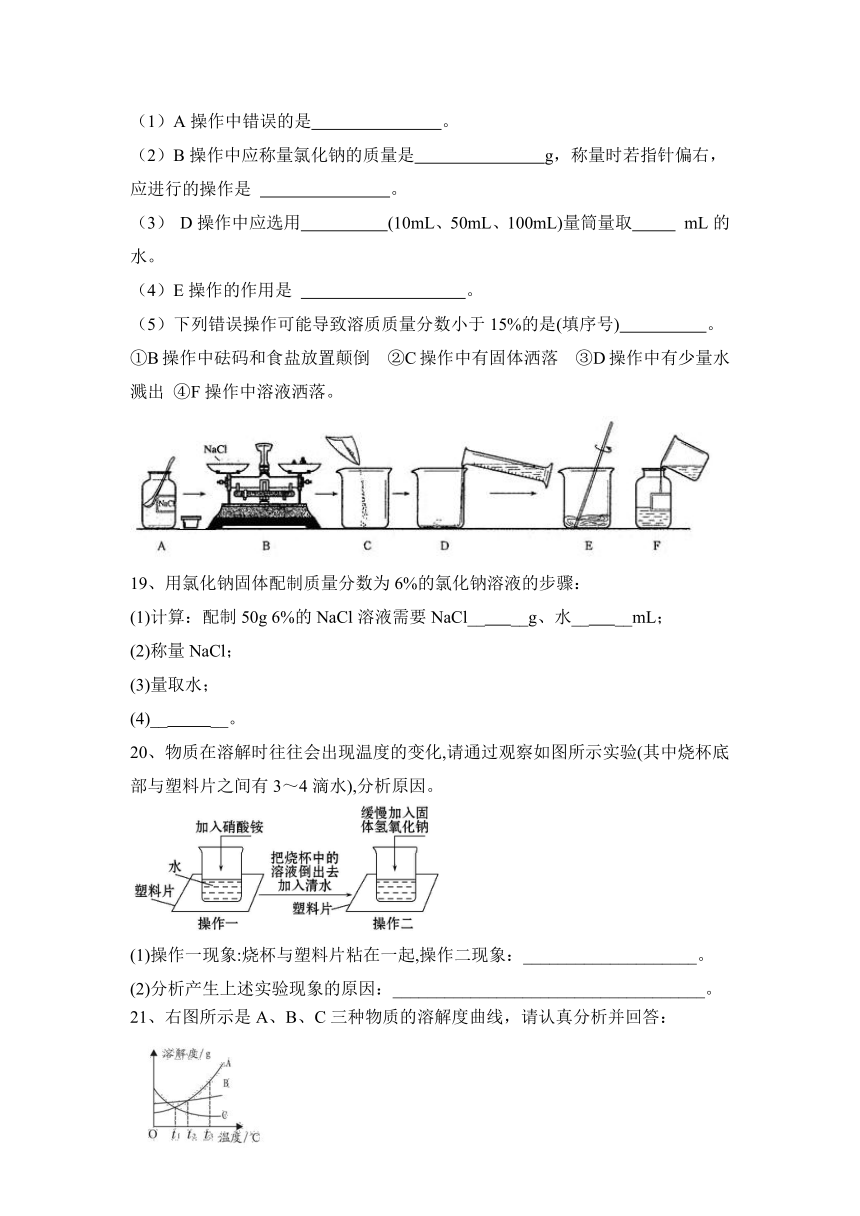
18、如下图所示是配制50g溶质质量分数为15%的氯化钠溶液的操作过程示意图。试回答:
(1)A操作中错误的是 。
(2)B操作中应称量氯化钠的质量是 g,称量时若指针偏右,应进行的操作是 。
(3) D操作中应选用 (10mL、50mL、100mL)量筒量取 mL的水。
(4)E操作的作用是 。
(5)下列错误操作可能导致溶质质量分数小于15%的是(填序号) 。①B操作中砝码和食盐放置颠倒 ②C操作中有固体洒落 ③D操作中有少量水溅出 ④F操作中溶液洒落。
19、用氯化钠固体配制质量分数为6%的氯化钠溶液的步骤:
(1)计算:配制50g 6%的NaCl溶液需要NaCl__ __g、水__ __mL;
(2)称量NaCl;
(3)量取水;
(4)__ __。
20、物质在溶解时往往会出现温度的变化,请通过观察如图所示实验(其中烧杯底部与塑料片之间有3~4滴水),分析原因。
(1)操作一现象:烧杯与塑料片粘在一起,操作二现象:____________________。
(2)分析产生上述实验现象的原因:____________________________________。
21、右图所示是A、B、C三种物质的溶解度曲线,请认真分析并回答:
(1)t3℃时,A、B、C三种物质的溶解度由小到大的顺序为 。
(2)t2℃时,A、B、C三种物质的饱和溶液降温到t1℃时变为不饱和溶液的 是 。
(3)当A中含有少量的B,可采用 (填“降温”或“蒸发”)结晶的方法提纯A物质。
(4)t3℃时,若用A、B两物质各50g配成饱和溶液,则所需加水
的质量A B(填“>”、“<”、“=”)。
22、如图为A、B、C三种固体物质(不含结晶水)在水中的溶解度曲线,请回答下列问题。
(1)t1℃时,A、B、C三种物质的饱和溶液,溶质质量分数由大到小的顺序是___。
(2)若B中混有少量A可用 ________的方法提纯B。
(3)t3℃时向25g A物质中加入60g水,形成的溶液是 ____(填“饱和溶液”或“不饱和溶液”)。
(4)将t3℃时A、B、C三种物质的饱和溶液降温到t1℃,析出晶体最多的是 ____(填数字序号)。
①A ②B ③C ④无法确定
(5)欲将t3℃时A的饱和溶液30g,稀释为10%的溶液需加水 ________g。
23、用6%的NaCl溶液配制50g 3%的NaCl溶液的步骤:
(1)计算:配制50g 3%的NaCl溶液需要6%的NaCl溶液__ __g,其密度约为1.04g/cm3,则体积为__ __mL;水__ __g;
(2)量取所需体积的6%的NaCl溶液和所需体积的水;
(3)混匀;
(4)装瓶并贴上标签。
三、实验题。
24、某同学以“物质溶于水后液体的温度是否改变 ”为课题进行探究,其用品和操作示意图如下表:
【实验目的】 探究下列物质溶解前后液体温度变化情况
实验用品 药匙、烧杯、玻璃棒、温度计、水、氢氧化钠、氯化钠、硝酸铵
操作过程
该同学取三只烧杯,向烧杯中各注入25 mL水,测得水的初温为20℃。再向三只烧杯中分别加入质量均为8 g的氢氧化钠、氯化钠、硝酸铵固体,搅拌,待溶解后用温度计分别测三只烧杯中溶液的温度。
(1)“搅拌”的目的是______________,图示④中的操作存在一处错误应改正为________________________________________________________________。
(2)三只烧杯中溶液的温度高于20℃的是______________________溶液,这是因为__________________________________________________。
(3)溶解硝酸铵固体的烧杯外壁有水珠产生,其原因是_____________________
___________________________________________________________________。
(4)由此探究实验可知_______________________溶于水温度没有明显的变化。
四、计算类题。
25、取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,请加稀盐酸的质量与产生气体质量的关系如图所示。求:
(1)混合物CaCO3中的质量为_______;
(2)稀盐酸中的溶质质量分数为________;
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数为________?(写出计算过程,计算结果精确到0.1%)
2022—2023学年化学人教版九年级下册第九单元 溶液 素质形成题含答案
人教第九单元 溶液
一、选择题。
1、下列关于溶液颜色的判断不正确的是( )
A.氯化亚铁溶液是黄色的 B.高锰酸钾溶液是紫红色的
C.硫酸铜溶液是蓝色的 D.葡萄糖水是无色的
【答案】A
2、把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
【答案】C
3、下列“水”中,属于纯净物的是( )
A.清纯的井水 B.淡化的海水
C.净化的河水 D.实验室配制试剂用的蒸馏水
【答案】D
4、配制溶液时,下列溶剂中最常用的是( )
A.酒精 B.植物油 C.汽油 D.水
【答案】D。
5、室温时,有两瓶硝酸钾溶液,已知一瓶为饱和溶液,另一瓶为不饱和溶液,分别取样(如图),则一定无法区分这两种溶液的实验操作是( )
A.加一定量的水 B.加入少量该晶体
C.略降低温度 D.恒温蒸发少量水
【答案】A
6、20 ℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入四个盛有50 g水的烧杯中,充分溶解,其溶解情况如下表。下列说法正确的是( )
物质 甲 乙 丙 丁
未溶解固体的质量/g 4.2 2 0 9.2
A.所得四杯溶液一定都是饱和溶液
B.丁溶液的质量最大
C.20 ℃时四种物质溶解度的关系:丙>乙>甲>丁
D.四杯溶液中溶剂的质量大小:丙溶液>乙溶液>甲溶液>丁溶液
【答案】C
7、下列判断正确的是( )
A.合金至少有两种金属熔合而成
B.不同种元素最本质的区别是质子数不同
C.饱和溶液变为不饱和溶液,其溶质质量分数一定变小
D.两种化合物相互作用生成另外两种化合物的反应一定是复分解反应
【答案】B
8、20℃时,取四份一定质量的饱和硝酸钾溶液分别进行如下实验后,所得结论正确的是( )
A. 保持温度不变,减少10g溶剂后,溶液中溶质的质量分数增大
B. 保持温度不变,加入10g溶质后,溶液中溶质的质量分数增大
C. 保持温度不变,减少10g溶剂后,溶质的溶解度减小
D. 降低至10℃后,溶质的溶解度减小
【答案】D
9、用氯化钠固体和水配制50 g质量分数为6%的氯化钠溶液,下列实验操作正确的是( )
A.用托盘天平称量3.0 g氯化钠
B.用烧杯量取所需的水
C.未等氯化钠固体完全溶解就将溶液转移到试剂瓶中
D.将只写药品名称的标签贴在试剂瓶上
【答案】A
10、下列有关水的认识错误的是( )
A.水是一种常见的溶剂
B.自然界中的水过滤后变成纯水
C.水的蒸馏是物理变化
D.硬水和软水可用肥皂水鉴别
【答案】B。
11、如图所示是甲、乙两种物质的溶解度曲线,下列说法不正确的是( )
A.t1℃时,甲、乙两种物质的溶解度相等
B.甲物质的溶解度随温度的升高而增大
C.将t2℃时甲、乙两种物质的饱和溶液降温到t1℃,溶液仍然饱和
D.t1℃时,将50g甲物质加入100g水中,充分搅拌,能得到甲物质的饱和溶液
【答案】C
12、下列实验符合如图所示变化趋势的是( )
序号 实验 横坐标 纵坐标
A 向一定量氢氧化钠溶液中滴加稀硫酸 稀硫酸的质量 水的质量
B 加热一定量高锰酸钾固体 加热时间 剩余固体中氧元素的质量
C 向一定量饱和硝酸钾溶液中加水 加水的质量 溶质的质量分数
D 向一定量锌粒中加入稀盐酸 稀盐酸的质量 锌粒的质量
A.A B.B C.C D.D
【答案】D
13、实验室用氯化钠固体配制50 g 溶质质量分数为10%的氯化钠溶液。下列描述错误的是( )
A.用50 mL的量筒量取45 mL蒸馏水
B.溶解时用到的玻璃仪器有烧杯、玻璃棒
C.实验的主要步骤为计算、称量、量取、溶解、装瓶贴标签
D.配制好的氯化钠溶液装入刚清洗过还未干燥的试剂瓶中保存
【答案】D
14、下列关于常见氧化物的叙述,不正确的是( )
A.H2O是最常用的溶剂,能溶解所有的物质
B.CO极易与血液中的血红蛋白结合,造成生物体内缺氧
C.固态CO2叫做“干冰”,可用于人工降雨
D.磁铁矿的主要成分是Fe3O4,有磁性,可用于炼铁
【答案】A。
15、许多化学反应都是在溶液中进行的,关于溶液理解正确的是( )
A.通过加热蒸发的方法提高75%酒精的浓度
B.将氧化钙溶于水,可以形成氧化钙溶液
C. 5gCuSO4 5H2O溶于95g水中配制CuSO4溶液,此溶液溶质的质量分数小于5%
D.将50℃下的饱和KNO3溶液冷却至室温,硝酸钾固体析出,过滤后可得纯水和硝酸钾固体
【答案】C
二、填空题。
16、请举出符合下列要求的溶液。
(1)溶质是固体,溶剂是液体:____________________________________。
(2)溶质是液体,溶剂是液体:____________________________________。
(3)有颜色的溶液:_____________________________________________。
(4)溶质由分子构成的溶液:_____________________________________。
(5)溶质由离子构成的溶液:_____________________________________。
(6)溶剂不是水的溶液:_________________________________________。
【答案】(1)蔗糖溶液 (2)医用酒精 (3)硫酸铜溶液
(4)蔗糖溶液 (5)食盐溶液 (6)碘酒(答案合理即可)
17、(1)现有H、O、Na、Mg、P五种元素,请根据下列要求写出由所给元素组成的物质(写化学式):
属于金属氧化物的是________(写出两种即可)
(2)A、B、C三种物质的溶解度曲线如图所示,请回答:
①对于物质A而言,点P的含义为________。
②t3℃时,A、B、C三种饱和溶液中,溶质质量分数由大到小的排列为________。
③若A、B、C三种物质中有一种是易溶于水的气体,则其溶解度曲线是________。
④烧杯中有t2℃时20%的A溶液50 g,要将该溶液变为同温度下的饱和溶液,至少需向烧杯中加入A物质________g。
【答案】.(1)Na2O MgO
(2)①t1℃时,A物质的溶解度为35 g ②A>B>C(A、B、C) ③C ④14
18、如下图所示是配制50g溶质质量分数为15%的氯化钠溶液的操作过程示意图。试回答:
(1)A操作中错误的是 。
(2)B操作中应称量氯化钠的质量是 g,称量时若指针偏右,应进行的操作是 。
(3) D操作中应选用 (10mL、50mL、100mL)量筒量取 mL的水。
(4)E操作的作用是 。
(5)下列错误操作可能导致溶质质量分数小于15%的是(填序号) 。①B操作中砝码和食盐放置颠倒 ②C操作中有固体洒落 ③D操作中有少量水溅出 ④F操作中溶液洒落。
【答案】(1)试剂瓶塞正放 (2)7.5 添加氯化钠至天平平衡
(3)50mL,42.5 (4)加速固体溶解 (5)①②
19、用氯化钠固体配制质量分数为6%的氯化钠溶液的步骤:
(1)计算:配制50g 6%的NaCl溶液需要NaCl__ __g、水__ __mL;
(2)称量NaCl;
(3)量取水;
(4)__ __。
【答案】(1) 3 47 (4) 溶解
20、物质在溶解时往往会出现温度的变化,请通过观察如图所示实验(其中烧杯底部与塑料片之间有3~4滴水),分析原因。
(1)操作一现象:烧杯与塑料片粘在一起,操作二现象:____________________。
(2)分析产生上述实验现象的原因:____________________________________。
【答案】(1)烧杯与塑料片分离
(2)操作一中加入硝酸铵,溶于水时吸收热量,使溶液的温度降低,塑料片上的水结冰,从而使烧杯与塑料片粘在一起;操作二中加入氢氧化钠固体,溶于水时放出热量,使粘在塑料片与烧杯之间的冰融化,使烧杯与塑料片分离
21、右图所示是A、B、C三种物质的溶解度曲线,请认真分析并回答:
(1)t3℃时,A、B、C三种物质的溶解度由小到大的顺序为 。
(2)t2℃时,A、B、C三种物质的饱和溶液降温到t1℃时变为不饱和溶液的 是 。
(3)当A中含有少量的B,可采用 (填“降温”或“蒸发”)结晶的方法提纯A物质。
(4)t3℃时,若用A、B两物质各50g配成饱和溶液,则所需加水
的质量A B(填“>”、“<”、“=”)。
【答案】(1) C<B<A (2)C (3)降温 (4)<
22、如图为A、B、C三种固体物质(不含结晶水)在水中的溶解度曲线,请回答下列问题。
(1)t1℃时,A、B、C三种物质的饱和溶液,溶质质量分数由大到小的顺序是___。
(2)若B中混有少量A可用 ________的方法提纯B。
(3)t3℃时向25g A物质中加入60g水,形成的溶液是 ____(填“饱和溶液”或“不饱和溶液”)。
(4)将t3℃时A、B、C三种物质的饱和溶液降温到t1℃,析出晶体最多的是 ____(填数字序号)。
①A ②B ③C ④无法确定
(5)欲将t3℃时A的饱和溶液30g,稀释为10%的溶液需加水 ________g。
【答案】(1)B>A=C (2)蒸发结晶 (3)不饱和溶液 (4)④ (5)70
23、用6%的NaCl溶液配制50g 3%的NaCl溶液的步骤:
(1)计算:配制50g 3%的NaCl溶液需要6%的NaCl溶液__ __g,其密度约为1.04g/cm3,则体积为__ __mL;水__ __g;
(2)量取所需体积的6%的NaCl溶液和所需体积的水;
(3)混匀;
(4)装瓶并贴上标签。
【答案】(1) 25 24.0 25
三、实验题。
24、某同学以“物质溶于水后液体的温度是否改变 ”为课题进行探究,其用品和操作示意图如下表:
【实验目的】 探究下列物质溶解前后液体温度变化情况
实验用品 药匙、烧杯、玻璃棒、温度计、水、氢氧化钠、氯化钠、硝酸铵
操作过程
该同学取三只烧杯,向烧杯中各注入25 mL水,测得水的初温为20℃。再向三只烧杯中分别加入质量均为8 g的氢氧化钠、氯化钠、硝酸铵固体,搅拌,待溶解后用温度计分别测三只烧杯中溶液的温度。
(1)“搅拌”的目的是______________,图示④中的操作存在一处错误应改正为________________________________________________________________。
(2)三只烧杯中溶液的温度高于20℃的是______________________溶液,这是因为__________________________________________________。
(3)溶解硝酸铵固体的烧杯外壁有水珠产生,其原因是_____________________
___________________________________________________________________。
(4)由此探究实验可知_______________________溶于水温度没有明显的变化。
【答案】(1)加快固体溶解 用玻璃棒搅拌 (2)氢氧化钠 氢氧化钠溶于水放热 (3)硝酸铵溶于水吸热 (4)氯化钠
四、计算类题。
25、取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,请加稀盐酸的质量与产生气体质量的关系如图所示。求:
(1)混合物CaCO3中的质量为_______;
(2)稀盐酸中的溶质质量分数为________;
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数为________?(写出计算过程,计算结果精确到0.1%)
【答案】(1) 10g (2) 7.3% (3) 12.6%
人教第九单元 溶液
一、选择题。
1、下列关于溶液颜色的判断不正确的是( )
A.氯化亚铁溶液是黄色的 B.高锰酸钾溶液是紫红色的
C.硫酸铜溶液是蓝色的 D.葡萄糖水是无色的
2、把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
3、下列“水”中,属于纯净物的是( )
A.清纯的井水 B.淡化的海水
C.净化的河水 D.实验室配制试剂用的蒸馏水
4、配制溶液时,下列溶剂中最常用的是( )
A.酒精 B.植物油 C.汽油 D.水
5、室温时,有两瓶硝酸钾溶液,已知一瓶为饱和溶液,另一瓶为不饱和溶液,分别取样(如图),则一定无法区分这两种溶液的实验操作是( )
A.加一定量的水 B.加入少量该晶体
C.略降低温度 D.恒温蒸发少量水
6、20 ℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入四个盛有50 g水的烧杯中,充分溶解,其溶解情况如下表。下列说法正确的是( )
物质 甲 乙 丙 丁
未溶解固体的质量/g 4.2 2 0 9.2
A.所得四杯溶液一定都是饱和溶液
B.丁溶液的质量最大
C.20 ℃时四种物质溶解度的关系:丙>乙>甲>丁
D.四杯溶液中溶剂的质量大小:丙溶液>乙溶液>甲溶液>丁溶液
7、下列判断正确的是( )
A.合金至少有两种金属熔合而成
B.不同种元素最本质的区别是质子数不同
C.饱和溶液变为不饱和溶液,其溶质质量分数一定变小
D.两种化合物相互作用生成另外两种化合物的反应一定是复分解反应
8、20℃时,取四份一定质量的饱和硝酸钾溶液分别进行如下实验后,所得结论正确的是( )
A. 保持温度不变,减少10g溶剂后,溶液中溶质的质量分数增大
B. 保持温度不变,加入10g溶质后,溶液中溶质的质量分数增大
C. 保持温度不变,减少10g溶剂后,溶质的溶解度减小
D. 降低至10℃后,溶质的溶解度减小
9、用氯化钠固体和水配制50 g质量分数为6%的氯化钠溶液,下列实验操作正确的是( )
A.用托盘天平称量3.0 g氯化钠
B.用烧杯量取所需的水
C.未等氯化钠固体完全溶解就将溶液转移到试剂瓶中
D.将只写药品名称的标签贴在试剂瓶上
10、下列有关水的认识错误的是( )
A.水是一种常见的溶剂
B.自然界中的水过滤后变成纯水
C.水的蒸馏是物理变化
D.硬水和软水可用肥皂水鉴别
11、如图所示是甲、乙两种物质的溶解度曲线,下列说法不正确的是( )
A.t1℃时,甲、乙两种物质的溶解度相等
B.甲物质的溶解度随温度的升高而增大
C.将t2℃时甲、乙两种物质的饱和溶液降温到t1℃,溶液仍然饱和
D.t1℃时,将50g甲物质加入100g水中,充分搅拌,能得到甲物质的饱和溶液
12、下列实验符合如图所示变化趋势的是( )
序号 实验 横坐标 纵坐标
A 向一定量氢氧化钠溶液中滴加稀硫酸 稀硫酸的质量 水的质量
B 加热一定量高锰酸钾固体 加热时间 剩余固体中氧元素的质量
C 向一定量饱和硝酸钾溶液中加水 加水的质量 溶质的质量分数
D 向一定量锌粒中加入稀盐酸 稀盐酸的质量 锌粒的质量
A.A B.B C.C D.D
13、实验室用氯化钠固体配制50 g 溶质质量分数为10%的氯化钠溶液。下列描述错误的是( )
A.用50 mL的量筒量取45 mL蒸馏水
B.溶解时用到的玻璃仪器有烧杯、玻璃棒
C.实验的主要步骤为计算、称量、量取、溶解、装瓶贴标签
D.配制好的氯化钠溶液装入刚清洗过还未干燥的试剂瓶中保存
14、下列关于常见氧化物的叙述,不正确的是( )
A.H2O是最常用的溶剂,能溶解所有的物质
B.CO极易与血液中的血红蛋白结合,造成生物体内缺氧
C.固态CO2叫做“干冰”,可用于人工降雨
D.磁铁矿的主要成分是Fe3O4,有磁性,可用于炼铁
15、许多化学反应都是在溶液中进行的,关于溶液理解正确的是( )
A.通过加热蒸发的方法提高75%酒精的浓度
B.将氧化钙溶于水,可以形成氧化钙溶液
C. 5gCuSO4 5H2O溶于95g水中配制CuSO4溶液,此溶液溶质的质量分数小于5%
D.将50℃下的饱和KNO3溶液冷却至室温,硝酸钾固体析出,过滤后可得纯水和硝酸钾固体
二、填空题。
16、请举出符合下列要求的溶液。
(1)溶质是固体,溶剂是液体:____________________________________。
(2)溶质是液体,溶剂是液体:____________________________________。
(3)有颜色的溶液:_____________________________________________。
(4)溶质由分子构成的溶液:_____________________________________。
(5)溶质由离子构成的溶液:_____________________________________。
(6)溶剂不是水的溶液:_________________________________________。
17、(1)现有H、O、Na、Mg、P五种元素,请根据下列要求写出由所给元素组成的物质(写化学式):
属于金属氧化物的是________(写出两种即可)
(2)A、B、C三种物质的溶解度曲线如图所示,请回答:
①对于物质A而言,点P的含义为________。
②t3℃时,A、B、C三种饱和溶液中,溶质质量分数由大到小的排列为________。
③若A、B、C三种物质中有一种是易溶于水的气体,则其溶解度曲线是________。
④烧杯中有t2℃时20%的A溶液50 g,要将该溶液变为同温度下的饱和溶液,至少需向烧杯中加入A物质________g。
18、如下图所示是配制50g溶质质量分数为15%的氯化钠溶液的操作过程示意图。试回答:
(1)A操作中错误的是 。
(2)B操作中应称量氯化钠的质量是 g,称量时若指针偏右,应进行的操作是 。
(3) D操作中应选用 (10mL、50mL、100mL)量筒量取 mL的水。
(4)E操作的作用是 。
(5)下列错误操作可能导致溶质质量分数小于15%的是(填序号) 。①B操作中砝码和食盐放置颠倒 ②C操作中有固体洒落 ③D操作中有少量水溅出 ④F操作中溶液洒落。
19、用氯化钠固体配制质量分数为6%的氯化钠溶液的步骤:
(1)计算:配制50g 6%的NaCl溶液需要NaCl__ __g、水__ __mL;
(2)称量NaCl;
(3)量取水;
(4)__ __。
20、物质在溶解时往往会出现温度的变化,请通过观察如图所示实验(其中烧杯底部与塑料片之间有3~4滴水),分析原因。
(1)操作一现象:烧杯与塑料片粘在一起,操作二现象:____________________。
(2)分析产生上述实验现象的原因:____________________________________。
21、右图所示是A、B、C三种物质的溶解度曲线,请认真分析并回答:
(1)t3℃时,A、B、C三种物质的溶解度由小到大的顺序为 。
(2)t2℃时,A、B、C三种物质的饱和溶液降温到t1℃时变为不饱和溶液的 是 。
(3)当A中含有少量的B,可采用 (填“降温”或“蒸发”)结晶的方法提纯A物质。
(4)t3℃时,若用A、B两物质各50g配成饱和溶液,则所需加水
的质量A B(填“>”、“<”、“=”)。
22、如图为A、B、C三种固体物质(不含结晶水)在水中的溶解度曲线,请回答下列问题。
(1)t1℃时,A、B、C三种物质的饱和溶液,溶质质量分数由大到小的顺序是___。
(2)若B中混有少量A可用 ________的方法提纯B。
(3)t3℃时向25g A物质中加入60g水,形成的溶液是 ____(填“饱和溶液”或“不饱和溶液”)。
(4)将t3℃时A、B、C三种物质的饱和溶液降温到t1℃,析出晶体最多的是 ____(填数字序号)。
①A ②B ③C ④无法确定
(5)欲将t3℃时A的饱和溶液30g,稀释为10%的溶液需加水 ________g。
23、用6%的NaCl溶液配制50g 3%的NaCl溶液的步骤:
(1)计算:配制50g 3%的NaCl溶液需要6%的NaCl溶液__ __g,其密度约为1.04g/cm3,则体积为__ __mL;水__ __g;
(2)量取所需体积的6%的NaCl溶液和所需体积的水;
(3)混匀;
(4)装瓶并贴上标签。
三、实验题。
24、某同学以“物质溶于水后液体的温度是否改变 ”为课题进行探究,其用品和操作示意图如下表:
【实验目的】 探究下列物质溶解前后液体温度变化情况
实验用品 药匙、烧杯、玻璃棒、温度计、水、氢氧化钠、氯化钠、硝酸铵
操作过程
该同学取三只烧杯,向烧杯中各注入25 mL水,测得水的初温为20℃。再向三只烧杯中分别加入质量均为8 g的氢氧化钠、氯化钠、硝酸铵固体,搅拌,待溶解后用温度计分别测三只烧杯中溶液的温度。
(1)“搅拌”的目的是______________,图示④中的操作存在一处错误应改正为________________________________________________________________。
(2)三只烧杯中溶液的温度高于20℃的是______________________溶液,这是因为__________________________________________________。
(3)溶解硝酸铵固体的烧杯外壁有水珠产生,其原因是_____________________
___________________________________________________________________。
(4)由此探究实验可知_______________________溶于水温度没有明显的变化。
四、计算类题。
25、取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,请加稀盐酸的质量与产生气体质量的关系如图所示。求:
(1)混合物CaCO3中的质量为_______;
(2)稀盐酸中的溶质质量分数为________;
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数为________?(写出计算过程,计算结果精确到0.1%)
2022—2023学年化学人教版九年级下册第九单元 溶液 素质形成题含答案
人教第九单元 溶液
一、选择题。
1、下列关于溶液颜色的判断不正确的是( )
A.氯化亚铁溶液是黄色的 B.高锰酸钾溶液是紫红色的
C.硫酸铜溶液是蓝色的 D.葡萄糖水是无色的
【答案】A
2、把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
【答案】C
3、下列“水”中,属于纯净物的是( )
A.清纯的井水 B.淡化的海水
C.净化的河水 D.实验室配制试剂用的蒸馏水
【答案】D
4、配制溶液时,下列溶剂中最常用的是( )
A.酒精 B.植物油 C.汽油 D.水
【答案】D。
5、室温时,有两瓶硝酸钾溶液,已知一瓶为饱和溶液,另一瓶为不饱和溶液,分别取样(如图),则一定无法区分这两种溶液的实验操作是( )
A.加一定量的水 B.加入少量该晶体
C.略降低温度 D.恒温蒸发少量水
【答案】A
6、20 ℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入四个盛有50 g水的烧杯中,充分溶解,其溶解情况如下表。下列说法正确的是( )
物质 甲 乙 丙 丁
未溶解固体的质量/g 4.2 2 0 9.2
A.所得四杯溶液一定都是饱和溶液
B.丁溶液的质量最大
C.20 ℃时四种物质溶解度的关系:丙>乙>甲>丁
D.四杯溶液中溶剂的质量大小:丙溶液>乙溶液>甲溶液>丁溶液
【答案】C
7、下列判断正确的是( )
A.合金至少有两种金属熔合而成
B.不同种元素最本质的区别是质子数不同
C.饱和溶液变为不饱和溶液,其溶质质量分数一定变小
D.两种化合物相互作用生成另外两种化合物的反应一定是复分解反应
【答案】B
8、20℃时,取四份一定质量的饱和硝酸钾溶液分别进行如下实验后,所得结论正确的是( )
A. 保持温度不变,减少10g溶剂后,溶液中溶质的质量分数增大
B. 保持温度不变,加入10g溶质后,溶液中溶质的质量分数增大
C. 保持温度不变,减少10g溶剂后,溶质的溶解度减小
D. 降低至10℃后,溶质的溶解度减小
【答案】D
9、用氯化钠固体和水配制50 g质量分数为6%的氯化钠溶液,下列实验操作正确的是( )
A.用托盘天平称量3.0 g氯化钠
B.用烧杯量取所需的水
C.未等氯化钠固体完全溶解就将溶液转移到试剂瓶中
D.将只写药品名称的标签贴在试剂瓶上
【答案】A
10、下列有关水的认识错误的是( )
A.水是一种常见的溶剂
B.自然界中的水过滤后变成纯水
C.水的蒸馏是物理变化
D.硬水和软水可用肥皂水鉴别
【答案】B。
11、如图所示是甲、乙两种物质的溶解度曲线,下列说法不正确的是( )
A.t1℃时,甲、乙两种物质的溶解度相等
B.甲物质的溶解度随温度的升高而增大
C.将t2℃时甲、乙两种物质的饱和溶液降温到t1℃,溶液仍然饱和
D.t1℃时,将50g甲物质加入100g水中,充分搅拌,能得到甲物质的饱和溶液
【答案】C
12、下列实验符合如图所示变化趋势的是( )
序号 实验 横坐标 纵坐标
A 向一定量氢氧化钠溶液中滴加稀硫酸 稀硫酸的质量 水的质量
B 加热一定量高锰酸钾固体 加热时间 剩余固体中氧元素的质量
C 向一定量饱和硝酸钾溶液中加水 加水的质量 溶质的质量分数
D 向一定量锌粒中加入稀盐酸 稀盐酸的质量 锌粒的质量
A.A B.B C.C D.D
【答案】D
13、实验室用氯化钠固体配制50 g 溶质质量分数为10%的氯化钠溶液。下列描述错误的是( )
A.用50 mL的量筒量取45 mL蒸馏水
B.溶解时用到的玻璃仪器有烧杯、玻璃棒
C.实验的主要步骤为计算、称量、量取、溶解、装瓶贴标签
D.配制好的氯化钠溶液装入刚清洗过还未干燥的试剂瓶中保存
【答案】D
14、下列关于常见氧化物的叙述,不正确的是( )
A.H2O是最常用的溶剂,能溶解所有的物质
B.CO极易与血液中的血红蛋白结合,造成生物体内缺氧
C.固态CO2叫做“干冰”,可用于人工降雨
D.磁铁矿的主要成分是Fe3O4,有磁性,可用于炼铁
【答案】A。
15、许多化学反应都是在溶液中进行的,关于溶液理解正确的是( )
A.通过加热蒸发的方法提高75%酒精的浓度
B.将氧化钙溶于水,可以形成氧化钙溶液
C. 5gCuSO4 5H2O溶于95g水中配制CuSO4溶液,此溶液溶质的质量分数小于5%
D.将50℃下的饱和KNO3溶液冷却至室温,硝酸钾固体析出,过滤后可得纯水和硝酸钾固体
【答案】C
二、填空题。
16、请举出符合下列要求的溶液。
(1)溶质是固体,溶剂是液体:____________________________________。
(2)溶质是液体,溶剂是液体:____________________________________。
(3)有颜色的溶液:_____________________________________________。
(4)溶质由分子构成的溶液:_____________________________________。
(5)溶质由离子构成的溶液:_____________________________________。
(6)溶剂不是水的溶液:_________________________________________。
【答案】(1)蔗糖溶液 (2)医用酒精 (3)硫酸铜溶液
(4)蔗糖溶液 (5)食盐溶液 (6)碘酒(答案合理即可)
17、(1)现有H、O、Na、Mg、P五种元素,请根据下列要求写出由所给元素组成的物质(写化学式):
属于金属氧化物的是________(写出两种即可)
(2)A、B、C三种物质的溶解度曲线如图所示,请回答:
①对于物质A而言,点P的含义为________。
②t3℃时,A、B、C三种饱和溶液中,溶质质量分数由大到小的排列为________。
③若A、B、C三种物质中有一种是易溶于水的气体,则其溶解度曲线是________。
④烧杯中有t2℃时20%的A溶液50 g,要将该溶液变为同温度下的饱和溶液,至少需向烧杯中加入A物质________g。
【答案】.(1)Na2O MgO
(2)①t1℃时,A物质的溶解度为35 g ②A>B>C(A、B、C) ③C ④14
18、如下图所示是配制50g溶质质量分数为15%的氯化钠溶液的操作过程示意图。试回答:
(1)A操作中错误的是 。
(2)B操作中应称量氯化钠的质量是 g,称量时若指针偏右,应进行的操作是 。
(3) D操作中应选用 (10mL、50mL、100mL)量筒量取 mL的水。
(4)E操作的作用是 。
(5)下列错误操作可能导致溶质质量分数小于15%的是(填序号) 。①B操作中砝码和食盐放置颠倒 ②C操作中有固体洒落 ③D操作中有少量水溅出 ④F操作中溶液洒落。
【答案】(1)试剂瓶塞正放 (2)7.5 添加氯化钠至天平平衡
(3)50mL,42.5 (4)加速固体溶解 (5)①②
19、用氯化钠固体配制质量分数为6%的氯化钠溶液的步骤:
(1)计算:配制50g 6%的NaCl溶液需要NaCl__ __g、水__ __mL;
(2)称量NaCl;
(3)量取水;
(4)__ __。
【答案】(1) 3 47 (4) 溶解
20、物质在溶解时往往会出现温度的变化,请通过观察如图所示实验(其中烧杯底部与塑料片之间有3~4滴水),分析原因。
(1)操作一现象:烧杯与塑料片粘在一起,操作二现象:____________________。
(2)分析产生上述实验现象的原因:____________________________________。
【答案】(1)烧杯与塑料片分离
(2)操作一中加入硝酸铵,溶于水时吸收热量,使溶液的温度降低,塑料片上的水结冰,从而使烧杯与塑料片粘在一起;操作二中加入氢氧化钠固体,溶于水时放出热量,使粘在塑料片与烧杯之间的冰融化,使烧杯与塑料片分离
21、右图所示是A、B、C三种物质的溶解度曲线,请认真分析并回答:
(1)t3℃时,A、B、C三种物质的溶解度由小到大的顺序为 。
(2)t2℃时,A、B、C三种物质的饱和溶液降温到t1℃时变为不饱和溶液的 是 。
(3)当A中含有少量的B,可采用 (填“降温”或“蒸发”)结晶的方法提纯A物质。
(4)t3℃时,若用A、B两物质各50g配成饱和溶液,则所需加水
的质量A B(填“>”、“<”、“=”)。
【答案】(1) C<B<A (2)C (3)降温 (4)<
22、如图为A、B、C三种固体物质(不含结晶水)在水中的溶解度曲线,请回答下列问题。
(1)t1℃时,A、B、C三种物质的饱和溶液,溶质质量分数由大到小的顺序是___。
(2)若B中混有少量A可用 ________的方法提纯B。
(3)t3℃时向25g A物质中加入60g水,形成的溶液是 ____(填“饱和溶液”或“不饱和溶液”)。
(4)将t3℃时A、B、C三种物质的饱和溶液降温到t1℃,析出晶体最多的是 ____(填数字序号)。
①A ②B ③C ④无法确定
(5)欲将t3℃时A的饱和溶液30g,稀释为10%的溶液需加水 ________g。
【答案】(1)B>A=C (2)蒸发结晶 (3)不饱和溶液 (4)④ (5)70
23、用6%的NaCl溶液配制50g 3%的NaCl溶液的步骤:
(1)计算:配制50g 3%的NaCl溶液需要6%的NaCl溶液__ __g,其密度约为1.04g/cm3,则体积为__ __mL;水__ __g;
(2)量取所需体积的6%的NaCl溶液和所需体积的水;
(3)混匀;
(4)装瓶并贴上标签。
【答案】(1) 25 24.0 25
三、实验题。
24、某同学以“物质溶于水后液体的温度是否改变 ”为课题进行探究,其用品和操作示意图如下表:
【实验目的】 探究下列物质溶解前后液体温度变化情况
实验用品 药匙、烧杯、玻璃棒、温度计、水、氢氧化钠、氯化钠、硝酸铵
操作过程
该同学取三只烧杯,向烧杯中各注入25 mL水,测得水的初温为20℃。再向三只烧杯中分别加入质量均为8 g的氢氧化钠、氯化钠、硝酸铵固体,搅拌,待溶解后用温度计分别测三只烧杯中溶液的温度。
(1)“搅拌”的目的是______________,图示④中的操作存在一处错误应改正为________________________________________________________________。
(2)三只烧杯中溶液的温度高于20℃的是______________________溶液,这是因为__________________________________________________。
(3)溶解硝酸铵固体的烧杯外壁有水珠产生,其原因是_____________________
___________________________________________________________________。
(4)由此探究实验可知_______________________溶于水温度没有明显的变化。
【答案】(1)加快固体溶解 用玻璃棒搅拌 (2)氢氧化钠 氢氧化钠溶于水放热 (3)硝酸铵溶于水吸热 (4)氯化钠
四、计算类题。
25、取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,请加稀盐酸的质量与产生气体质量的关系如图所示。求:
(1)混合物CaCO3中的质量为_______;
(2)稀盐酸中的溶质质量分数为________;
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数为________?(写出计算过程,计算结果精确到0.1%)
【答案】(1) 10g (2) 7.3% (3) 12.6%
同课章节目录
