化学人教版(2019)选择性必修1 4.1.1原电池的工作原理(共36张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.1.1原电池的工作原理(共36张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 81.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-27 00:00:00 | ||
图片预览





文档简介
(共36张PPT)
第四章 化学反应与电能
第一节 原电池
第1课时 原电池的工作原理
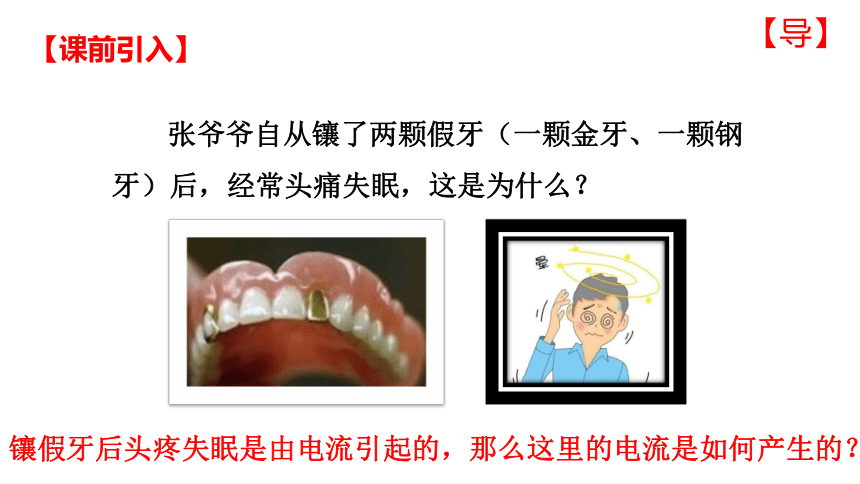
张爷爷自从镶了两颗假牙(一颗金牙、一颗钢牙)后,经常头痛失眠,这是为什么?
【课前引入】
镶假牙后头疼失眠是由电流引起的,那么这里的电流是如何产生的?
【导】
素养目标
重点难点
课标要求 核心素养
1.认识化学能与电能相互转化的实际意义及其重要应用。 2.了解原电池的工作原理,认识从简单原电池发展到带有盐桥原电池的过程变化,并能理解带有盐桥原电池的实用性。 1.以锌铜原电池为例,从宏观和微观的角度,分析理解原电池的工作原理,培养宏观辨识与微观探析的能力。
2.通过对锌铜原电池工作原理的分析,建立对电化学过程的系统分析思路,培养证据推理与模型认知的意识。
了解原电池的工作原理,电极反应式的书写及双液盐桥电池的设计。
【导】
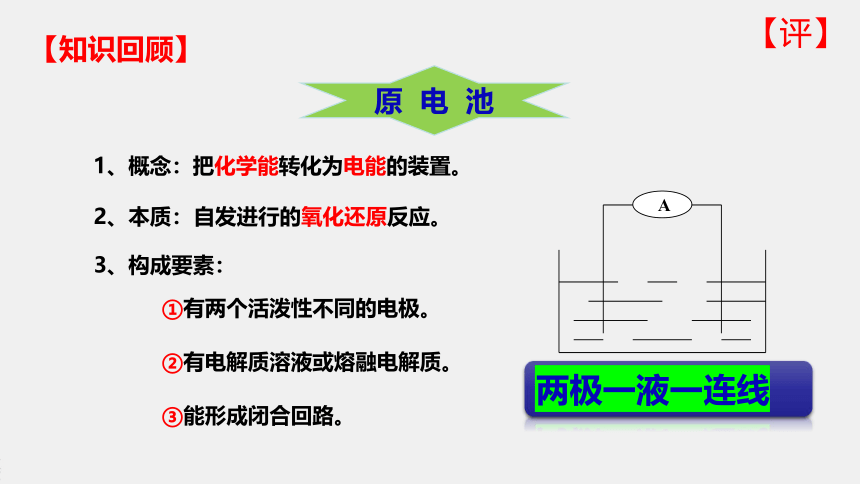
1、概念:把化学能转化为电能的装置。
3、构成要素:
①有两个活泼性不同的电极。
②有电解质溶液或熔融电解质。
③能形成闭合回路。
A
2、本质:
自发进行的氧化还原反应。
两极一液一连线
原 电 池
【知识回顾】
【评】
Zn Cu
Fe C(石墨)
Zn Cu
Zn Cu
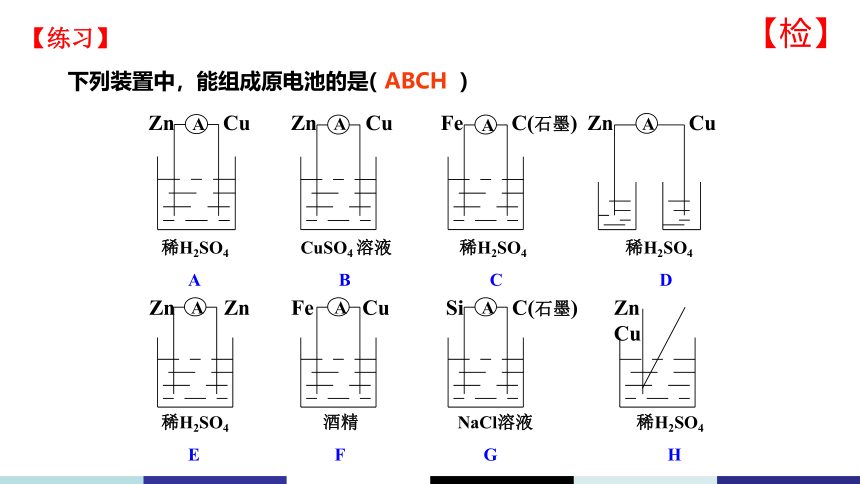
下列装置中,能组成原电池的是( )
ABCH
稀H2SO4 CuSO4 溶液 稀H2SO4 稀H2SO4
A B C D
A
A
A
A
A
A
Zn Zn
Fe Cu
Si C(石墨)
A
稀H2SO4 酒精 NaCl溶液 稀H2SO4
E F G H
Zn Cu
【练习】
【检】
Zn
A
Cu
Cu2+
Zn2+
e-
Zn
Cu2+
Cu
SO42-
SO42-
内电路:阳(正)离子移向正极,阴(负)离子移向负极。
外电路:电子由负极经导线流向正极
Cu2+
SO42-
e-
负极
正极
Zn - 2e- = Zn2+
Cu2+ + 2e- = Cu
发生氧化反应
发生还原反应
CuSO4
溶液
Zn
电子不下水
离子不上岸
一、单液原电池原理
【展】
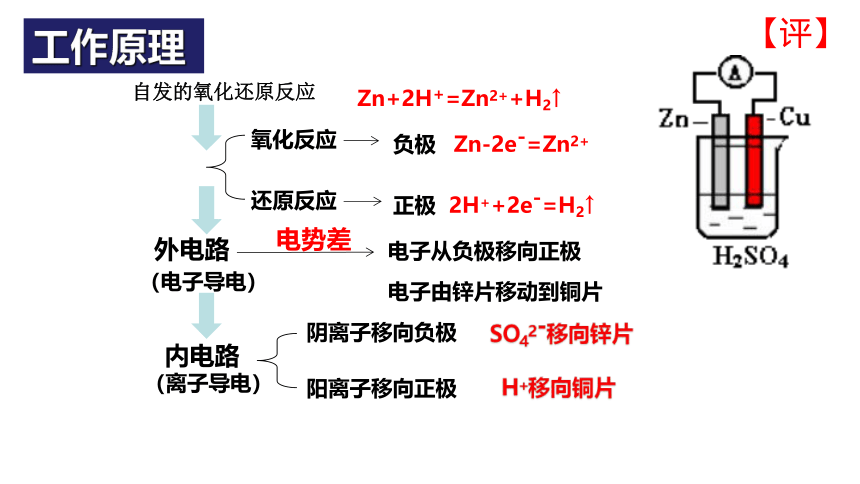
自发的氧化还原反应
氧化反应
还原反应
外电路
内电路
(电子导电)
(离子导电)
电子从负极移向正极
阴离子移向负极
阳离子移向正极
负极
正极
Zn+2H+=Zn2++H2↑
Zn-2e-=Zn2+
2H++2e-=H2↑
电子由锌片移动到铜片
SO42-移向锌片
H+移向铜片
电势差
工作原理
【评】
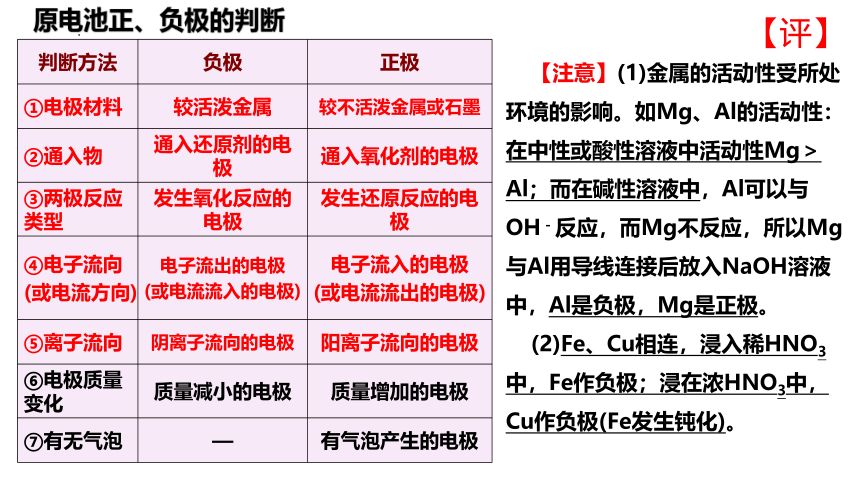
原电池正、负极的判断
判断方法 负极 正极
①电极材料 较活泼金属 较不活泼金属或石墨
②通入物 通入还原剂的电极 通入氧化剂的电极
③两极反应类型 发生氧化反应的电极 发生还原反应的电极
④电子流向 (或电流方向) 电子流出的电极 (或电流流入的电极) 电子流入的电极
(或电流流出的电极)
⑤离子流向 阴离子流向的电极 阳离子流向的电极
⑥电极质量变化 质量减小的电极 质量增加的电极
⑦有无气泡 — 有气泡产生的电极
【注意】(1)金属的活动性受所处环境的影响。如Mg、Al的活动性:在中性或酸性溶液中活动性Mg>Al;而在碱性溶液中,Al可以与OH-反应,而Mg不反应,所以Mg与Al用导线连接后放入NaOH溶液中,Al是负极,Mg是正极。
(2)Fe、Cu相连,浸入稀HNO3中,Fe作负极;浸在浓HNO3中,Cu作负极(Fe发生钝化)。
【评】
(1)原电池中电流的方向是负极→导线→正极( )
(2)原电池中负极发生的反应是还原反应( )
(3)锌铜原电池中电子由锌电极经过电解质溶液流向铜电极( )
(4)在原电池中阳离子移向正极,阴离子移向负极( )
(5)原电池的正极一定是化学性质不活泼的金属( )
×
×
×
√
×
判断下列说法是否正确。
【课堂练习1】
【检】
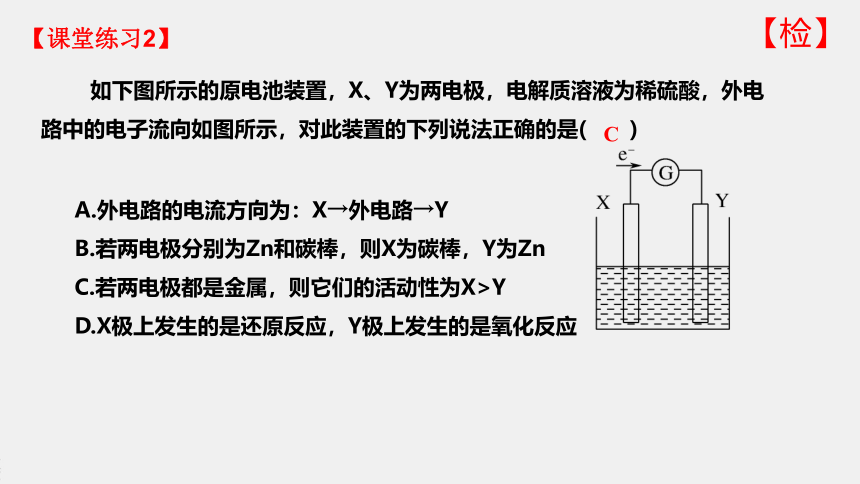
如下图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为Zn和碳棒,则X为碳棒,Y为Zn
C.若两电极都是金属,则它们的活动性为X>Y
D.X极上发生的是还原反应,Y极上发生的是氧化反应
C
【课堂练习2】
【检】
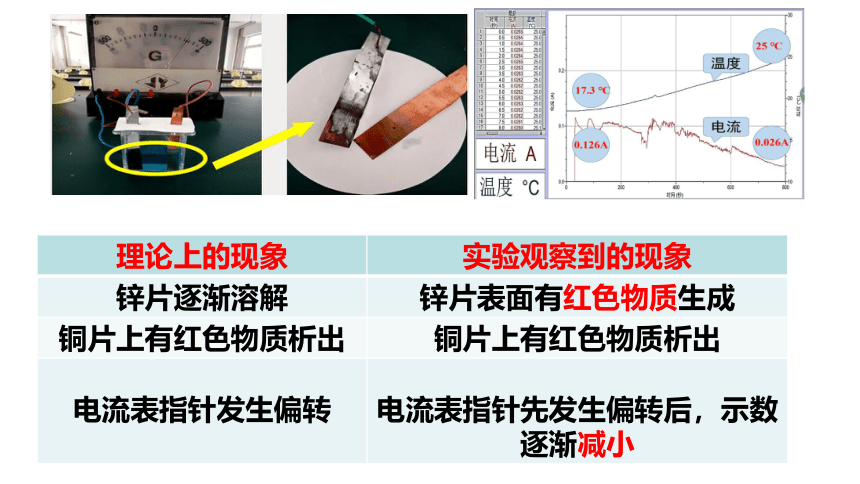
单液铜锌原电池实验探究
理论上的现象 实验观察到的现象
锌片逐渐溶解 锌片表面有红色物质生成
铜片上有红色物质析出 铜片上有红色物质析出
电流表指针发生偏转
电流表指针先发生偏转后,示数逐渐减小
分析“锌片表面附着红色固体,电流逐渐衰减” 的原因。
现象 原因
锌片表面附着红色固体
电流逐渐衰减
Zn与Cu2+直接接触发生反应,Zn片、附着在Zn上的Cu以及CuSO4溶液局部形成了原电池,促进了Cu在锌片表面析出。
转移的电子没有经过导线,电流逐渐衰减
【思】
解决问题的关键:还原剂Zn与氧化剂CuSO4不直接接触
该装置能量转化率低的原因是什么?如何解决?
现象:?
原电池装置的改造
【思】
实验探究——双液锌铜原电池
解决问题的关键:还原剂Zn与氧化剂CuSO4不直接接触
该装置能量转化率低的原因是什么?如何解决?
现象:
电流表指针不偏转
原电池装置的改造
【展】
两个溶液间缺少离子导体,无法形成闭合回路。
为什么没有电流?该如何解决?
盐桥
一种凝胶态的离子导体
※资料卡片
盐桥:装有含KCl饱和溶液的琼胶,Cl-、K+可在其中自由移动。
原电池装置的改造
【思】
【展】
实验探究——双液锌铜原电池
有盐桥存在时,电流表指针偏转
取出盐桥,电流表指针不再偏转
ZnSO4溶液
CuSO4溶液
Zn
Cu
A
随着时间的延续,能产生持续稳定的电流
有盐桥存在为什么能产生持续稳定的电流?
【思】
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到锌片全部溶解或CuSO4溶液中的Cu2+几乎完全变成Cu。
在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完成的。取出盐桥,Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+变为Cu,使得SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻止电子从锌片流向铜片,造成电流中断。
双液原电池 解决了电池自放电的损耗问题,
提高了能量转化率,
增加了原电池的使用寿命。
K+
Cl-
e-
Zn2+
Zn
Cu2+
Cu
二、双液原电池原理
Zn - 2e- = Zn2+
Cu2+ + 2e- = Cu
发生氧化反应
发生还原反应
负极
正极
通常是装有含琼胶的KCl 饱和溶液。盐桥中的K+、Cl-是可以自由移动,琼胶的固定作用可以防止KCl溶液直接流出来。
盐桥的作用:
1、使整个装置构成通路,代替两溶液直接接触。(离子通路)
2、平衡电荷。(离子库,可以源源不断的供给需要的离子)
盐桥
【打破思维定势】氧化剂和还原剂不直接接触也能发生反应。
原电池 双液电池 单液电池
电极反应
电极材料
离子导体
电子导体
负极:Zn -2e- Zn2+
正极:Cu2++2e- Cu
正极:铜片;负极:锌片
正极:铜片;负极:锌片
ZnSO4溶液、盐桥、CuSO4溶液
CuSO4 溶液
导线
导线
负极:Zn -2e- Zn2+
正极:Cu2++2e- Cu
对比锌铜原电池
总反应:Cu2+ + Zn Cu+ Zn2+
【评】
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有含KCl饱和溶液的琼胶)构成一个原电池(如下图)。以下有关该原电池的叙述正确的是( )
①在外电路中,电子由铜电极流向银电极
②正极反应为Ag++e- = Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应
与该原电池反应相同
A.只有①② B.①②④ C.只有②③ D.①③④
B
【课堂练习3】
【检】
电流大小:
电流稳定性:
转化效率:
较小
稳定
高
电流大小:
电流稳定性:
转化效率:
较大
衰减快
低
【展】
1、阳离子交换膜:只允许阳离子通过
3、质 子 交 换 膜:只允许H+通过
2、阴离子交换膜:只允许阴离子通过
改进
增大电流呢?
缩短盐桥的长度,增大盐桥的横截面积
能否用一张薄薄的隔膜代替盐桥呢?
双液原电池电流弱的原因?
1.离子运动的距离长
2.离子运动的通道窄
3.离子容量小
Cu
【思】
离子交换膜简介
离子交换膜是一种含离子基团的、对溶液里的离子具有选择透过能力的
高分子膜。
单液原电池
双液原电池
隔膜原电池
隔膜原电池微型化
1.两极
2.电解质溶液
3.导线
4.自发进行的氧化还原反应
电池四要素
—离子导体
—电子导体
归纳小结
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是( )
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c 减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
C
【课堂练习4】
【检】
(1)比较金属的活动性强弱:原电池中,负极一般是活动性 的金属,正极一般是活动性较弱的金属(或其它能导电的物质)。
(2)加快化学反应速率:氧化还原反应形成原电池时,反应速率加快。
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
(3)用于金属的防护:将需要保护的金属制品作原电池的 而受到保护。
钢铁中含有碳,C与Fe组成原电池,发生原电池反应而使钢铁(做负极)遭到腐蚀
(4)设计制作化学电源
①首先将氧化还原反应分成两个半反应。
②根据原电池的工作原理,结合两个半反应,选择正、负电极材料以及电解质溶液。
较强
正极
三、原电池原理的应用
【展】
例:依据反应2Fe3++2I- = I2+2Fe2+,设计原电池,实现化学能转化为电能,并概括设计原电池的一般思路。
盐桥
C
KI溶液
A
FeCl3溶液
电流计
C
还原反应:2Fe3++2e- = 2Fe2+
氧化反应:2I- - 2e- = I2
分析
氧化反应和
还原反应
选择
电极材料
与电极反应
相对应
选择
正极区、负极区
的电解液
设计原电池的思路
正极
负极
【评】
M、N、P、E四种金属,已知:
①M+N2+ =N+M2+;
②M、P用导线连接放入硫酸氢钠溶液中,M表面有大量气泡逸出;
③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-=E,
N-2e-=N2+。则这种金属的还原性由强到弱的顺序是( )
A.P>M>N>E B.E>N>M>P
C.P>N>M>E D.E>P>M>N
A
【课堂练习5】
【检】
一个完整的氧化还原反应可以拆分,写成两个“半反应”式,一个是“氧化反应”式,一个是“还原反应”式。如氧化还原反应:2FeCl3 + Cu = 2FeCl2 + CuCl2。
(1)可以写成氧化反应:_________________ 还原反应:_________________
(2)请将此反应设计成带盐桥的原电池,画出装置图
盐桥
Cu
FeCl3溶液
A
CuCl2溶液
电流计
C
Cu-2e-=Cu2+
2Fe3++2e-=2Fe2+
【课堂练习6】
【检】
1.写出总反应式并改成离子方程式,
分析化合价升降,找出氧化剂、还原剂及还原产物、氧化产物,确定两极上对应的反应物及产物,定得失及其数目。
负极电极反应式模板:(升)还原剂-ne-= 氧化产物
正极电极反应式模板:(降)氧化剂+ne-= 还原产物
2.根据电解质环境,利用H+(酸性)、OH-(碱性),O2-、CO32-(熔融盐)等使电极反应式电荷守恒。
3.配平电极反应式,利用H2O或其他使电极反应式原子守恒。
三步: 1.列物质,定得失
2.电荷守恒看介质
3.原子守恒
注:电极反应式中若有气体生成,需加“↑”;若有固体生成,一般不标“↓”
四、电极方程式的书写思路
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
2Al + 8OH_ -6e_ = 2AlO2_ + 4H2O
6H2O + 6e_ = 6OH_ + 3H2↑
优先失电子为负极
Mg + H2SO4 = MgSO4 + H2↑
Mg + 2H+ = Mg2+ + H2↑
Mg-2e_ = Mg2+
2H+ + 2e_ = H2↑
总反应:
离子方程式:
负极:
正极:
总反应:
离子方程式:
负极:
正极:
【课堂练习7】
【检】
Al + 4HNO3(稀) = Al(NO3)3 + NO↑ +2H2O
Al∣稀HNO3∣Cu
Al∣浓HNO3∣Cu
Cu + 4H+ + 2NO3-= Cu2+ + 2NO2↑ + 2H2O
Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑ + 2H2O
Cu-2e_ = Cu2+
4H+ + 2NO3- + 2e_= 2NO2↑ + 2H2O
优先失电子为负极
总反应:
离子方程式:
负极:
正极:
总反应:
离子方程式:
负极:
正极:
Al + 4H+ + NO3-= Al3+ + NO↑ + 2H2O
Al-3e_ = Al3+
4H+ + NO3- + 3e_= NO↑ + 2H2O
【课堂练习8】
【检】
原 电 池
一、单液原电池
二、双液原电池及其工作原理
盐桥作用:1、连通电路 2、平衡电荷
缺点:电流不稳定
优点:电流稳定
缺点:电流小
优点:电流大且稳定
三、原电池的应用
四、原电池电极反应式的书写
课堂小结
【评】
第四章 化学反应与电能
第一节 原电池
第1课时 原电池的工作原理
张爷爷自从镶了两颗假牙(一颗金牙、一颗钢牙)后,经常头痛失眠,这是为什么?
【课前引入】
镶假牙后头疼失眠是由电流引起的,那么这里的电流是如何产生的?
【导】
素养目标
重点难点
课标要求 核心素养
1.认识化学能与电能相互转化的实际意义及其重要应用。 2.了解原电池的工作原理,认识从简单原电池发展到带有盐桥原电池的过程变化,并能理解带有盐桥原电池的实用性。 1.以锌铜原电池为例,从宏观和微观的角度,分析理解原电池的工作原理,培养宏观辨识与微观探析的能力。
2.通过对锌铜原电池工作原理的分析,建立对电化学过程的系统分析思路,培养证据推理与模型认知的意识。
了解原电池的工作原理,电极反应式的书写及双液盐桥电池的设计。
【导】
1、概念:把化学能转化为电能的装置。
3、构成要素:
①有两个活泼性不同的电极。
②有电解质溶液或熔融电解质。
③能形成闭合回路。
A
2、本质:
自发进行的氧化还原反应。
两极一液一连线
原 电 池
【知识回顾】
【评】
Zn Cu
Fe C(石墨)
Zn Cu
Zn Cu
下列装置中,能组成原电池的是( )
ABCH
稀H2SO4 CuSO4 溶液 稀H2SO4 稀H2SO4
A B C D
A
A
A
A
A
A
Zn Zn
Fe Cu
Si C(石墨)
A
稀H2SO4 酒精 NaCl溶液 稀H2SO4
E F G H
Zn Cu
【练习】
【检】
Zn
A
Cu
Cu2+
Zn2+
e-
Zn
Cu2+
Cu
SO42-
SO42-
内电路:阳(正)离子移向正极,阴(负)离子移向负极。
外电路:电子由负极经导线流向正极
Cu2+
SO42-
e-
负极
正极
Zn - 2e- = Zn2+
Cu2+ + 2e- = Cu
发生氧化反应
发生还原反应
CuSO4
溶液
Zn
电子不下水
离子不上岸
一、单液原电池原理
【展】
自发的氧化还原反应
氧化反应
还原反应
外电路
内电路
(电子导电)
(离子导电)
电子从负极移向正极
阴离子移向负极
阳离子移向正极
负极
正极
Zn+2H+=Zn2++H2↑
Zn-2e-=Zn2+
2H++2e-=H2↑
电子由锌片移动到铜片
SO42-移向锌片
H+移向铜片
电势差
工作原理
【评】
原电池正、负极的判断
判断方法 负极 正极
①电极材料 较活泼金属 较不活泼金属或石墨
②通入物 通入还原剂的电极 通入氧化剂的电极
③两极反应类型 发生氧化反应的电极 发生还原反应的电极
④电子流向 (或电流方向) 电子流出的电极 (或电流流入的电极) 电子流入的电极
(或电流流出的电极)
⑤离子流向 阴离子流向的电极 阳离子流向的电极
⑥电极质量变化 质量减小的电极 质量增加的电极
⑦有无气泡 — 有气泡产生的电极
【注意】(1)金属的活动性受所处环境的影响。如Mg、Al的活动性:在中性或酸性溶液中活动性Mg>Al;而在碱性溶液中,Al可以与OH-反应,而Mg不反应,所以Mg与Al用导线连接后放入NaOH溶液中,Al是负极,Mg是正极。
(2)Fe、Cu相连,浸入稀HNO3中,Fe作负极;浸在浓HNO3中,Cu作负极(Fe发生钝化)。
【评】
(1)原电池中电流的方向是负极→导线→正极( )
(2)原电池中负极发生的反应是还原反应( )
(3)锌铜原电池中电子由锌电极经过电解质溶液流向铜电极( )
(4)在原电池中阳离子移向正极,阴离子移向负极( )
(5)原电池的正极一定是化学性质不活泼的金属( )
×
×
×
√
×
判断下列说法是否正确。
【课堂练习1】
【检】
如下图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为Zn和碳棒,则X为碳棒,Y为Zn
C.若两电极都是金属,则它们的活动性为X>Y
D.X极上发生的是还原反应,Y极上发生的是氧化反应
C
【课堂练习2】
【检】
单液铜锌原电池实验探究
理论上的现象 实验观察到的现象
锌片逐渐溶解 锌片表面有红色物质生成
铜片上有红色物质析出 铜片上有红色物质析出
电流表指针发生偏转
电流表指针先发生偏转后,示数逐渐减小
分析“锌片表面附着红色固体,电流逐渐衰减” 的原因。
现象 原因
锌片表面附着红色固体
电流逐渐衰减
Zn与Cu2+直接接触发生反应,Zn片、附着在Zn上的Cu以及CuSO4溶液局部形成了原电池,促进了Cu在锌片表面析出。
转移的电子没有经过导线,电流逐渐衰减
【思】
解决问题的关键:还原剂Zn与氧化剂CuSO4不直接接触
该装置能量转化率低的原因是什么?如何解决?
现象:?
原电池装置的改造
【思】
实验探究——双液锌铜原电池
解决问题的关键:还原剂Zn与氧化剂CuSO4不直接接触
该装置能量转化率低的原因是什么?如何解决?
现象:
电流表指针不偏转
原电池装置的改造
【展】
两个溶液间缺少离子导体,无法形成闭合回路。
为什么没有电流?该如何解决?
盐桥
一种凝胶态的离子导体
※资料卡片
盐桥:装有含KCl饱和溶液的琼胶,Cl-、K+可在其中自由移动。
原电池装置的改造
【思】
【展】
实验探究——双液锌铜原电池
有盐桥存在时,电流表指针偏转
取出盐桥,电流表指针不再偏转
ZnSO4溶液
CuSO4溶液
Zn
Cu
A
随着时间的延续,能产生持续稳定的电流
有盐桥存在为什么能产生持续稳定的电流?
【思】
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到锌片全部溶解或CuSO4溶液中的Cu2+几乎完全变成Cu。
在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完成的。取出盐桥,Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+变为Cu,使得SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻止电子从锌片流向铜片,造成电流中断。
双液原电池 解决了电池自放电的损耗问题,
提高了能量转化率,
增加了原电池的使用寿命。
K+
Cl-
e-
Zn2+
Zn
Cu2+
Cu
二、双液原电池原理
Zn - 2e- = Zn2+
Cu2+ + 2e- = Cu
发生氧化反应
发生还原反应
负极
正极
通常是装有含琼胶的KCl 饱和溶液。盐桥中的K+、Cl-是可以自由移动,琼胶的固定作用可以防止KCl溶液直接流出来。
盐桥的作用:
1、使整个装置构成通路,代替两溶液直接接触。(离子通路)
2、平衡电荷。(离子库,可以源源不断的供给需要的离子)
盐桥
【打破思维定势】氧化剂和还原剂不直接接触也能发生反应。
原电池 双液电池 单液电池
电极反应
电极材料
离子导体
电子导体
负极:Zn -2e- Zn2+
正极:Cu2++2e- Cu
正极:铜片;负极:锌片
正极:铜片;负极:锌片
ZnSO4溶液、盐桥、CuSO4溶液
CuSO4 溶液
导线
导线
负极:Zn -2e- Zn2+
正极:Cu2++2e- Cu
对比锌铜原电池
总反应:Cu2+ + Zn Cu+ Zn2+
【评】
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有含KCl饱和溶液的琼胶)构成一个原电池(如下图)。以下有关该原电池的叙述正确的是( )
①在外电路中,电子由铜电极流向银电极
②正极反应为Ag++e- = Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应
与该原电池反应相同
A.只有①② B.①②④ C.只有②③ D.①③④
B
【课堂练习3】
【检】
电流大小:
电流稳定性:
转化效率:
较小
稳定
高
电流大小:
电流稳定性:
转化效率:
较大
衰减快
低
【展】
1、阳离子交换膜:只允许阳离子通过
3、质 子 交 换 膜:只允许H+通过
2、阴离子交换膜:只允许阴离子通过
改进
增大电流呢?
缩短盐桥的长度,增大盐桥的横截面积
能否用一张薄薄的隔膜代替盐桥呢?
双液原电池电流弱的原因?
1.离子运动的距离长
2.离子运动的通道窄
3.离子容量小
Cu
【思】
离子交换膜简介
离子交换膜是一种含离子基团的、对溶液里的离子具有选择透过能力的
高分子膜。
单液原电池
双液原电池
隔膜原电池
隔膜原电池微型化
1.两极
2.电解质溶液
3.导线
4.自发进行的氧化还原反应
电池四要素
—离子导体
—电子导体
归纳小结
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是( )
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c 减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
C
【课堂练习4】
【检】
(1)比较金属的活动性强弱:原电池中,负极一般是活动性 的金属,正极一般是活动性较弱的金属(或其它能导电的物质)。
(2)加快化学反应速率:氧化还原反应形成原电池时,反应速率加快。
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
(3)用于金属的防护:将需要保护的金属制品作原电池的 而受到保护。
钢铁中含有碳,C与Fe组成原电池,发生原电池反应而使钢铁(做负极)遭到腐蚀
(4)设计制作化学电源
①首先将氧化还原反应分成两个半反应。
②根据原电池的工作原理,结合两个半反应,选择正、负电极材料以及电解质溶液。
较强
正极
三、原电池原理的应用
【展】
例:依据反应2Fe3++2I- = I2+2Fe2+,设计原电池,实现化学能转化为电能,并概括设计原电池的一般思路。
盐桥
C
KI溶液
A
FeCl3溶液
电流计
C
还原反应:2Fe3++2e- = 2Fe2+
氧化反应:2I- - 2e- = I2
分析
氧化反应和
还原反应
选择
电极材料
与电极反应
相对应
选择
正极区、负极区
的电解液
设计原电池的思路
正极
负极
【评】
M、N、P、E四种金属,已知:
①M+N2+ =N+M2+;
②M、P用导线连接放入硫酸氢钠溶液中,M表面有大量气泡逸出;
③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-=E,
N-2e-=N2+。则这种金属的还原性由强到弱的顺序是( )
A.P>M>N>E B.E>N>M>P
C.P>N>M>E D.E>P>M>N
A
【课堂练习5】
【检】
一个完整的氧化还原反应可以拆分,写成两个“半反应”式,一个是“氧化反应”式,一个是“还原反应”式。如氧化还原反应:2FeCl3 + Cu = 2FeCl2 + CuCl2。
(1)可以写成氧化反应:_________________ 还原反应:_________________
(2)请将此反应设计成带盐桥的原电池,画出装置图
盐桥
Cu
FeCl3溶液
A
CuCl2溶液
电流计
C
Cu-2e-=Cu2+
2Fe3++2e-=2Fe2+
【课堂练习6】
【检】
1.写出总反应式并改成离子方程式,
分析化合价升降,找出氧化剂、还原剂及还原产物、氧化产物,确定两极上对应的反应物及产物,定得失及其数目。
负极电极反应式模板:(升)还原剂-ne-= 氧化产物
正极电极反应式模板:(降)氧化剂+ne-= 还原产物
2.根据电解质环境,利用H+(酸性)、OH-(碱性),O2-、CO32-(熔融盐)等使电极反应式电荷守恒。
3.配平电极反应式,利用H2O或其他使电极反应式原子守恒。
三步: 1.列物质,定得失
2.电荷守恒看介质
3.原子守恒
注:电极反应式中若有气体生成,需加“↑”;若有固体生成,一般不标“↓”
四、电极方程式的书写思路
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
2Al + 8OH_ -6e_ = 2AlO2_ + 4H2O
6H2O + 6e_ = 6OH_ + 3H2↑
优先失电子为负极
Mg + H2SO4 = MgSO4 + H2↑
Mg + 2H+ = Mg2+ + H2↑
Mg-2e_ = Mg2+
2H+ + 2e_ = H2↑
总反应:
离子方程式:
负极:
正极:
总反应:
离子方程式:
负极:
正极:
【课堂练习7】
【检】
Al + 4HNO3(稀) = Al(NO3)3 + NO↑ +2H2O
Al∣稀HNO3∣Cu
Al∣浓HNO3∣Cu
Cu + 4H+ + 2NO3-= Cu2+ + 2NO2↑ + 2H2O
Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑ + 2H2O
Cu-2e_ = Cu2+
4H+ + 2NO3- + 2e_= 2NO2↑ + 2H2O
优先失电子为负极
总反应:
离子方程式:
负极:
正极:
总反应:
离子方程式:
负极:
正极:
Al + 4H+ + NO3-= Al3+ + NO↑ + 2H2O
Al-3e_ = Al3+
4H+ + NO3- + 3e_= NO↑ + 2H2O
【课堂练习8】
【检】
原 电 池
一、单液原电池
二、双液原电池及其工作原理
盐桥作用:1、连通电路 2、平衡电荷
缺点:电流不稳定
优点:电流稳定
缺点:电流小
优点:电流大且稳定
三、原电池的应用
四、原电池电极反应式的书写
课堂小结
【评】
