化学人教版(2019)选择性必修1 4.1.2化学电源(共41张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.1.2化学电源(共41张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 13.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-27 22:35:11 | ||
图片预览










文档简介
(共41张PPT)
第四章 化学反应与电能
第一节 原电池
第2课时 化学电源
化学史:发明电池的故事
伏特是意大利帕维亚大学的研究电学的物理学家。有一天,伏特看了一位名叫加伐尼的解剖学家的一篇论文,说动物肌肉里贮存着电,可以用金属接触肌肉把电引出来。看了这篇论文,伏特非常兴奋,便决定亲自来做这个实验。他用许多只活青蛙反复实验,终于发现,实际情况并不像加伐尼所说的那样,而是两种不同的金属接触产生的电流,才使蛙腿的肌肉充电而收缩。
为了证明自己的发现是正确的,伏特决定更深入地了解电的来源。
为了纪念他的贡献,人们把电压的计量单位叫做伏特,简称伏,符号V。比如我们手电筒里的电池的电压是1.5伏特,我们家里的电灯的电压是220伏特。
【导】
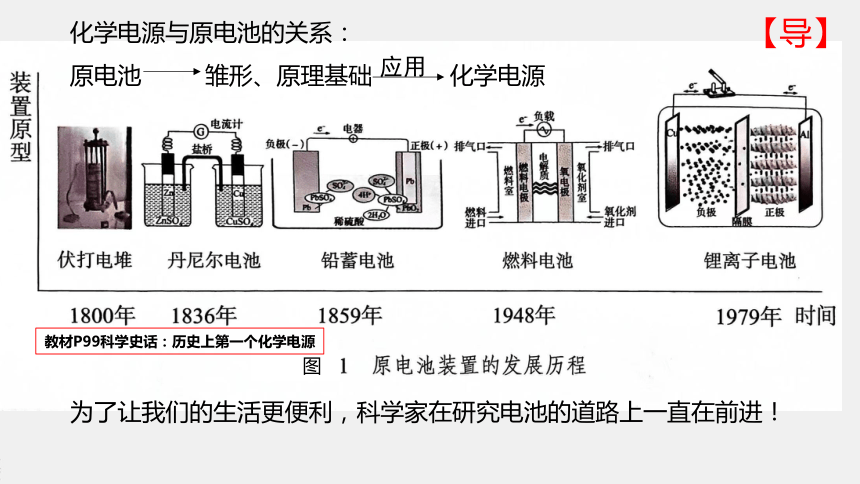
化学电源与原电池的关系:
原电池 雏形、原理基础 化学电源
应用
为了让我们的生活更便利,科学家在研究电池的道路上一直在前进!
图
教材P99科学史话:历史上第一个化学电源
【导】
素养目标
重点难点
课标要求 核心素养
1.了解化学电源的种类及工作原理,知道化学电源在生产、生活和国防中的实际应用; 2.掌握一次电池、二次电池、燃料电池的反应原理,会书写电极反应式; 3.了解新型电池的工作原理。 1.通过对常见化学电池的分析,培养证据推理与模型认知的能力。
2.通过认识新型化学电源的作用及废旧电池对环境的危害,形成科学态度与社会责任意识。
电池反应的方程式和电极反应式的书写
【导】
用途广泛的各种化学电池
为什么电池的用途如此广泛呢?
思考
方便携带、易于维护,能量转换效率高,供能稳定可靠,可以制成各种形状和大小、不同容量和电压的电池和电池组。
【思】
电池优劣的判断标准:
① 比能量
指电池单位质量或单位体积所能输出电能的多少
② 比功率
指电池单位质量或单位体积所能输出功率的大小.
③ 电池的可储存时间的长短
除特殊情况外,质量轻、体积小而输出电能多、功率大、储存时间长的电池,其质量好。
【评】
一次电池:
铅蓄电池、锂离子电池等
氢氧燃料电池
干电池
二次电池:
燃料电池:
(可充电电池)
化学电源的分类
放电后不可再充电。
(干电池)
电解质溶液用淀粉糊固定化,称为干电池。
一次电池
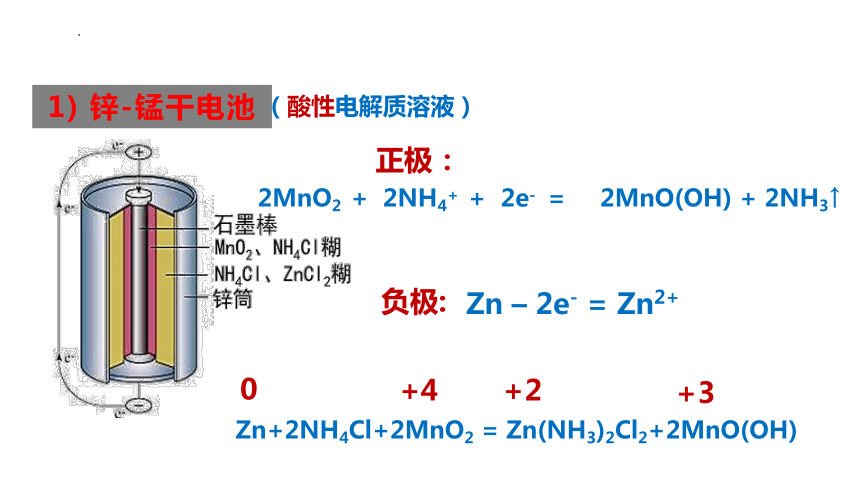
1) 锌-锰干电池
负极:
正极:
Zn – 2e- = Zn2+
(酸性电解质溶液)
2MnO2 + 2NH4+ + 2e- = 2MnO(OH) + 2NH3↑
Zn+2NH4Cl+2MnO2 = Zn(NH3)2Cl2+2MnO(OH)
0
+4
+3
+2
会发生自放电。
放置长时间后
优点:
缺点:
结构简单、价格低廉。
金属外壳
离子型
导电隔膜
Zn粉和
KOH混合物
铜针
2) 锌-锰干电池
(碱性电解质溶液)
Zn - 2e- + 2OH- = Zn(OH)2
2MnO2 + 2e- + 2H2O = 2MnO(OH) + 2OH-
Zn + 2MnO2 + 2H2O = 2MnO(OH) + Zn(OH)2
0
+4
+3
+2
总反应:
正极:
负极:
MnO2
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+ 2MnO2(s) + H2O(l) =Zn(OH)2(s) + Mn2O3(s)
下列说法错误的是……………………………( )
A.电池工作时,锌失去电子
B.电池正极电极反应为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路每通过0.2mole-,理论上减小锌的质量6.5g
C
【课堂练习1】
【检】
正极:
负极:
电解质是KOH
总反应:
(3)锌银电池:
锌银电池比能量___、电压____,储存时间___,适宜____电流连续放电,常制成____式微型电池,广泛用于电子手表、照相机、_____和其他微型电子仪器。
Zn -2e- +2OH-=Zn(OH)2
Ag2O + 2e- + H2O=2Ag+2OH-
Zn + Ag2O + H2O = 2Ag + Zn(OH)2
大
稳定
长
较小
纽扣
手表
银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O=2Ag+Zn(OH)2,下列说法中不正确的是( )
A.工作时,正极上发生反应的物质是Ag2O
B.负极发生的反应是Zn+2OH--2e-=Zn(OH)2
C.工作时,负极区溶液c(OH-)减小
D.溶液中OH-向正极移动,K+、H+向负极移动
D
【课堂练习2】
【检】
优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉。
(又叫充电电池、蓄电池,放电后能充电复原继续使用)
1.铅酸蓄电池
(1)构造:
铅蓄电池的构造
缺点:比能量低、笨重、废弃电池污染环境
(2)组成:
Pb/30%H2SO4溶液/PbO2
二次电池
(3)工作原理:
总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb -2e- + SO42- =PbSO4
正极:
PbO2 +2e- + 4H++SO42-=PbSO4 +2H2O
氧化反应
还原反应
负极:
①放电过程:
铅蓄电池充电的反应则是上述反应的逆过程
②充电过程:
PbSO4 +2e- =Pb + SO42-
还原反应
阴极(接负极):
阳极(接正极):
PbSO4 -2e- +2H2O = PbO2 + 4H++ SO42-
氧化反应
总反应:
2PbSO4+2H2O=Pb+PbO2+2H2SO4
充放电过程:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
正接正作阳极,负接负阴极
可逆反应?
放电:化学能转化为电能
充电:电能转化为化学能
~转2e-
关于铅蓄电池放电时的说法正确的( )
A.电池的负极材料是铅板
B.正极发生的反应是 Pb +SO42--2e-= PbSO4
C.电池中硫酸的浓度不发生变化
D.负极质量减少、正极质量增加
A
【课堂练习3】
【检】
2.镍氢电池
圆柱可充镍氢电池
方形可充镍氢电池
能量密度高;无镉污染,是一种绿色电池;可大电流快速充放电;电池工作电压为1.2V;在小型便携电子器件、电动工具、电动车辆和混合动力车上逐步得到应用。
优点:
H2 + 2NiOOH 2Ni(OH)2
放电
充电
正极:
负极:
放电
阳极:
阴极:
充电
总反应:
H2 - 2e- + 2OH- = 2H2O
2NiOOH +2 e- + 2H2O = 2Ni(OH)2 +2 OH-
2H2O +2 e- = H2 + 2OH-
2 Ni(OH)2 -2 e- + 2OH-= 2NiOOH +2 H2O
氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是 H2+2NiO(OH) 2Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,H2在负极上反应
CD
负极:H2+2OH--2e- = 2H2O
正极:2NiO(OH)+2H2O+2e- = 2Ni(OH)2+2OH-
【课堂练习4】
(双选)
【检】
3.锂离子电池
总反应:
正极:
负极:
放电
阳极:
阴极:
充电
LixC6 +Li1-xCoO2 LiCoO2+6C
放电
充电
负极材料:嵌锂层状石墨(LixC6 )
正极材料:钴酸锂(Li1-xCoO2)
电解液:锂导电有机电解液
LixC6 - xe-= 6C+xLi+
Li1-xCoO2+xe-+xLi =LiCoO2
6C+xe-+xLi+=LixC6
LiCoO2-xe- =Li1-xCoO2+xLi+
放电时,Li+从石墨中脱嵌移向正极,嵌入钴酸锂晶体中,
充电时,Li+从钴酸锂晶体中脱嵌,由正极回到负极,嵌入石墨中。
这样在放电、充电时,锂离子往返于电池的正极、负极之间完成化学能与电能的相互转化。
锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池,某种锂电池的总反应为Li +MnO2=LiMnO2,下列说法正确的是( )
A、Li是正极,电极反应为 Li-e- =Li+
B、Li是负极,电极反应为 Li-e- =Li+
C、Li是负极,电极反应为 MnO2 +e-=MnO2 –
D、Li是负极,电极反应为 Li-2e- = Li2+
B
【课堂练习5】
【检】
一种连续将燃料和氧化剂的化学能直接转换成电能的化学电池。电池的电极本身不包含活性物质,只是一个催化转化元件。工作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生成物不断地被排除,于是电池就连续不断地提供电能。清洁、能量转换率高的特点。
可供选择的燃料很多,如:氢气、烃类、肼、甲醇、氨、煤气等液态或气态的燃料。
燃料电池
氢氧燃料电池动力的法国产标致TAXI
同济大学研制的燃料电池汽车-超越3号
我国自主研发的燃料电池车
神舟六号燃料电池发电系统
燃料电池的应用
1、氢氧燃料电池——酸性
H2、O2/酸性
负极 电极 还原剂 氧化产物 电极反应式
正极 电极 氧化剂 还原产物 电极反应式
总反应式:
Pt
H2
H+
2H2- 4e-=4H+
Pt
O2
H2O
O2+4H++4e-=2H2O
2H2 + O2=2H2O
【展】
H2、O2/碱性
负极 电极 还原剂 氧化产物 电极反应式
正极 电极 氧化剂 还原产物 电极反应式
总反应式:
2、氢氧燃料电池——碱性
Pt
H2
H2O
2H2- 4e-+4OH-=4H2O
Pt
O2
OH-
O2+4e-+2H2O=4OH-
2H2 + O2=2H2O
【展】
介质 电池反应:
负极
正极
负极
正极
2H2 - 4e- = 4H+
O2 + 4H+ + 4e-= 2H2O
2H2 - 4e- +2O2-= 2H2O
O2 + 4e-= 2O2-
2H2 +O2 = 2H2O
3、氢氧燃料电池——高温传导O2-
【展】
一极通入H2,一极通入空气和CO2混合气体,以Li2CO3和Na2CO3的熔融盐作电解质。
负 极:
正 极:
总反应式:
4、氢氧燃料电池——熔融碳酸盐
2H2+2CO32--4e-=2CO2 +2H2O
O2+2CO2+4e-=2CO32-
2H2 + O2=2H2O
【展】
氢氧燃料电池是符合绿色化学理念的新型发电装置。关于以KOH为电解质的氢氧燃料电池叙述错误的是( )
A、氢氧燃料电池直接把热能转化为电能
B、电子从负极出发,沿导线流向正极
C、负极反应式为H2+2OH--2e- =2H2O
D、电解质 KOH的物质的量不发生变化
A
【课堂练习6】
【检】
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是( )
A.电池的总反应是:2C4H10+13O2→8CO2+10H2O
B.在熔融电解质中,O2-由负极移向正极
C.通入空气一极是正极,电极反应为:O2+4e-=2O2-
D.通入丁烷一极是正极,电极反应为:C4H10+26e-+13O2-=4CO2+5H2O
AC
【课堂练习7】
(双选)
【检】
找还原剂
写出稳定的电极产物
找正负
使守恒
看环境
相加减
②电荷守恒
③原子守恒
①电子守恒
正极+负极=总反应式
找氧化剂
酸性补H+
碱性补OH-
给什么补什么
电极反应式的书写
【评】
酸性
碱性
H2O
OH-
O2-
含氧酸
根离子
熔融氧化物
熔融盐
H2-2e-=2H+
H2-2e-+2OH-=2H2O
H+
H2O
酸性
碱性
我们该如何准确找出稳定电极产物呢?
H2
O2
O2+4e-+2H2O=4OH-
O2+4e-+4H+=2H2O
O2+4e-=2O2-
O2+4e-+2CO2=2CO32-
(1)甲烷-氧气燃料电池
负极:
正极:
总反应式:
电解质为H2SO4溶液
写出下列甲烷燃料电池的电极反应式及总反应式。
CH4 - 8e-+ 2H2O = CO2 +8H+
2O2 + 8e- + 8H+ = 4H2O
CH4 + 2O2 = CO2+ 2H2O
【课堂练习8】
【检】
(2)甲烷-氧气燃料电池
负极:
正极:
总反应式:
电解质为KOH溶液
CH4 - 8e- + 10OH- = CO32- + 7H2O
2O2 + 8e- + 4H2O = 8OH-
CH4+2O2+2OH -=CO32-+3H2O
【检】
(3)甲烷-氧气燃料电池
负极:
正极:
总反应式:
电解质为熔融氧化物(高温下能传导O2-)
CH4 - 8e-+ 4O2- = CO2 + 2H2O
2O2 + 8e- = 4O2-
CH4 + 2O2 = CO2+ 2H2O
【检】
(4)甲烷-氧气燃料电池
负极:
正极:
总反应式:
电解质为熔融碳酸盐(熔融K2CO3)
CH4 - 8e-+ 4CO32- = 5CO2 + 2H2O
2O2 + 8e- +4CO2 = 4CO32-
CH4 + 2O2 = CO2+ 2H2O
【检】
负极:
正极:
总反应式:
2CH3OH - 12e- + 16OH- = 1CO32- + 12H2O
3O2 + 12e- + 6H2O = 12OH-
2CH3OH +3O2 + 4OH-=2CO32- +6H2O
写出甲醇燃料电池的电极反应式及总反应式 (电解质为KOH溶液)
【课堂练习9】
【检】
减少污染、节约资源
电池中含有大量的重金属如锌、铅、镉、汞、锰等。据专家测试,一节纽扣电池能污染60万升水;一节一号电池烂在地里,能使一平方米的土地失去利用价值。若将废旧电池混入生活垃圾一起填埋,渗出的重金属物质就会渗透土壤、污染地下水,进而进入鱼类、农作物等,破坏人类的生存环境,间接威胁到人类的健康,有的还能致癌。所以我们不要乱扔电池,要及时回收。
太阳能电池
将太阳能转换成电能的装置
原子能电池
将放射性同位素自然衰变时产生的热能通过热电转换器转变为电能的装置
用于“神六”的太阳能电池
普通锌锰干电池
将放射性同位素自然衰变时产生的热能通过热电转换器转变为电能的装置
电池
一次电池
碱性锌锰电池
锌银纽扣电池
构造
组成
优点
缺点
应用
正极
负极
总反应
二次电池
燃料电池
铅蓄电池
H2、甲烷、丁烷、甲醇、肼于酸性、碱性、熔融氧化物及碳酸盐介质中
锂离子电池
镍氢电池
将化学能转换成电能的装置
太阳能电池
原子能电池
将太阳能转换成电能的装置
化学电池
电极方程式书写方法的渗透
锂金属电池
三步法
1.列物质,找升降
2.看介质,配电荷
3.巧用水(或其他),配原子
课堂小结
【评】
第四章 化学反应与电能
第一节 原电池
第2课时 化学电源
化学史:发明电池的故事
伏特是意大利帕维亚大学的研究电学的物理学家。有一天,伏特看了一位名叫加伐尼的解剖学家的一篇论文,说动物肌肉里贮存着电,可以用金属接触肌肉把电引出来。看了这篇论文,伏特非常兴奋,便决定亲自来做这个实验。他用许多只活青蛙反复实验,终于发现,实际情况并不像加伐尼所说的那样,而是两种不同的金属接触产生的电流,才使蛙腿的肌肉充电而收缩。
为了证明自己的发现是正确的,伏特决定更深入地了解电的来源。
为了纪念他的贡献,人们把电压的计量单位叫做伏特,简称伏,符号V。比如我们手电筒里的电池的电压是1.5伏特,我们家里的电灯的电压是220伏特。
【导】
化学电源与原电池的关系:
原电池 雏形、原理基础 化学电源
应用
为了让我们的生活更便利,科学家在研究电池的道路上一直在前进!
图
教材P99科学史话:历史上第一个化学电源
【导】
素养目标
重点难点
课标要求 核心素养
1.了解化学电源的种类及工作原理,知道化学电源在生产、生活和国防中的实际应用; 2.掌握一次电池、二次电池、燃料电池的反应原理,会书写电极反应式; 3.了解新型电池的工作原理。 1.通过对常见化学电池的分析,培养证据推理与模型认知的能力。
2.通过认识新型化学电源的作用及废旧电池对环境的危害,形成科学态度与社会责任意识。
电池反应的方程式和电极反应式的书写
【导】
用途广泛的各种化学电池
为什么电池的用途如此广泛呢?
思考
方便携带、易于维护,能量转换效率高,供能稳定可靠,可以制成各种形状和大小、不同容量和电压的电池和电池组。
【思】
电池优劣的判断标准:
① 比能量
指电池单位质量或单位体积所能输出电能的多少
② 比功率
指电池单位质量或单位体积所能输出功率的大小.
③ 电池的可储存时间的长短
除特殊情况外,质量轻、体积小而输出电能多、功率大、储存时间长的电池,其质量好。
【评】
一次电池:
铅蓄电池、锂离子电池等
氢氧燃料电池
干电池
二次电池:
燃料电池:
(可充电电池)
化学电源的分类
放电后不可再充电。
(干电池)
电解质溶液用淀粉糊固定化,称为干电池。
一次电池
1) 锌-锰干电池
负极:
正极:
Zn – 2e- = Zn2+
(酸性电解质溶液)
2MnO2 + 2NH4+ + 2e- = 2MnO(OH) + 2NH3↑
Zn+2NH4Cl+2MnO2 = Zn(NH3)2Cl2+2MnO(OH)
0
+4
+3
+2
会发生自放电。
放置长时间后
优点:
缺点:
结构简单、价格低廉。
金属外壳
离子型
导电隔膜
Zn粉和
KOH混合物
铜针
2) 锌-锰干电池
(碱性电解质溶液)
Zn - 2e- + 2OH- = Zn(OH)2
2MnO2 + 2e- + 2H2O = 2MnO(OH) + 2OH-
Zn + 2MnO2 + 2H2O = 2MnO(OH) + Zn(OH)2
0
+4
+3
+2
总反应:
正极:
负极:
MnO2
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+ 2MnO2(s) + H2O(l) =Zn(OH)2(s) + Mn2O3(s)
下列说法错误的是……………………………( )
A.电池工作时,锌失去电子
B.电池正极电极反应为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路每通过0.2mole-,理论上减小锌的质量6.5g
C
【课堂练习1】
【检】
正极:
负极:
电解质是KOH
总反应:
(3)锌银电池:
锌银电池比能量___、电压____,储存时间___,适宜____电流连续放电,常制成____式微型电池,广泛用于电子手表、照相机、_____和其他微型电子仪器。
Zn -2e- +2OH-=Zn(OH)2
Ag2O + 2e- + H2O=2Ag+2OH-
Zn + Ag2O + H2O = 2Ag + Zn(OH)2
大
稳定
长
较小
纽扣
手表
银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O=2Ag+Zn(OH)2,下列说法中不正确的是( )
A.工作时,正极上发生反应的物质是Ag2O
B.负极发生的反应是Zn+2OH--2e-=Zn(OH)2
C.工作时,负极区溶液c(OH-)减小
D.溶液中OH-向正极移动,K+、H+向负极移动
D
【课堂练习2】
【检】
优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉。
(又叫充电电池、蓄电池,放电后能充电复原继续使用)
1.铅酸蓄电池
(1)构造:
铅蓄电池的构造
缺点:比能量低、笨重、废弃电池污染环境
(2)组成:
Pb/30%H2SO4溶液/PbO2
二次电池
(3)工作原理:
总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb -2e- + SO42- =PbSO4
正极:
PbO2 +2e- + 4H++SO42-=PbSO4 +2H2O
氧化反应
还原反应
负极:
①放电过程:
铅蓄电池充电的反应则是上述反应的逆过程
②充电过程:
PbSO4 +2e- =Pb + SO42-
还原反应
阴极(接负极):
阳极(接正极):
PbSO4 -2e- +2H2O = PbO2 + 4H++ SO42-
氧化反应
总反应:
2PbSO4+2H2O=Pb+PbO2+2H2SO4
充放电过程:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
正接正作阳极,负接负阴极
可逆反应?
放电:化学能转化为电能
充电:电能转化为化学能
~转2e-
关于铅蓄电池放电时的说法正确的( )
A.电池的负极材料是铅板
B.正极发生的反应是 Pb +SO42--2e-= PbSO4
C.电池中硫酸的浓度不发生变化
D.负极质量减少、正极质量增加
A
【课堂练习3】
【检】
2.镍氢电池
圆柱可充镍氢电池
方形可充镍氢电池
能量密度高;无镉污染,是一种绿色电池;可大电流快速充放电;电池工作电压为1.2V;在小型便携电子器件、电动工具、电动车辆和混合动力车上逐步得到应用。
优点:
H2 + 2NiOOH 2Ni(OH)2
放电
充电
正极:
负极:
放电
阳极:
阴极:
充电
总反应:
H2 - 2e- + 2OH- = 2H2O
2NiOOH +2 e- + 2H2O = 2Ni(OH)2 +2 OH-
2H2O +2 e- = H2 + 2OH-
2 Ni(OH)2 -2 e- + 2OH-= 2NiOOH +2 H2O
氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是 H2+2NiO(OH) 2Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,H2在负极上反应
CD
负极:H2+2OH--2e- = 2H2O
正极:2NiO(OH)+2H2O+2e- = 2Ni(OH)2+2OH-
【课堂练习4】
(双选)
【检】
3.锂离子电池
总反应:
正极:
负极:
放电
阳极:
阴极:
充电
LixC6 +Li1-xCoO2 LiCoO2+6C
放电
充电
负极材料:嵌锂层状石墨(LixC6 )
正极材料:钴酸锂(Li1-xCoO2)
电解液:锂导电有机电解液
LixC6 - xe-= 6C+xLi+
Li1-xCoO2+xe-+xLi =LiCoO2
6C+xe-+xLi+=LixC6
LiCoO2-xe- =Li1-xCoO2+xLi+
放电时,Li+从石墨中脱嵌移向正极,嵌入钴酸锂晶体中,
充电时,Li+从钴酸锂晶体中脱嵌,由正极回到负极,嵌入石墨中。
这样在放电、充电时,锂离子往返于电池的正极、负极之间完成化学能与电能的相互转化。
锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池,某种锂电池的总反应为Li +MnO2=LiMnO2,下列说法正确的是( )
A、Li是正极,电极反应为 Li-e- =Li+
B、Li是负极,电极反应为 Li-e- =Li+
C、Li是负极,电极反应为 MnO2 +e-=MnO2 –
D、Li是负极,电极反应为 Li-2e- = Li2+
B
【课堂练习5】
【检】
一种连续将燃料和氧化剂的化学能直接转换成电能的化学电池。电池的电极本身不包含活性物质,只是一个催化转化元件。工作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生成物不断地被排除,于是电池就连续不断地提供电能。清洁、能量转换率高的特点。
可供选择的燃料很多,如:氢气、烃类、肼、甲醇、氨、煤气等液态或气态的燃料。
燃料电池
氢氧燃料电池动力的法国产标致TAXI
同济大学研制的燃料电池汽车-超越3号
我国自主研发的燃料电池车
神舟六号燃料电池发电系统
燃料电池的应用
1、氢氧燃料电池——酸性
H2、O2/酸性
负极 电极 还原剂 氧化产物 电极反应式
正极 电极 氧化剂 还原产物 电极反应式
总反应式:
Pt
H2
H+
2H2- 4e-=4H+
Pt
O2
H2O
O2+4H++4e-=2H2O
2H2 + O2=2H2O
【展】
H2、O2/碱性
负极 电极 还原剂 氧化产物 电极反应式
正极 电极 氧化剂 还原产物 电极反应式
总反应式:
2、氢氧燃料电池——碱性
Pt
H2
H2O
2H2- 4e-+4OH-=4H2O
Pt
O2
OH-
O2+4e-+2H2O=4OH-
2H2 + O2=2H2O
【展】
介质 电池反应:
负极
正极
负极
正极
2H2 - 4e- = 4H+
O2 + 4H+ + 4e-= 2H2O
2H2 - 4e- +2O2-= 2H2O
O2 + 4e-= 2O2-
2H2 +O2 = 2H2O
3、氢氧燃料电池——高温传导O2-
【展】
一极通入H2,一极通入空气和CO2混合气体,以Li2CO3和Na2CO3的熔融盐作电解质。
负 极:
正 极:
总反应式:
4、氢氧燃料电池——熔融碳酸盐
2H2+2CO32--4e-=2CO2 +2H2O
O2+2CO2+4e-=2CO32-
2H2 + O2=2H2O
【展】
氢氧燃料电池是符合绿色化学理念的新型发电装置。关于以KOH为电解质的氢氧燃料电池叙述错误的是( )
A、氢氧燃料电池直接把热能转化为电能
B、电子从负极出发,沿导线流向正极
C、负极反应式为H2+2OH--2e- =2H2O
D、电解质 KOH的物质的量不发生变化
A
【课堂练习6】
【检】
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是( )
A.电池的总反应是:2C4H10+13O2→8CO2+10H2O
B.在熔融电解质中,O2-由负极移向正极
C.通入空气一极是正极,电极反应为:O2+4e-=2O2-
D.通入丁烷一极是正极,电极反应为:C4H10+26e-+13O2-=4CO2+5H2O
AC
【课堂练习7】
(双选)
【检】
找还原剂
写出稳定的电极产物
找正负
使守恒
看环境
相加减
②电荷守恒
③原子守恒
①电子守恒
正极+负极=总反应式
找氧化剂
酸性补H+
碱性补OH-
给什么补什么
电极反应式的书写
【评】
酸性
碱性
H2O
OH-
O2-
含氧酸
根离子
熔融氧化物
熔融盐
H2-2e-=2H+
H2-2e-+2OH-=2H2O
H+
H2O
酸性
碱性
我们该如何准确找出稳定电极产物呢?
H2
O2
O2+4e-+2H2O=4OH-
O2+4e-+4H+=2H2O
O2+4e-=2O2-
O2+4e-+2CO2=2CO32-
(1)甲烷-氧气燃料电池
负极:
正极:
总反应式:
电解质为H2SO4溶液
写出下列甲烷燃料电池的电极反应式及总反应式。
CH4 - 8e-+ 2H2O = CO2 +8H+
2O2 + 8e- + 8H+ = 4H2O
CH4 + 2O2 = CO2+ 2H2O
【课堂练习8】
【检】
(2)甲烷-氧气燃料电池
负极:
正极:
总反应式:
电解质为KOH溶液
CH4 - 8e- + 10OH- = CO32- + 7H2O
2O2 + 8e- + 4H2O = 8OH-
CH4+2O2+2OH -=CO32-+3H2O
【检】
(3)甲烷-氧气燃料电池
负极:
正极:
总反应式:
电解质为熔融氧化物(高温下能传导O2-)
CH4 - 8e-+ 4O2- = CO2 + 2H2O
2O2 + 8e- = 4O2-
CH4 + 2O2 = CO2+ 2H2O
【检】
(4)甲烷-氧气燃料电池
负极:
正极:
总反应式:
电解质为熔融碳酸盐(熔融K2CO3)
CH4 - 8e-+ 4CO32- = 5CO2 + 2H2O
2O2 + 8e- +4CO2 = 4CO32-
CH4 + 2O2 = CO2+ 2H2O
【检】
负极:
正极:
总反应式:
2CH3OH - 12e- + 16OH- = 1CO32- + 12H2O
3O2 + 12e- + 6H2O = 12OH-
2CH3OH +3O2 + 4OH-=2CO32- +6H2O
写出甲醇燃料电池的电极反应式及总反应式 (电解质为KOH溶液)
【课堂练习9】
【检】
减少污染、节约资源
电池中含有大量的重金属如锌、铅、镉、汞、锰等。据专家测试,一节纽扣电池能污染60万升水;一节一号电池烂在地里,能使一平方米的土地失去利用价值。若将废旧电池混入生活垃圾一起填埋,渗出的重金属物质就会渗透土壤、污染地下水,进而进入鱼类、农作物等,破坏人类的生存环境,间接威胁到人类的健康,有的还能致癌。所以我们不要乱扔电池,要及时回收。
太阳能电池
将太阳能转换成电能的装置
原子能电池
将放射性同位素自然衰变时产生的热能通过热电转换器转变为电能的装置
用于“神六”的太阳能电池
普通锌锰干电池
将放射性同位素自然衰变时产生的热能通过热电转换器转变为电能的装置
电池
一次电池
碱性锌锰电池
锌银纽扣电池
构造
组成
优点
缺点
应用
正极
负极
总反应
二次电池
燃料电池
铅蓄电池
H2、甲烷、丁烷、甲醇、肼于酸性、碱性、熔融氧化物及碳酸盐介质中
锂离子电池
镍氢电池
将化学能转换成电能的装置
太阳能电池
原子能电池
将太阳能转换成电能的装置
化学电池
电极方程式书写方法的渗透
锂金属电池
三步法
1.列物质,找升降
2.看介质,配电荷
3.巧用水(或其他),配原子
课堂小结
【评】
