第八单元 课题2 第1课时 金属与氧气、酸的反应-【优质课件】2022-2023学年九年级化学下册同步精品课件(人教版)
文档属性
| 名称 | 第八单元 课题2 第1课时 金属与氧气、酸的反应-【优质课件】2022-2023学年九年级化学下册同步精品课件(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-29 22:49:48 | ||
图片预览




文档简介
(共14张PPT)
第八单元 金属和金属材料
课题2 金属的化学性质
(第1课时)
金属材料的发展
青铜器
铁器
铝器
导入新课
思考:
为什么铝有这么好的抗腐蚀性能呢?(化学性质)
铝器
4Al + 3O2 === 2Al2O3
铝在常温下和能氧气发生反应,生成一层致密的氧化铝薄膜,从而防止铝被腐蚀,因此铝具有很好的抗腐蚀性。
知识点1 金属和氧气的反应
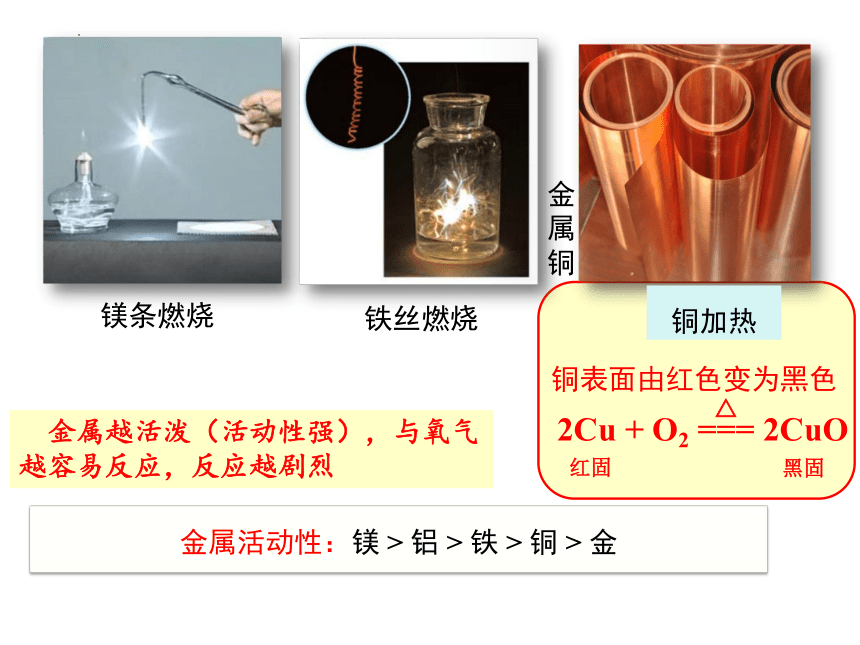
镁条燃烧
铁丝燃烧
金属铜
铜加热
铜表面由红色变为黑色
2Cu + O2 === 2CuO
△
红固
黑固
金属越活泼(活动性强),与氧气越容易反应,反应越剧烈
金属活动性:镁 > 铝 > 铁 > 铜 > 金
许多金属都能与氧气反应,但反应的难易和剧烈程度不同。
1.镁、铝在常温下就能与氧气反应;
2.铁、铜在常温下几乎不与氧气反应,但在点燃或加热时能与氧气反应;
3.金在高温下也不与氧气反应(真金不怕火炼)。
化学性质
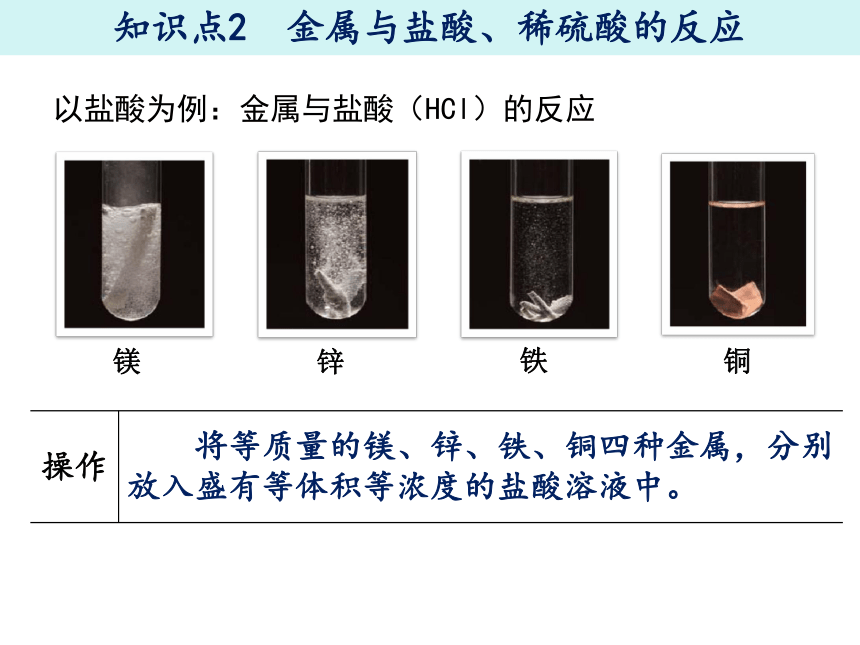
以盐酸为例:金属与盐酸(HCl)的反应
知识点2 金属与盐酸、稀硫酸的反应
操作
镁
锌
铁
铜
将等质量的镁、锌、铁、铜四种金属,分别放入盛有等体积等浓度的盐酸溶液中。
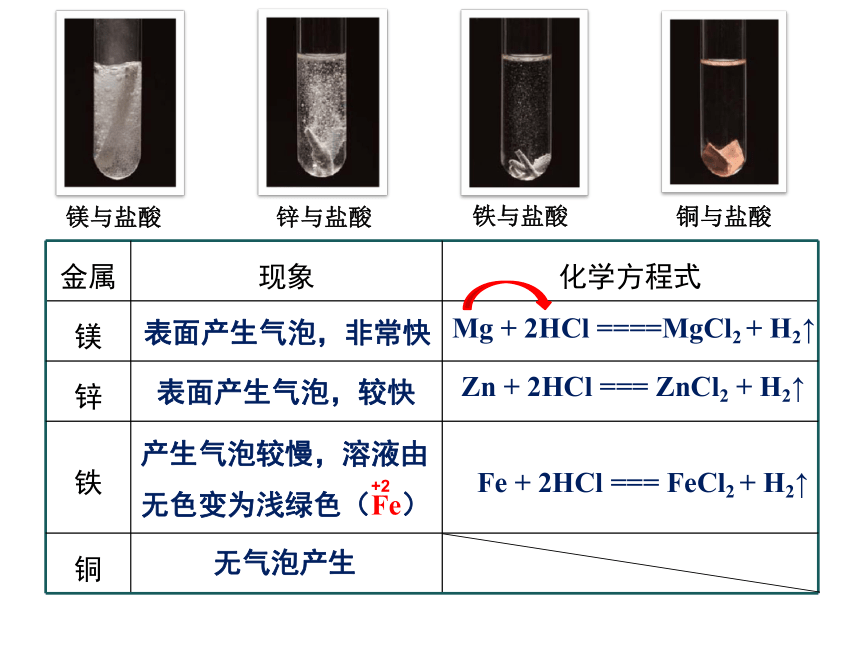
金属 现象 化学方程式
镁
锌
铁
铜
表面产生气泡,非常快
表面产生气泡,较快
产生气泡较慢,溶液由无色变为浅绿色(Fe)
无气泡产生
Mg + 2HCl ====MgCl2 + H2↑
Zn + 2HCl === ZnCl2 + H2↑
Fe + 2HCl === FeCl2 + H2↑
镁与盐酸
锌与盐酸
铁与盐酸
铜与盐酸
+2
金属越活泼(活动性强),与酸越容易反应,反应越剧烈
金属活动性: 镁 > 锌 > 铁 > 铜
2.判断金属活动性的方法二:
根据金属是否与盐酸或稀硫酸反应,以及反应的剧烈程度判断。
小结
1.判断金属活动性的方法一:
根据金属与氧气反应的难易程度或者反应的剧烈程度进行判断。
3.金属的活动性顺序:
强 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 弱
钾钙钠镁铝、锌铁锡铅(氢)、铜汞银铂金
强 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 弱
氢前金属可置换氢
Mg + 2HCl == MgCl2 + H2↑
Fe + 2HCl == FeCl2 + H2↑
Zn + 2HCl == ZnCl2 + H2↑
置换反应:一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。A+BC===B+AC
单质
单质
化合物
化合物
讲授新课
这四个化学方程式
有什么特点?
规律:金属与H元素换位置,置换出氢气H2
Mg + H2SO4 == MgSO4 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
Zn + H2SO4 == ZnSO4 + H2↑
2Al + 3H2SO4 == Al2(SO4)3 + 3H2↑
写出镁Mg、铁Fe、锌Zn、铝Al与硫酸H2SO4的置换反应:
0 +1 -2 +2 -2 0
0 +1 -2 +2 -2 0
0 +1 -2 +2 -2 0
0 +1 -2 +3 -2 0
化合价:
单质(金属和氢气)为0价,化合物元素(H正1,Mg、Zn正2、Al正3)背口诀,SO4 是原子团看作一个整体为-2价。
【回顾】化学反应基本类型
化合反应
分解反应
置换反应
A+B==AB
CaO+H2O===Ca(OH)2
A==B+C +D
C +O2===CO2
点燃
KMnO4===K2MnO4+MnO2+O2↑
△
讲授新课
A+BC===B+AC
由两种或两种以上物质生成另一种物质的反应
由一种反应物生成两种或两种以上其他物质的反应
一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。
置换反应的字母表示:
A+B===C+D
A+BC===B+AC
×
√
必须要单质和化合物变成另一种单质和化合物
【判断】是不是置换反应?
H2 + CuO === Cu + H2O
C + CuO === Cu + CO2
CO + CuO === Cu + CO2
△
△
△
单质 化合物 单质 化合物
单质 化合物 单质 化合物
单质 化合物 单质 化合物
置换反应
置换反应
不是
◆ 金属的化学性质:
1.能与氧气反应
2.能与稀盐酸(稀硫酸)反应
(金属越活泼,反应越容易,越剧烈)
◆ 置换反应
A+BC===B+AC
◆ 金属活动性
Mg > Zn > Fe > (H)> Cu
课堂小结
第八单元 金属和金属材料
课题2 金属的化学性质
(第1课时)
金属材料的发展
青铜器
铁器
铝器
导入新课
思考:
为什么铝有这么好的抗腐蚀性能呢?(化学性质)
铝器
4Al + 3O2 === 2Al2O3
铝在常温下和能氧气发生反应,生成一层致密的氧化铝薄膜,从而防止铝被腐蚀,因此铝具有很好的抗腐蚀性。
知识点1 金属和氧气的反应
镁条燃烧
铁丝燃烧
金属铜
铜加热
铜表面由红色变为黑色
2Cu + O2 === 2CuO
△
红固
黑固
金属越活泼(活动性强),与氧气越容易反应,反应越剧烈
金属活动性:镁 > 铝 > 铁 > 铜 > 金
许多金属都能与氧气反应,但反应的难易和剧烈程度不同。
1.镁、铝在常温下就能与氧气反应;
2.铁、铜在常温下几乎不与氧气反应,但在点燃或加热时能与氧气反应;
3.金在高温下也不与氧气反应(真金不怕火炼)。
化学性质
以盐酸为例:金属与盐酸(HCl)的反应
知识点2 金属与盐酸、稀硫酸的反应
操作
镁
锌
铁
铜
将等质量的镁、锌、铁、铜四种金属,分别放入盛有等体积等浓度的盐酸溶液中。
金属 现象 化学方程式
镁
锌
铁
铜
表面产生气泡,非常快
表面产生气泡,较快
产生气泡较慢,溶液由无色变为浅绿色(Fe)
无气泡产生
Mg + 2HCl ====MgCl2 + H2↑
Zn + 2HCl === ZnCl2 + H2↑
Fe + 2HCl === FeCl2 + H2↑
镁与盐酸
锌与盐酸
铁与盐酸
铜与盐酸
+2
金属越活泼(活动性强),与酸越容易反应,反应越剧烈
金属活动性: 镁 > 锌 > 铁 > 铜
2.判断金属活动性的方法二:
根据金属是否与盐酸或稀硫酸反应,以及反应的剧烈程度判断。
小结
1.判断金属活动性的方法一:
根据金属与氧气反应的难易程度或者反应的剧烈程度进行判断。
3.金属的活动性顺序:
强 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 弱
钾钙钠镁铝、锌铁锡铅(氢)、铜汞银铂金
强 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 弱
氢前金属可置换氢
Mg + 2HCl == MgCl2 + H2↑
Fe + 2HCl == FeCl2 + H2↑
Zn + 2HCl == ZnCl2 + H2↑
置换反应:一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。A+BC===B+AC
单质
单质
化合物
化合物
讲授新课
这四个化学方程式
有什么特点?
规律:金属与H元素换位置,置换出氢气H2
Mg + H2SO4 == MgSO4 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
Zn + H2SO4 == ZnSO4 + H2↑
2Al + 3H2SO4 == Al2(SO4)3 + 3H2↑
写出镁Mg、铁Fe、锌Zn、铝Al与硫酸H2SO4的置换反应:
0 +1 -2 +2 -2 0
0 +1 -2 +2 -2 0
0 +1 -2 +2 -2 0
0 +1 -2 +3 -2 0
化合价:
单质(金属和氢气)为0价,化合物元素(H正1,Mg、Zn正2、Al正3)背口诀,SO4 是原子团看作一个整体为-2价。
【回顾】化学反应基本类型
化合反应
分解反应
置换反应
A+B==AB
CaO+H2O===Ca(OH)2
A==B+C +D
C +O2===CO2
点燃
KMnO4===K2MnO4+MnO2+O2↑
△
讲授新课
A+BC===B+AC
由两种或两种以上物质生成另一种物质的反应
由一种反应物生成两种或两种以上其他物质的反应
一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。
置换反应的字母表示:
A+B===C+D
A+BC===B+AC
×
√
必须要单质和化合物变成另一种单质和化合物
【判断】是不是置换反应?
H2 + CuO === Cu + H2O
C + CuO === Cu + CO2
CO + CuO === Cu + CO2
△
△
△
单质 化合物 单质 化合物
单质 化合物 单质 化合物
单质 化合物 单质 化合物
置换反应
置换反应
不是
◆ 金属的化学性质:
1.能与氧气反应
2.能与稀盐酸(稀硫酸)反应
(金属越活泼,反应越容易,越剧烈)
◆ 置换反应
A+BC===B+AC
◆ 金属活动性
Mg > Zn > Fe > (H)> Cu
课堂小结
同课章节目录
