第九单元 课题3 溶液的浓度-【优质课件22页】2022-2023学年九年级化学下册同步精品课件(人教版)
文档属性
| 名称 | 第九单元 课题3 溶液的浓度-【优质课件22页】2022-2023学年九年级化学下册同步精品课件(人教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 395.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 00:00:00 | ||
图片预览






文档简介
(共22张PPT)
第九单元 溶液
课题3 溶液的浓度
52%
酒类的酒精度
导入新课
10%
葡萄糖注射液的浓度
100g酒精溶液中溶解有52g酒精
100g葡萄糖溶液中溶解有10g葡萄糖
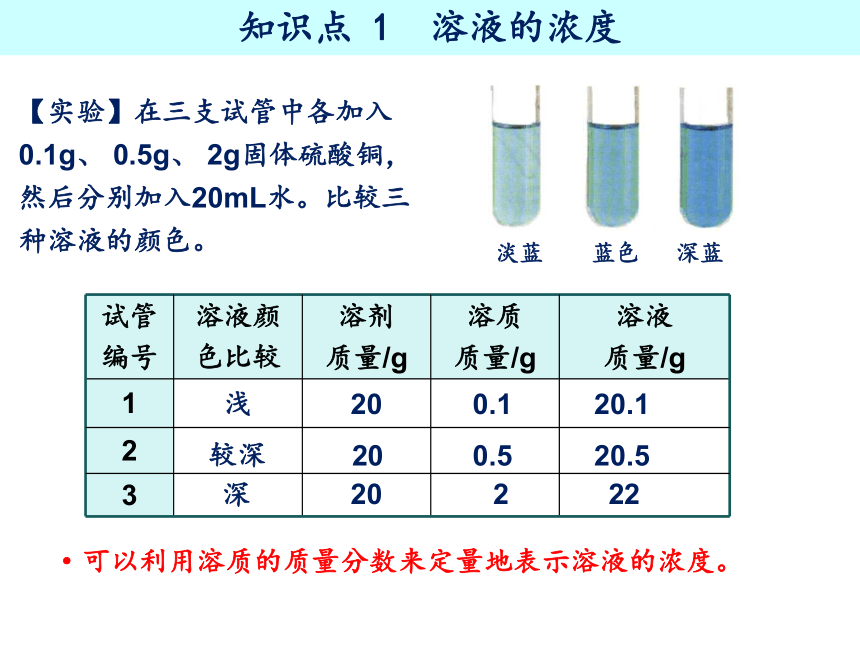
【实验】在三支试管中各加入 0.1g、 0.5g、 2g固体硫酸铜,然后分别加入20mL水。比较三种溶液的颜色。
试管 编号 溶液颜 色比较 溶剂 质量/g 溶质 质量/g 溶液
质量/g
1
2
3
浅
较深
深
20
20
20
0.1
0.5
2
20.1
20.5
22
知识点 1 溶液的浓度
淡蓝 蓝色 深蓝
·可以利用溶质的质量分数来定量地表示溶液的浓度。
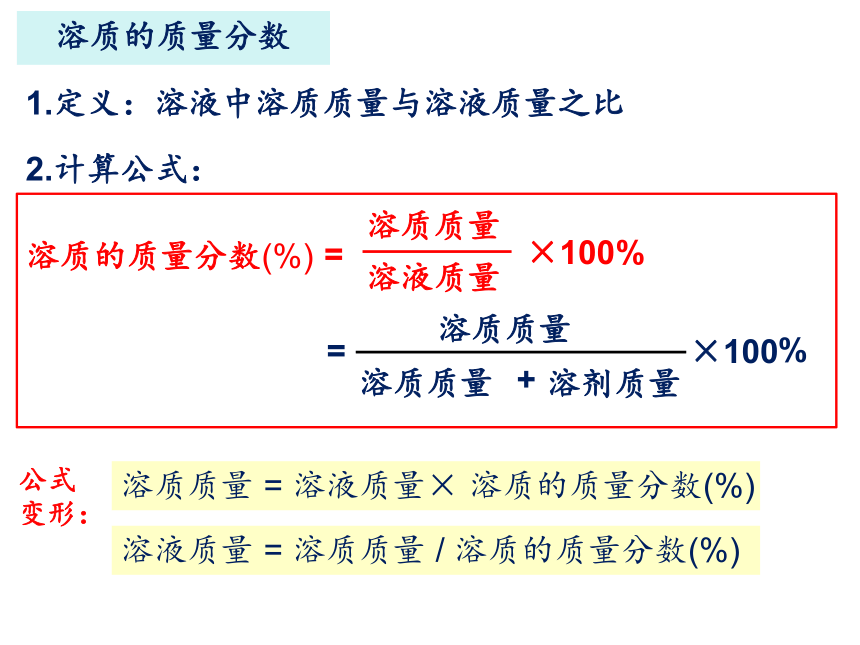
溶质的质量分数
1.定义:溶液中溶质质量与溶液质量之比
2.计算公式:
溶质质量 = 溶液质量× 溶质的质量分数(%)
=
溶液质量
溶质质量
溶质的质量分数(%)
%
×100
+
=
溶剂质量
溶质质量
溶质质量
×100%
公式变形:
溶液质量 = 溶质质量 / 溶质的质量分数(%)
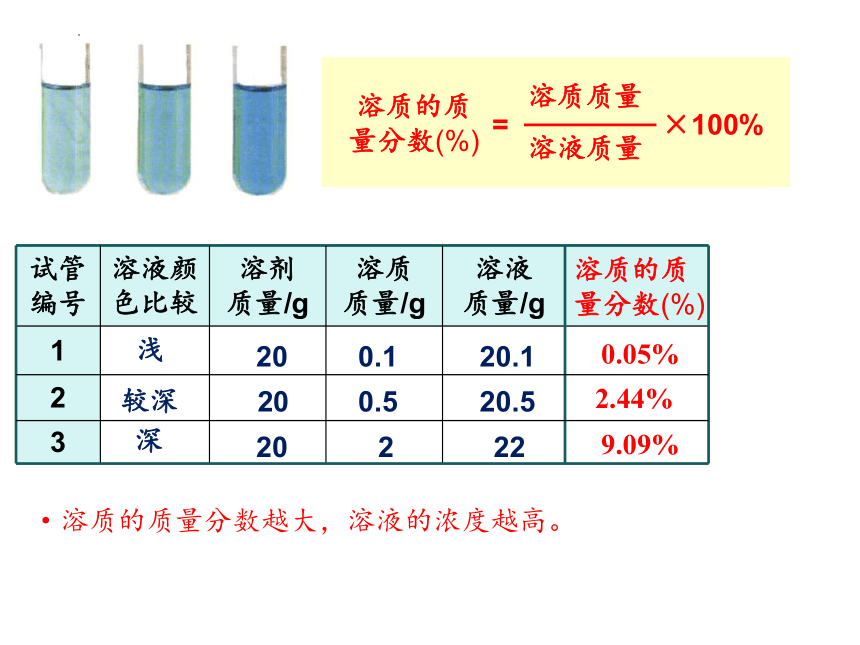
试管 编号 溶液颜 色比较 溶剂 质量/g 溶质 质量/g 溶液 质量/g
1
2
3
浅
较深
深
20
20
20
0.1
0.5
2
20.1
20.5
22
溶质的质量分数(%)
0.05%
2.44%
9.09%
=
溶液质量
溶质质量
溶质的质
量分数(%)
×100%
·溶质的质量分数越大,溶液的浓度越高。
溶解度与质量分数
36g
100+36g
100%
×
= 26.5%
已知200C时,氯化钠的溶解度是36g。在该温度下,将36g氯化钠加入100g水中,溶解后,所得溶液的质量分数是多少?
=
溶液质量
溶质质量
溶质的质
量分数(%)
×100%
=
在该温度下,将40g氯化钠加入100g水中,溶解后,所得溶液的质量分数是多少?
36g
100+36g
100%
×
= 26.5%
由溶解度知,在该温度下,100g水中只能溶解36g氯化钠。溶质质量为36g
【例1】在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
解:
溶质质量
溶液质量
溶质的
质量分数
100% ;
变式1:溶质质量
= 溶液质量
×溶质的质量分数
氯化钠质量= 150kg
×16%
= 24kg
溶液质量
= 溶剂质量
+ 溶质质量
水的质量= 150kg
- 24kg
= 126kg
答:需要氯化钠的质量为24kg,水的质量为126kg。
×
知识点 2 溶质的质量分数的简单计算
=
变式2:溶剂质量
= 溶液质量
- 溶质质量
氯化钠:溶质
水:溶剂
练习
1. 在100g溶质质量分数为20%的碘酒溶液中,碘的质量是 g,酒精的质量是 g;
碘:溶质
酒精:溶剂
溶质 = 溶液×溶质%
碘 = 100g× 20% = 20g
碘酒溶液:溶液
20
溶剂 = 溶液-溶质
酒精 = 100g-20g = 80g
80
2. 将配制好的100g溶质质量分数为20%的碘酒溶液,倒掉一半,剩下的溶液溶质质量分数为 %。
·溶液具有均一性,即每个部分浓度相同,剩下的溶液浓度也不会改变。
20
小结
1.什么是溶质的质量分数?
%
×100
+
=
溶剂质量
溶质质量
溶质质量
溶质的质量分数
2.溶质质量分数与溶解度的联系:
溶解度
100g+溶解度
溶质的质量分数=
×100%
溶质质量是指被溶解的溶质的质量,没有被溶解的不能计算在内。
饱和溶液的溶解度可以看作溶质质量
知识点 3 溶液的稀释的计算
【例1】将1 g食盐放入烧杯中,再加入9 mL水,用玻璃棒搅拌,至溶解。再向上述烧杯中加入10 mL水搅拌。(水的密度为1 g/cm3)
1.试分别写出稀释前后溶质质量、溶液质量、溶质质量分数。
2.分析各量的变化情况。溶液稀释问题解题的关键是什么
1.稀释前溶质质量是1 g,溶剂质量是9 g,溶质质量分数为10%;稀释后溶质的质量是1 g,溶液质量是20 g,溶质质量分数是5%。
2.稀释后溶液质量增加,溶质质量分数减小,溶质质量不变。
质量 = 密度×体积
·m1溶质=m1溶液×m1溶质% m2溶质=m2溶液×m2溶质%
=
【例2】把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液。需要多少克水
50克98%的浓硫酸 20%的稀硫酸
加水
解法1:设稀释后溶液的质量为x。
50g×98% = x·20%,
x = 245 g
故水的质量为:245g-50g=195g
答:需要加水195g。
加水稀释前后,溶质质量不变(相等)。
·m溶质=m溶液×溶质%
·m1溶质=m1溶液×m1溶质%
·m2溶质=m2溶液×m2溶质%
=
解法2:设需要加水的质量为x。
50g×98% = (50g+x)×20%
x = 195g。
【例2】把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液。需要多少克水
加水后稀溶液质量50g+x
50克98%的浓硫酸 20%的稀硫酸
加水质量为x
答:需要加水195g。
·m1溶质=m1溶液×m1溶质%
·m2溶质=m2溶液×m2溶质%
=
【例3】某工厂化验室配制5000 g 20%的盐酸,需38%的盐酸(密度为1.19 g/cm3)多少毫升
解:设需38%的盐酸的体积为x,即质量为1.19 g/cm3·x。
5000 g×20% = 1.19 g/cm3×x×38%
x ≈ 2211 mL。
答:需38%的盐酸2211 mL。
质量 = 密度×体积
·m1溶质=m1溶液×m1溶质%
·m2溶质=m2溶液×m2溶质%
=
有关溶液稀释问题的计算
解题依据:溶液稀释前后,溶质的质量不变。
若有某溶液Ag,其溶质的质量分数为a%,稀释后得到溶质质量分数为b%的溶液Bg。则有:
Ag×a% = Bg×b%
(稀释前)(稀释后)
小结
第2课时 溶质质量分数的综合计算和配制
溶质的质量分数的综合计算——化学方程式
溶液常参与化学反应,但实际上发生化学反应的是溶液中的溶质:
硫酸溶液——溶质H2SO4
稀盐酸溶液——溶质HCl
过氧化氢溶液——溶质H2O2
锌Zn与稀盐酸HCl反应后的溶液——溶质ZnCl2
Zn + 2HCl = ZnCl2 + H2
【例题】12克Mg条与100克稀H2SO4恰好完全反应,则该硫酸中溶质的质量是多少?原硫酸溶液中溶质的质量分数是多少?
100g稀H2SO4:硫酸溶液
溶质 H2SO4
解:设溶质H2SO4的质量为x。
Mg+H2SO4 ==
MgSO4 + H2↑
24 98
12g x
24
98
12g
x
=
x = 49g
答:溶质H2SO4的质量为49g。
m溶质
m溶液
m溶质%
100%
×
=
49g
100g
100%
×
= 49%
溶质的质量分数为49%。
【练习】100 g某硫酸溶液恰好与13 g锌完全反应。试计算这种硫酸中溶质的质量分数。
解:设硫酸溶液中溶质质量为x。
Zn + H2SO4 = ZnSO4 + H2
65 98
13g x
x =
19.6g
答:这种硫酸中溶质的质量分数为19.6%。
65
13g
98
x
=
溶质质量
溶液质量
溶质的质量分数=
×100%
×100%=19.6%。
=
19.6g
100g
配制一定质量分数的溶液
医疗上如何配制50g质量分数为0.6%的氯化钠注射液?
步骤:
1.计算:所需溶质氯化钠和水的质量;
2.称量:称取所需的氯化钠;
3.量取:量取所需的水;
4.溶解:搅拌溶解;
5.装瓶存放:装瓶贴标签。
配制50g质量分数为6%的氯化钠溶液:
1.计算:所需溶质氯化钠的质量为 g,水的体积为 mL。
m溶质= m溶液×m溶质%
m氯化钠= 50g×6%
= 3g
3
m溶剂= m溶液-m溶质
m水= 50g-3g
= 47g
47
V= m·密度
= 47g×1g/mL
= 47mL
配制50g质量分数为6%的氯化钠溶液:
2.用托盘天平称取氯化钠;
3.用量筒量取水。
水47mL:选择接近的50mL量筒,减少误差。
氯化钠3g:先调节天平为3g,再添加药品。
俯视读数大,而实际取少了;
正确:平视凹液面最低处;
仰视读数小,而实际取多了;
4.溶解:将称好的氯化钠和量好的水倒入烧杯中,用玻璃棒搅拌使之完全溶解。
加速溶解
5.装瓶存放:把配制好的溶液装入试剂瓶,盖好瓶塞,贴上标签。
氯化钠溶液
6%
一、溶液稀释和配制问题的计算
关键:稀释前溶质的质量 = 稀释后溶质的质量
涉及体积时:
溶质质量=溶液体积×溶液密度×溶质的质量分数
二、溶质的质量分数应用于化学方程式的计算
参加化学反应的是溶液中的溶质。
课堂小结
第九单元 溶液
课题3 溶液的浓度
52%
酒类的酒精度
导入新课
10%
葡萄糖注射液的浓度
100g酒精溶液中溶解有52g酒精
100g葡萄糖溶液中溶解有10g葡萄糖
【实验】在三支试管中各加入 0.1g、 0.5g、 2g固体硫酸铜,然后分别加入20mL水。比较三种溶液的颜色。
试管 编号 溶液颜 色比较 溶剂 质量/g 溶质 质量/g 溶液
质量/g
1
2
3
浅
较深
深
20
20
20
0.1
0.5
2
20.1
20.5
22
知识点 1 溶液的浓度
淡蓝 蓝色 深蓝
·可以利用溶质的质量分数来定量地表示溶液的浓度。
溶质的质量分数
1.定义:溶液中溶质质量与溶液质量之比
2.计算公式:
溶质质量 = 溶液质量× 溶质的质量分数(%)
=
溶液质量
溶质质量
溶质的质量分数(%)
%
×100
+
=
溶剂质量
溶质质量
溶质质量
×100%
公式变形:
溶液质量 = 溶质质量 / 溶质的质量分数(%)
试管 编号 溶液颜 色比较 溶剂 质量/g 溶质 质量/g 溶液 质量/g
1
2
3
浅
较深
深
20
20
20
0.1
0.5
2
20.1
20.5
22
溶质的质量分数(%)
0.05%
2.44%
9.09%
=
溶液质量
溶质质量
溶质的质
量分数(%)
×100%
·溶质的质量分数越大,溶液的浓度越高。
溶解度与质量分数
36g
100+36g
100%
×
= 26.5%
已知200C时,氯化钠的溶解度是36g。在该温度下,将36g氯化钠加入100g水中,溶解后,所得溶液的质量分数是多少?
=
溶液质量
溶质质量
溶质的质
量分数(%)
×100%
=
在该温度下,将40g氯化钠加入100g水中,溶解后,所得溶液的质量分数是多少?
36g
100+36g
100%
×
= 26.5%
由溶解度知,在该温度下,100g水中只能溶解36g氯化钠。溶质质量为36g
【例1】在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
解:
溶质质量
溶液质量
溶质的
质量分数
100% ;
变式1:溶质质量
= 溶液质量
×溶质的质量分数
氯化钠质量= 150kg
×16%
= 24kg
溶液质量
= 溶剂质量
+ 溶质质量
水的质量= 150kg
- 24kg
= 126kg
答:需要氯化钠的质量为24kg,水的质量为126kg。
×
知识点 2 溶质的质量分数的简单计算
=
变式2:溶剂质量
= 溶液质量
- 溶质质量
氯化钠:溶质
水:溶剂
练习
1. 在100g溶质质量分数为20%的碘酒溶液中,碘的质量是 g,酒精的质量是 g;
碘:溶质
酒精:溶剂
溶质 = 溶液×溶质%
碘 = 100g× 20% = 20g
碘酒溶液:溶液
20
溶剂 = 溶液-溶质
酒精 = 100g-20g = 80g
80
2. 将配制好的100g溶质质量分数为20%的碘酒溶液,倒掉一半,剩下的溶液溶质质量分数为 %。
·溶液具有均一性,即每个部分浓度相同,剩下的溶液浓度也不会改变。
20
小结
1.什么是溶质的质量分数?
%
×100
+
=
溶剂质量
溶质质量
溶质质量
溶质的质量分数
2.溶质质量分数与溶解度的联系:
溶解度
100g+溶解度
溶质的质量分数=
×100%
溶质质量是指被溶解的溶质的质量,没有被溶解的不能计算在内。
饱和溶液的溶解度可以看作溶质质量
知识点 3 溶液的稀释的计算
【例1】将1 g食盐放入烧杯中,再加入9 mL水,用玻璃棒搅拌,至溶解。再向上述烧杯中加入10 mL水搅拌。(水的密度为1 g/cm3)
1.试分别写出稀释前后溶质质量、溶液质量、溶质质量分数。
2.分析各量的变化情况。溶液稀释问题解题的关键是什么
1.稀释前溶质质量是1 g,溶剂质量是9 g,溶质质量分数为10%;稀释后溶质的质量是1 g,溶液质量是20 g,溶质质量分数是5%。
2.稀释后溶液质量增加,溶质质量分数减小,溶质质量不变。
质量 = 密度×体积
·m1溶质=m1溶液×m1溶质% m2溶质=m2溶液×m2溶质%
=
【例2】把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液。需要多少克水
50克98%的浓硫酸 20%的稀硫酸
加水
解法1:设稀释后溶液的质量为x。
50g×98% = x·20%,
x = 245 g
故水的质量为:245g-50g=195g
答:需要加水195g。
加水稀释前后,溶质质量不变(相等)。
·m溶质=m溶液×溶质%
·m1溶质=m1溶液×m1溶质%
·m2溶质=m2溶液×m2溶质%
=
解法2:设需要加水的质量为x。
50g×98% = (50g+x)×20%
x = 195g。
【例2】把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液。需要多少克水
加水后稀溶液质量50g+x
50克98%的浓硫酸 20%的稀硫酸
加水质量为x
答:需要加水195g。
·m1溶质=m1溶液×m1溶质%
·m2溶质=m2溶液×m2溶质%
=
【例3】某工厂化验室配制5000 g 20%的盐酸,需38%的盐酸(密度为1.19 g/cm3)多少毫升
解:设需38%的盐酸的体积为x,即质量为1.19 g/cm3·x。
5000 g×20% = 1.19 g/cm3×x×38%
x ≈ 2211 mL。
答:需38%的盐酸2211 mL。
质量 = 密度×体积
·m1溶质=m1溶液×m1溶质%
·m2溶质=m2溶液×m2溶质%
=
有关溶液稀释问题的计算
解题依据:溶液稀释前后,溶质的质量不变。
若有某溶液Ag,其溶质的质量分数为a%,稀释后得到溶质质量分数为b%的溶液Bg。则有:
Ag×a% = Bg×b%
(稀释前)(稀释后)
小结
第2课时 溶质质量分数的综合计算和配制
溶质的质量分数的综合计算——化学方程式
溶液常参与化学反应,但实际上发生化学反应的是溶液中的溶质:
硫酸溶液——溶质H2SO4
稀盐酸溶液——溶质HCl
过氧化氢溶液——溶质H2O2
锌Zn与稀盐酸HCl反应后的溶液——溶质ZnCl2
Zn + 2HCl = ZnCl2 + H2
【例题】12克Mg条与100克稀H2SO4恰好完全反应,则该硫酸中溶质的质量是多少?原硫酸溶液中溶质的质量分数是多少?
100g稀H2SO4:硫酸溶液
溶质 H2SO4
解:设溶质H2SO4的质量为x。
Mg+H2SO4 ==
MgSO4 + H2↑
24 98
12g x
24
98
12g
x
=
x = 49g
答:溶质H2SO4的质量为49g。
m溶质
m溶液
m溶质%
100%
×
=
49g
100g
100%
×
= 49%
溶质的质量分数为49%。
【练习】100 g某硫酸溶液恰好与13 g锌完全反应。试计算这种硫酸中溶质的质量分数。
解:设硫酸溶液中溶质质量为x。
Zn + H2SO4 = ZnSO4 + H2
65 98
13g x
x =
19.6g
答:这种硫酸中溶质的质量分数为19.6%。
65
13g
98
x
=
溶质质量
溶液质量
溶质的质量分数=
×100%
×100%=19.6%。
=
19.6g
100g
配制一定质量分数的溶液
医疗上如何配制50g质量分数为0.6%的氯化钠注射液?
步骤:
1.计算:所需溶质氯化钠和水的质量;
2.称量:称取所需的氯化钠;
3.量取:量取所需的水;
4.溶解:搅拌溶解;
5.装瓶存放:装瓶贴标签。
配制50g质量分数为6%的氯化钠溶液:
1.计算:所需溶质氯化钠的质量为 g,水的体积为 mL。
m溶质= m溶液×m溶质%
m氯化钠= 50g×6%
= 3g
3
m溶剂= m溶液-m溶质
m水= 50g-3g
= 47g
47
V= m·密度
= 47g×1g/mL
= 47mL
配制50g质量分数为6%的氯化钠溶液:
2.用托盘天平称取氯化钠;
3.用量筒量取水。
水47mL:选择接近的50mL量筒,减少误差。
氯化钠3g:先调节天平为3g,再添加药品。
俯视读数大,而实际取少了;
正确:平视凹液面最低处;
仰视读数小,而实际取多了;
4.溶解:将称好的氯化钠和量好的水倒入烧杯中,用玻璃棒搅拌使之完全溶解。
加速溶解
5.装瓶存放:把配制好的溶液装入试剂瓶,盖好瓶塞,贴上标签。
氯化钠溶液
6%
一、溶液稀释和配制问题的计算
关键:稀释前溶质的质量 = 稀释后溶质的质量
涉及体积时:
溶质质量=溶液体积×溶液密度×溶质的质量分数
二、溶质的质量分数应用于化学方程式的计算
参加化学反应的是溶液中的溶质。
课堂小结
同课章节目录
