第九单元课题3课时2 有关溶质质量分数的综合计算(优质课件29页)-2022-2023学年九年级化学下册同步高效课堂优质课件(人教版)
文档属性
| 名称 | 第九单元课题3课时2 有关溶质质量分数的综合计算(优质课件29页)-2022-2023学年九年级化学下册同步高效课堂优质课件(人教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 00:00:00 | ||
图片预览








文档简介
(共29张PPT)
第九单元 课题3 溶液的浓度
第2课时 有关溶质质量分数的综合计算
情景导入
《煮粥诗》:
“煮饭何如煮粥强,好同儿女细商量。一升可作三升用,两日堪为六日粮。有客只需添水火,无钱不必作羹汤。莫嫌淡泊少滋味,淡泊之中滋味长。”
粥中加水后,米粒不变,粥变得更稀。如果是菜汤加水,汤中食盐质量不变,汤的味道变淡。这种现象和溶液的稀释相似。
学习目标
1.掌握溶液稀释和配制问题的计算。
2.掌握溶质的质量分数运用于化学方程式的计算。
一、溶液稀释和配制问题的计算
观察与思考:
授课
【例1】将2 g氢氧化钠放入烧杯中,再加入8 mL水,用玻璃棒搅拌,至溶解。再向上述烧杯中加入10 mL水搅拌。(水的密度为1 g/cm3)
1.试分别写出稀释前后溶质质量、溶液质量、溶质质量分数。
2.分析各量的变化情况。溶液稀释问题解题的关键是什么
1.稀释前溶质质量是2 g,溶剂质量是8 g,溶质质量分数为20%;稀释后溶质的质量是2 g,溶液质量是20 g,溶质质量分数是10%。
2.稀释后溶液质量增加,溶质质量分数减小,溶质质量不变。
【例2】化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把10 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水
解法1:设需加水的质量为x。
10 g×98%=(10 g+x)×20%,
x=39 g。
答:把10 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液需加水39g。
解法2:设稀释后溶液的质量为x。
10 g×98%=x×20%,
x=49 g,
49 g-10 g=39 g。
答:把10 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液需加水39 g。
【例3】某工厂化验室配制5000 g 20%的盐酸,需38%的盐酸(密度为1.19 g/cm3)多少毫升
提问:此题与上述练习题有何异同?能否用体积直接带入公式进行计算
解:设需38%的盐酸的体积为x。
5000 g×20%=1.19 g/cm3×x×38%,x≈2211 mL。
答:需38%的盐酸2211 mL。
【归纳】溶质质量=溶液体积×溶液密度×溶质的质量分数。
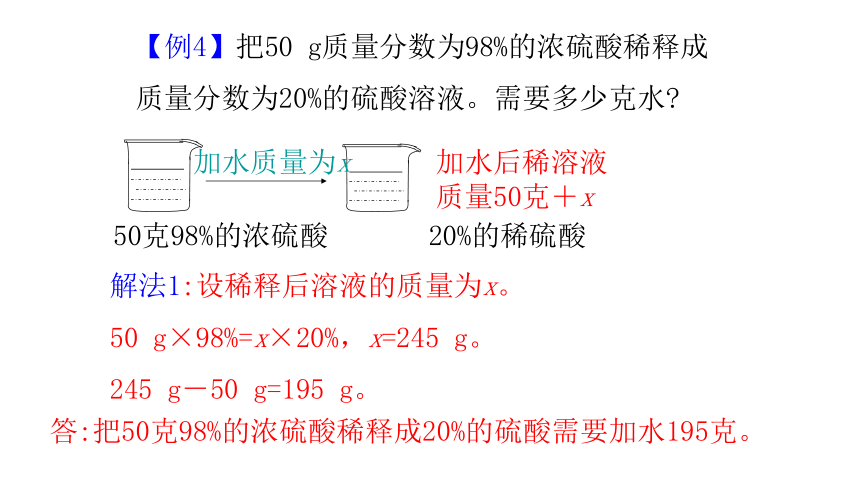
【例4】把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液。需要多少克水
加水后稀溶液质量50克+x
50克98%的浓硫酸 20%的稀硫酸
加水质量为x
解法1:设稀释后溶液的质量为x。
50 g×98%=x×20%,x=245 g。
245 g-50 g=195 g。
答:把50克98%的浓硫酸稀释成20%的硫酸需要加水195克。
【例4】把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液。需要多少克水
加水后稀溶液质量50克+x
50克98%的浓硫酸 20%的稀硫酸
加水质量为x
解法2:设把50g 98%的浓硫酸稀释成20%的稀硫酸需要加水的质量为x,则稀释后溶液的质量为(50g+x),根据稀释前后溶液中溶质的质量不变,得:50g×98%=(50g+x)×20%
解得:x=195g。
答:把50克98%的浓硫酸稀释成20%的硫酸需要加水195克。
【例5】配制500 mL质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸多少毫升 (质量分数为20%的硫酸溶液密度为1.14 g/mL,质量分数为98%的浓硫酸密度为1.84 g/mL)。
解:设配制500 mL质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸的体积为x,根据稀释前后溶液中溶质的质量不变,得:
500 mL×1.14 g/mL×20%=x×1.84 g/mL×98%。
解得:x≈63.2 mL。
答:配制500 mL质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸63.2 mL。
二、溶质的质量分数运用于化学方程式的计算
观察与思考:
授课
【例1】100 g盐酸溶液恰好与6.5 g锌完全反应。试计算这种盐酸中溶质的质量分数。
解:设100 g硫酸溶液中溶质质量为x。
Zn + 2 HCl = ZnCl2 + H2
65 73
6.5g x
65
6.5g
73
x
=
x =
7.3g
溶质的质量分数=
×100%
×100%=7.3%。
=
溶质质量
溶液质量
7.3
100g
答:这种硫酸中溶质的质量分数为7.3%。
【例2】2.4克Mg条与100克稀H2SO4恰好完全反应,则该硫酸中溶质的质量是 克,原硫酸溶液中溶质的质量分数是 。生成物溶液中溶质的化学式是 。生成物溶液的溶质质量分数是 。
Mg+H2SO4 ==
MgSO4 + H2↑
24 98 120 2
2.4 g z x y
24
98
2.4g
z
=
解得z=9.8 g。
24
2
2.4g
y
=
解得y=0.2 g。
24
120
2.4g
x
=
解得x=12 g。
【例2】2.4克Mg条与100克稀H2SO4恰好完全反应,则该硫酸中溶质的质量是 克,原硫酸溶液中溶质的质量分数是 。生成物溶液中溶质的化学式是 。生成物溶液的溶质质量分数是 。
因2.4克Mg条与100克稀H2SO4恰好完全反应,生成的H2逸散到空气中,故生成的溶液时MgSO4溶液,其质量为:
m(MgSO4溶液)=m(Mg) +m(稀H2SO4溶液)-m(H2)=2.4g+100g-0.2g=102.2g
MgSO4溶液溶质的质量分数=12g/102.2g=11.74%。
【例3】将20 g由NaCl和CaCl2组成的固体混合物溶于水配成50 g溶液,向所得混合溶液中逐滴加入一定质量分数的Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀的质量关系如下表。
(提示:CaCl2+Na2CO3=== CaCO3↓+2NaCl)
(1)x的值为 。
(2)计算恰好完全反应时所得溶液中溶质的质量分数。
(结果精确到0.1%)
Na2CO3溶液的质量/g 20 40 60 80 100
生成沉淀的质量/g 4 8 x 10 10
10
归纳与小结:
方法 计算依据 计算公式
溶液的稀释 ①加水稀释 ②加稀溶液稀释 ①加水稀释前后,溶液中溶质的质量不变 ②用稀溶液稀释浓溶液时,稀溶液中溶质的质量与浓溶液中溶质的质量之和等于混合后溶液中溶质的质量 加水稀释:稀释前后溶液中溶质的质量不变
m浓×ω浓%=(m浓+m水)×ω稀%
溶液的浓缩 ①添加溶质 ②蒸发溶剂 ③加入浓溶液 ①原溶液中的溶质与后加入的溶质质量之和等于混合后溶液中的溶质质量 ②蒸发溶剂前后溶液中溶质的质量不变(没有溶质析出) ③原溶液中的溶质与后加入浓溶液中的溶质质量之和等于混合后溶液中的溶质质量 蒸发浓缩:浓缩前后溶液中溶质的质量不变
(m稀-m水)×ω浓%=m稀×ω稀%
注意:
1.几种溶液混合,溶液的体积不能简单相加,
即V总≠VA+VB。
2.混合后溶液的质量、溶质的质量可以相加,
即m总=mA+mB。
3.要求混合后溶液的总体积,必须依据公式V=m/ρ,所以要知道混合溶液的密度才能求出总体积。
一、溶液稀释和配制问题的计算
关键:稀释前溶质的质量=稀释后溶质的质量
涉及体积时:
溶质质量=溶液体积×溶液密度×溶质的质量分数
二、溶质的质量分数应用于化学方程式的计算
参加化学反应的是溶液中的溶质。
课堂小结:
1.要配制200 kg 10%的CaCl2溶液作路面保湿剂,需要CaCl2固体的质量为 kg,水的质量为 kg。
2.现有98%的浓硫酸500 g,可以配制40%的硫酸溶液 g。
课堂检测
20
180
1225
3.【跨学科】如图所示,一物体悬挂在饱和氯化钠溶液中,在恒温条件下向烧杯内溶液中分别加入下列物质(悬挂物不参与反应),说明弹簧秤读数的变化情况(填“变大”“不变”或“变小”)。
(1)如果加入氯化钠晶体,弹簧秤读数 不变 。
(2)如果加入蒸馏水,弹簧秤读数 变大 。
(3)如果加入硝酸钾晶体,弹簧秤读数 变小 。
不变
变大
变小
4.某化学兴趣小组取部分变质的Ca(OH)2(含杂质CaCO3)样品4.0g投入200.0g水中,充分搅拌,通入足量CO2,溶液质量与反应的CO2质量的关系如图所示,则:
2.2
(1)Ca(OH)2全部转化为CaCO3时消耗的CO2质量为 2.2 g。
(2)4.0g样品中杂质CaCO3的质量为多少(写出计算过程)?
解:设4.0g样品中Ca(OH)2的质量为x。
CO2+Ca(OH)2CaCO3↓+H2O
44 74
2.2g x
=,x=3.7g
4.0g样品中杂质CaCO3的质量为4.0g-3.7g=0.3g
答:4.0g样品中杂质CaCO3的质量为0.3g。
(3)通入m3gCO2时,溶液中生成物的溶质的质量分数为 4.1% (精确到0.1%)。若所取样品中的Ca(OH)2没有完全溶于水,对最后的计算结果 没有 (填“有”或“没有”)影响。原因是 未溶解的氢氧化钙也能与二氧化碳反应生成碳酸钙 。
4.1%
没有
未溶解的氢氧化钙也
能与二氧化碳反应生成碳酸钙
直击中考
1.(2022福建)从植物“地不容”中提取抑制新冠病毒的新药——千金藤素,需用到5%的Na2CO3溶液。若配制100 g该溶液,需要称取Na2CO3的质量为( )
A.95 g B.5 g C.20 g D.90 g
B
2.(2022岳阳)化学实验考查时,小芳抽到的考题是“配制40 g质量分数为18%的氯化钠溶液”,她的实验操作正确的是( )
D.玻璃棒搅拌溶解
A.取氯化钠固体
B.称量7.2 g氯化钠
C.量取32.8 mL水
D
D
3.(2021·江苏扬州)为测定某石灰石样品中碳酸钙的质量分数,取2.0g石灰石样品于烧杯中,将20g稀盐酸分4次加入样品中,充分反应后经过滤、干燥、称重,得实验数据如下:
第一次 第二次 第三次 第四次
稀盐酸的用量/g 5.0 5.0 5.0 5.0
剩余固体的质量/g 1.5 1.0 0.5 0.3
已知石灰石中的杂质既不与盐酸反应,也不溶解于水。下列说法正确的是( )
A.第三次实验后碳酸钙无剩余 B.第四次实验后盐酸无剩余
C.盐酸中HCl的质量分数是3.65% D.样品中碳酸钙的质量分数是85%
4.(2022黄石)某氢氧化钠固体因保存不当部分变质生成了Na2CO3,取该样品12.5g逐滴加入一定量的稀盐酸,恰好完全反应时,得到75g溶液。反应中产生的气体的质量与稀盐酸的用量关系如图所示。试计算:
(1)x= 64.7 g。
(2)样品中NaOH的质量分数。
64.7
解:由图可知,生成二氧化碳气体的质量为2.2g。
设碳酸钠的质量为y。
Na2CO3+2HCl2NaCl+H2O+CO2↑
106 44
y 2.2g
=,y=5.3g
氢氧化钠质量为12.5g-5.3g=7.2g,样品中氢氧化钠的质量分数为×100%=57.6%
答:样品中NaOH的质量分数57.6%。
5.(2022广东)铁铜双金属粉末可用于生产机械零件。利用还原铁粉和CuSO4溶液制备该产品的工艺流程如图所示。
(1)“搅拌”时发生的反应利用了铁的金属活动性比铜的 强 (填“强”或“弱”)。
(2)“过滤”后滤液的主要成分是 FeSO4 (写化学式)。
(3)若用该工艺制备了1 000g铁铜双金属粉末产品,其中Cu单质的质量分数为19.2%。计算置换这些Cu单质所需还原铁粉的质量(写出计算过程)。
强
FeSO4
解:(3)1 000g铁铜双金属粉末中铜的质量为1 000g×19.2%=192g,设需还原铁粉的质量为x。
Fe+CuSO4FeSO4+Cu
56 64
x 192g
=,x=168g
答:需还原铁粉的质量为168g。
(4)“干燥还原”可在不同的温度下进行,产品中氧元素的质量分数随温度的变化如图所示。若(3)中产品是在500℃时干燥还原后得到的,则其中最多含Fe元素 804 g(产品中只含三种元素)。
804
第九单元 课题3 溶液的浓度
第2课时 有关溶质质量分数的综合计算
情景导入
《煮粥诗》:
“煮饭何如煮粥强,好同儿女细商量。一升可作三升用,两日堪为六日粮。有客只需添水火,无钱不必作羹汤。莫嫌淡泊少滋味,淡泊之中滋味长。”
粥中加水后,米粒不变,粥变得更稀。如果是菜汤加水,汤中食盐质量不变,汤的味道变淡。这种现象和溶液的稀释相似。
学习目标
1.掌握溶液稀释和配制问题的计算。
2.掌握溶质的质量分数运用于化学方程式的计算。
一、溶液稀释和配制问题的计算
观察与思考:
授课
【例1】将2 g氢氧化钠放入烧杯中,再加入8 mL水,用玻璃棒搅拌,至溶解。再向上述烧杯中加入10 mL水搅拌。(水的密度为1 g/cm3)
1.试分别写出稀释前后溶质质量、溶液质量、溶质质量分数。
2.分析各量的变化情况。溶液稀释问题解题的关键是什么
1.稀释前溶质质量是2 g,溶剂质量是8 g,溶质质量分数为20%;稀释后溶质的质量是2 g,溶液质量是20 g,溶质质量分数是10%。
2.稀释后溶液质量增加,溶质质量分数减小,溶质质量不变。
【例2】化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把10 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水
解法1:设需加水的质量为x。
10 g×98%=(10 g+x)×20%,
x=39 g。
答:把10 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液需加水39g。
解法2:设稀释后溶液的质量为x。
10 g×98%=x×20%,
x=49 g,
49 g-10 g=39 g。
答:把10 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液需加水39 g。
【例3】某工厂化验室配制5000 g 20%的盐酸,需38%的盐酸(密度为1.19 g/cm3)多少毫升
提问:此题与上述练习题有何异同?能否用体积直接带入公式进行计算
解:设需38%的盐酸的体积为x。
5000 g×20%=1.19 g/cm3×x×38%,x≈2211 mL。
答:需38%的盐酸2211 mL。
【归纳】溶质质量=溶液体积×溶液密度×溶质的质量分数。
【例4】把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液。需要多少克水
加水后稀溶液质量50克+x
50克98%的浓硫酸 20%的稀硫酸
加水质量为x
解法1:设稀释后溶液的质量为x。
50 g×98%=x×20%,x=245 g。
245 g-50 g=195 g。
答:把50克98%的浓硫酸稀释成20%的硫酸需要加水195克。
【例4】把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液。需要多少克水
加水后稀溶液质量50克+x
50克98%的浓硫酸 20%的稀硫酸
加水质量为x
解法2:设把50g 98%的浓硫酸稀释成20%的稀硫酸需要加水的质量为x,则稀释后溶液的质量为(50g+x),根据稀释前后溶液中溶质的质量不变,得:50g×98%=(50g+x)×20%
解得:x=195g。
答:把50克98%的浓硫酸稀释成20%的硫酸需要加水195克。
【例5】配制500 mL质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸多少毫升 (质量分数为20%的硫酸溶液密度为1.14 g/mL,质量分数为98%的浓硫酸密度为1.84 g/mL)。
解:设配制500 mL质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸的体积为x,根据稀释前后溶液中溶质的质量不变,得:
500 mL×1.14 g/mL×20%=x×1.84 g/mL×98%。
解得:x≈63.2 mL。
答:配制500 mL质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸63.2 mL。
二、溶质的质量分数运用于化学方程式的计算
观察与思考:
授课
【例1】100 g盐酸溶液恰好与6.5 g锌完全反应。试计算这种盐酸中溶质的质量分数。
解:设100 g硫酸溶液中溶质质量为x。
Zn + 2 HCl = ZnCl2 + H2
65 73
6.5g x
65
6.5g
73
x
=
x =
7.3g
溶质的质量分数=
×100%
×100%=7.3%。
=
溶质质量
溶液质量
7.3
100g
答:这种硫酸中溶质的质量分数为7.3%。
【例2】2.4克Mg条与100克稀H2SO4恰好完全反应,则该硫酸中溶质的质量是 克,原硫酸溶液中溶质的质量分数是 。生成物溶液中溶质的化学式是 。生成物溶液的溶质质量分数是 。
Mg+H2SO4 ==
MgSO4 + H2↑
24 98 120 2
2.4 g z x y
24
98
2.4g
z
=
解得z=9.8 g。
24
2
2.4g
y
=
解得y=0.2 g。
24
120
2.4g
x
=
解得x=12 g。
【例2】2.4克Mg条与100克稀H2SO4恰好完全反应,则该硫酸中溶质的质量是 克,原硫酸溶液中溶质的质量分数是 。生成物溶液中溶质的化学式是 。生成物溶液的溶质质量分数是 。
因2.4克Mg条与100克稀H2SO4恰好完全反应,生成的H2逸散到空气中,故生成的溶液时MgSO4溶液,其质量为:
m(MgSO4溶液)=m(Mg) +m(稀H2SO4溶液)-m(H2)=2.4g+100g-0.2g=102.2g
MgSO4溶液溶质的质量分数=12g/102.2g=11.74%。
【例3】将20 g由NaCl和CaCl2组成的固体混合物溶于水配成50 g溶液,向所得混合溶液中逐滴加入一定质量分数的Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀的质量关系如下表。
(提示:CaCl2+Na2CO3=== CaCO3↓+2NaCl)
(1)x的值为 。
(2)计算恰好完全反应时所得溶液中溶质的质量分数。
(结果精确到0.1%)
Na2CO3溶液的质量/g 20 40 60 80 100
生成沉淀的质量/g 4 8 x 10 10
10
归纳与小结:
方法 计算依据 计算公式
溶液的稀释 ①加水稀释 ②加稀溶液稀释 ①加水稀释前后,溶液中溶质的质量不变 ②用稀溶液稀释浓溶液时,稀溶液中溶质的质量与浓溶液中溶质的质量之和等于混合后溶液中溶质的质量 加水稀释:稀释前后溶液中溶质的质量不变
m浓×ω浓%=(m浓+m水)×ω稀%
溶液的浓缩 ①添加溶质 ②蒸发溶剂 ③加入浓溶液 ①原溶液中的溶质与后加入的溶质质量之和等于混合后溶液中的溶质质量 ②蒸发溶剂前后溶液中溶质的质量不变(没有溶质析出) ③原溶液中的溶质与后加入浓溶液中的溶质质量之和等于混合后溶液中的溶质质量 蒸发浓缩:浓缩前后溶液中溶质的质量不变
(m稀-m水)×ω浓%=m稀×ω稀%
注意:
1.几种溶液混合,溶液的体积不能简单相加,
即V总≠VA+VB。
2.混合后溶液的质量、溶质的质量可以相加,
即m总=mA+mB。
3.要求混合后溶液的总体积,必须依据公式V=m/ρ,所以要知道混合溶液的密度才能求出总体积。
一、溶液稀释和配制问题的计算
关键:稀释前溶质的质量=稀释后溶质的质量
涉及体积时:
溶质质量=溶液体积×溶液密度×溶质的质量分数
二、溶质的质量分数应用于化学方程式的计算
参加化学反应的是溶液中的溶质。
课堂小结:
1.要配制200 kg 10%的CaCl2溶液作路面保湿剂,需要CaCl2固体的质量为 kg,水的质量为 kg。
2.现有98%的浓硫酸500 g,可以配制40%的硫酸溶液 g。
课堂检测
20
180
1225
3.【跨学科】如图所示,一物体悬挂在饱和氯化钠溶液中,在恒温条件下向烧杯内溶液中分别加入下列物质(悬挂物不参与反应),说明弹簧秤读数的变化情况(填“变大”“不变”或“变小”)。
(1)如果加入氯化钠晶体,弹簧秤读数 不变 。
(2)如果加入蒸馏水,弹簧秤读数 变大 。
(3)如果加入硝酸钾晶体,弹簧秤读数 变小 。
不变
变大
变小
4.某化学兴趣小组取部分变质的Ca(OH)2(含杂质CaCO3)样品4.0g投入200.0g水中,充分搅拌,通入足量CO2,溶液质量与反应的CO2质量的关系如图所示,则:
2.2
(1)Ca(OH)2全部转化为CaCO3时消耗的CO2质量为 2.2 g。
(2)4.0g样品中杂质CaCO3的质量为多少(写出计算过程)?
解:设4.0g样品中Ca(OH)2的质量为x。
CO2+Ca(OH)2CaCO3↓+H2O
44 74
2.2g x
=,x=3.7g
4.0g样品中杂质CaCO3的质量为4.0g-3.7g=0.3g
答:4.0g样品中杂质CaCO3的质量为0.3g。
(3)通入m3gCO2时,溶液中生成物的溶质的质量分数为 4.1% (精确到0.1%)。若所取样品中的Ca(OH)2没有完全溶于水,对最后的计算结果 没有 (填“有”或“没有”)影响。原因是 未溶解的氢氧化钙也能与二氧化碳反应生成碳酸钙 。
4.1%
没有
未溶解的氢氧化钙也
能与二氧化碳反应生成碳酸钙
直击中考
1.(2022福建)从植物“地不容”中提取抑制新冠病毒的新药——千金藤素,需用到5%的Na2CO3溶液。若配制100 g该溶液,需要称取Na2CO3的质量为( )
A.95 g B.5 g C.20 g D.90 g
B
2.(2022岳阳)化学实验考查时,小芳抽到的考题是“配制40 g质量分数为18%的氯化钠溶液”,她的实验操作正确的是( )
D.玻璃棒搅拌溶解
A.取氯化钠固体
B.称量7.2 g氯化钠
C.量取32.8 mL水
D
D
3.(2021·江苏扬州)为测定某石灰石样品中碳酸钙的质量分数,取2.0g石灰石样品于烧杯中,将20g稀盐酸分4次加入样品中,充分反应后经过滤、干燥、称重,得实验数据如下:
第一次 第二次 第三次 第四次
稀盐酸的用量/g 5.0 5.0 5.0 5.0
剩余固体的质量/g 1.5 1.0 0.5 0.3
已知石灰石中的杂质既不与盐酸反应,也不溶解于水。下列说法正确的是( )
A.第三次实验后碳酸钙无剩余 B.第四次实验后盐酸无剩余
C.盐酸中HCl的质量分数是3.65% D.样品中碳酸钙的质量分数是85%
4.(2022黄石)某氢氧化钠固体因保存不当部分变质生成了Na2CO3,取该样品12.5g逐滴加入一定量的稀盐酸,恰好完全反应时,得到75g溶液。反应中产生的气体的质量与稀盐酸的用量关系如图所示。试计算:
(1)x= 64.7 g。
(2)样品中NaOH的质量分数。
64.7
解:由图可知,生成二氧化碳气体的质量为2.2g。
设碳酸钠的质量为y。
Na2CO3+2HCl2NaCl+H2O+CO2↑
106 44
y 2.2g
=,y=5.3g
氢氧化钠质量为12.5g-5.3g=7.2g,样品中氢氧化钠的质量分数为×100%=57.6%
答:样品中NaOH的质量分数57.6%。
5.(2022广东)铁铜双金属粉末可用于生产机械零件。利用还原铁粉和CuSO4溶液制备该产品的工艺流程如图所示。
(1)“搅拌”时发生的反应利用了铁的金属活动性比铜的 强 (填“强”或“弱”)。
(2)“过滤”后滤液的主要成分是 FeSO4 (写化学式)。
(3)若用该工艺制备了1 000g铁铜双金属粉末产品,其中Cu单质的质量分数为19.2%。计算置换这些Cu单质所需还原铁粉的质量(写出计算过程)。
强
FeSO4
解:(3)1 000g铁铜双金属粉末中铜的质量为1 000g×19.2%=192g,设需还原铁粉的质量为x。
Fe+CuSO4FeSO4+Cu
56 64
x 192g
=,x=168g
答:需还原铁粉的质量为168g。
(4)“干燥还原”可在不同的温度下进行,产品中氧元素的质量分数随温度的变化如图所示。若(3)中产品是在500℃时干燥还原后得到的,则其中最多含Fe元素 804 g(产品中只含三种元素)。
804
同课章节目录
