化学人教版(2019)选择性必修1 3.3.1盐类的水解(共42张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.3.1盐类的水解(共42张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 250.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-28 09:50:18 | ||
图片预览





文档简介
(共42张PPT)
水溶液中的离子反应与平衡
高中化学 / 人教版 / 选择性必修一/第三单元
3.3.1盐类的水解
学习目标
1.理解盐类水解的实质。
2.掌握强酸弱碱盐和强碱弱酸盐水解的规律。
3.会书写简单的盐类水解方程式。
新课导入
纯碱是什么
从组成上看是哪类物质
为什么叫纯碱
Na2CO3
盐类
其水溶液呈碱性
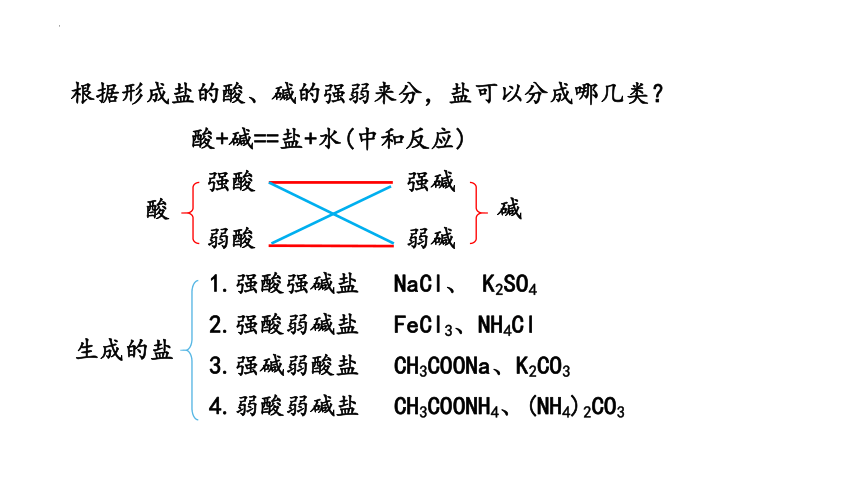
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
酸+碱==盐+水(中和反应)
酸
强酸
弱酸
弱碱
强碱
碱
生成的盐
1.强酸强碱盐
2.强酸弱碱盐
3.强碱弱酸盐
4.弱酸弱碱盐
NaCl、 K2SO4
FeCl3、NH4Cl
CH3COONH4、(NH4)2CO3
CH3COONa、K2CO3
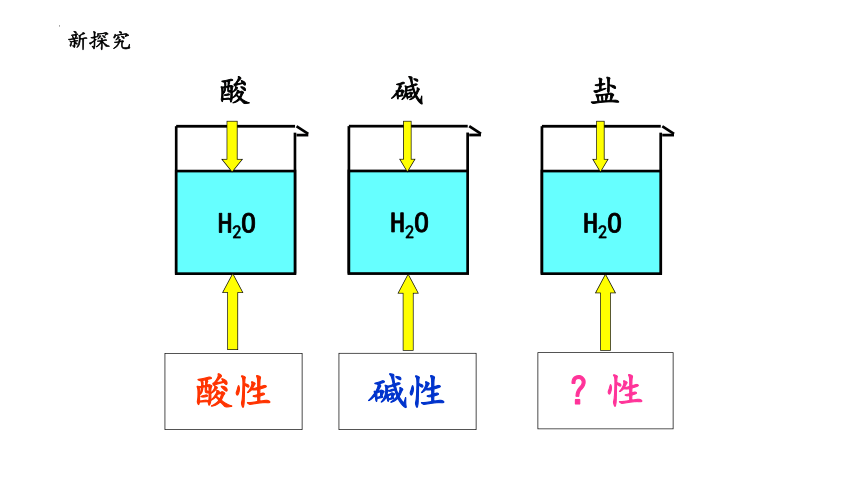
新探究
H2O
酸性
酸
H2O
碱性
碱
H2O
?性
盐
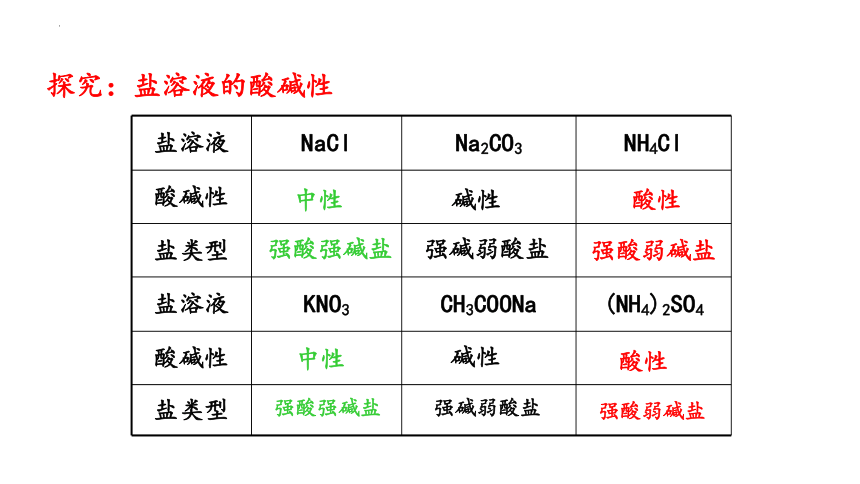
盐溶液 NaCl Na2CO3 NH4Cl
酸碱性
盐类型
盐溶液 KNO3 CH3COONa (NH4)2SO4
酸碱性
盐类型
探究:盐溶液的酸碱性
中性
碱性
碱性
酸性
中性
酸性
强酸强碱盐
强碱弱酸盐
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
强酸弱碱盐
结论:盐的类型与盐溶液酸碱性的关系:
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
盐溶液酸碱性
中性
酸性
碱性
规律:谁强显谁性,同强显中性。
盐溶液有的显酸性,有的显碱性,还有的显中性。
为什么盐溶液可呈中性、酸性或碱性
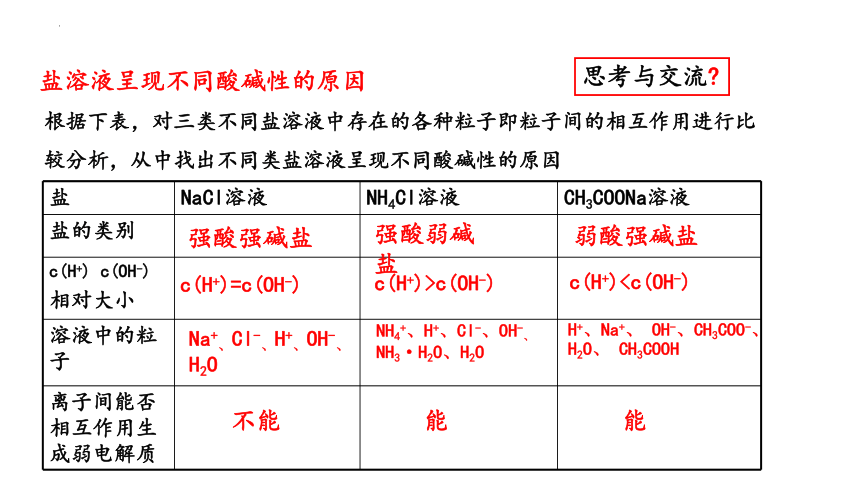
盐溶液呈现不同酸碱性的原因
思考与交流
根据下表,对三类不同盐溶液中存在的各种粒子即粒子间的相互作用进行比较分析,从中找出不同类盐溶液呈现不同酸碱性的原因
盐 NaCl溶液 NH4Cl溶液 CH3COONa溶液
盐的类别
c(H+) c(OH-) 相对大小
溶液中的粒子
离子间能否相互作用生成弱电解质
强酸强碱盐
强酸弱碱盐
弱酸强碱盐
c(H+)=c(OH-)
c(H+)>c(OH-)
c(H+)Na+、Cl-、H+、OH-、H2O
NH4+、H+、Cl-、OH-、NH3·H2O、H2O
H+、Na+、 OH-、CH3COO-、H2O、 CH3COOH
不能
能
能
NH4Cl = NH4+ + Cl-
+
NH3·H2O
H2O OH- + H+
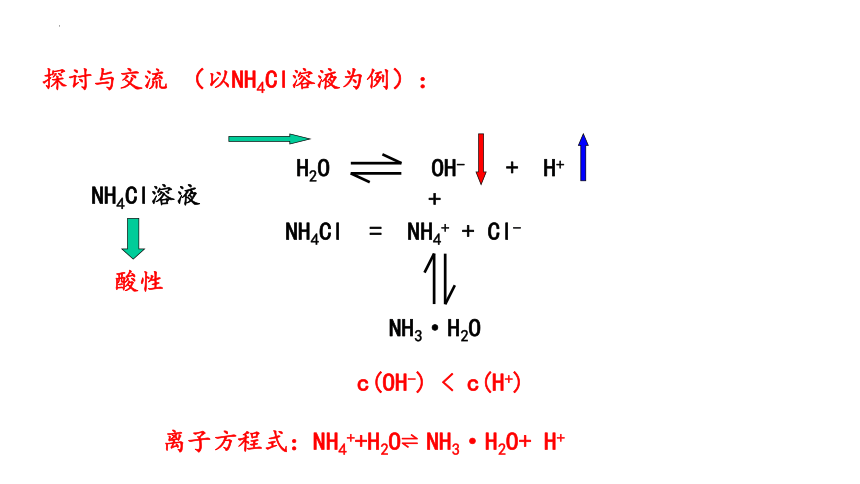
探讨与交流 (以NH4Cl溶液为例):
酸性
NH4Cl溶液
c(OH-) < c(H+)
离子方程式:NH4++H2O NH3·H2O+ H+
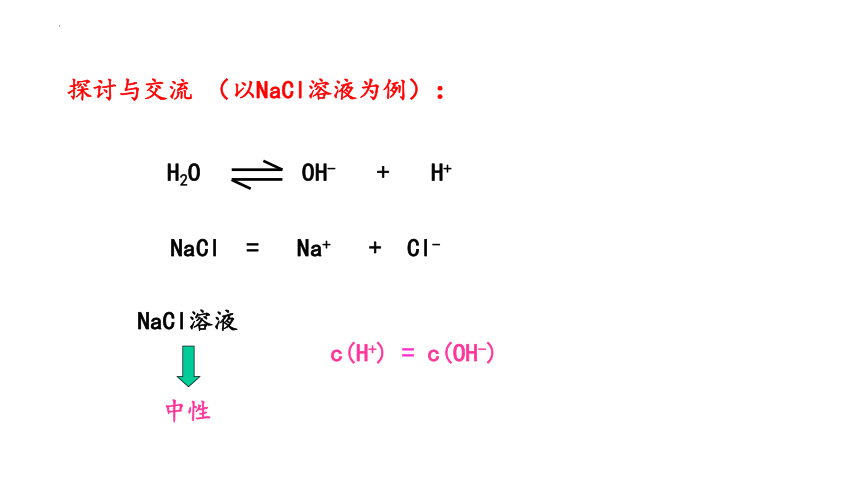
NaCl = Na+ + Cl-
H2O OH- + H+
c(H+) = c(OH-)
探讨与交流 (以NaCl溶液为例):
中性
NaCl溶液
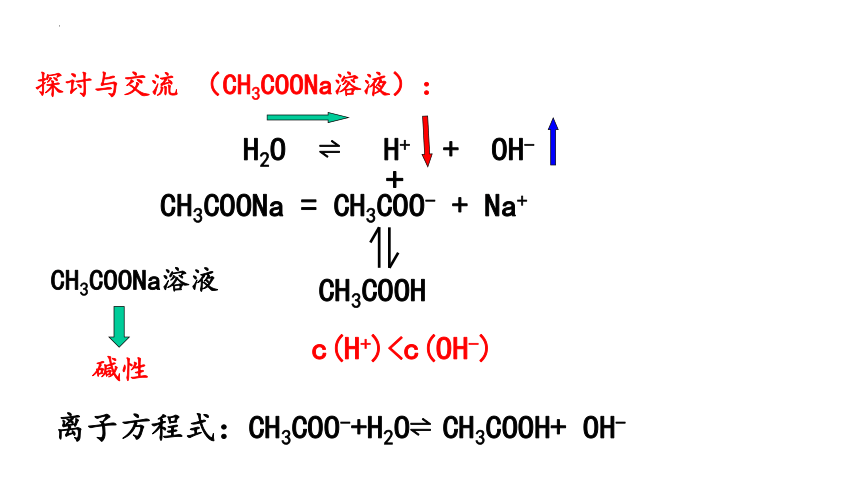
CH3COONa = CH3COO- + Na+
+
CH3COOH
探讨与交流 (CH3COONa溶液):
c(H+)碱性
CH3COONa溶液
H2O H+ + OH-
离子方程式:CH3COO-+H2O CH3COOH+ OH-
H2O H + + OH -
CH3COONa = Na+ + CH3COO-
NH4Cl = Cl- + NH4+
探讨与交流 (CH3COONa和NH4Cl的水解机理):
盐溶液呈不同酸碱性的原因:
盐类的水解
在溶液中盐电离出来的弱离子跟水所电离出来的 H+ 或 OH –结合生成弱电解质的反应,叫做盐类的水解。
(弱酸、弱碱)
1.概念:
盐 + 水 酸 + 碱
盐 + 水 酸 + 碱
盐易溶,有弱离子。
促进水的电离。
2.水解的条件:
3.水解的实质:
使 c (H+) ≠ c (OH–)
生成弱电解质;
4.水解的特点:
⑴ 可逆
⑵ 吸热
⑶ 一般很微弱
中和
水解
一般不用“↑”或“↓”;
一般不写“ ”,而写“ ”
,必有弱酸或弱碱生成
5.盐类水解的规律
无弱不水解。
谁强显谁性,
同强显中性。
有弱才水解,
越弱越水解,
都弱都水解。
升温,促进水的电离
加入酸或碱,抑制水的电离
稀释,促进水的电离
影响水的电离平衡的因素:
加入能水解的盐,促进水的电离
6.水解方程式的书写:
(1)盐类水解是可逆反应,反应方程式要写可逆符号 ;
(2)一般水解程度较小,水解产物很少,通常不生成气体和沉淀,不写↑↓符号,不稳定的生成物如H2CO3、NH3·H2O也不写分解产物
(4)多元弱碱盐分步水解但不分步书写方程式,一步书写到位。
HCO3 – + H2O H2CO3 + OH –
CO3 2– + H2O HCO3 – + OH –
(主)
(次)
(3)多元弱酸盐分步水解,第一步为主,水解方程式通常只写第一步
Al 3++3H2O Al(OH)3+3H+
如:AlCl3
强酸弱碱盐水解的离子方程式(通式):
Mn+ + n H2O M(OH)n + n H+
强碱弱酸盐水解的离子方程式(通式):
Rn- + H2O HR(n-1) - + OH-
(5)弱酸弱碱盐水解
1、一般的双水解:程度不是很大,阴阳离子仍能在溶液中大量共存的,如NH4HCO3、(NH4)2CO3
若不能同时产生沉淀和气体,水解不完全
进行“一般双水解”用
CH3COO– + NH4+ + H2O CH3COOH + NH3·H2O
若同时产生沉淀和气体,水解趋于完全
“完全双水解”的,用“ =”、“↑”、“↓”。
2、完全双水解:水解进行完全,阴阳离子不能在溶液中大量共存的:
①Al3+ 与 AlO2-、CO32-、HCO3- 、 HS-、S2-、SiO32-
② Fe3+ 与 AlO2-、CO32-、HCO3-
③ NH4+ 与 SiO32-、AlO2-
2Al3+ + 3S2- + 6H2O = 2Al(OH)3↓+3H2S↑
2Al3+ + 3CO32- + 3H2O = 2Al(OH)3↓+3CO2↑
Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓
Al3+ + 3HCO3-= Al(OH)3↓+3CO2 ↑
双水解的离子方程式的书写:
(1) Al3+ 与 CO32- (2) Al3+ 与 HCO3-
(3) Al3+ 与 S2- (4)Al3+ 与 AlO2-
(6)多元弱酸酸式酸根的水解与电离的区别:
⑴ NaHCO3
HCO3–+H2O H2CO3+OH–
①
②
HCO3–+H2O CO32–+H3O+
① 水解
② 电离
程度:
>
∴溶液呈 性
碱
⑵ NaHSO3
HSO3 –+H2O H2SO3+OH–
①
②
HSO3 –+H2O SO32– +H3O+
① 水解
② 电离
程度:
<
∴溶液呈 性
酸
⑶ NaH2PO4
溶液呈弱酸性
⑷ Na2HPO4
溶液呈弱碱性
[练习1]盐类水解的过程中正确的说法是( )
A、盐的电离平衡破坏
B、水的电离平衡发生移动
C、溶液的pH减小
D、没有发生中和反应
B
[练习3]常温下,下列溶液 pH小于7的是( )
A. KBr B. CuSO4 C. NaF D. Ba(NO3)2
[练习4]下列溶液显碱性的是( )
A. K2CO3 B. NaHSO4 C. Na2S D. FeCl3
[练习2]下列离子在水溶液中不会发生水解的是( )
A. NH4+ B. SO42_ C. Al3+ D. F_
B
B
AC
[练习5]在溶液中,不能发生水解的离子是( )
A、ClO – B、CO3 2 –
C、Fe 3+ D、SO4 2 –
D
[练习6]下列盐的水溶液中,哪些呈酸性( )
哪些呈碱性( )
① FeCl3 ② NaClO ③ (NH4)2SO4
④ AgNO3 ⑤ Na2S ⑥ K2SO4
①③④
②⑤
[练习7]下列物质分别加入到水中,因促进水的电离而使溶液呈酸性的是( )
A、硫酸 B、NaOH C、硫酸铝 D. 碳酸钠
C
酸性
碱性
[练习8]在Na2S溶液中,c (Na+) 与 c (S2–) 之比值( )于2。
A、大 B、小
C、等 D、无法确定
A
[练习9]在盐类的水解过程中,下列叙述正确的是( )
A. 盐的电离平衡被平破坏
B. 水的电离平衡被破坏
C. 没有中和反应发生
D. 溶液的pH值一定变大
B
[练习10]能使水的电离平衡向电离方向移动,并使溶液
中的c(H+) >c(OH-)的措施是( )
A. 向纯水中加入几滴稀盐酸
B. 将水加热煮沸
C. 向水中加入碳酸钠
D. 向水中加入氯化铵
D
[练习11]室温下pH=12的某溶液中,由水电离的c(OH—)为( )
A. 1.0×10-7mol/L B. 1.0×10-6mol/L
C. 1.0×10-2mol/L D. 1.0×10-12mol/L
C D
[练习12]下列盐的溶液哪些能发生盐类水解?
水解后溶液显什么性?
(NH4)2NO3 FeCl3 AgNO3
Na2SiO3
CuSO4
NaClO
Na2S
K2CO3
NaF
Na2SO3
KNO3
AlCl3
酸性
酸性
酸性
酸性
酸性
碱性
碱性
碱性
碱性
碱性
碱性
中性
[练习13]NaClO溶液和NaHCO3溶液显酸性还是碱性?
哪种溶液的碱性更强呢?为什么?
碱性
NaClO溶液
因为HClO的酸性比H2CO3弱,所以NaClO溶液的水解程度更大,溶液的碱性更强。
[练习14]下列水解离子方程式正确的是 ( )
A、Fe3++3H2O Fe(OH)3↓+3H+
B、Br-+H2O HBr+OH-
C、CO32-+H2O H2CO3+2OH-
D、NH4++ H2O NH3.H2O +H+
D
[练习15]判断下列盐溶液的酸碱性, 写出水解反应的离子方程式:KF、NH4NO3 、Na2SO4 、CuSO4 、NaHCO3、NaHSO4
KF: F— + H2O HF + OH— 呈碱性
NH4NO3 : NH4+ + H2O NH3·H2O + H+ 呈酸性
Na2SO4 : 不水解,呈中性
CuSO4 : Cu2+ + H2O Cu(OH)2 + 2H+ 呈酸性
NaHCO3: HCO3— + H2O H2CO3 + OH— 呈碱性
NaHSO4: 不水解,电离产生H+,呈酸性
[练习6](1)相同物质的量浓度的NaX、NaY、NaZ三种溶液的pH分别为7、8、9,则相同物质的量浓度的 HX、HY、HZ的酸性强弱顺序为 。
HX>HY>HZ
(2)K(HNO2) > K(CH3COOH) > K(HClO)推测相同浓度的 NaClO、CH3COONa、NaNO2溶液pH由大到小的顺序是:
NaClO > CH3COONa > NaNO2
分析:相同浓度的上述物质的溶液,水解程度越大,c(OH-)越大,pH越大;若要pH相同同,则水解程度越小的,所需溶质浓度越大。
(3)pH相同的 CH3COONa NaHCO3 Na2CO3溶液的物质的量浓度大小为______________。
CH3COONa > NaHCO3 > Na2CO3
[练习17]比较下列各组物质的溶液在同条件下pH值的大小: (1)Na2S和NaHS
(2)NaH2PO4,Na2HPO4和Na3PO4
[练习18]写出下列盐水解的离子方程式:
(1) NaF溶液 (2) Na2S溶液
(3) NH4Cl溶液 (4) Al2(SO4)3溶液
条 件
移动方向
H+数
pH
Fe3+水解率
升温
加水稀释
通HCl
填表:Fe3++3H2O Fe(OH)3+3H+
盐本身的性质(越弱越水解)
①盐的离子对应的酸或碱越弱,则水解程度越大。
②正盐离子比其对应酸式盐离子的水解程度大.
(1)内因:
HAc H2CO3
如酸性:
水解的能力
或者结合H+的能力:
Ac- HCO3-
水解能力:CO32- > HCO3-
7.影响盐类水解平衡的因素
>
<
①升温:
促进水解
②稀释:
(2)外因——化学平衡移动的原理:
促进水解
稀释使水解平衡正向移动,但由于加水溶液体积增大,溶液的酸性或者碱性减弱。
③加入物质:
酸可抑制阳离子水解,促进阴离子水解;
碱可抑制阴离子水解,促进阳离子水解。
[练习19]下列离子在溶液中能大量共存的是
A. Na+ 、H2PO4-、HPO42-、Cl-
B. Al3+、Cl2-、CO32-、NO3-
C. Fe3+ 、Na+ 、HCO- 、Cl-
D. AlO2-、Al3+、H+ 、 Cl-
A
[练习20]在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为a mol·L-1与b mol·L-1,则a和b的关系为( )。
A.a>b
B.a=10-4b
C.b=10-4a
D.a=b
B
[练习21]已知相同温度下,Ka(CH3COOH)>Ka(HClO)>Ka(HCN), 则等物质的量浓度①NaCN、②CH3COONa、③NaClO三种溶液,pH由大到小的顺序是( )。
A.①>②>③
B.②>①>③
C.②>③>①
D.①>③>②
D
水溶液中的离子反应与平衡
高中化学 / 人教版 / 选择性必修一/第三单元
3.3.1盐类的水解
学习目标
1.理解盐类水解的实质。
2.掌握强酸弱碱盐和强碱弱酸盐水解的规律。
3.会书写简单的盐类水解方程式。
新课导入
纯碱是什么
从组成上看是哪类物质
为什么叫纯碱
Na2CO3
盐类
其水溶液呈碱性
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
酸+碱==盐+水(中和反应)
酸
强酸
弱酸
弱碱
强碱
碱
生成的盐
1.强酸强碱盐
2.强酸弱碱盐
3.强碱弱酸盐
4.弱酸弱碱盐
NaCl、 K2SO4
FeCl3、NH4Cl
CH3COONH4、(NH4)2CO3
CH3COONa、K2CO3
新探究
H2O
酸性
酸
H2O
碱性
碱
H2O
?性
盐
盐溶液 NaCl Na2CO3 NH4Cl
酸碱性
盐类型
盐溶液 KNO3 CH3COONa (NH4)2SO4
酸碱性
盐类型
探究:盐溶液的酸碱性
中性
碱性
碱性
酸性
中性
酸性
强酸强碱盐
强碱弱酸盐
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
强酸弱碱盐
结论:盐的类型与盐溶液酸碱性的关系:
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
盐溶液酸碱性
中性
酸性
碱性
规律:谁强显谁性,同强显中性。
盐溶液有的显酸性,有的显碱性,还有的显中性。
为什么盐溶液可呈中性、酸性或碱性
盐溶液呈现不同酸碱性的原因
思考与交流
根据下表,对三类不同盐溶液中存在的各种粒子即粒子间的相互作用进行比较分析,从中找出不同类盐溶液呈现不同酸碱性的原因
盐 NaCl溶液 NH4Cl溶液 CH3COONa溶液
盐的类别
c(H+) c(OH-) 相对大小
溶液中的粒子
离子间能否相互作用生成弱电解质
强酸强碱盐
强酸弱碱盐
弱酸强碱盐
c(H+)=c(OH-)
c(H+)>c(OH-)
c(H+)
NH4+、H+、Cl-、OH-、NH3·H2O、H2O
H+、Na+、 OH-、CH3COO-、H2O、 CH3COOH
不能
能
能
NH4Cl = NH4+ + Cl-
+
NH3·H2O
H2O OH- + H+
探讨与交流 (以NH4Cl溶液为例):
酸性
NH4Cl溶液
c(OH-) < c(H+)
离子方程式:NH4++H2O NH3·H2O+ H+
NaCl = Na+ + Cl-
H2O OH- + H+
c(H+) = c(OH-)
探讨与交流 (以NaCl溶液为例):
中性
NaCl溶液
CH3COONa = CH3COO- + Na+
+
CH3COOH
探讨与交流 (CH3COONa溶液):
c(H+)
CH3COONa溶液
H2O H+ + OH-
离子方程式:CH3COO-+H2O CH3COOH+ OH-
H2O H + + OH -
CH3COONa = Na+ + CH3COO-
NH4Cl = Cl- + NH4+
探讨与交流 (CH3COONa和NH4Cl的水解机理):
盐溶液呈不同酸碱性的原因:
盐类的水解
在溶液中盐电离出来的弱离子跟水所电离出来的 H+ 或 OH –结合生成弱电解质的反应,叫做盐类的水解。
(弱酸、弱碱)
1.概念:
盐 + 水 酸 + 碱
盐 + 水 酸 + 碱
盐易溶,有弱离子。
促进水的电离。
2.水解的条件:
3.水解的实质:
使 c (H+) ≠ c (OH–)
生成弱电解质;
4.水解的特点:
⑴ 可逆
⑵ 吸热
⑶ 一般很微弱
中和
水解
一般不用“↑”或“↓”;
一般不写“ ”,而写“ ”
,必有弱酸或弱碱生成
5.盐类水解的规律
无弱不水解。
谁强显谁性,
同强显中性。
有弱才水解,
越弱越水解,
都弱都水解。
升温,促进水的电离
加入酸或碱,抑制水的电离
稀释,促进水的电离
影响水的电离平衡的因素:
加入能水解的盐,促进水的电离
6.水解方程式的书写:
(1)盐类水解是可逆反应,反应方程式要写可逆符号 ;
(2)一般水解程度较小,水解产物很少,通常不生成气体和沉淀,不写↑↓符号,不稳定的生成物如H2CO3、NH3·H2O也不写分解产物
(4)多元弱碱盐分步水解但不分步书写方程式,一步书写到位。
HCO3 – + H2O H2CO3 + OH –
CO3 2– + H2O HCO3 – + OH –
(主)
(次)
(3)多元弱酸盐分步水解,第一步为主,水解方程式通常只写第一步
Al 3++3H2O Al(OH)3+3H+
如:AlCl3
强酸弱碱盐水解的离子方程式(通式):
Mn+ + n H2O M(OH)n + n H+
强碱弱酸盐水解的离子方程式(通式):
Rn- + H2O HR(n-1) - + OH-
(5)弱酸弱碱盐水解
1、一般的双水解:程度不是很大,阴阳离子仍能在溶液中大量共存的,如NH4HCO3、(NH4)2CO3
若不能同时产生沉淀和气体,水解不完全
进行“一般双水解”用
CH3COO– + NH4+ + H2O CH3COOH + NH3·H2O
若同时产生沉淀和气体,水解趋于完全
“完全双水解”的,用“ =”、“↑”、“↓”。
2、完全双水解:水解进行完全,阴阳离子不能在溶液中大量共存的:
①Al3+ 与 AlO2-、CO32-、HCO3- 、 HS-、S2-、SiO32-
② Fe3+ 与 AlO2-、CO32-、HCO3-
③ NH4+ 与 SiO32-、AlO2-
2Al3+ + 3S2- + 6H2O = 2Al(OH)3↓+3H2S↑
2Al3+ + 3CO32- + 3H2O = 2Al(OH)3↓+3CO2↑
Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓
Al3+ + 3HCO3-= Al(OH)3↓+3CO2 ↑
双水解的离子方程式的书写:
(1) Al3+ 与 CO32- (2) Al3+ 与 HCO3-
(3) Al3+ 与 S2- (4)Al3+ 与 AlO2-
(6)多元弱酸酸式酸根的水解与电离的区别:
⑴ NaHCO3
HCO3–+H2O H2CO3+OH–
①
②
HCO3–+H2O CO32–+H3O+
① 水解
② 电离
程度:
>
∴溶液呈 性
碱
⑵ NaHSO3
HSO3 –+H2O H2SO3+OH–
①
②
HSO3 –+H2O SO32– +H3O+
① 水解
② 电离
程度:
<
∴溶液呈 性
酸
⑶ NaH2PO4
溶液呈弱酸性
⑷ Na2HPO4
溶液呈弱碱性
[练习1]盐类水解的过程中正确的说法是( )
A、盐的电离平衡破坏
B、水的电离平衡发生移动
C、溶液的pH减小
D、没有发生中和反应
B
[练习3]常温下,下列溶液 pH小于7的是( )
A. KBr B. CuSO4 C. NaF D. Ba(NO3)2
[练习4]下列溶液显碱性的是( )
A. K2CO3 B. NaHSO4 C. Na2S D. FeCl3
[练习2]下列离子在水溶液中不会发生水解的是( )
A. NH4+ B. SO42_ C. Al3+ D. F_
B
B
AC
[练习5]在溶液中,不能发生水解的离子是( )
A、ClO – B、CO3 2 –
C、Fe 3+ D、SO4 2 –
D
[练习6]下列盐的水溶液中,哪些呈酸性( )
哪些呈碱性( )
① FeCl3 ② NaClO ③ (NH4)2SO4
④ AgNO3 ⑤ Na2S ⑥ K2SO4
①③④
②⑤
[练习7]下列物质分别加入到水中,因促进水的电离而使溶液呈酸性的是( )
A、硫酸 B、NaOH C、硫酸铝 D. 碳酸钠
C
酸性
碱性
[练习8]在Na2S溶液中,c (Na+) 与 c (S2–) 之比值( )于2。
A、大 B、小
C、等 D、无法确定
A
[练习9]在盐类的水解过程中,下列叙述正确的是( )
A. 盐的电离平衡被平破坏
B. 水的电离平衡被破坏
C. 没有中和反应发生
D. 溶液的pH值一定变大
B
[练习10]能使水的电离平衡向电离方向移动,并使溶液
中的c(H+) >c(OH-)的措施是( )
A. 向纯水中加入几滴稀盐酸
B. 将水加热煮沸
C. 向水中加入碳酸钠
D. 向水中加入氯化铵
D
[练习11]室温下pH=12的某溶液中,由水电离的c(OH—)为( )
A. 1.0×10-7mol/L B. 1.0×10-6mol/L
C. 1.0×10-2mol/L D. 1.0×10-12mol/L
C D
[练习12]下列盐的溶液哪些能发生盐类水解?
水解后溶液显什么性?
(NH4)2NO3 FeCl3 AgNO3
Na2SiO3
CuSO4
NaClO
Na2S
K2CO3
NaF
Na2SO3
KNO3
AlCl3
酸性
酸性
酸性
酸性
酸性
碱性
碱性
碱性
碱性
碱性
碱性
中性
[练习13]NaClO溶液和NaHCO3溶液显酸性还是碱性?
哪种溶液的碱性更强呢?为什么?
碱性
NaClO溶液
因为HClO的酸性比H2CO3弱,所以NaClO溶液的水解程度更大,溶液的碱性更强。
[练习14]下列水解离子方程式正确的是 ( )
A、Fe3++3H2O Fe(OH)3↓+3H+
B、Br-+H2O HBr+OH-
C、CO32-+H2O H2CO3+2OH-
D、NH4++ H2O NH3.H2O +H+
D
[练习15]判断下列盐溶液的酸碱性, 写出水解反应的离子方程式:KF、NH4NO3 、Na2SO4 、CuSO4 、NaHCO3、NaHSO4
KF: F— + H2O HF + OH— 呈碱性
NH4NO3 : NH4+ + H2O NH3·H2O + H+ 呈酸性
Na2SO4 : 不水解,呈中性
CuSO4 : Cu2+ + H2O Cu(OH)2 + 2H+ 呈酸性
NaHCO3: HCO3— + H2O H2CO3 + OH— 呈碱性
NaHSO4: 不水解,电离产生H+,呈酸性
[练习6](1)相同物质的量浓度的NaX、NaY、NaZ三种溶液的pH分别为7、8、9,则相同物质的量浓度的 HX、HY、HZ的酸性强弱顺序为 。
HX>HY>HZ
(2)K(HNO2) > K(CH3COOH) > K(HClO)推测相同浓度的 NaClO、CH3COONa、NaNO2溶液pH由大到小的顺序是:
NaClO > CH3COONa > NaNO2
分析:相同浓度的上述物质的溶液,水解程度越大,c(OH-)越大,pH越大;若要pH相同同,则水解程度越小的,所需溶质浓度越大。
(3)pH相同的 CH3COONa NaHCO3 Na2CO3溶液的物质的量浓度大小为______________。
CH3COONa > NaHCO3 > Na2CO3
[练习17]比较下列各组物质的溶液在同条件下pH值的大小: (1)Na2S和NaHS
(2)NaH2PO4,Na2HPO4和Na3PO4
[练习18]写出下列盐水解的离子方程式:
(1) NaF溶液 (2) Na2S溶液
(3) NH4Cl溶液 (4) Al2(SO4)3溶液
条 件
移动方向
H+数
pH
Fe3+水解率
升温
加水稀释
通HCl
填表:Fe3++3H2O Fe(OH)3+3H+
盐本身的性质(越弱越水解)
①盐的离子对应的酸或碱越弱,则水解程度越大。
②正盐离子比其对应酸式盐离子的水解程度大.
(1)内因:
HAc H2CO3
如酸性:
水解的能力
或者结合H+的能力:
Ac- HCO3-
水解能力:CO32- > HCO3-
7.影响盐类水解平衡的因素
>
<
①升温:
促进水解
②稀释:
(2)外因——化学平衡移动的原理:
促进水解
稀释使水解平衡正向移动,但由于加水溶液体积增大,溶液的酸性或者碱性减弱。
③加入物质:
酸可抑制阳离子水解,促进阴离子水解;
碱可抑制阴离子水解,促进阳离子水解。
[练习19]下列离子在溶液中能大量共存的是
A. Na+ 、H2PO4-、HPO42-、Cl-
B. Al3+、Cl2-、CO32-、NO3-
C. Fe3+ 、Na+ 、HCO- 、Cl-
D. AlO2-、Al3+、H+ 、 Cl-
A
[练习20]在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为a mol·L-1与b mol·L-1,则a和b的关系为( )。
A.a>b
B.a=10-4b
C.b=10-4a
D.a=b
B
[练习21]已知相同温度下,Ka(CH3COOH)>Ka(HClO)>Ka(HCN), 则等物质的量浓度①NaCN、②CH3COONa、③NaClO三种溶液,pH由大到小的顺序是( )。
A.①>②>③
B.②>①>③
C.②>③>①
D.①>③>②
D
