(培优篇)2022-2023学年下学期初中化学人教版九年级第9单元练习卷(含解析)
文档属性
| 名称 | (培优篇)2022-2023学年下学期初中化学人教版九年级第9单元练习卷(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 366.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-28 12:44:50 | ||
图片预览


文档简介
(培优篇)2022-2023学年下学期
初中化学人教版九年级
第9单元练习卷
一.选择题(共9小题)
1.推理是一种常用的思维方法。下列推理正确的是( )
A.洗涤剂去除油污的原理是乳化,则汽油去除油污的原理也是乳化
B.铁粉能够被磁铁吸引,则能被磁铁吸引的黑色物质一定是铁粉
C.有声音产生一定有物体发生了振动,则物体振动一定能听到声音
D.同种元素的原子质子数相同,则质子数相同的原子一定是同种元素
2.把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.花生油 B.食盐 C.面粉 D.泥土
3.甲、乙、丙三种物质的溶解度曲线如图所示。下列说法不正确的是( )
A.P点表示t2℃时,甲、乙两种物质的溶解度相等
B.气体的溶解度随温度变化的趋势与丙相似
C.t3℃时,将40g甲物质加到50g水中充分溶解后,所得溶液的质量为85g
D.将t3℃时等质量的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液的溶剂质量:丙=甲>乙
4.一定质量某硝酸钾样品中不含可溶性杂质。在10℃时加水使之充分溶解,残留固体的质量为250g。该实验在40℃下进行时,残留固体质量为115g;70℃时为20g。已知KNO3在不同温度下的溶解度如下。对该样品的推断正确的是( )
温度/℃ 10 40 55 70
溶解度/g 20 65 100 140
A.该硝酸钾样品为纯净物
B.40℃时溶于水的硝酸钾为135g
C.70℃时KNO3溶液为饱和溶液
D.55℃左右时KNO3完全溶解
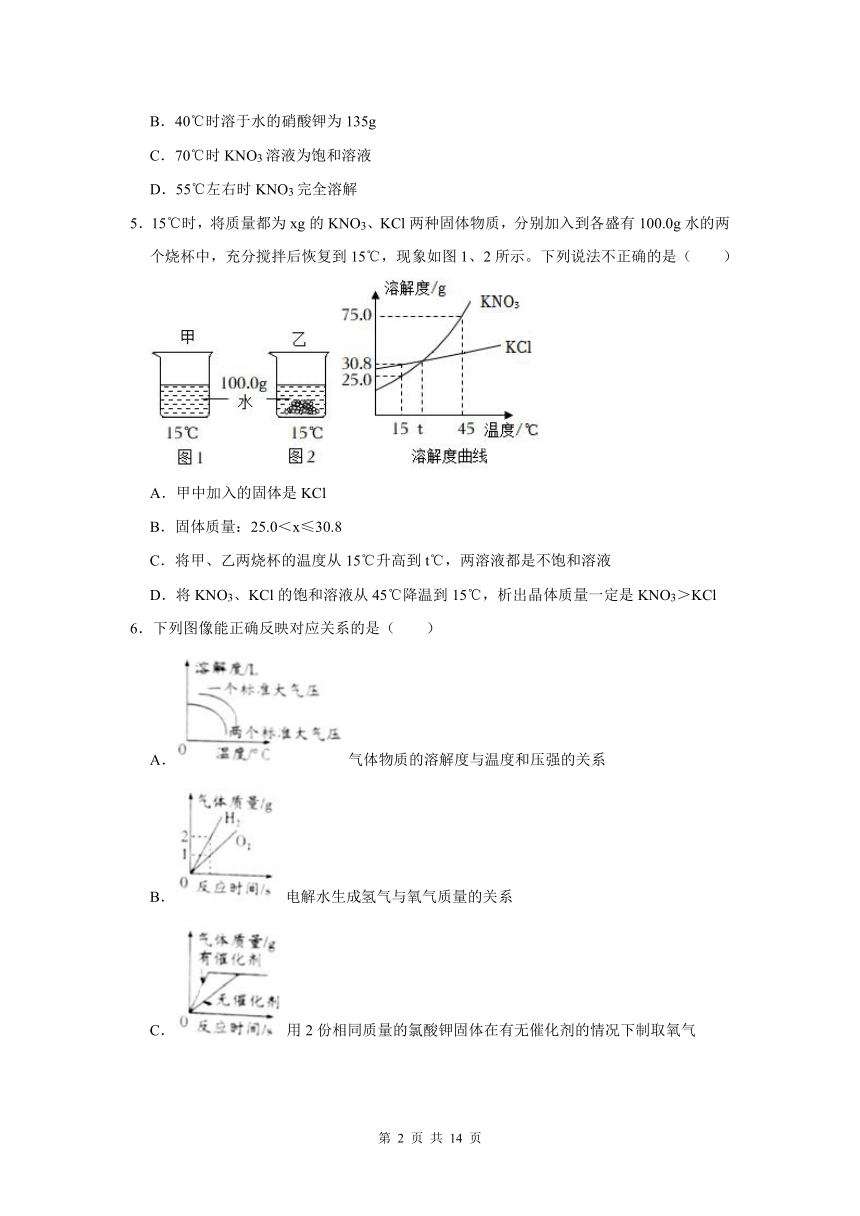
5.15℃时,将质量都为xg的KNO3、KCl两种固体物质,分别加入到各盛有100.0g水的两个烧杯中,充分搅拌后恢复到15℃,现象如图1、2所示。下列说法不正确的是( )
A.甲中加入的固体是KCl
B.固体质量:25.0<x≤30.8
C.将甲、乙两烧杯的温度从15℃升高到t℃,两溶液都是不饱和溶液
D.将KNO3、KCl的饱和溶液从45℃降温到15℃,析出晶体质量一定是KNO3>KCl
6.下列图像能正确反映对应关系的是( )
A.气体物质的溶解度与温度和压强的关系
B.电解水生成氢气与氧气质量的关系
C.用2份相同质量的氯酸钾固体在有无催化剂的情况下制取氧气
D.在一定体积的密闭容器中,一定量的硝酸铵固体与水混合
7.某溶液溶质的质量分数为10%,加入100g水后变为5%,则稀释后溶液中溶质的质量为( )
A.10g B.40g C.50g D.100g
8.要使50g溶质质量分数为10%的硝酸钾溶液的溶质质量分数变为20%,下列措施中:①再加入50g溶质质量分数为10%的硝酸钾溶液;②加入硝酸钾5g;③加入硝酸钾6.25g;④蒸发水25g;⑤加入水25g;⑥升温。可行的是( )
A.①③ B.③④ C.②⑤ D.②⑥
9.配制100g溶质的质量分数为16%的NaCl溶液。下列说法不正确的是( )
A.实验操作顺序为③⑤①④②
B.配制好的溶液倒出10mL,剩余溶液浓度变小
C.需称量NaCl的质量为16g
D.选用100mL量筒量取所需的水
10.下列有关溶液的说法正确的是( )
A.长期放置不分层的液体一定是溶液
B.饱和的氢氧化钙溶液久置于空气中,氢氧化钙的质量分数会变小
C.降低饱和溶液的温度,一定有晶体析出
D.配制好的6%的NaCl溶液,装入试剂瓶中时不慎撒漏一部分,浓度减小
二.填空题(共1小题)
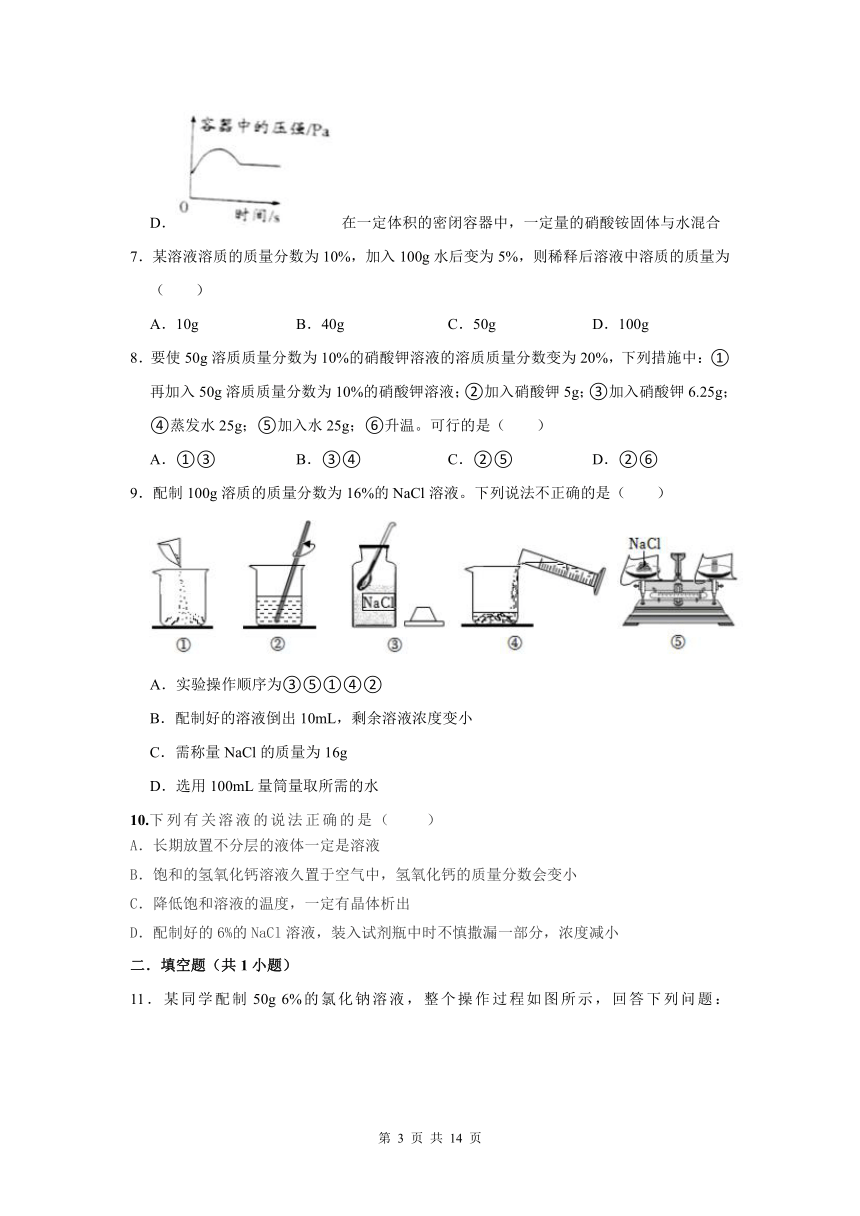
11.某同学配制50g 6%的氯化钠溶液,整个操作过程如图所示,回答下列问题:
(1)配制溶液的正确操作顺序为 (填序号,下同),其中操作错误的是 。
(2)图②中盛放氯化钠固体的仪器名称是 ,需称取氯化钠 g。
(3)量取水时选用的量筒的量程最合适的是 (填序号),读数时视线要与量筒内 保持水平。
A.10mL
B.25mL
C.50mL
D.100mL
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 (填序号)。
A.氯化钠固体不纯
B.用生锈砝码称量
C.装瓶时有少量溶液洒出
D.溶解时烧杯内壁有水珠
三.实验题
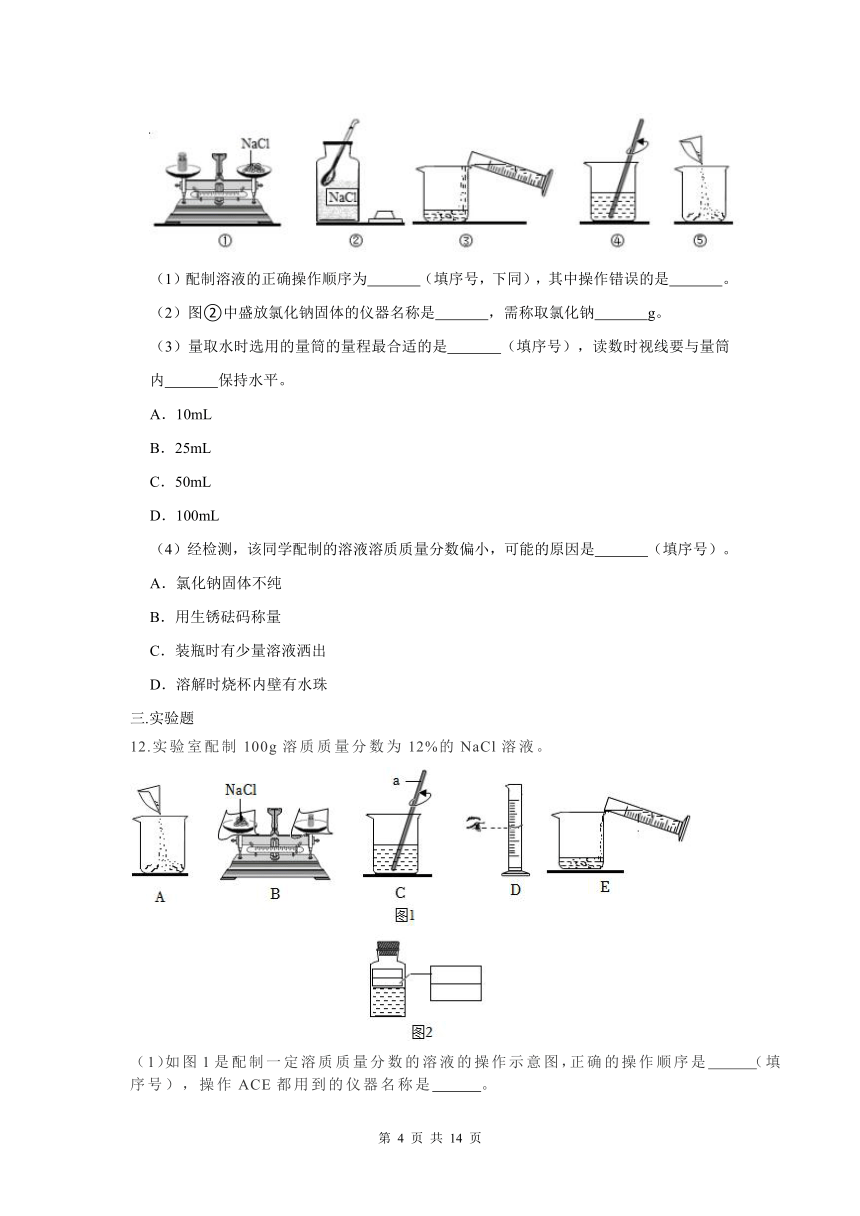
12.实验室配制100g溶质质量分数为12%的NaCl溶液。
(1)如图1是配制一定溶质质量分数的溶液的操作示意图,正确的操作顺序是 (填序号),操作ACE都用到的仪器名称是 。
(2)水的密度为1g/cm3,应量取水的体积是 mL,量水时选用的量筒的量程最合适的是 (填序号),读数时视线要与量筒内 保持水平。
A.10mL
B.25mL
C.50mL
D.100mL
(3)图中仪器a的名称为 ,在操作C中作用是 。
(4)配制好溶液后装入试剂瓶,贴上标签。请在如图2的标签中填上相应的内容。
(5)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 (填序号)。
①将称好的氯化钠固体转移到烧杯中时,有少量撒出
②用量筒量取水时,将量筒举过头顶读数
③装瓶时有少量溶液洒出
④盛装溶液的试剂瓶刷洗后未干燥
(6)若改用溶质质量分数为20%的氯化钠溶液来配制此溶液,需要此溶液的质量是 g。
(培优篇)2022-2023学年下学期
初中化学人教版九年级
第9单元练习卷
参考答案与试题解析
一.选择题(共9小题)
1.推理是一种常用的思维方法。下列推理正确的是( )
A.洗涤剂去除油污的原理是乳化,则汽油去除油污的原理也是乳化
B.铁粉能够被磁铁吸引,则能被磁铁吸引的黑色物质一定是铁粉
C.有声音产生一定有物体发生了振动,则物体振动一定能听到声音
D.同种元素的原子质子数相同,则质子数相同的原子一定是同种元素
【解答】解:A、洗涤剂去除油污的原理是乳化,而汽油去除油污的原理是汽油能溶解油污(相似相溶),利用的是溶解原理,故选项推理错误。
B、铁粉能够被磁铁吸引,磁铁矿的主要成分四氧化三铁也能被磁铁吸引,所以能被磁铁吸引的黑色物质不一定是铁粉,故选项推理错误。
C、有声音产生一定有物体发生了振动,而物体振动不一定能听到声音,比如蝴蝶振动翅膀产生的声音人听不到,真空中没有介质人也听不到声音,故选项推理错误。
D、元素是质子数(或核电荷数)相同的一类原子的总称,同种元素的原子质子数相同,则质子数相同的原子一定是同种元素,故选项推理正确。
故选:D。
2.把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.花生油 B.食盐 C.面粉 D.泥土
【解答】解:A、花生油不溶于水,与水混合形成乳浊液,故A错;
食盐易溶于水形成均一稳定的混合物,属于溶液,故B正确;
C、面粉不溶于水,与水混合形成悬浊液,故C错;
D、泥土不溶于水,与水混合形成悬浊液,故D错。
故选:B。
3.甲、乙、丙三种物质的溶解度曲线如图所示。下列说法不正确的是( )
A.P点表示t2℃时,甲、乙两种物质的溶解度相等
B.气体的溶解度随温度变化的趋势与丙相似
C.t3℃时,将40g甲物质加到50g水中充分溶解后,所得溶液的质量为85g
D.将t3℃时等质量的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液的溶剂质量:丙=甲>乙
【解答】解:A、通过分析溶解度曲线可知,P点表示t2℃时,甲、乙两种物质的溶解度相等,故A正确;
B、气体的溶解度随温度变化的趋势与丙相似,故B正确;
C、t3℃时,甲物质的溶解度是70g,所以将40g甲物质加到50g水中充分溶解后,只能溶解35g的晶体,所得溶液的质量为85g,故C正确;
D、t3℃时,甲物质的溶解度最大,丙物质的溶解度最小,等质量的甲、乙、丙三种物质的饱和溶液中,甲物质的溶剂最少,丙物质的溶剂最多,分别降温到t1℃,溶剂质量不变,所得溶液的溶剂质量:丙>乙>甲,故D错误。
故选:D。
4.一定质量某硝酸钾样品中不含可溶性杂质。在10℃时加水使之充分溶解,残留固体的质量为250g。该实验在40℃下进行时,残留固体质量为115g;70℃时为20g。已知KNO3在不同温度下的溶解度如下。对该样品的推断正确的是( )
温度/℃ 10 40 55 70
溶解度/g 20 65 100 140
A.该硝酸钾样品为纯净物
B.40℃时溶于水的硝酸钾为135g
C.70℃时KNO3溶液为饱和溶液
D.55℃左右时KNO3完全溶解
【解答】解:A、在10℃时加水使之充分溶解,残留固体的质量为250g,该实验在40℃下进行时,残留固体质量为115g;10℃时硝酸钾的溶解度为20g,40℃时硝酸钾的溶解度为
65g,每100g水中,最多再能溶解45g,从10℃到40℃,溶质溶解了135g,则水的质量是135g/45g×100g=300g;从40℃到70℃,每100g水中,最多再能溶解65g,300g水将多溶解溶质=65g×3=195g,但是从提供的数据可知,溶质只增加了115g﹣20g=95g,则70℃溶液不是饱和的,剩余20g为杂质;该硝酸钾样品为混合物,故选项说法错误。
B、40℃时溶于水的硝酸钾为300g/100g×65g=195g,故选项说法错误。
C、由A选项的分析,70℃时KNO3溶液为不饱和溶液,故选项说法错误。
D、根据溶质溶质增加100g时,此温度下的溶解度是x,,x≈98.3g,55℃硝酸钾的溶解度为100g,则在55℃时硝酸钾全部溶解,故选项说法正确。
故选:D。
5.15℃时,将质量都为xg的KNO3、KCl两种固体物质,分别加入到各盛有100.0g水的两个烧杯中,充分搅拌后恢复到15℃,现象如图1、2所示。下列说法不正确的是( )
A.甲中加入的固体是KCl
B.固体质量:25.0<x≤30.8
C.将甲、乙两烧杯的温度从15℃升高到t℃,两溶液都是不饱和溶液
D.将KNO3、KCl的饱和溶液从45℃降温到15℃,析出晶体质量一定是KNO3>KCl
【解答】解:A、15℃时,将等质量的KNO3、KCl分别加入到各盛有100.0g水的两个烧杯中,充分搅拌后恢复到15℃,乙有剩余,15℃时,KNO3的溶解度小于KCl的溶解度,所以甲中加入的固体是氯化钾,故A正确;
B、由于在15℃时硝酸钾的溶解度是25.0g,氯化钾的溶解度是30.8g,由溶图1和图2中解的情况可知,固体质量:25.0<x≤30.8,故B正确;
C、硝酸钾、氯化钾的溶解度随温度的升高而增大,所以将甲、乙两烧杯的温度从15℃升高到t℃,两溶液都是不饱和溶液,故C正确;
D、KNO3、KCl的饱和溶液的质量不能确定,所以从45℃降温到15℃,析出晶体质量也不能确定,故D错误。
故选:D。
6.下列图像能正确反映对应关系的是( )
A.气体物质的溶解度与温度和压强的关系
B.电解水生成氢气与氧气质量的关系
C.用2份相同质量的氯酸钾固体在有无催化剂的情况下制取氧气
D.在一定体积的密闭容器中,一定量的硝酸铵固体与水混合
【解答】解:A、气体的溶解度随温度的升高而减小,随着压强的增大而增大,故选项图象错误。
B、通电分解水,生成氢气和氧气的体积(而不是质量)之比为2:1,故选项图象错误。
C、2份相同质量的氯酸钾固体在有无催化剂的情况下制取氧气,催化剂只能影响反应速率,不影响产生氧气的质量,有催化剂的反应速率快,至完全反应所需时间短,故选项图象正确。
D、在一定体积的密闭容器中,一定量的硝酸铵固体与水混合,硝酸铵溶于水吸热,温度降低,压强减小,后压强逐渐恢复至常温,故选项图象错误。
故选:C。
7.某溶液溶质的质量分数为10%,加入100g水后变为5%,则稀释后溶液中溶质的质量为( )
A.10g B.40g C.50g D.100g
【解答】解:设稀释前溶液的质量为x,根据溶液稀释前后溶质的质量不变,可得:x×10%=(100g+x)×5%,解得:x=100g,所以稀释后溶液中溶质的质量为100g×10%=10g。
故选:A。
8.要使50g溶质质量分数为10%的硝酸钾溶液的溶质质量分数变为20%,下列措施中:①再加入50g溶质质量分数为10%的硝酸钾溶液;②加入硝酸钾5g;③加入硝酸钾6.25g;④蒸发水25g;⑤加入水25g;⑥升温。可行的是( )
A.①③ B.③④ C.②⑤ D.②⑥
【解答】解:①再加入50g溶质质量分数为10%的硝酸钾溶液,溶质质量分数仍然是10%,该选项不正确。
②加入硝酸钾5g,溶质质量是50g×10%+5g=10g,溶质质量分数是×100%≈18.2%,该选项不正确。
③加入硝酸钾6.25g,溶质质量分数是,该选项正确。
④蒸发水25g,溶质质量分数是,该选项正确。
⑤加入水25g,溶质质量分数是×100%≈6.7%,该选项不正确。
⑥升温后溶质质量分数仍然是10%,该选项不正确。
故选:B。
9.配制100g溶质的质量分数为16%的NaCl溶液。下列说法不正确的是( )
A.实验操作顺序为③⑤①④②
B.配制好的溶液倒出10mL,剩余溶液浓度变小
C.需称量NaCl的质量为16g
D.选用100mL量筒量取所需的水
【解答】解:A.配制溶质质量分数为16%的NaCl溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,实验操作顺序为③⑤①④②,故选项说法正确;
B、配制好的溶液倒出10 mL,剩余溶液浓度是不变的,因为溶液是均一的,故选项说法不正确;
C、溶质质量=溶液质量×溶质的质量分数,实验室配制100g16%的NaCl溶液,需氯化钠的质量=100g×16%=16.0g,故选项说法正确;
D、溶剂质量=溶液质量﹣溶质质量,所需氯化钠质量=100g×16%=16g,溶剂的质量为100g﹣16.0g=84.0g(合84.0mL),应用规格为100mL的量筒量取水的体积,故选项说法正确。
故选:B。
10.下列有关溶液的说法正确的是( )
A.长期放置不分层的液体一定是溶液
B.饱和的氢氧化钙溶液久置于空气中,氢氧化钙的质量分数会变小
C.降低饱和溶液的温度,一定有晶体析出
D.配制好的6%的NaCl溶液,装入试剂瓶中时不慎撒漏一部分,浓度减小
【解答】解:A.溶液的特征是均一、稳定的混合物,长期放置不分层的液体不一定是混合物,如水,故A错误;
B.饱和的氢氧化钙溶液久置于空气中发生的反应为CO2+Ca(OH)2=CaCO3↓+H2O,氢氧化钙被消耗,则氢氧化钙的质量分数会变小,故B正确;
C.若物质的溶解度随温度的升高而减小,升高该物质饱和溶液的温度,没有晶体析出,故C错误;
D.溶液是均一的,配制好的6%的NaCl溶液,装入试剂瓶中时不慎撒漏一部分,浓度不变,故D错误;
故选:B。
二.填空题(共1小题)
11.某同学配制50g 6%的氯化钠溶液,整个操作过程如图所示,回答下列问题:
(1)配制溶液的正确操作顺序为 ②①⑤③④ (填序号,下同),其中操作错误的是 ① 。
(2)图②中盛放氯化钠固体的仪器名称是 广口瓶 ,需称取氯化钠 3 g。
(3)量取水时选用的量筒的量程最合适的是 C (填序号),读数时视线要与量筒内 液体凹液面的最低处 保持水平。
A.10mL
B.25mL
C.50mL
D.100mL
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 AD (填序号)。
A.氯化钠固体不纯
B.用生锈砝码称量
C.装瓶时有少量溶液洒出
D.溶解时烧杯内壁有水珠
【解答】解:(1)实验室配制溶液的步骤是:计算、称量、量取、溶解和装瓶,所以正确操作顺序为:②①⑤③④;在用托盘天平称量固体药品时应左物右码,所以图中①是错误的;
(2)图②中盛放氯化钠固体的仪器名称是广口瓶;需称取氯化钠的质量为:50g×6%=3g;需要水的质量为:50g﹣3g=47g,水的体积为:47g÷1g/mL=47mL;
(3)从减小实验误差的角度去选择量筒的量程,量筒量程选择的依据有两点:一是保证测量一次,二是量程要与液体的取用量最接近,应选C;读数时视线要与量筒内液体凹液面的最低处保持水平;
(4)A.氯化钠固体不纯,使氯化钠的质量偏小,配制溶液溶质的质量分数偏小,故A正确;
B.砝码生锈,导致称量的氯化钠质量偏大,配制溶液溶质的质量分数偏大,故B错误;
C.因为溶液是均一的,稳定的,所以装瓶时有少量溶液洒出,对溶液的浓度无影响,故C错误;
D.溶解时烧杯内壁有水珠,使水的质量偏大,配制溶液溶质的质量分数偏小,故D正确。
故答案为:
(1)②①⑤③④;①;
(2)广口瓶;3;
(3)C;液体凹液面的最低处;
(4)AD
三、实验题
12.实验室配制100g溶质质量分数为12%的NaCl溶液。
(1)如图1是配制一定溶质质量分数的溶液的操作示意图,正确的操作顺序是BADEC(填序号),操作ACE都用到的仪器名称是烧杯。
(2)水的密度为1g/cm3,应量取水的体积是88mL,量水时选用的量筒的量程最合适的是 D(填序号),读数时视线要与量筒内 液体凹液面的最低处保持水平。
A.10mL
B.25mL
C.50mL
D.100mL
(3)图中仪器a的名称为玻璃棒,在操作C中作用是搅拌,加速溶解。
(4)配制好溶液后装入试剂瓶,贴上标签。请在如图2的标签中填上相应的内容。
(5)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是①②④(填序号)。
①将称好的氯化钠固体转移到烧杯中时,有少量撒出
②用量筒量取水时,将量筒举过头顶读数
③装瓶时有少量溶液洒出
④盛装溶液的试剂瓶刷洗后未干燥
(6)若改用溶质质量分数为20%的氯化钠溶液来配制此溶液,需要此溶液的质量是60g。
【解答】解:(1)配制氯化钠溶液的顺序是称取12克氯化钠,把氯化钠放入烧杯,量取88mL水,把水倒入烧杯,搅拌溶解,操作ACE都用到的仪器是烧杯,故答案为:BADEC;烧杯;
(2)溶质氯化钠质量为100×12%=12克,水的质量为100-12=88克,水的密度为1g/cm3,因此应量取水的体积是88mL,选用10mL、25mL、50mL量筒会增大误差,因此应选100mL规格的,量筒使用规范是视线要与量筒内液面的最低处保持水平,故答案为:88;D;液体凹液面最低处;
(3)仪器a是玻璃棒,在操作|C中的作用是搅拌溶液,加速氯化钠的溶解;
(4)配制好的溶液装入试剂瓶,需显示名称和质量分数,故答案为:;
(5)①称好的氯化钠固体转移到烧杯中时,有少量撒出,则溶质质量较少,配制的溶液溶质质量分数偏小,故符合题意;
②用量筒量取水时,将量筒举过头顶读数,所得水大于读数,溶剂质量增大,则配制的溶液溶质质量分数偏,故符合题意;
③溶液配制完成后,溶质质量分数不因洒出而变化,故不符合题意;
④盛装溶液的试剂瓶刷洗后未干燥溶,剂质量增大,则配制的溶液溶质质量分数偏,故符合题意;
故选:①②④;
(6)已知配制此溶液需氯化钠12克,设需要质量分数为20%的氯化钠溶液质量为x,则x×20%=12,求得x=60克,故答案为60。
初中化学人教版九年级
第9单元练习卷
一.选择题(共9小题)
1.推理是一种常用的思维方法。下列推理正确的是( )
A.洗涤剂去除油污的原理是乳化,则汽油去除油污的原理也是乳化
B.铁粉能够被磁铁吸引,则能被磁铁吸引的黑色物质一定是铁粉
C.有声音产生一定有物体发生了振动,则物体振动一定能听到声音
D.同种元素的原子质子数相同,则质子数相同的原子一定是同种元素
2.把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.花生油 B.食盐 C.面粉 D.泥土
3.甲、乙、丙三种物质的溶解度曲线如图所示。下列说法不正确的是( )
A.P点表示t2℃时,甲、乙两种物质的溶解度相等
B.气体的溶解度随温度变化的趋势与丙相似
C.t3℃时,将40g甲物质加到50g水中充分溶解后,所得溶液的质量为85g
D.将t3℃时等质量的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液的溶剂质量:丙=甲>乙
4.一定质量某硝酸钾样品中不含可溶性杂质。在10℃时加水使之充分溶解,残留固体的质量为250g。该实验在40℃下进行时,残留固体质量为115g;70℃时为20g。已知KNO3在不同温度下的溶解度如下。对该样品的推断正确的是( )
温度/℃ 10 40 55 70
溶解度/g 20 65 100 140
A.该硝酸钾样品为纯净物
B.40℃时溶于水的硝酸钾为135g
C.70℃时KNO3溶液为饱和溶液
D.55℃左右时KNO3完全溶解
5.15℃时,将质量都为xg的KNO3、KCl两种固体物质,分别加入到各盛有100.0g水的两个烧杯中,充分搅拌后恢复到15℃,现象如图1、2所示。下列说法不正确的是( )
A.甲中加入的固体是KCl
B.固体质量:25.0<x≤30.8
C.将甲、乙两烧杯的温度从15℃升高到t℃,两溶液都是不饱和溶液
D.将KNO3、KCl的饱和溶液从45℃降温到15℃,析出晶体质量一定是KNO3>KCl
6.下列图像能正确反映对应关系的是( )
A.气体物质的溶解度与温度和压强的关系
B.电解水生成氢气与氧气质量的关系
C.用2份相同质量的氯酸钾固体在有无催化剂的情况下制取氧气
D.在一定体积的密闭容器中,一定量的硝酸铵固体与水混合
7.某溶液溶质的质量分数为10%,加入100g水后变为5%,则稀释后溶液中溶质的质量为( )
A.10g B.40g C.50g D.100g
8.要使50g溶质质量分数为10%的硝酸钾溶液的溶质质量分数变为20%,下列措施中:①再加入50g溶质质量分数为10%的硝酸钾溶液;②加入硝酸钾5g;③加入硝酸钾6.25g;④蒸发水25g;⑤加入水25g;⑥升温。可行的是( )
A.①③ B.③④ C.②⑤ D.②⑥
9.配制100g溶质的质量分数为16%的NaCl溶液。下列说法不正确的是( )
A.实验操作顺序为③⑤①④②
B.配制好的溶液倒出10mL,剩余溶液浓度变小
C.需称量NaCl的质量为16g
D.选用100mL量筒量取所需的水
10.下列有关溶液的说法正确的是( )
A.长期放置不分层的液体一定是溶液
B.饱和的氢氧化钙溶液久置于空气中,氢氧化钙的质量分数会变小
C.降低饱和溶液的温度,一定有晶体析出
D.配制好的6%的NaCl溶液,装入试剂瓶中时不慎撒漏一部分,浓度减小
二.填空题(共1小题)
11.某同学配制50g 6%的氯化钠溶液,整个操作过程如图所示,回答下列问题:
(1)配制溶液的正确操作顺序为 (填序号,下同),其中操作错误的是 。
(2)图②中盛放氯化钠固体的仪器名称是 ,需称取氯化钠 g。
(3)量取水时选用的量筒的量程最合适的是 (填序号),读数时视线要与量筒内 保持水平。
A.10mL
B.25mL
C.50mL
D.100mL
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 (填序号)。
A.氯化钠固体不纯
B.用生锈砝码称量
C.装瓶时有少量溶液洒出
D.溶解时烧杯内壁有水珠
三.实验题
12.实验室配制100g溶质质量分数为12%的NaCl溶液。
(1)如图1是配制一定溶质质量分数的溶液的操作示意图,正确的操作顺序是 (填序号),操作ACE都用到的仪器名称是 。
(2)水的密度为1g/cm3,应量取水的体积是 mL,量水时选用的量筒的量程最合适的是 (填序号),读数时视线要与量筒内 保持水平。
A.10mL
B.25mL
C.50mL
D.100mL
(3)图中仪器a的名称为 ,在操作C中作用是 。
(4)配制好溶液后装入试剂瓶,贴上标签。请在如图2的标签中填上相应的内容。
(5)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 (填序号)。
①将称好的氯化钠固体转移到烧杯中时,有少量撒出
②用量筒量取水时,将量筒举过头顶读数
③装瓶时有少量溶液洒出
④盛装溶液的试剂瓶刷洗后未干燥
(6)若改用溶质质量分数为20%的氯化钠溶液来配制此溶液,需要此溶液的质量是 g。
(培优篇)2022-2023学年下学期
初中化学人教版九年级
第9单元练习卷
参考答案与试题解析
一.选择题(共9小题)
1.推理是一种常用的思维方法。下列推理正确的是( )
A.洗涤剂去除油污的原理是乳化,则汽油去除油污的原理也是乳化
B.铁粉能够被磁铁吸引,则能被磁铁吸引的黑色物质一定是铁粉
C.有声音产生一定有物体发生了振动,则物体振动一定能听到声音
D.同种元素的原子质子数相同,则质子数相同的原子一定是同种元素
【解答】解:A、洗涤剂去除油污的原理是乳化,而汽油去除油污的原理是汽油能溶解油污(相似相溶),利用的是溶解原理,故选项推理错误。
B、铁粉能够被磁铁吸引,磁铁矿的主要成分四氧化三铁也能被磁铁吸引,所以能被磁铁吸引的黑色物质不一定是铁粉,故选项推理错误。
C、有声音产生一定有物体发生了振动,而物体振动不一定能听到声音,比如蝴蝶振动翅膀产生的声音人听不到,真空中没有介质人也听不到声音,故选项推理错误。
D、元素是质子数(或核电荷数)相同的一类原子的总称,同种元素的原子质子数相同,则质子数相同的原子一定是同种元素,故选项推理正确。
故选:D。
2.把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.花生油 B.食盐 C.面粉 D.泥土
【解答】解:A、花生油不溶于水,与水混合形成乳浊液,故A错;
食盐易溶于水形成均一稳定的混合物,属于溶液,故B正确;
C、面粉不溶于水,与水混合形成悬浊液,故C错;
D、泥土不溶于水,与水混合形成悬浊液,故D错。
故选:B。
3.甲、乙、丙三种物质的溶解度曲线如图所示。下列说法不正确的是( )
A.P点表示t2℃时,甲、乙两种物质的溶解度相等
B.气体的溶解度随温度变化的趋势与丙相似
C.t3℃时,将40g甲物质加到50g水中充分溶解后,所得溶液的质量为85g
D.将t3℃时等质量的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液的溶剂质量:丙=甲>乙
【解答】解:A、通过分析溶解度曲线可知,P点表示t2℃时,甲、乙两种物质的溶解度相等,故A正确;
B、气体的溶解度随温度变化的趋势与丙相似,故B正确;
C、t3℃时,甲物质的溶解度是70g,所以将40g甲物质加到50g水中充分溶解后,只能溶解35g的晶体,所得溶液的质量为85g,故C正确;
D、t3℃时,甲物质的溶解度最大,丙物质的溶解度最小,等质量的甲、乙、丙三种物质的饱和溶液中,甲物质的溶剂最少,丙物质的溶剂最多,分别降温到t1℃,溶剂质量不变,所得溶液的溶剂质量:丙>乙>甲,故D错误。
故选:D。
4.一定质量某硝酸钾样品中不含可溶性杂质。在10℃时加水使之充分溶解,残留固体的质量为250g。该实验在40℃下进行时,残留固体质量为115g;70℃时为20g。已知KNO3在不同温度下的溶解度如下。对该样品的推断正确的是( )
温度/℃ 10 40 55 70
溶解度/g 20 65 100 140
A.该硝酸钾样品为纯净物
B.40℃时溶于水的硝酸钾为135g
C.70℃时KNO3溶液为饱和溶液
D.55℃左右时KNO3完全溶解
【解答】解:A、在10℃时加水使之充分溶解,残留固体的质量为250g,该实验在40℃下进行时,残留固体质量为115g;10℃时硝酸钾的溶解度为20g,40℃时硝酸钾的溶解度为
65g,每100g水中,最多再能溶解45g,从10℃到40℃,溶质溶解了135g,则水的质量是135g/45g×100g=300g;从40℃到70℃,每100g水中,最多再能溶解65g,300g水将多溶解溶质=65g×3=195g,但是从提供的数据可知,溶质只增加了115g﹣20g=95g,则70℃溶液不是饱和的,剩余20g为杂质;该硝酸钾样品为混合物,故选项说法错误。
B、40℃时溶于水的硝酸钾为300g/100g×65g=195g,故选项说法错误。
C、由A选项的分析,70℃时KNO3溶液为不饱和溶液,故选项说法错误。
D、根据溶质溶质增加100g时,此温度下的溶解度是x,,x≈98.3g,55℃硝酸钾的溶解度为100g,则在55℃时硝酸钾全部溶解,故选项说法正确。
故选:D。
5.15℃时,将质量都为xg的KNO3、KCl两种固体物质,分别加入到各盛有100.0g水的两个烧杯中,充分搅拌后恢复到15℃,现象如图1、2所示。下列说法不正确的是( )
A.甲中加入的固体是KCl
B.固体质量:25.0<x≤30.8
C.将甲、乙两烧杯的温度从15℃升高到t℃,两溶液都是不饱和溶液
D.将KNO3、KCl的饱和溶液从45℃降温到15℃,析出晶体质量一定是KNO3>KCl
【解答】解:A、15℃时,将等质量的KNO3、KCl分别加入到各盛有100.0g水的两个烧杯中,充分搅拌后恢复到15℃,乙有剩余,15℃时,KNO3的溶解度小于KCl的溶解度,所以甲中加入的固体是氯化钾,故A正确;
B、由于在15℃时硝酸钾的溶解度是25.0g,氯化钾的溶解度是30.8g,由溶图1和图2中解的情况可知,固体质量:25.0<x≤30.8,故B正确;
C、硝酸钾、氯化钾的溶解度随温度的升高而增大,所以将甲、乙两烧杯的温度从15℃升高到t℃,两溶液都是不饱和溶液,故C正确;
D、KNO3、KCl的饱和溶液的质量不能确定,所以从45℃降温到15℃,析出晶体质量也不能确定,故D错误。
故选:D。
6.下列图像能正确反映对应关系的是( )
A.气体物质的溶解度与温度和压强的关系
B.电解水生成氢气与氧气质量的关系
C.用2份相同质量的氯酸钾固体在有无催化剂的情况下制取氧气
D.在一定体积的密闭容器中,一定量的硝酸铵固体与水混合
【解答】解:A、气体的溶解度随温度的升高而减小,随着压强的增大而增大,故选项图象错误。
B、通电分解水,生成氢气和氧气的体积(而不是质量)之比为2:1,故选项图象错误。
C、2份相同质量的氯酸钾固体在有无催化剂的情况下制取氧气,催化剂只能影响反应速率,不影响产生氧气的质量,有催化剂的反应速率快,至完全反应所需时间短,故选项图象正确。
D、在一定体积的密闭容器中,一定量的硝酸铵固体与水混合,硝酸铵溶于水吸热,温度降低,压强减小,后压强逐渐恢复至常温,故选项图象错误。
故选:C。
7.某溶液溶质的质量分数为10%,加入100g水后变为5%,则稀释后溶液中溶质的质量为( )
A.10g B.40g C.50g D.100g
【解答】解:设稀释前溶液的质量为x,根据溶液稀释前后溶质的质量不变,可得:x×10%=(100g+x)×5%,解得:x=100g,所以稀释后溶液中溶质的质量为100g×10%=10g。
故选:A。
8.要使50g溶质质量分数为10%的硝酸钾溶液的溶质质量分数变为20%,下列措施中:①再加入50g溶质质量分数为10%的硝酸钾溶液;②加入硝酸钾5g;③加入硝酸钾6.25g;④蒸发水25g;⑤加入水25g;⑥升温。可行的是( )
A.①③ B.③④ C.②⑤ D.②⑥
【解答】解:①再加入50g溶质质量分数为10%的硝酸钾溶液,溶质质量分数仍然是10%,该选项不正确。
②加入硝酸钾5g,溶质质量是50g×10%+5g=10g,溶质质量分数是×100%≈18.2%,该选项不正确。
③加入硝酸钾6.25g,溶质质量分数是,该选项正确。
④蒸发水25g,溶质质量分数是,该选项正确。
⑤加入水25g,溶质质量分数是×100%≈6.7%,该选项不正确。
⑥升温后溶质质量分数仍然是10%,该选项不正确。
故选:B。
9.配制100g溶质的质量分数为16%的NaCl溶液。下列说法不正确的是( )
A.实验操作顺序为③⑤①④②
B.配制好的溶液倒出10mL,剩余溶液浓度变小
C.需称量NaCl的质量为16g
D.选用100mL量筒量取所需的水
【解答】解:A.配制溶质质量分数为16%的NaCl溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,实验操作顺序为③⑤①④②,故选项说法正确;
B、配制好的溶液倒出10 mL,剩余溶液浓度是不变的,因为溶液是均一的,故选项说法不正确;
C、溶质质量=溶液质量×溶质的质量分数,实验室配制100g16%的NaCl溶液,需氯化钠的质量=100g×16%=16.0g,故选项说法正确;
D、溶剂质量=溶液质量﹣溶质质量,所需氯化钠质量=100g×16%=16g,溶剂的质量为100g﹣16.0g=84.0g(合84.0mL),应用规格为100mL的量筒量取水的体积,故选项说法正确。
故选:B。
10.下列有关溶液的说法正确的是( )
A.长期放置不分层的液体一定是溶液
B.饱和的氢氧化钙溶液久置于空气中,氢氧化钙的质量分数会变小
C.降低饱和溶液的温度,一定有晶体析出
D.配制好的6%的NaCl溶液,装入试剂瓶中时不慎撒漏一部分,浓度减小
【解答】解:A.溶液的特征是均一、稳定的混合物,长期放置不分层的液体不一定是混合物,如水,故A错误;
B.饱和的氢氧化钙溶液久置于空气中发生的反应为CO2+Ca(OH)2=CaCO3↓+H2O,氢氧化钙被消耗,则氢氧化钙的质量分数会变小,故B正确;
C.若物质的溶解度随温度的升高而减小,升高该物质饱和溶液的温度,没有晶体析出,故C错误;
D.溶液是均一的,配制好的6%的NaCl溶液,装入试剂瓶中时不慎撒漏一部分,浓度不变,故D错误;
故选:B。
二.填空题(共1小题)
11.某同学配制50g 6%的氯化钠溶液,整个操作过程如图所示,回答下列问题:
(1)配制溶液的正确操作顺序为 ②①⑤③④ (填序号,下同),其中操作错误的是 ① 。
(2)图②中盛放氯化钠固体的仪器名称是 广口瓶 ,需称取氯化钠 3 g。
(3)量取水时选用的量筒的量程最合适的是 C (填序号),读数时视线要与量筒内 液体凹液面的最低处 保持水平。
A.10mL
B.25mL
C.50mL
D.100mL
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 AD (填序号)。
A.氯化钠固体不纯
B.用生锈砝码称量
C.装瓶时有少量溶液洒出
D.溶解时烧杯内壁有水珠
【解答】解:(1)实验室配制溶液的步骤是:计算、称量、量取、溶解和装瓶,所以正确操作顺序为:②①⑤③④;在用托盘天平称量固体药品时应左物右码,所以图中①是错误的;
(2)图②中盛放氯化钠固体的仪器名称是广口瓶;需称取氯化钠的质量为:50g×6%=3g;需要水的质量为:50g﹣3g=47g,水的体积为:47g÷1g/mL=47mL;
(3)从减小实验误差的角度去选择量筒的量程,量筒量程选择的依据有两点:一是保证测量一次,二是量程要与液体的取用量最接近,应选C;读数时视线要与量筒内液体凹液面的最低处保持水平;
(4)A.氯化钠固体不纯,使氯化钠的质量偏小,配制溶液溶质的质量分数偏小,故A正确;
B.砝码生锈,导致称量的氯化钠质量偏大,配制溶液溶质的质量分数偏大,故B错误;
C.因为溶液是均一的,稳定的,所以装瓶时有少量溶液洒出,对溶液的浓度无影响,故C错误;
D.溶解时烧杯内壁有水珠,使水的质量偏大,配制溶液溶质的质量分数偏小,故D正确。
故答案为:
(1)②①⑤③④;①;
(2)广口瓶;3;
(3)C;液体凹液面的最低处;
(4)AD
三、实验题
12.实验室配制100g溶质质量分数为12%的NaCl溶液。
(1)如图1是配制一定溶质质量分数的溶液的操作示意图,正确的操作顺序是BADEC(填序号),操作ACE都用到的仪器名称是烧杯。
(2)水的密度为1g/cm3,应量取水的体积是88mL,量水时选用的量筒的量程最合适的是 D(填序号),读数时视线要与量筒内 液体凹液面的最低处保持水平。
A.10mL
B.25mL
C.50mL
D.100mL
(3)图中仪器a的名称为玻璃棒,在操作C中作用是搅拌,加速溶解。
(4)配制好溶液后装入试剂瓶,贴上标签。请在如图2的标签中填上相应的内容。
(5)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是①②④(填序号)。
①将称好的氯化钠固体转移到烧杯中时,有少量撒出
②用量筒量取水时,将量筒举过头顶读数
③装瓶时有少量溶液洒出
④盛装溶液的试剂瓶刷洗后未干燥
(6)若改用溶质质量分数为20%的氯化钠溶液来配制此溶液,需要此溶液的质量是60g。
【解答】解:(1)配制氯化钠溶液的顺序是称取12克氯化钠,把氯化钠放入烧杯,量取88mL水,把水倒入烧杯,搅拌溶解,操作ACE都用到的仪器是烧杯,故答案为:BADEC;烧杯;
(2)溶质氯化钠质量为100×12%=12克,水的质量为100-12=88克,水的密度为1g/cm3,因此应量取水的体积是88mL,选用10mL、25mL、50mL量筒会增大误差,因此应选100mL规格的,量筒使用规范是视线要与量筒内液面的最低处保持水平,故答案为:88;D;液体凹液面最低处;
(3)仪器a是玻璃棒,在操作|C中的作用是搅拌溶液,加速氯化钠的溶解;
(4)配制好的溶液装入试剂瓶,需显示名称和质量分数,故答案为:;
(5)①称好的氯化钠固体转移到烧杯中时,有少量撒出,则溶质质量较少,配制的溶液溶质质量分数偏小,故符合题意;
②用量筒量取水时,将量筒举过头顶读数,所得水大于读数,溶剂质量增大,则配制的溶液溶质质量分数偏,故符合题意;
③溶液配制完成后,溶质质量分数不因洒出而变化,故不符合题意;
④盛装溶液的试剂瓶刷洗后未干燥溶,剂质量增大,则配制的溶液溶质质量分数偏,故符合题意;
故选:①②④;
(6)已知配制此溶液需氯化钠12克,设需要质量分数为20%的氯化钠溶液质量为x,则x×20%=12,求得x=60克,故答案为60。
同课章节目录
