化学人教版九下:9.2溶解度(第二课时)课件(共20张PPT)
文档属性
| 名称 | 化学人教版九下:9.2溶解度(第二课时)课件(共20张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 825.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-29 00:00:00 | ||
图片预览





文档简介
(共20张PPT)
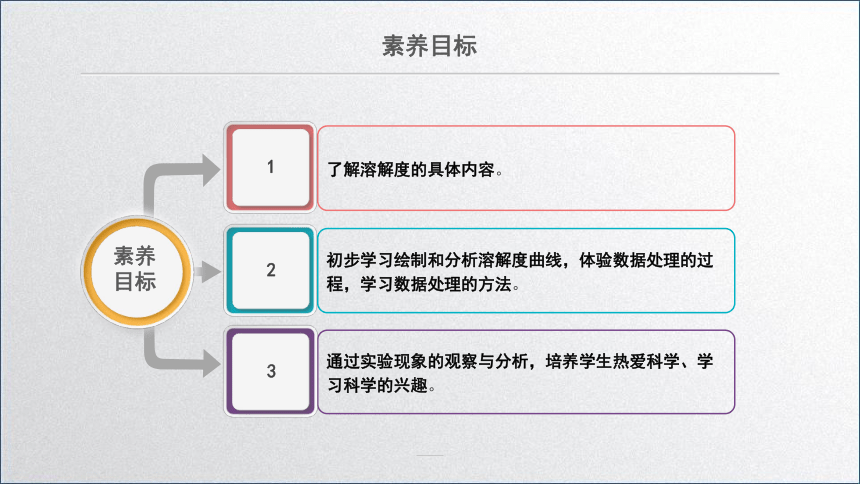
素养目标
了解溶解度的具体内容。
初步学习绘制和分析溶解度曲线,体验数据处理的过程,学习数据处理的方法。
通过实验现象的观察与分析,培养学生热爱科学、学习科学的兴趣。
素养
目标
1
2
3
新课导入
什么前提条件下讨论溶液的饱和与不饱和溶液才有确定意义?
一定温度、一定量的溶剂
在课题1的学习中,我们就明白:不同溶质在同种溶剂中溶解能力不同,同种溶质在不同溶剂中溶解能力也不同。这节课我们就来从量的角度研究物质的溶解能力。
知识点1 溶解度
固体溶解度
在 下,某固体物质在 里达到 状态时所溶解的溶质的质量克数。
一定温度
100 g溶剂
饱和
条件:
一定温度
标准:
100 g溶剂(一般指水)
状态:
饱和
溶质单位:
克
知识点1 溶解度
讨论:20℃时硝酸钾的溶解度为31.6 g,这句话的含义
温度
溶质的质量
溶剂的质量
饱和溶液的质量
20℃
31.6 g
100 g
131.6 g
知识点1 溶解度
溶解度与溶解性的关系
溶解性 易溶 可溶 微溶 难溶
溶解度/g (20℃) >10 1~10 0.01~1 <0.01
知识点1 溶解度
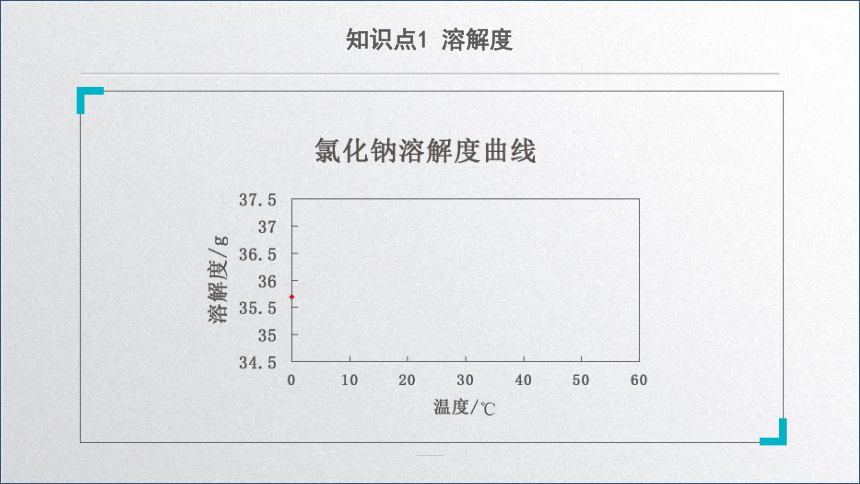
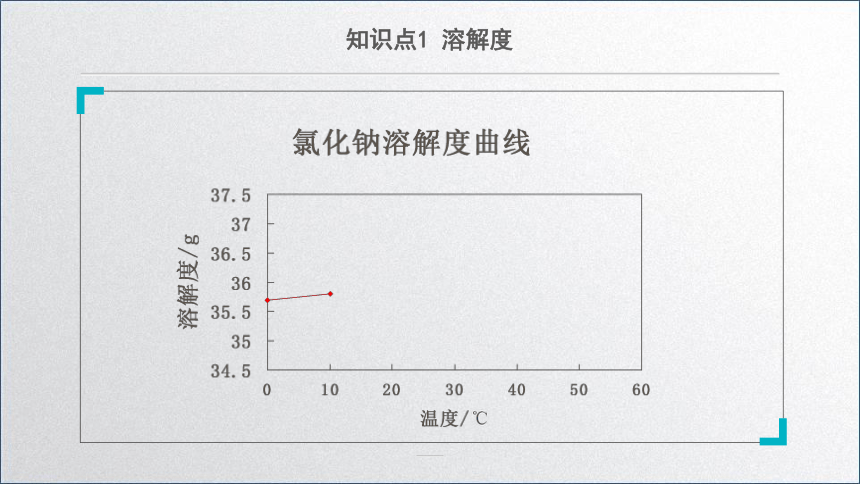
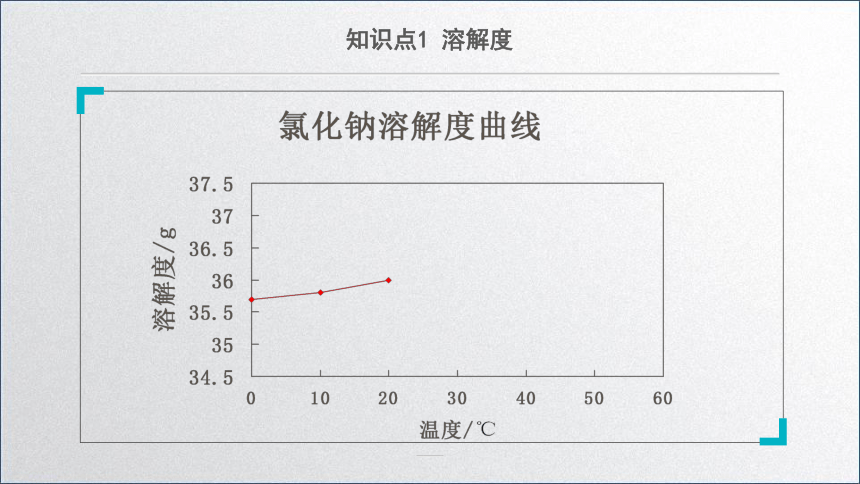
溶解度曲线
用纵坐标表示溶解度,用横坐标表示温度。
通过绘制、观察氯化钠溶解度曲线,你得到什么信息?
温度
溶解度
知识点1 溶解度
知识点1 溶解度
知识点1 溶解度
知识点1 溶解度
知识点1 溶解度
知识点1 溶解度
从溶解度曲线中,我们可以查出物质在不同温度下的溶解度,还可以知道物质的溶解性与温度的关系。
1.部分固体物质的溶解度随温度的升高而增大,例如硝酸钾、氯化铵。
2.只有少数的溶解度受温度的影响很少,例如氯化钠。
3.也有极少数物质的溶解度随温度的升高而减少,例如熟石灰。
知识点2 气体溶解度
气体溶解度
气体在压强为101 kPa和一定温度时溶解在1体积水里达到饱和状态时的气体体积。
如:在0℃时,氮气的溶解度为0.024。
即:在101 kPa和温度为0℃时,1体积水里最多能溶解0.024体积氮气。
气体溶解度 固体溶解度
溶剂的量 1体积水 100 g溶剂
条件 温度和压强(101 kPa) 温度
单位 体积 克(g)
气体溶解度的表达方式与固体溶解度的比较
知识点2 气体溶解度
气体的溶解度与什么有关系呢?回答以下问题找出答案。
(1)打开汽水盖时,汽水会自动喷出来。这说明气体在水中的溶解度与什么有关?
(2)喝了汽水以后,常常会打嗝。这说明气体的溶解度还与什么有关?
气体的溶解度与温度、压强有关,温度越高,溶解度越小;压强越大溶解度越大。
课堂练习
1.打开汽水瓶塞时会有大量气泡冒出,产生这一现象的原因是二氧化碳气体的溶解度( )
A.随压强的增大而增大 B.随压强的减小而减小
C.随温度的升高而身高
D.随温度的降低而减小
B
课堂练习
2.50℃时氯化铵的溶解度是50 g,50℃时氯化铵的饱和溶液中溶质、溶剂、溶液之间的质量比为( )
A.1:2:3
B.2:3:1
C.3:2:1
D.1:3:2
A
课堂练习
3.现有a、b两种物质在t1℃的饱和溶液,将它们的温度分别升高到t2℃,a溶液有晶体析出,而b溶液还可以继续溶解一些b晶体。则表示a、b两种物质的溶解度曲线是( )
A B C D
B
课堂小结
作业布置
完成配套课后作业。
本课结束 谢谢观看
素养目标
了解溶解度的具体内容。
初步学习绘制和分析溶解度曲线,体验数据处理的过程,学习数据处理的方法。
通过实验现象的观察与分析,培养学生热爱科学、学习科学的兴趣。
素养
目标
1
2
3
新课导入
什么前提条件下讨论溶液的饱和与不饱和溶液才有确定意义?
一定温度、一定量的溶剂
在课题1的学习中,我们就明白:不同溶质在同种溶剂中溶解能力不同,同种溶质在不同溶剂中溶解能力也不同。这节课我们就来从量的角度研究物质的溶解能力。
知识点1 溶解度
固体溶解度
在 下,某固体物质在 里达到 状态时所溶解的溶质的质量克数。
一定温度
100 g溶剂
饱和
条件:
一定温度
标准:
100 g溶剂(一般指水)
状态:
饱和
溶质单位:
克
知识点1 溶解度
讨论:20℃时硝酸钾的溶解度为31.6 g,这句话的含义
温度
溶质的质量
溶剂的质量
饱和溶液的质量
20℃
31.6 g
100 g
131.6 g
知识点1 溶解度
溶解度与溶解性的关系
溶解性 易溶 可溶 微溶 难溶
溶解度/g (20℃) >10 1~10 0.01~1 <0.01
知识点1 溶解度
溶解度曲线
用纵坐标表示溶解度,用横坐标表示温度。
通过绘制、观察氯化钠溶解度曲线,你得到什么信息?
温度
溶解度
知识点1 溶解度
知识点1 溶解度
知识点1 溶解度
知识点1 溶解度
知识点1 溶解度
知识点1 溶解度
从溶解度曲线中,我们可以查出物质在不同温度下的溶解度,还可以知道物质的溶解性与温度的关系。
1.部分固体物质的溶解度随温度的升高而增大,例如硝酸钾、氯化铵。
2.只有少数的溶解度受温度的影响很少,例如氯化钠。
3.也有极少数物质的溶解度随温度的升高而减少,例如熟石灰。
知识点2 气体溶解度
气体溶解度
气体在压强为101 kPa和一定温度时溶解在1体积水里达到饱和状态时的气体体积。
如:在0℃时,氮气的溶解度为0.024。
即:在101 kPa和温度为0℃时,1体积水里最多能溶解0.024体积氮气。
气体溶解度 固体溶解度
溶剂的量 1体积水 100 g溶剂
条件 温度和压强(101 kPa) 温度
单位 体积 克(g)
气体溶解度的表达方式与固体溶解度的比较
知识点2 气体溶解度
气体的溶解度与什么有关系呢?回答以下问题找出答案。
(1)打开汽水盖时,汽水会自动喷出来。这说明气体在水中的溶解度与什么有关?
(2)喝了汽水以后,常常会打嗝。这说明气体的溶解度还与什么有关?
气体的溶解度与温度、压强有关,温度越高,溶解度越小;压强越大溶解度越大。
课堂练习
1.打开汽水瓶塞时会有大量气泡冒出,产生这一现象的原因是二氧化碳气体的溶解度( )
A.随压强的增大而增大 B.随压强的减小而减小
C.随温度的升高而身高
D.随温度的降低而减小
B
课堂练习
2.50℃时氯化铵的溶解度是50 g,50℃时氯化铵的饱和溶液中溶质、溶剂、溶液之间的质量比为( )
A.1:2:3
B.2:3:1
C.3:2:1
D.1:3:2
A
课堂练习
3.现有a、b两种物质在t1℃的饱和溶液,将它们的温度分别升高到t2℃,a溶液有晶体析出,而b溶液还可以继续溶解一些b晶体。则表示a、b两种物质的溶解度曲线是( )
A B C D
B
课堂小结
作业布置
完成配套课后作业。
本课结束 谢谢观看
同课章节目录
