化学人教版九下:10.2酸和碱的中和反应(第一课时)课件(共18张PPT)
文档属性
| 名称 | 化学人教版九下:10.2酸和碱的中和反应(第一课时)课件(共18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-29 00:00:00 | ||
图片预览




文档简介
(共18张PPT)
第十单元 课题2
酸和碱的中和反应(第一课时)
初
学
化
中
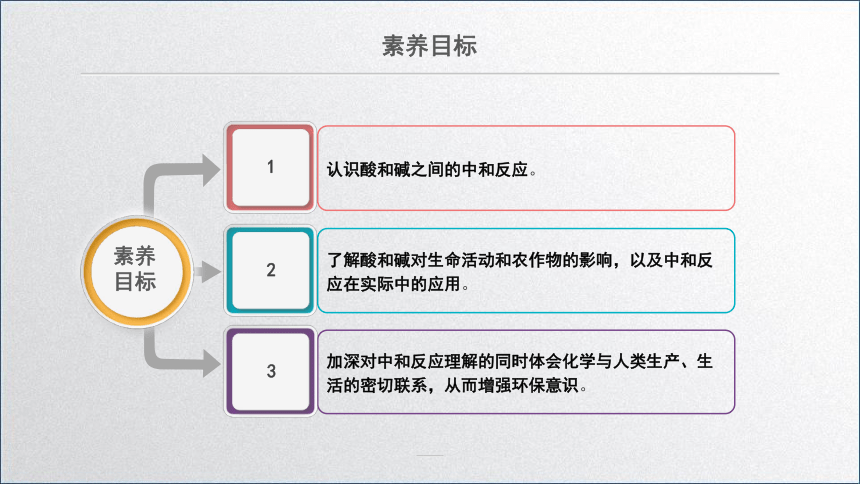
素养目标
认识酸和碱之间的中和反应。
了解酸和碱对生命活动和农作物的影响,以及中和反应在实际中的应用。
加深对中和反应理解的同时体会化学与人类生产、生活的密切联系,从而增强环保意识。
素养
目标
1
2
3
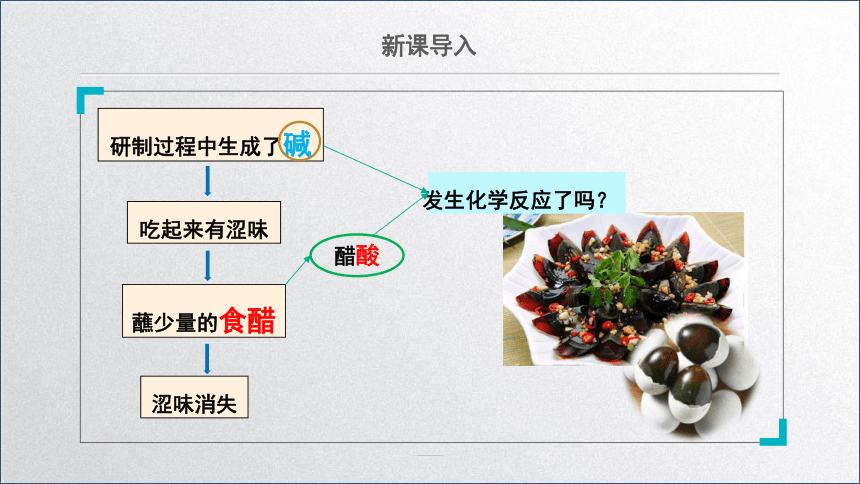
新课导入
研制过程中生成了碱
吃起来有涩味
蘸少量的食醋
涩味消失
发生化学反应了吗?
醋酸
知识点1 中和反应
讨论:
1.请你猜想酸和碱混合在一起能发生化学反应吗?
2.怎样证明酸和碱发生了化学反应?
3.请你设计实验证明酸和碱发生了化学反应?
知识点1 中和反应
实验方案:
氢氧化钠溶液
方案一:
滴加酚酞
溶液变为红色
滴加盐酸
无色溶液
氢氧化钠溶液
方案一:
滴加石蕊
溶液变为蓝色
滴加盐酸
紫色溶液
盐酸溶液
方案三:
滴入酚酞
溶液为无色
滴加氢氧化钠溶液
无色或红色溶液
盐酸溶液
方案四:
滴入石蕊
溶液变为红色
滴加氢氧化钠溶液
紫色溶液
知识点1 中和反应
最佳方案的选择:
通过自主探究,我们可以发现:
方案三中溶液变红色,NaOH已经过量,溶液呈碱性。方案二和方案四用石蕊溶液作为指示剂,很难观察到最终的紫色。因此上述四种方案中第一种方案是最佳方案。
知识点1 中和反应
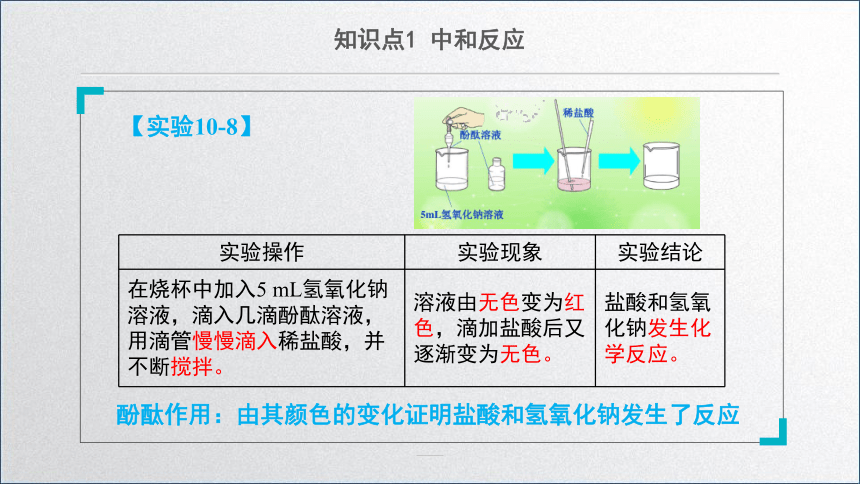
【实验10-8】
酚酞作用:由其颜色的变化证明盐酸和氢氧化钠发生了反应
实验操作 实验现象 实验结论
在烧杯中加入5 mL氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入稀盐酸,并不断搅拌。 溶液由无色变为红色,滴加盐酸后又逐渐变为无色。 盐酸和氢氧化钠发生化学反应。
知识点1 中和反应
实验交流
1.实验过程中为什么要用滴管慢慢滴入稀盐酸并不断搅拌?
用滴管慢慢滴入是为了避免加入的盐酸过量,搅拌使氢氧化钠与稀盐酸混合均匀,充分反应。
2.盐酸过量是否怎么进行检验?
①取少量反应后溶液于试管中,滴加石蕊溶液,观察,石蕊溶液变红,则说明盐酸过量
②… …(主要考虑酸的性质)
3.反应后生成的是什么物质?能否从微观角度分析两者的反应原理?
知识点1 中和反应
氢氧化钠与盐酸反应
HCl + NaOH == NaCl + H2O
HCl + KOH == KCl + H2O
H2SO4 + 2KOH == K2SO4 + 2H2O
2HCl + Ca(OH)2 == CaCl2 + 2H2O
H2SO4 + Ca(OH)2 == CaSO4 + 2H2O
金属离子+酸根离子
盐
酸 + 碱 == 盐 + 水
中和反应:酸和碱作用生成盐和水的反应
实质:H+ + OH— == H2O
知识点1 中和反应
思考:
有盐和水生成的反应一定是中和反应吗?请举例说明。
不是
2NaOH + CO2 == Na2CO3 + H2O
2HCl + CuO == CuCl2 + H2O
知识点2 中和反应在实际中的应用
改变土壤酸碱性
酸雨会使土壤酸化,可用熟石灰中和酸性
Ca(OH)2+H2SO4==CaSO4+2H2O
Ca(OH)2+2HNO3==Ca(NO3)2+2H2O
知识点2 中和反应在实际中的应用
处理工厂废水
硫酸厂污水,可用熟石灰中和
Ca(OH)2+H2SO4==CaSO4+2H2O
知识点2 中和反应在实际中的应用
用于医药
①蚊虫叮咬后皮肤肿痛,涂一些含有碱性的药物,如稀氨水(NH3·H2O)、肥皂水等,可减轻痛疼。
②碱性药物中和过多的胃酸。
课堂练习
1.实验室用盐酸与氢氧化钠溶液作用,探究中和反应时,看不到明显的实验现象。此时,采用下列一些做法,其中正确的是( )
A.用稀硫酸代替盐酸
B.放弃对中和反应的实验探究
C.用氢氧化钾代替氢氧化钠
D.实验前向氢氧化钠溶液中滴加两滴酚酞
D
课堂练习
2.下列气体能用浓硫酸干燥,而不能用氢氧化钠固体干燥的是( )
A.H2 B.O2 C.CO2 D.N2
C
课堂练习
3.如图所示是将盐酸滴入氢氧化钠溶液中有关粒子之间反应的示意图,请回答。
(1)写出该反应的化学方程式: ,该反应的反应类型是 。
(2)从图中可看出该反应的微观本质是 。
中和反应
HCl+NaOH====NaCl+H2O
酸中的氢离子和碱中的氢氧根离子结合生成水
课堂小结
本课结束 谢谢观看
第十单元 课题2
酸和碱的中和反应(第一课时)
初
学
化
中
素养目标
认识酸和碱之间的中和反应。
了解酸和碱对生命活动和农作物的影响,以及中和反应在实际中的应用。
加深对中和反应理解的同时体会化学与人类生产、生活的密切联系,从而增强环保意识。
素养
目标
1
2
3
新课导入
研制过程中生成了碱
吃起来有涩味
蘸少量的食醋
涩味消失
发生化学反应了吗?
醋酸
知识点1 中和反应
讨论:
1.请你猜想酸和碱混合在一起能发生化学反应吗?
2.怎样证明酸和碱发生了化学反应?
3.请你设计实验证明酸和碱发生了化学反应?
知识点1 中和反应
实验方案:
氢氧化钠溶液
方案一:
滴加酚酞
溶液变为红色
滴加盐酸
无色溶液
氢氧化钠溶液
方案一:
滴加石蕊
溶液变为蓝色
滴加盐酸
紫色溶液
盐酸溶液
方案三:
滴入酚酞
溶液为无色
滴加氢氧化钠溶液
无色或红色溶液
盐酸溶液
方案四:
滴入石蕊
溶液变为红色
滴加氢氧化钠溶液
紫色溶液
知识点1 中和反应
最佳方案的选择:
通过自主探究,我们可以发现:
方案三中溶液变红色,NaOH已经过量,溶液呈碱性。方案二和方案四用石蕊溶液作为指示剂,很难观察到最终的紫色。因此上述四种方案中第一种方案是最佳方案。
知识点1 中和反应
【实验10-8】
酚酞作用:由其颜色的变化证明盐酸和氢氧化钠发生了反应
实验操作 实验现象 实验结论
在烧杯中加入5 mL氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入稀盐酸,并不断搅拌。 溶液由无色变为红色,滴加盐酸后又逐渐变为无色。 盐酸和氢氧化钠发生化学反应。
知识点1 中和反应
实验交流
1.实验过程中为什么要用滴管慢慢滴入稀盐酸并不断搅拌?
用滴管慢慢滴入是为了避免加入的盐酸过量,搅拌使氢氧化钠与稀盐酸混合均匀,充分反应。
2.盐酸过量是否怎么进行检验?
①取少量反应后溶液于试管中,滴加石蕊溶液,观察,石蕊溶液变红,则说明盐酸过量
②… …(主要考虑酸的性质)
3.反应后生成的是什么物质?能否从微观角度分析两者的反应原理?
知识点1 中和反应
氢氧化钠与盐酸反应
HCl + NaOH == NaCl + H2O
HCl + KOH == KCl + H2O
H2SO4 + 2KOH == K2SO4 + 2H2O
2HCl + Ca(OH)2 == CaCl2 + 2H2O
H2SO4 + Ca(OH)2 == CaSO4 + 2H2O
金属离子+酸根离子
盐
酸 + 碱 == 盐 + 水
中和反应:酸和碱作用生成盐和水的反应
实质:H+ + OH— == H2O
知识点1 中和反应
思考:
有盐和水生成的反应一定是中和反应吗?请举例说明。
不是
2NaOH + CO2 == Na2CO3 + H2O
2HCl + CuO == CuCl2 + H2O
知识点2 中和反应在实际中的应用
改变土壤酸碱性
酸雨会使土壤酸化,可用熟石灰中和酸性
Ca(OH)2+H2SO4==CaSO4+2H2O
Ca(OH)2+2HNO3==Ca(NO3)2+2H2O
知识点2 中和反应在实际中的应用
处理工厂废水
硫酸厂污水,可用熟石灰中和
Ca(OH)2+H2SO4==CaSO4+2H2O
知识点2 中和反应在实际中的应用
用于医药
①蚊虫叮咬后皮肤肿痛,涂一些含有碱性的药物,如稀氨水(NH3·H2O)、肥皂水等,可减轻痛疼。
②碱性药物中和过多的胃酸。
课堂练习
1.实验室用盐酸与氢氧化钠溶液作用,探究中和反应时,看不到明显的实验现象。此时,采用下列一些做法,其中正确的是( )
A.用稀硫酸代替盐酸
B.放弃对中和反应的实验探究
C.用氢氧化钾代替氢氧化钠
D.实验前向氢氧化钠溶液中滴加两滴酚酞
D
课堂练习
2.下列气体能用浓硫酸干燥,而不能用氢氧化钠固体干燥的是( )
A.H2 B.O2 C.CO2 D.N2
C
课堂练习
3.如图所示是将盐酸滴入氢氧化钠溶液中有关粒子之间反应的示意图,请回答。
(1)写出该反应的化学方程式: ,该反应的反应类型是 。
(2)从图中可看出该反应的微观本质是 。
中和反应
HCl+NaOH====NaCl+H2O
酸中的氢离子和碱中的氢氧根离子结合生成水
课堂小结
本课结束 谢谢观看
同课章节目录
