6.1.2化学反应与电能课件(共46张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.2化学反应与电能课件(共46张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 83.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-29 22:49:33 | ||
图片预览





文档简介
(共46张PPT)
第六章 化学反应与能量
第一节 化学反应与能量
第2课时 化学反应与电能
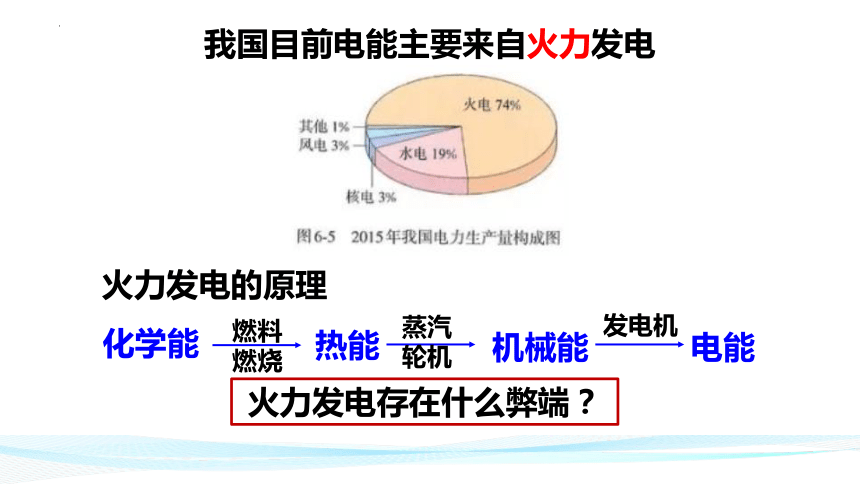
火力发电存在什么弊端?
火力发电的原理
我国目前电能主要来自火力发电
化学能
燃料燃烧
蒸汽轮机
发电机
电能
机械能
热能
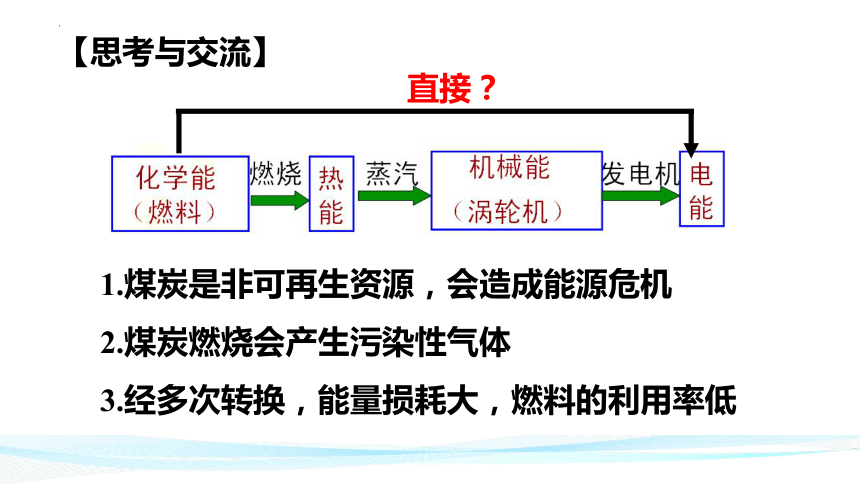
【思考与交流】
直接?
1.煤炭是非可再生资源,会造成能源危机
2.煤炭燃烧会产生污染性气体
3.经多次转换,能量损耗大,燃料的利用率低
化学能 电能
直接
想一想:
1.电流是怎样产生的?
写一写:
写出锌和稀硫酸反应的离子方程式并画出单线桥。
2.哪些化学反应中有电子的转移?
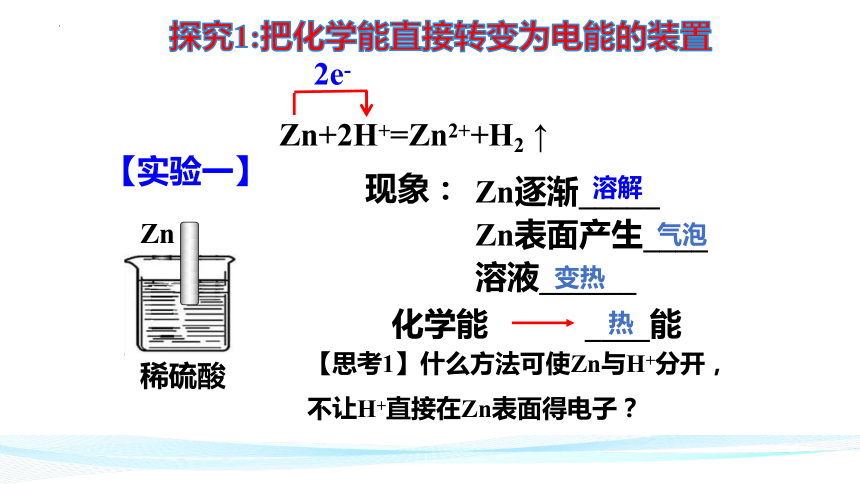
Zn+2H+=Zn2++H2 ↑
2e-
稀硫酸
Zn
Zn逐渐_____
Zn表面产生____溶液______
现象:
【实验一】
【思考1】什么方法可使Zn与H+分开,
不让H+直接在Zn表面得电子?
探究1:把化学能直接转变为电能的装置
化学能 ____能
溶解
气泡
变热
热
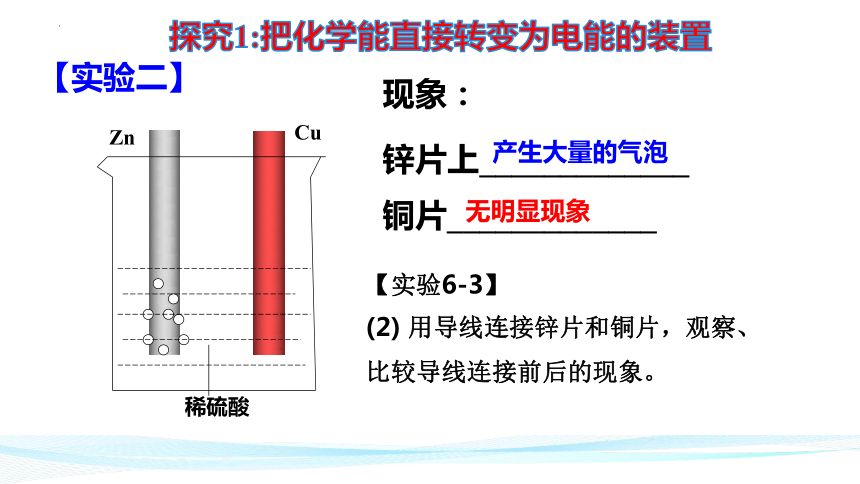
【实验二】
锌片上_____________
铜片_____________
稀硫酸
Zn
Cu
现象:
探究1:把化学能直接转变为电能的装置
产生大量的气泡
无明显现象
【实验6-3】
(2) 用导线连接锌片和铜片,观察、
比较导线连接前后的现象。
【实验6-3】
(2) 用导线连接锌片和铜片,观察、比较导线连接前后的现象。
[思考2]怎样才能知道电子发生了电子的定向移动?
【实验6-3】
(3) 如图6-6所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
锌片_____________
铜片上_____________
逐渐溶解
有气泡产生
现象:
稀硫酸
Zn
Cu
现象:
探究1:把化学能直接转变为电能的装置
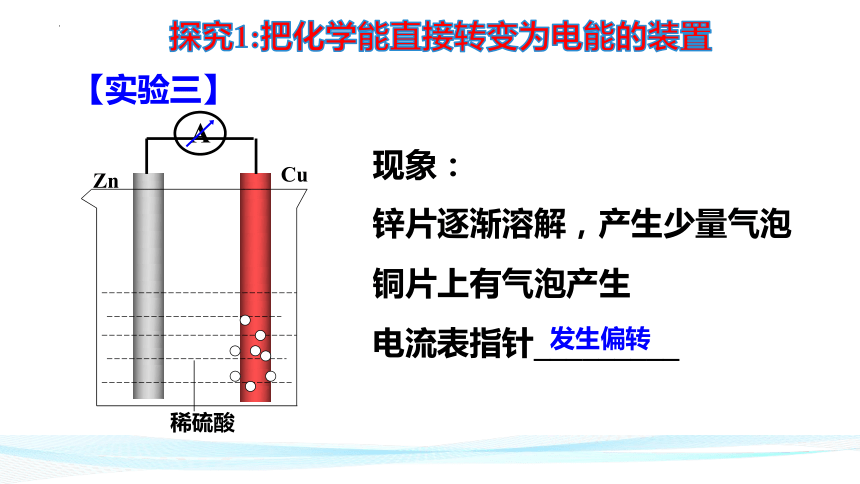
【实验三】
锌片逐渐溶解,产生少量气泡
铜片上有气泡产生
电流表指针_________
A
发生偏转
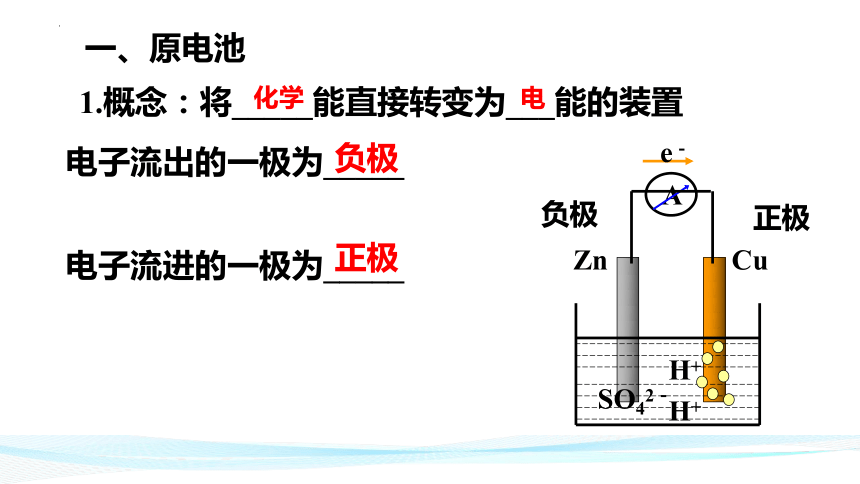
一、原电池
1.概念:将_____能直接转变为___能的装置
A
Zn
Cu
SO42-
H+
H+
正极
负极
e-
负极
正极
电子流出的一极为_____
电子流进的一极为_____
化学
电
Cu
Zn
-
-
-
Zn2+
H+
H+
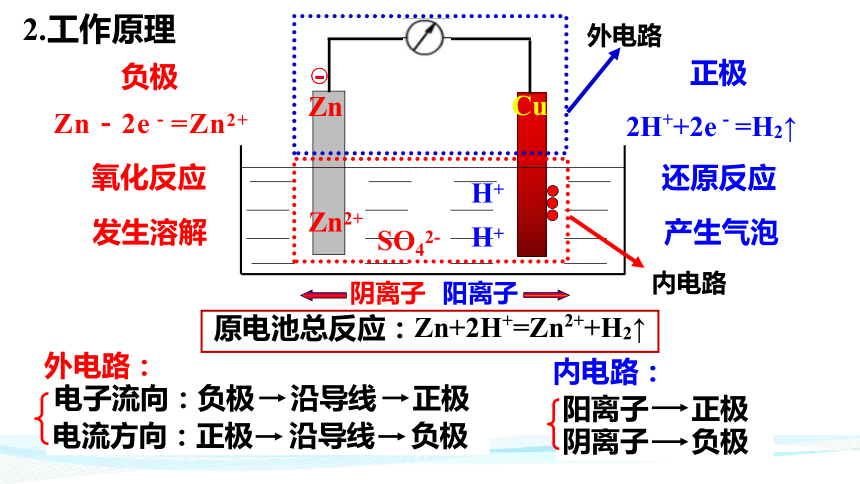
Zn-2e-=Zn2+
氧化反应
还原反应
负极
正极
阳离子
阴离子
SO42-
发生溶解
产生气泡
原电池总反应:Zn+2H+=Zn2++H2↑
电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
外电路:
内电路:
阴离子 负极
阳离子 正极
外电路
内电路
2.工作原理
2H++2e-=H2↑
原电池
1、概念:将化学能直接转变为电能的装置
A
Zn
Cu
SO42-
H+
H+
2、本质:_________________________
_________________________________
锌片:
铜片:
氧化反应和还原反应分别在两
个不同的区域进行。
Zn-2e- = Zn2+ (氧化反应)
2H++2e- = H2↑(还原反应)
通过以上实验,想一想原电池是由哪几部分组成的,构成原电池的条件又有哪些?
原电池的组成:
____________________
怎样才能构成一个原电池呢?
A
Zn
Cu
SO42-
H+
H+
正极
负极
e-
两电极、导线、电解质溶液
(可以)
(可以)
(可以)
(不可以)
形成条件一:
_________________
负极:__________________
正极:__________________
探究2:构成原电池的条件
活泼性不同的两个电极
较活泼的金属
较不活泼的金属、石墨等
(可以)
(不可以)
形成条件二:_____________________
探究2:构成原电池的条件
电极需浸入电解质
溶液中
(不可以)
形成条件三:
____________________
必须形成闭合回路
形成条件四:能自发进行的氧化还原反应
(不可以)
Ag
探究2:构成原电池的条件
3.原电池构成条件
①活泼性不同的金属作电极
(或其中一种为能导电的非金属,如“碳棒”)
其中较活泼金属为负极
较不活泼金属(或非金属)为正极
②电解质溶液
③形成闭合回路
④能自发进行氧化还原反应
两极一液一线一反应
A
B
C
D
【练习】下列哪些装置能构成原电池?
√
E
√
稀硫酸
Zn
Fe
稀硫酸
Ag
Cu
A
稀硫酸
Zn
Cu
√
Zn
H2SO4溶液
F
负极
正极
e-
金属活泼性:
得或失电子:
发生什么反应:
电极现象:
阴离子或阳离子
移向:
金属活泼性:
得或失电子:
发生什么反应:
电极现象:
阴离子或阳离子
移向:
较活泼金属
较不活泼金属
失去电子
得到电子
氧化反应
还原反应
金属溶解
有气体产生
或有固体析出
阴离子移向
阳离子移向
导线
※如何判断原电池的正负两极?
电池漏液
一次电池
【常见的化学电源】
锌锰干电池
汽车用铅酸蓄电池
Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
充电
放电
化学能
电能
充电
放电
二次电池
【常见的化学电源】
锂离子电池
镍氢充电电池
我国研发的燃料电池和超级高电容混合能源列车
燃料电池
【发展中的燃料电池】
优点:效率高、无污染,装置可持续使用
燃料电池不是把还原剂、氧化剂全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。
【燃料电池】
氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电。
常见的燃料电池有氢氧燃料电池、甲烷燃料电池等。
介质 电池反应: 2H2 +O2 = 2H2O
酸性 水溶液 负极
正极
碱性 水溶液 负极
正极
熔融 状态 负极
正极
氢氧燃料电池
溶液pH变化
电极pH变化
10.【2021.1】17.锌(Zn)-空气电池的总反应式:2Zn+O2+2H2O=2Zn(OH)2,装置如图所示。下列说法不正确的是A.多孔石墨电极上发生还原反应B.电子从锌电极经过KOH溶液流向石墨电极C.负极的电极反应:Zn-2e +2OH =Zn(OH)2D.电池工作时,电解质溶液中K+的数目保持不变
A.根据总反应价态判断
C.电极pH变化/电解质溶液pH变化
正极反应:O2+4e— = 2O2—
二、原电池、简易电池的设计与制作
【目的】根据原电池原理,设计和制作简易电池,体会原电池的构成要素。
【用品】水果(苹果、柑橘或柠檬等),食盐水,滤纸,铜片、铁片、铝片等金属片,石墨棒,导线,小型用电器(发光二极管、电子音乐卡或小电动机等),电流表。
【实验】
(1)水果电池
(2)简易电池
(3)趣味实验
(3) 原电池的设计
Fe + Cu2+ = Cu + Fe2+ 设计成一个原电池。
※电极材料:负极 ,正极 。
※电解液: 。
※电极反应式 :
负极: .
正极: .
5、原电池的应用
CuSO4溶液
Fe
Cu
Cu 2+ +2e — = Cu
Fe -2e — = Fe 2+
思考题:
请根据反应 :Fe + 2Fe 3+ = 3Fe 2+ 设计一个原电池,画出装置图
【练习】把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,外电路的电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,d极逐渐溶解,则四种金属的活动性由强到弱的顺序为( )
A、a>b>c>d B、a>c>d>b
C、c>a>d>b D、b>d>c>a
4、原电池的应用
比较金属的活动性强弱:
原电池中,一般活动性较强的金属为 极,
活动性较弱的金属为 极。
负
正
B
(2)加快氧化还原反应速率
5、原电池的应用
【练习】实验室中欲制氢气,最好的方法是( )
A.纯锌与稀硫酸反应 B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应 D.粗锌(含铅、铜杂质)与稀硫酸反应
D
如实验室中制氢气,常用粗锌。因为粗锌中的杂质、锌、稀硫酸形成原电池,加快了锌的腐蚀,使产生氢气的速率加快。
2.下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是 ( )
A.电解水 D.干电池
7.某兴趣小组设计如图实验装置,电流表指针发生偏转。下列说法不正确的是 ( )A.该装置中铝箔为负极B.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔C.活性炭表面有气泡产生D.该原电池的总反应是2Al+6H+ = 2Al3++3H2↑
11.由U形管、质量为m g的铁棒、质量为m g的碳棒和1 L 2 mol·L-1 CuCl2溶液组成的装置如图所示,下列说法正确的是(假设物质充足) ( )A.闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为18 gB.打开K,碳棒上有紫红色固体析出C.闭合K,铁棒上发生反应:Fe-3e-= Fe3+D.闭合K,铁棒表面发生的电极反应式为
Cu2++2e-= Cu
13.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+ = 2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:(1)该电池的负极材料是 ,发生 (填“氧化”或“还原”)反应,电解质溶液是 。 (2)正极上出现的现象是 。 (3)若导线上转移电子1 mol,则生成银的质量为 g。
8.某原电池的总反应是Fe+Cu2+ = Fe2++Cu,该原电池的正确组成是 ( )
9.一学生用如图装置研究原电池原理,下列说法错误的是 ( )
A.图(2)中电子由Zn沿导线流向CuB.图(3)中Zn片增重质量与Cu棒减轻的质量之比为65∶64C.图(1)中铜棒上没有气体产生D.图(2)与图(3)中正极生成物质量比为1∶32时,Zn片减轻的质量相等
10.如图所示,电流表A指针发生偏转,同时M极质量增加,N极质量减少,B为电解质溶液。则M、N、B分别为 ( )A.M是Cu,N是Zn,B是稀硫酸B.M是Zn,N是Cu,B是CuCl2溶液C.M是Ag,N是Fe,B是稀AgNO3溶液D.M是Ag,N是Fe,B是稀硫酸
3.【2017.11】17.金属(M)-空气电池的工作原理如图所示。下列说法不正确的是A.金属M作电池负极
B.电解质是熔融的MOC.正极的电极反应:O2+4e +2H2O=4OH D.电池反应:2M+O2+2H2O=2M(OH)2
4.【2018.4】17.锂(Li)-空气电池的工作原理如图所示。下列说法不正确的是
A.金属锂作负极,发生氧化反应
B.Li+通过有机电解质向水溶液处移
C.正极的电极反应:O2+4eˉ=2O2ˉ
D.电池总反应:4Li+O2+2H2O=4LiOH
6. 【2018.11】17.最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是A.右边吸附层中发生了还原反应B.负极的电极反应是H2-2e-+2OH- ==== 2H2O
C.电池的总反应是2H2+O2 ==== 2H2O
D.电解质溶液中Na+向右移动,ClO4-向左移动
7.【2019.6】17.银锌纽扣电池的构造如图所示。其电池反应方程式为:Ag2O+Zn+H2O=2Ag+Zn(OH)2
下列说法正确的是A.锌粉为正极B.Ag2O发生氧化反应
C.电池工作时,电子从锌粉经过KOH溶液流向Ag2O
D.正极的电极反应式为:Ag2O+2e-+H2O=2Ag+2OH-
9.【2020.7】17.机动车使用的铅蓄电池构造如图
所示,其电池反应的方程式为:
Pb+PbO2 + 2H2SO4 =2PbSO4 +2H2O。
电池工作时,下列说法不正确的是A.铅作正极B.二氧化铅发生还原反应C.电子从铅电极经导线流向二氧化铅电极D.铅电极的电极反应式:Pb-2e- +SO42- =PbSO4
12.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入3mol·L-1的H2SO4溶液中,乙同学将电极放入3mol·L-1的NaOH溶液中,如图所示。(1)写出甲中正极的电极反应式:_________________________;
(2)乙中负极为_______,总反应的离子方程式:__________________;
13.常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如上图1),测得原电池的电流强度(I)随时间(t)的变化如上图2所示,下列说法正确的是 ( )A.0~t1时,原电池的负极是铜片
B.0~t1时,正极的电极反应式是2H++2e- = H2↑C.t1时刻,电流方向发生变化的原因是Al在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应D.t1时刻后,电子从铝经过导线流向铜
第六章 化学反应与能量
第一节 化学反应与能量
第2课时 化学反应与电能
火力发电存在什么弊端?
火力发电的原理
我国目前电能主要来自火力发电
化学能
燃料燃烧
蒸汽轮机
发电机
电能
机械能
热能
【思考与交流】
直接?
1.煤炭是非可再生资源,会造成能源危机
2.煤炭燃烧会产生污染性气体
3.经多次转换,能量损耗大,燃料的利用率低
化学能 电能
直接
想一想:
1.电流是怎样产生的?
写一写:
写出锌和稀硫酸反应的离子方程式并画出单线桥。
2.哪些化学反应中有电子的转移?
Zn+2H+=Zn2++H2 ↑
2e-
稀硫酸
Zn
Zn逐渐_____
Zn表面产生____溶液______
现象:
【实验一】
【思考1】什么方法可使Zn与H+分开,
不让H+直接在Zn表面得电子?
探究1:把化学能直接转变为电能的装置
化学能 ____能
溶解
气泡
变热
热
【实验二】
锌片上_____________
铜片_____________
稀硫酸
Zn
Cu
现象:
探究1:把化学能直接转变为电能的装置
产生大量的气泡
无明显现象
【实验6-3】
(2) 用导线连接锌片和铜片,观察、
比较导线连接前后的现象。
【实验6-3】
(2) 用导线连接锌片和铜片,观察、比较导线连接前后的现象。
[思考2]怎样才能知道电子发生了电子的定向移动?
【实验6-3】
(3) 如图6-6所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
锌片_____________
铜片上_____________
逐渐溶解
有气泡产生
现象:
稀硫酸
Zn
Cu
现象:
探究1:把化学能直接转变为电能的装置
【实验三】
锌片逐渐溶解,产生少量气泡
铜片上有气泡产生
电流表指针_________
A
发生偏转
一、原电池
1.概念:将_____能直接转变为___能的装置
A
Zn
Cu
SO42-
H+
H+
正极
负极
e-
负极
正极
电子流出的一极为_____
电子流进的一极为_____
化学
电
Cu
Zn
-
-
-
Zn2+
H+
H+
Zn-2e-=Zn2+
氧化反应
还原反应
负极
正极
阳离子
阴离子
SO42-
发生溶解
产生气泡
原电池总反应:Zn+2H+=Zn2++H2↑
电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
外电路:
内电路:
阴离子 负极
阳离子 正极
外电路
内电路
2.工作原理
2H++2e-=H2↑
原电池
1、概念:将化学能直接转变为电能的装置
A
Zn
Cu
SO42-
H+
H+
2、本质:_________________________
_________________________________
锌片:
铜片:
氧化反应和还原反应分别在两
个不同的区域进行。
Zn-2e- = Zn2+ (氧化反应)
2H++2e- = H2↑(还原反应)
通过以上实验,想一想原电池是由哪几部分组成的,构成原电池的条件又有哪些?
原电池的组成:
____________________
怎样才能构成一个原电池呢?
A
Zn
Cu
SO42-
H+
H+
正极
负极
e-
两电极、导线、电解质溶液
(可以)
(可以)
(可以)
(不可以)
形成条件一:
_________________
负极:__________________
正极:__________________
探究2:构成原电池的条件
活泼性不同的两个电极
较活泼的金属
较不活泼的金属、石墨等
(可以)
(不可以)
形成条件二:_____________________
探究2:构成原电池的条件
电极需浸入电解质
溶液中
(不可以)
形成条件三:
____________________
必须形成闭合回路
形成条件四:能自发进行的氧化还原反应
(不可以)
Ag
探究2:构成原电池的条件
3.原电池构成条件
①活泼性不同的金属作电极
(或其中一种为能导电的非金属,如“碳棒”)
其中较活泼金属为负极
较不活泼金属(或非金属)为正极
②电解质溶液
③形成闭合回路
④能自发进行氧化还原反应
两极一液一线一反应
A
B
C
D
【练习】下列哪些装置能构成原电池?
√
E
√
稀硫酸
Zn
Fe
稀硫酸
Ag
Cu
A
稀硫酸
Zn
Cu
√
Zn
H2SO4溶液
F
负极
正极
e-
金属活泼性:
得或失电子:
发生什么反应:
电极现象:
阴离子或阳离子
移向:
金属活泼性:
得或失电子:
发生什么反应:
电极现象:
阴离子或阳离子
移向:
较活泼金属
较不活泼金属
失去电子
得到电子
氧化反应
还原反应
金属溶解
有气体产生
或有固体析出
阴离子移向
阳离子移向
导线
※如何判断原电池的正负两极?
电池漏液
一次电池
【常见的化学电源】
锌锰干电池
汽车用铅酸蓄电池
Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
充电
放电
化学能
电能
充电
放电
二次电池
【常见的化学电源】
锂离子电池
镍氢充电电池
我国研发的燃料电池和超级高电容混合能源列车
燃料电池
【发展中的燃料电池】
优点:效率高、无污染,装置可持续使用
燃料电池不是把还原剂、氧化剂全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。
【燃料电池】
氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电。
常见的燃料电池有氢氧燃料电池、甲烷燃料电池等。
介质 电池反应: 2H2 +O2 = 2H2O
酸性 水溶液 负极
正极
碱性 水溶液 负极
正极
熔融 状态 负极
正极
氢氧燃料电池
溶液pH变化
电极pH变化
10.【2021.1】17.锌(Zn)-空气电池的总反应式:2Zn+O2+2H2O=2Zn(OH)2,装置如图所示。下列说法不正确的是A.多孔石墨电极上发生还原反应B.电子从锌电极经过KOH溶液流向石墨电极C.负极的电极反应:Zn-2e +2OH =Zn(OH)2D.电池工作时,电解质溶液中K+的数目保持不变
A.根据总反应价态判断
C.电极pH变化/电解质溶液pH变化
正极反应:O2+4e— = 2O2—
二、原电池、简易电池的设计与制作
【目的】根据原电池原理,设计和制作简易电池,体会原电池的构成要素。
【用品】水果(苹果、柑橘或柠檬等),食盐水,滤纸,铜片、铁片、铝片等金属片,石墨棒,导线,小型用电器(发光二极管、电子音乐卡或小电动机等),电流表。
【实验】
(1)水果电池
(2)简易电池
(3)趣味实验
(3) 原电池的设计
Fe + Cu2+ = Cu + Fe2+ 设计成一个原电池。
※电极材料:负极 ,正极 。
※电解液: 。
※电极反应式 :
负极: .
正极: .
5、原电池的应用
CuSO4溶液
Fe
Cu
Cu 2+ +2e — = Cu
Fe -2e — = Fe 2+
思考题:
请根据反应 :Fe + 2Fe 3+ = 3Fe 2+ 设计一个原电池,画出装置图
【练习】把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,外电路的电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,d极逐渐溶解,则四种金属的活动性由强到弱的顺序为( )
A、a>b>c>d B、a>c>d>b
C、c>a>d>b D、b>d>c>a
4、原电池的应用
比较金属的活动性强弱:
原电池中,一般活动性较强的金属为 极,
活动性较弱的金属为 极。
负
正
B
(2)加快氧化还原反应速率
5、原电池的应用
【练习】实验室中欲制氢气,最好的方法是( )
A.纯锌与稀硫酸反应 B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应 D.粗锌(含铅、铜杂质)与稀硫酸反应
D
如实验室中制氢气,常用粗锌。因为粗锌中的杂质、锌、稀硫酸形成原电池,加快了锌的腐蚀,使产生氢气的速率加快。
2.下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是 ( )
A.电解水 D.干电池
7.某兴趣小组设计如图实验装置,电流表指针发生偏转。下列说法不正确的是 ( )A.该装置中铝箔为负极B.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔C.活性炭表面有气泡产生D.该原电池的总反应是2Al+6H+ = 2Al3++3H2↑
11.由U形管、质量为m g的铁棒、质量为m g的碳棒和1 L 2 mol·L-1 CuCl2溶液组成的装置如图所示,下列说法正确的是(假设物质充足) ( )A.闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为18 gB.打开K,碳棒上有紫红色固体析出C.闭合K,铁棒上发生反应:Fe-3e-= Fe3+D.闭合K,铁棒表面发生的电极反应式为
Cu2++2e-= Cu
13.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+ = 2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:(1)该电池的负极材料是 ,发生 (填“氧化”或“还原”)反应,电解质溶液是 。 (2)正极上出现的现象是 。 (3)若导线上转移电子1 mol,则生成银的质量为 g。
8.某原电池的总反应是Fe+Cu2+ = Fe2++Cu,该原电池的正确组成是 ( )
9.一学生用如图装置研究原电池原理,下列说法错误的是 ( )
A.图(2)中电子由Zn沿导线流向CuB.图(3)中Zn片增重质量与Cu棒减轻的质量之比为65∶64C.图(1)中铜棒上没有气体产生D.图(2)与图(3)中正极生成物质量比为1∶32时,Zn片减轻的质量相等
10.如图所示,电流表A指针发生偏转,同时M极质量增加,N极质量减少,B为电解质溶液。则M、N、B分别为 ( )A.M是Cu,N是Zn,B是稀硫酸B.M是Zn,N是Cu,B是CuCl2溶液C.M是Ag,N是Fe,B是稀AgNO3溶液D.M是Ag,N是Fe,B是稀硫酸
3.【2017.11】17.金属(M)-空气电池的工作原理如图所示。下列说法不正确的是A.金属M作电池负极
B.电解质是熔融的MOC.正极的电极反应:O2+4e +2H2O=4OH D.电池反应:2M+O2+2H2O=2M(OH)2
4.【2018.4】17.锂(Li)-空气电池的工作原理如图所示。下列说法不正确的是
A.金属锂作负极,发生氧化反应
B.Li+通过有机电解质向水溶液处移
C.正极的电极反应:O2+4eˉ=2O2ˉ
D.电池总反应:4Li+O2+2H2O=4LiOH
6. 【2018.11】17.最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是A.右边吸附层中发生了还原反应B.负极的电极反应是H2-2e-+2OH- ==== 2H2O
C.电池的总反应是2H2+O2 ==== 2H2O
D.电解质溶液中Na+向右移动,ClO4-向左移动
7.【2019.6】17.银锌纽扣电池的构造如图所示。其电池反应方程式为:Ag2O+Zn+H2O=2Ag+Zn(OH)2
下列说法正确的是A.锌粉为正极B.Ag2O发生氧化反应
C.电池工作时,电子从锌粉经过KOH溶液流向Ag2O
D.正极的电极反应式为:Ag2O+2e-+H2O=2Ag+2OH-
9.【2020.7】17.机动车使用的铅蓄电池构造如图
所示,其电池反应的方程式为:
Pb+PbO2 + 2H2SO4 =2PbSO4 +2H2O。
电池工作时,下列说法不正确的是A.铅作正极B.二氧化铅发生还原反应C.电子从铅电极经导线流向二氧化铅电极D.铅电极的电极反应式:Pb-2e- +SO42- =PbSO4
12.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入3mol·L-1的H2SO4溶液中,乙同学将电极放入3mol·L-1的NaOH溶液中,如图所示。(1)写出甲中正极的电极反应式:_________________________;
(2)乙中负极为_______,总反应的离子方程式:__________________;
13.常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如上图1),测得原电池的电流强度(I)随时间(t)的变化如上图2所示,下列说法正确的是 ( )A.0~t1时,原电池的负极是铜片
B.0~t1时,正极的电极反应式是2H++2e- = H2↑C.t1时刻,电流方向发生变化的原因是Al在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应D.t1时刻后,电子从铝经过导线流向铜
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
