5.1.硫及其化合物课件(共18张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1.硫及其化合物课件(共18张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-29 00:00:00 | ||
图片预览





文档简介
(共18张PPT)
第五章化工生产中的重要非金属元素
第一节硫及其化合物
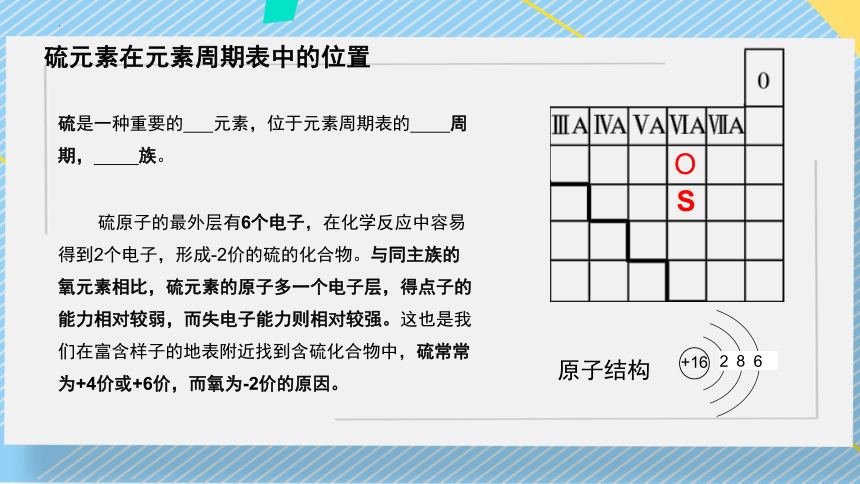
硫是一种重要的 元素,位于元素周期表的 周期, 族。
O
S
原子结构
+16
2
8
6
硫原子的最外层有6个电子,在化学反应中容易得到2个电子,形成-2价的硫的化合物。与同主族的氧元素相比,硫元素的原子多一个电子层,得点子的能力相对较弱,而失电子能力则相对较强。这也是我们在富含样子的地表附近找到含硫化合物中,硫常常为+4价或+6价,而氧为-2价的原因。
硫元素在元素周期表中的位置
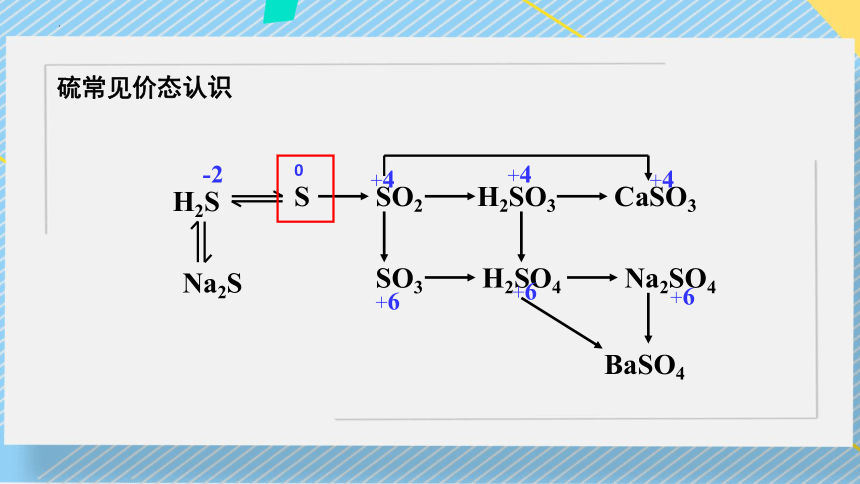
H2S
Na2S
S
SO2
SO3
H2SO3
CaSO3
H2SO4
Na2SO4
BaSO4
0
-2
+4
+4
+4
+6
+6
+6
硫常见价态认识
一、自然界中的硫
火山爆发
火山口的硫
(一).存在形式
一、硫
化学式 名称
BaSO4 重晶石
CaSO4·2H2O 石膏
ZnSO4·7H2O 皓矾
FeSO4·7H2O 绿矾
Na2SO4·10H2O 芒硝
(二)物理性质
俗称 颜色状态 硬度 溶解性 水 酒精 CS2
硫黄 ___色晶体 质___、易研成粉末 ___溶 ___溶 ___溶
黄
脆
难
微
易
【思考1】若试管内壁附着有单质硫时,如何洗涤除去
一、硫
(三)化学性质
一、硫
现象:剧烈燃烧,发光发热,生成黑色固体。
结论: Fe + S ==== FeS
注意:生成硫化亚铁 FeS
不生成硫化铁 Fe2S3
实 验
把研细的硫粉和铁粉混合物放在石棉网上堆成条状,用一根加热后的玻璃棒去引燃药品的一端。
结合此实验请你写出铜与硫的反应
(三)化学性质
一、硫
实 验
把研细的硫粉和铁粉混合物放在石棉网上堆成条状,用一根加热后的玻璃棒去引燃药品的一端。
(三)化学性质
一、硫
1、硫与铁的反应
Fe + S ==== FeS
硫和氯气都能分别与铜、铁反应,试比较反应有何异同?
2Cu + S ==== Cu2S
2、铜与铁反应
(三)化学性质
一、硫
2、硫与非金属的反应
回忆:硫在空气中燃烧、纯氧中燃烧的现象
(三)化学性质
一、硫
2、硫与非金属的反应
S + O2 ==== SO2
点燃
0
+4
硫作为还原剂
具有还原性
回忆:硫在空气中燃烧、纯氧中燃烧的现象
注意:硫在氧气中的燃烧产物只能是二氧化硫SO2,不可能是 SO3
H2 + S == H2S
硫作为氧化剂,具有氧化性。
总结:硫的化学性质
一、硫
1、与金属反应(能与许多金属反应)
2、与非金属反应:
3、可与强碱溶液反应:
3S + 6NaOH === 2Na2S + Na2SO3 + 3H2O
1、下列反应中,硫表现还原性的是( )
A、硫与氧气 B、硫与氢气
C、硫与铁 D、硫与铜
A
2、关于硫的叙述正确的是 ( )
A、硫的非金属性较强,所以只以化合态存在于自然界中
B、S与金属或非金属反应时均作氧化剂
C、S的两种单质之间的转化属于化学变化
D、硫在空气中的燃烧产物是SO2,在纯氧中燃烧产物是SO3
C
(一) 物理性质
颜色 状态 气味 毒性 密度 溶解性
___色 气体 _______气味 有毒 比空气__ ___溶于水(1∶40)
无
刺激性
大
易
二、二氧化硫
(二)化学性质
实验探究 【实验5-1】
把充满SO2,塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内液面的上升。待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定试管中溶液的酸碱度(保留该溶液供实验5-2使用)
SO2+H2O H2SO3
二、二氧化硫
?
?
①正反应:向_______方向进行的反应;
②逆反应:向_______方向进行的反应;
③可逆反应:在_________下,既能向正反应方向进行,_____又能向逆反应方向进行的反应。
生成物
反应物
同一条件
同时
可逆反应
二、二氧化硫
SO2+H2O H2SO3
(二)二氧化硫
1.酸性氧化物的通性
第五章化工生产中的重要非金属元素
第一节硫及其化合物
硫是一种重要的 元素,位于元素周期表的 周期, 族。
O
S
原子结构
+16
2
8
6
硫原子的最外层有6个电子,在化学反应中容易得到2个电子,形成-2价的硫的化合物。与同主族的氧元素相比,硫元素的原子多一个电子层,得点子的能力相对较弱,而失电子能力则相对较强。这也是我们在富含样子的地表附近找到含硫化合物中,硫常常为+4价或+6价,而氧为-2价的原因。
硫元素在元素周期表中的位置
H2S
Na2S
S
SO2
SO3
H2SO3
CaSO3
H2SO4
Na2SO4
BaSO4
0
-2
+4
+4
+4
+6
+6
+6
硫常见价态认识
一、自然界中的硫
火山爆发
火山口的硫
(一).存在形式
一、硫
化学式 名称
BaSO4 重晶石
CaSO4·2H2O 石膏
ZnSO4·7H2O 皓矾
FeSO4·7H2O 绿矾
Na2SO4·10H2O 芒硝
(二)物理性质
俗称 颜色状态 硬度 溶解性 水 酒精 CS2
硫黄 ___色晶体 质___、易研成粉末 ___溶 ___溶 ___溶
黄
脆
难
微
易
【思考1】若试管内壁附着有单质硫时,如何洗涤除去
一、硫
(三)化学性质
一、硫
现象:剧烈燃烧,发光发热,生成黑色固体。
结论: Fe + S ==== FeS
注意:生成硫化亚铁 FeS
不生成硫化铁 Fe2S3
实 验
把研细的硫粉和铁粉混合物放在石棉网上堆成条状,用一根加热后的玻璃棒去引燃药品的一端。
结合此实验请你写出铜与硫的反应
(三)化学性质
一、硫
实 验
把研细的硫粉和铁粉混合物放在石棉网上堆成条状,用一根加热后的玻璃棒去引燃药品的一端。
(三)化学性质
一、硫
1、硫与铁的反应
Fe + S ==== FeS
硫和氯气都能分别与铜、铁反应,试比较反应有何异同?
2Cu + S ==== Cu2S
2、铜与铁反应
(三)化学性质
一、硫
2、硫与非金属的反应
回忆:硫在空气中燃烧、纯氧中燃烧的现象
(三)化学性质
一、硫
2、硫与非金属的反应
S + O2 ==== SO2
点燃
0
+4
硫作为还原剂
具有还原性
回忆:硫在空气中燃烧、纯氧中燃烧的现象
注意:硫在氧气中的燃烧产物只能是二氧化硫SO2,不可能是 SO3
H2 + S == H2S
硫作为氧化剂,具有氧化性。
总结:硫的化学性质
一、硫
1、与金属反应(能与许多金属反应)
2、与非金属反应:
3、可与强碱溶液反应:
3S + 6NaOH === 2Na2S + Na2SO3 + 3H2O
1、下列反应中,硫表现还原性的是( )
A、硫与氧气 B、硫与氢气
C、硫与铁 D、硫与铜
A
2、关于硫的叙述正确的是 ( )
A、硫的非金属性较强,所以只以化合态存在于自然界中
B、S与金属或非金属反应时均作氧化剂
C、S的两种单质之间的转化属于化学变化
D、硫在空气中的燃烧产物是SO2,在纯氧中燃烧产物是SO3
C
(一) 物理性质
颜色 状态 气味 毒性 密度 溶解性
___色 气体 _______气味 有毒 比空气__ ___溶于水(1∶40)
无
刺激性
大
易
二、二氧化硫
(二)化学性质
实验探究 【实验5-1】
把充满SO2,塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内液面的上升。待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定试管中溶液的酸碱度(保留该溶液供实验5-2使用)
SO2+H2O H2SO3
二、二氧化硫
?
?
①正反应:向_______方向进行的反应;
②逆反应:向_______方向进行的反应;
③可逆反应:在_________下,既能向正反应方向进行,_____又能向逆反应方向进行的反应。
生成物
反应物
同一条件
同时
可逆反应
二、二氧化硫
SO2+H2O H2SO3
(二)二氧化硫
1.酸性氧化物的通性
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
