广西柳州市2022-2023学年高一下学期1月开学联考仿真模拟化学试题(含答案)
文档属性
| 名称 | 广西柳州市2022-2023学年高一下学期1月开学联考仿真模拟化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 394.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 08:43:27 | ||
图片预览



文档简介
柳州市2022-2023学年高一下学期1月开学联考仿真模拟
化学
(考试范围:人教版2019必修一 考试时间:75分钟 试卷满分:100分)
一、选择题:本题共16个小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.关于物质的类别或成分,下列说法正确的是
A.食盐水、糖水和冰水都是溶液,故属于混合物
B.盐酸、硝酸、硫酸和硫酸氢钠都能电离出氢离子,故都属于酸
C.氯化氢、氨气的水溶液都能导电,故都属于电解质
D.二氧化碳、二氧化硫都能与氢氧化钠溶液反应生成盐和水,故都属于酸性氧化物
2.在无色透明的溶液中,可以大量共存的离子是
A.、、、 B.、、、
C.、、、 D.、、、
3.据最新报道,放射性同位素钬可有效地治疗肝癌。该同位素原子内的中子数与核外电子数之差为
A. B. C. D.
4.下列物质中,有离子键的是( )
A.N2 B.CH4 C.NaCl D.HCl
5.新制氯水既可以用来消毒杀菌,也可以用作漂白剂,其中起主要作用的是
A.Cl2 B.HCl C.HClO D.O2
6.下列说法正确的是
A.Na2O 和 Na2O2 中阴阳离子个数比不相等
B.焰色试验火焰呈黄色的肯定是钠盐
C.相同条件下,在水中溶解度:Na2CO3D.可通过相互滴加的方式鉴别盐酸和Na2CO3 溶液
7.下列离子方程式书写正确的是
A.与稀硝酸反应:
B.与溶液反应:
C.与溶液反应:
D.与溶液反应:
8.下列物质中,既能用单质间的化合反应又能由单质与盐酸反应而制得的是
A. B. C. D.
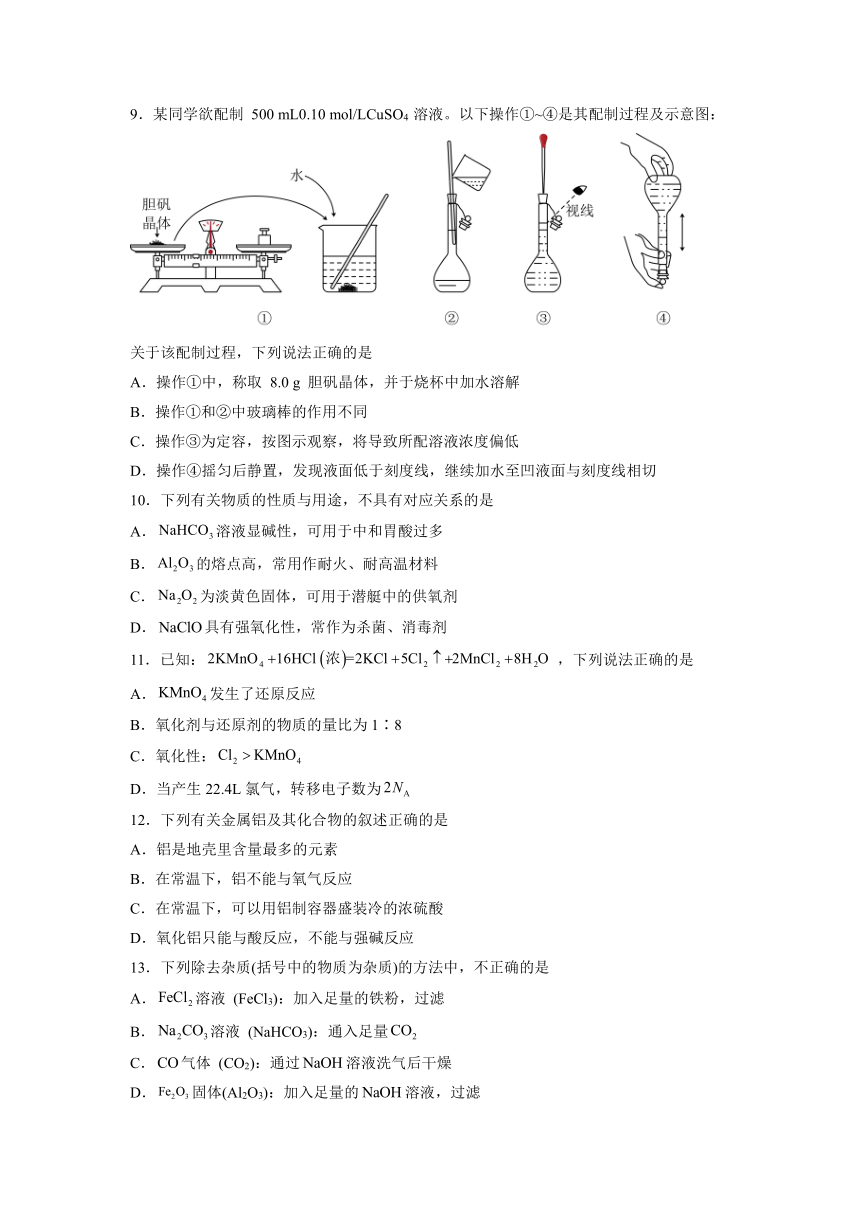
9.某同学欲配制 500 mL0.10 mol/LCuSO4 溶液。以下操作①~④是其配制过程及示意图:
关于该配制过程,下列说法正确的是
A.操作①中,称取 8.0 g 胆矾晶体,并于烧杯中加水溶解
B.操作①和②中玻璃棒的作用不同
C.操作③为定容,按图示观察,将导致所配溶液浓度偏低
D.操作④摇匀后静置,发现液面低于刻度线,继续加水至凹液面与刻度线相切
10.下列有关物质的性质与用途,不具有对应关系的是
A.溶液显碱性,可用于中和胃酸过多
B.的熔点高,常用作耐火、耐高温材料
C.为淡黄色固体,可用于潜艇中的供氧剂
D.具有强氧化性,常作为杀菌、消毒剂
11.已知:,下列说法正确的是
A.发生了还原反应
B.氧化剂与还原剂的物质的量比为1∶8
C.氧化性:
D.当产生22.4L氯气,转移电子数为
12.下列有关金属铝及其化合物的叙述正确的是
A.铝是地壳里含量最多的元素
B.在常温下,铝不能与氧气反应
C.在常温下,可以用铝制容器盛装冷的浓硫酸
D.氧化铝只能与酸反应,不能与强碱反应
13.下列除去杂质(括号中的物质为杂质)的方法中,不正确的是
A.溶液 (FeCl3):加入足量的铁粉,过滤
B.溶液 (NaHCO3):通入足量
C.气体 (CO2):通过溶液洗气后干燥
D.固体(Al2O3):加入足量的溶液,过滤
14.Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如表所列物质不能按如图关系(“→”表示一步完成)相互转化的是
选项 A B C D
a Na Al Fe
b NaOH
c NaCl CuO
A.A B.B C.C D.D
15.下列有关元素周期律的比较中正确的是
A.金属性:
B.单质与氢气化合由易到难的顺序:
C.简单氢化物的稳定性:
D.碱性强弱:
16.W、X、Y、Z是原子序数依次增大的短周期主族元素,W、X、Z组成的一种化合物与蒸馏水按体积比3∶1混合后可用于杀灭新型冠状病毒,Y的一种单质在空气中含量最高。下列有关说法正确的是
A.简单离子的半径:
B.简单氢化物的稳定性:
C.最高价氧化物对应水化物的酸性:
D.W、Y、Z既能形成共价化合物又能形成离子化合物
二、非选择题:包括第17题~第20题4个大题,共52分。
17.(12分)回答下列问题
(1)有以下六种物质:①乙醇;②0.1mol/LNa2CO3溶液;③NaOH固体;④液态氯化氢;⑤冰醋酸;⑥石墨。上述状态下的物质中,能导电的有___________(填序号,下同),属于电解质的有___________。
(2)请写出氯气与氢氧化钠反应的化学方程式,并用双线桥法标出电子转移方向和数目:___________。
(3)请写出下列物质在水溶液中的电离方程式:
①HNO3___________;
②Ba(OH)2___________;
③Fe2(SO4)3___________;
④NaHSO4___________
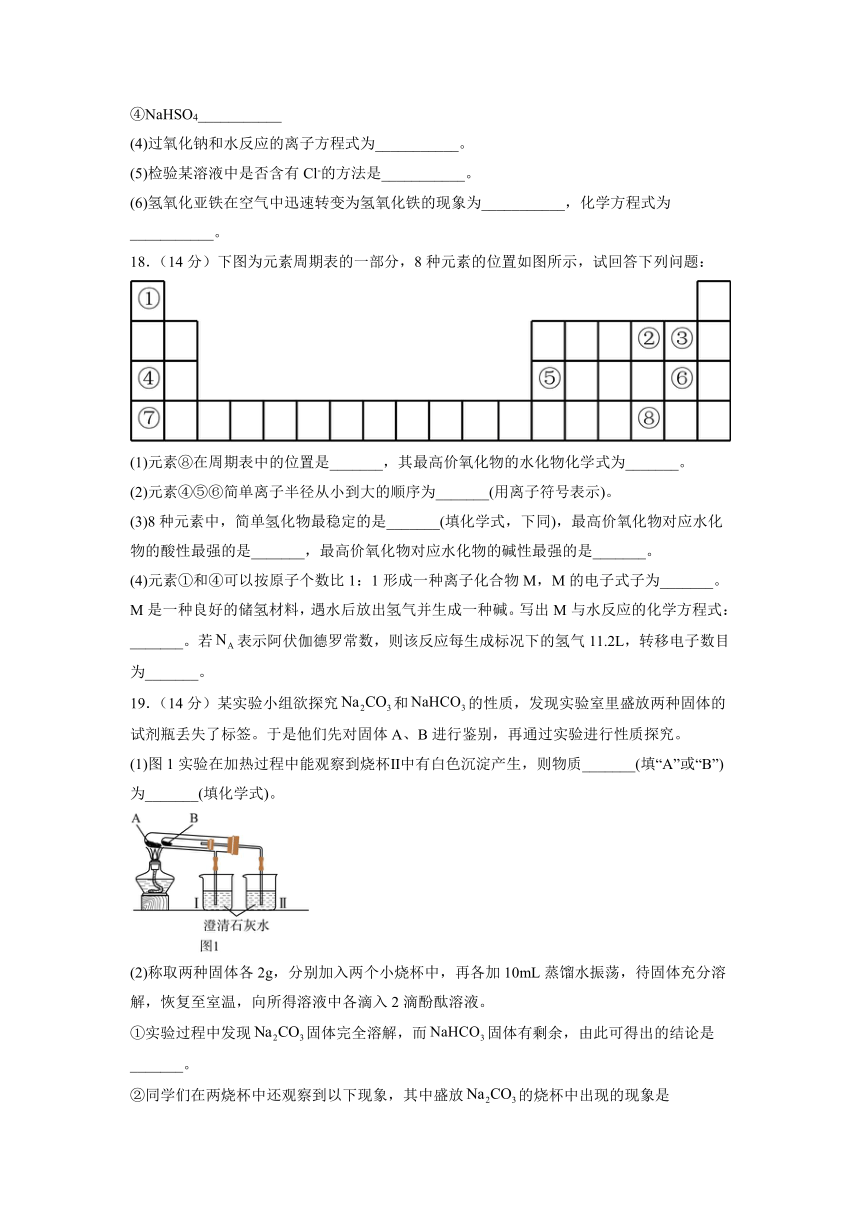
(4)过氧化钠和水反应的离子方程式为___________。
(5)检验某溶液中是否含有Cl-的方法是___________。
(6)氢氧化亚铁在空气中迅速转变为氢氧化铁的现象为___________,化学方程式为___________。
18.(14分)下图为元素周期表的一部分,8种元素的位置如图所示,试回答下列问题:
(1)元素⑧在周期表中的位置是_______,其最高价氧化物的水化物化学式为_______。
(2)元素④⑤⑥简单离子半径从小到大的顺序为_______(用离子符号表示)。
(3)8种元素中,简单氢化物最稳定的是_______(填化学式,下同),最高价氧化物对应水化物的酸性最强的是_______,最高价氧化物对应水化物的碱性最强的是_______。
(4)元素①和④可以按原子个数比1:1形成一种离子化合物M,M的电子式子为_______。M是一种良好的储氢材料,遇水后放出氢气并生成一种碱。写出M与水反应的化学方程式:_______。若表示阿伏伽德罗常数,则该反应每生成标况下的氢气11.2L,转移电子数目为_______。
19.(14分)某实验小组欲探究和的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)图1实验在加热过程中能观察到烧杯Ⅱ中有白色沉淀产生,则物质_______(填“A”或“B”)为_______(填化学式)。
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水振荡,待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①实验过程中发现固体完全溶解,而固体有剩余,由此可得出的结论是_______。
②同学们在两烧杯中还观察到以下现象,其中盛放的烧杯中出现的现象是_______(填字母)。
a.溶液温度下降
b.溶液温度升高
c.滴入酚酞后呈浅红色
d.滴入酚酞后呈红色
(3)如图2所示,在气密性良好的Ⅰ和Ⅱ试管中分别加入足量等浓度、等体积的稀盐酸,将气球内的固体同时倒入试管中。
①两试管中均产生气体,_______(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,_______(填“Ⅰ”或“Ⅱ”)的气球体积较大。
20.(12分)铁是人类较早使用的金属之一,运用所学知识,回答下列问题。电子工业常用 30%的 FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中存在Fe3+的试剂是_______(填化学式)溶液,证明 Fe3+存在的现象是_______。
(2)写出 FeCl3溶液与金属铜发生反应的离子方程式_______。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:
回答下列问题:
①试剂a是_______,操作I用到的玻璃仪器有烧杯、玻璃棒和_______。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为_______。
③上述流程中操作III包括_______、过滤、洗涤。
参考答案:
1.D
【详解】A.食盐水、糖水都是溶液,都属于混合物,冰水是由一种物质组成的纯净物,故A错误;
B.盐酸是氯化氢的水溶液,属于混合物,显酸性;硫酸、硝酸都能电离出氢离子,故都属于酸,硫酸氢钠电离出的阳离子有硫酸根离子、钠离子、氢离子,属于盐,故B错误;
C.氯化氢溶于水电离出阴阳离子,能导电,故属于电解质,氨气不能电离,属于非电解质,故C错误;
D.能与碱反应生成盐和水的氧化物是酸性氧化物,二氧化碳、二氧化硫都能与氢氧化钠溶液反应生成盐和水,故都属于酸性氧化物,故D正确;
故选D。
2.A
【详解】A.、、、相互之间不反应,且没有颜色,可以共存,A正确;
B.含铜离子的溶液为蓝色,B错误;
C.含亚铁离子的溶液为浅绿色,且、相互之间反应生成氢氧化亚铁沉淀,不能共存,C错误;
D.、相互反应生成硫酸钡沉淀,不能共存,D错误;
故选A。
3.A
【详解】的质子数等于核外电子数等于67,质量数为166,中子数为166-67=99,故中子数与核外电子数之差为99-67=32,故选A。
4.C
【详解】A、N2中含有同种非金属元素形成的非极性共价键,故A错误;
B、CH4中只有C、H元素之间形成的极性共价键,故B错误;
C、NaCl中钠离子与氯离子以离子键结合,故C正确;
D、HCl中只有H、Cl元素之间形成的极性共价键,故D错误;
故选:C。
5.C
【详解】氯水作漂白剂和杀菌剂主要是氯水中含有HClO的缘故,综上所述故选C。
6.D
【详解】A.Na2O 阴阳离子个数比为1:2,Na2O2中阴阳离子个数比为1:2,两者相等,A错误;
B.钾离子焰色在不透过蓝色钴玻璃观察时也是黄色的,B错误;
C.相同条件下,在水中溶解度:Na2CO3>NaHCO3,C错误;
D.可通过相互滴加的方式鉴别盐酸和Na2CO3 溶液,盐酸加入Na2CO3 溶液产生二氧化碳的时间大于Na2CO3 溶液加入盐酸中的时间,D正确;
答案选D。
7.B
【详解】A.Cu与稀硝酸反应生成NO,3Cu+2+8H+=3Cu2++2NO↑+4H2O,A错误;
B.Cl2与KI溶液反应:Cl2+2I =2Cl +I2,B正确;
C.Fe与FeCl3溶液反应,电荷不守恒,Fe++2Fe3+=3Fe2+,C错误;
D.Mg(OH)2与H2SO4溶液反应,Mg(OH)2难溶物不能拆,Mg(OH)2+2H+=Mg2++2H2O, D错误;
故答案为:B。
8.A
【详解】A.钠和氯气反应生成氯化钠,,钠和盐酸反应生成氯化钠和氢气,,A符合;
B.铁和氯气反应生成氯化铁,,铁和盐酸反应生成氯化亚铁和氢气,,B不符合;
C.铜和氯气反应生成氯化铜,,铜和盐酸不反应,C不符合;
D.铁和氯气反应生成氯化铁,,铁和盐酸反应生成氯化亚铁和氢气,,D不符合;
故本题选A。
9.B
【详解】A.操作①中,应称取12.5g胆矾晶体,并于烧杯中加水溶解,故A错误;
B.操作①中玻璃棒作用为搅拌,操作②中玻璃棒作用为引流,故B正确;
C.定容时俯视刻度线,导致溶液体积偏小,所配溶液浓度偏高,故C错误;
D.摇匀后静置,发现液面低于刻度线,属于正常现象,再加水则溶液的体积偏大,导致溶液浓度偏小,故D错误;
故答案选B。
10.C
【详解】A.NaHCO3是弱酸强碱盐,溶液呈弱碱性,可用于中和胃酸过多,故A正确;
B.Al2O3的离子键强,导致其熔点高,可用作耐火、耐高温材料,故B正确;
C.Na2O2能与二氧化碳、水反应生成氧气,可作潜艇中的供氧剂,与Na2O2为淡黄色固体无关,故C错误;
D.NaClO具有强氧化性,能杀灭细菌,所以NaClO可作杀菌、消毒剂,故D正确;
故选C。
11.A
【分析】该反应中Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,得电子化合价降低的反应物是氧化剂,所以氧化剂是KMnO4,盐酸是还原剂;
【详解】A.该反应中发生了还原反应,HCl发生了氧化反应,故A正确;
B.16molHCl只有10molHCl被氧化为5mol的氯气,体现了HCl的还原性,另外的6molHCl化合价没变,体现的是HCl的酸性,则氧化剂与还原剂的物质的量比为2:10=1:5,故B错误;
C.还原剂失去电子被氧化的产物为氧化产物,所以氧化产物为Cl2,氧化剂的氧化性大于氧化产物,则氧化性:KMnO4>Cl2,故C错误;
D.当标准状况下产生22.4L氯气,每生成1mol氯气转移电子数为2NA个,未指明标准状况就难以计算,故D错误;
故选A。
12.C
【详解】A.地壳中含量最多的非金属元素是氧,含量最多的金属元素是铝,A错误;
B.铝在常温下与空气中氧气反应,表面生成一层致密的氧化膜,B错误;
C.常温下可以用铁、铝制容器盛装冷的浓硫酸,是因为铁、铝遇冷的浓硫酸发生钝化,是因为浓硫酸的强氧化性,C正确;
D.氧化铝为两性氧化物,既能与强酸反应有能与强碱反应,D错误;
故选C。
13.B
【详解】A.铁粉和FeCl3发生反应:2FeCl3+Fe=3FeCl2,过滤除去过量铁粉,A正确;
B.溶液与足量反应生成NaHCO3,将主物质除去,不符合除杂原则,B错误;
C.CO与NaOH溶液不反应,CO2与NaOH溶液反应,生成碳酸钠和水,所以混有CO2的CO气体可通过NaOH溶液洗气后干燥,得到纯净干燥的CO2,C正确;
D.Fe2O3和氢氧化钠溶液不反应,Al2O3和氢氧化钠发生反应如下:Al2O3+2NaOH=2NaAlO2+H2O,生成可溶性钠盐,过滤将其除去,D正确;
答案为:B。
14.B
【详解】A.钠与水反应生成氢氧化钠,氢氧化钠与盐酸反应生成氯化钠,电解熔融的氯化钠生成金属钠,均可一步实现转化,选项A不符合题意;
B.铝与氢氧化钠溶液反应生成偏铝酸钠,偏铝酸铝溶液与适量强酸或二氧化碳作用生成氢氧化铝,不能直接转化为氧化铝,不能一步实现转化,选项B符合题意;
C.铁在氯气中燃烧生成氯化铁,氯化铁与铁反应生成氯化亚铁,氯化亚铁被锌置换生成铁,均可一步实现转化,故C不符合题意;
D.氯化铜与氢氧化钠反应生成氢氧化铜,氢氧化铜受热分解成氧化铜,氧化铜和盐酸反应生成氯化铜,均可一步实现转化,选项D不符合题意;
答案选B。
15.B
【详解】A.同主族元素自上而下金属性逐渐增强,金属性:,选项A错误;
B.Cl、S、P为同周期元素,根据元素周期律可知,非金属性:,故其单质与氢气化合由易到难的顺序:,选项B正确;
C.非金属性:,所以简单氢化物的稳定性:,选项C错误;
D.同主族自上而下金属性逐渐增强,最高价氧化物对应的水化物的碱性增强,所以碱性:,选项D错误;
答案选B。
16.D
【分析】Y的一种单质在空气中含量最高,Y为N;W、X、Z组成的一种化合物与蒸馏水按体积比3∶1混合后可用于杀灭新型冠状病毒,化合物为乙醇,则W、X、Z分别为H、C、O,因此W、X、Y、Z分别为H、C、N、O。
【详解】A.简单离子半径:,选项A错误;
B.非金属性越强简单气态氢化物的稳定性越强,则简单氢化物的稳定性:,选项B错误;
C.最高价氧化物对应水化物的酸性:,选项C错误;
D.H、N、O能形成共价化合物、离子化合物,选项D正确;
答案选D。
17.(1) ②⑥ ③④⑤
(2)
(3) HNO3=H++ Ba(OH)2=Ba2++2OH- Fe2(SO4)3=2Fe3++3 NaHSO4=Na++H++
(4)2Na2O2+2H2O=4Na++4OH-+O2↑
(5)取样于试管中,加硝酸酸化的硝酸银/先加硝酸酸化后加硝酸银,出现白色沉淀则证明溶液中含Cl-;先加硝酸银,出现白色沉淀,加硝酸,仍有白色沉淀存在,则证明溶液中含Cl-
(6) 白色沉淀迅速转变为灰绿色,最终生成红褐色沉淀 4Fe(OH)2+2H2O+O2=4Fe(OH)3
【解析】(1)
判断能导电的物质,要看物质在熔融状态下是否有自由移动的离子,在溶液状态下是否出现离子。固体物质导电是由于存在可自由移动的电子,如金属单质。0.1mol/LNa2CO3溶液中有自由移动的阴阳离子;石墨中存在自由移动的电子。③NaOH固体;④液态氯化氢;⑤冰醋酸都是化合物且其在水溶液中能电离出离子导电是电解质,故答案为:②⑥;③④⑤。
(2)
氯气与氢氧化钠反应发生歧化反应,生成氯化钠和次氯酸钠和水,由氯气到氯化钠,氯元素化合价由0价变为-1价,由氯气到次氯酸钠,氯元素化合价由0价变为+1价,电子转移方向和数目表示为:。
(3)
注意强电解质电离方程式的书写用“=”且强酸的酸式盐需把酸式酸根拆开。四种物质的电离方程式:HNO3=H++;Ba(OH)2=Ba2++2OH-;Fe2(SO4)3=2Fe3++3;NaHSO4=Na++H++。
(4)
过氧化钠和水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,注意过氧化钠不能拆。
(5)
取样于试管中,加硝酸酸化的硝酸银/先加硝酸酸化后加硝酸银,出现白色沉淀则证明溶液中含Cl-;先加硝酸银,出现白色沉淀,加硝酸,仍有白色沉淀存在,则证明溶液中含Cl-
(6)
氢氧化亚铁在空气中发生反应迅速转变为氢氧化铁
4Fe(OH)2+2H2O+O2=4Fe(OH)3,现象为白色沉淀迅速转变为灰绿色,最终生成红褐色沉淀。
18.(1) 第四周期ⅣA族
(2)
(3) HF KOH
(4)
【分析】根据元素在周期表中的位置,①是H元素;②是O元素;③是F元素;④是Na元素;⑤是Al元素;⑥是Cl元素;⑦是K元素;⑧是Se元素。
(1)
⑧是Se元素,在周期表中的位置是第四周期ⅣA族,最高价为+6,其最高价氧化物的水化物化学式为。
(2)
一般离子的电子层数越多,半径越大,若离子电子层数相同,质子数越多半径越小,元素④⑤⑥简单离子半径从小到大的顺序为Al3+ Na+ Cl-。
(3)
8种元素中,K的金属性最强,最高价氧化物对应水化物的碱性最强的是KOH;最高价氧化物对应水化物的酸性最强的是,F的非金属性最强,简单氢化物最稳定的是HF。
(4)
H和Na可以按原子个数比1:1形成离子化合物NaH,NaH的电子式子为。NaH是一种良好的储氢材料,遇水后生成氢气和氢氧化钠,反应的化学方程式。若NA表示阿伏伽德罗常数,则该反应每生成标况下的氢气11.2L即0.5molH2,转移电子数目为0.5NA。
19.(1) B
(2) 相同温度下比易溶于水或相同温度下的溶解度大于的 bd
(3) Ⅰ Ⅰ
【分析】本实验为探究和的性质,根据实验现象,得出相应的结论。
【详解】(1)碳酸钠较稳定,受热难分解,碳酸氢钠热稳定性差,受热易分解,生成CO2使澄清石灰水变浑浊,则物质B为碳酸氢钠;
(2)①固体完全溶解,而固体有剩余,说明在相同的温度下,的溶解度大于的;
②碳酸钠溶解过程为放热过程,温度升高;碳酸钠溶液的碱性较强,滴入酚酞后溶液呈红色;碳酸氢钠溶液的碱性较弱,滴入酚酞后溶液呈浅红色,故选bd;
(3)将气球内的固体同时倒入试管中发生反应:,;
①同等条件下,碳酸钠与盐酸反应的速率较碳酸氢钠与盐酸反应的速率慢,所以Ⅰ的反应程度更为剧烈;
②的相对分子质量为106,的相对分子质量为84,根据反应的化学方程式可知,生成等质量的二氧化碳需要消耗碳酸钠的质量更多,因此等质量的和与足量的稀盐酸反应,反应生成的二氧化碳多,所以Ⅰ的气球体积较大。
20.(1) KSCN 溶液变成红色
(2)Cu+2Fe3+=2Fe2++Cu2+
(3) 铁() 漏斗 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 蒸发浓缩、冷却结晶
【分析】腐蚀废液中含有氯化铁、氯化铜、氯化亚铁,加入过量的铁可以和氯化铁、氯化铜反应生成金属铜和氯化亚铁,经过滤所得滤液X是氯化亚铁,滤渣Y是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量盐酸可以将铜分离,得到氯化亚铁溶液,滤液合并后通入氯气,能将氯化亚铁氧化为氯化铁,以此解题。
【详解】(1)检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液与试管中,滴加KSCN溶液,溶液变红说明Fe3+存在,故答案为:KSCN溶液;溶液变成红色;
(2)三价铁可以和单质铜反应生成二价铁和铜离子,离子方程式为:Cu+2Fe3+=2Fe2++Cu2+;
(3)①腐蚀废液中含有氯化铁、氯化铜、氯化亚铁,加入过量的铁可以和氯化铁、氯化铜反应生成金属铜和氯化亚铁,所以试剂a是铁,操作I是过滤,用到的玻璃仪器有烧杯、玻璃棒和漏斗;
②滤液X、Z中都有氯化亚铁,氯化亚铁溶液中通入氯气,转化为氯化铁,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl 。
③操作III是氯化铁溶液蒸发浓缩、冷却结晶、过滤、洗涤得到氯化铁晶体。
化学
(考试范围:人教版2019必修一 考试时间:75分钟 试卷满分:100分)
一、选择题:本题共16个小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.关于物质的类别或成分,下列说法正确的是
A.食盐水、糖水和冰水都是溶液,故属于混合物
B.盐酸、硝酸、硫酸和硫酸氢钠都能电离出氢离子,故都属于酸
C.氯化氢、氨气的水溶液都能导电,故都属于电解质
D.二氧化碳、二氧化硫都能与氢氧化钠溶液反应生成盐和水,故都属于酸性氧化物
2.在无色透明的溶液中,可以大量共存的离子是
A.、、、 B.、、、
C.、、、 D.、、、
3.据最新报道,放射性同位素钬可有效地治疗肝癌。该同位素原子内的中子数与核外电子数之差为
A. B. C. D.
4.下列物质中,有离子键的是( )
A.N2 B.CH4 C.NaCl D.HCl
5.新制氯水既可以用来消毒杀菌,也可以用作漂白剂,其中起主要作用的是
A.Cl2 B.HCl C.HClO D.O2
6.下列说法正确的是
A.Na2O 和 Na2O2 中阴阳离子个数比不相等
B.焰色试验火焰呈黄色的肯定是钠盐
C.相同条件下,在水中溶解度:Na2CO3
7.下列离子方程式书写正确的是
A.与稀硝酸反应:
B.与溶液反应:
C.与溶液反应:
D.与溶液反应:
8.下列物质中,既能用单质间的化合反应又能由单质与盐酸反应而制得的是
A. B. C. D.
9.某同学欲配制 500 mL0.10 mol/LCuSO4 溶液。以下操作①~④是其配制过程及示意图:
关于该配制过程,下列说法正确的是
A.操作①中,称取 8.0 g 胆矾晶体,并于烧杯中加水溶解
B.操作①和②中玻璃棒的作用不同
C.操作③为定容,按图示观察,将导致所配溶液浓度偏低
D.操作④摇匀后静置,发现液面低于刻度线,继续加水至凹液面与刻度线相切
10.下列有关物质的性质与用途,不具有对应关系的是
A.溶液显碱性,可用于中和胃酸过多
B.的熔点高,常用作耐火、耐高温材料
C.为淡黄色固体,可用于潜艇中的供氧剂
D.具有强氧化性,常作为杀菌、消毒剂
11.已知:,下列说法正确的是
A.发生了还原反应
B.氧化剂与还原剂的物质的量比为1∶8
C.氧化性:
D.当产生22.4L氯气,转移电子数为
12.下列有关金属铝及其化合物的叙述正确的是
A.铝是地壳里含量最多的元素
B.在常温下,铝不能与氧气反应
C.在常温下,可以用铝制容器盛装冷的浓硫酸
D.氧化铝只能与酸反应,不能与强碱反应
13.下列除去杂质(括号中的物质为杂质)的方法中,不正确的是
A.溶液 (FeCl3):加入足量的铁粉,过滤
B.溶液 (NaHCO3):通入足量
C.气体 (CO2):通过溶液洗气后干燥
D.固体(Al2O3):加入足量的溶液,过滤
14.Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如表所列物质不能按如图关系(“→”表示一步完成)相互转化的是
选项 A B C D
a Na Al Fe
b NaOH
c NaCl CuO
A.A B.B C.C D.D
15.下列有关元素周期律的比较中正确的是
A.金属性:
B.单质与氢气化合由易到难的顺序:
C.简单氢化物的稳定性:
D.碱性强弱:
16.W、X、Y、Z是原子序数依次增大的短周期主族元素,W、X、Z组成的一种化合物与蒸馏水按体积比3∶1混合后可用于杀灭新型冠状病毒,Y的一种单质在空气中含量最高。下列有关说法正确的是
A.简单离子的半径:
B.简单氢化物的稳定性:
C.最高价氧化物对应水化物的酸性:
D.W、Y、Z既能形成共价化合物又能形成离子化合物
二、非选择题:包括第17题~第20题4个大题,共52分。
17.(12分)回答下列问题
(1)有以下六种物质:①乙醇;②0.1mol/LNa2CO3溶液;③NaOH固体;④液态氯化氢;⑤冰醋酸;⑥石墨。上述状态下的物质中,能导电的有___________(填序号,下同),属于电解质的有___________。
(2)请写出氯气与氢氧化钠反应的化学方程式,并用双线桥法标出电子转移方向和数目:___________。
(3)请写出下列物质在水溶液中的电离方程式:
①HNO3___________;
②Ba(OH)2___________;
③Fe2(SO4)3___________;
④NaHSO4___________
(4)过氧化钠和水反应的离子方程式为___________。
(5)检验某溶液中是否含有Cl-的方法是___________。
(6)氢氧化亚铁在空气中迅速转变为氢氧化铁的现象为___________,化学方程式为___________。
18.(14分)下图为元素周期表的一部分,8种元素的位置如图所示,试回答下列问题:
(1)元素⑧在周期表中的位置是_______,其最高价氧化物的水化物化学式为_______。
(2)元素④⑤⑥简单离子半径从小到大的顺序为_______(用离子符号表示)。
(3)8种元素中,简单氢化物最稳定的是_______(填化学式,下同),最高价氧化物对应水化物的酸性最强的是_______,最高价氧化物对应水化物的碱性最强的是_______。
(4)元素①和④可以按原子个数比1:1形成一种离子化合物M,M的电子式子为_______。M是一种良好的储氢材料,遇水后放出氢气并生成一种碱。写出M与水反应的化学方程式:_______。若表示阿伏伽德罗常数,则该反应每生成标况下的氢气11.2L,转移电子数目为_______。
19.(14分)某实验小组欲探究和的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)图1实验在加热过程中能观察到烧杯Ⅱ中有白色沉淀产生,则物质_______(填“A”或“B”)为_______(填化学式)。
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水振荡,待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①实验过程中发现固体完全溶解,而固体有剩余,由此可得出的结论是_______。
②同学们在两烧杯中还观察到以下现象,其中盛放的烧杯中出现的现象是_______(填字母)。
a.溶液温度下降
b.溶液温度升高
c.滴入酚酞后呈浅红色
d.滴入酚酞后呈红色
(3)如图2所示,在气密性良好的Ⅰ和Ⅱ试管中分别加入足量等浓度、等体积的稀盐酸,将气球内的固体同时倒入试管中。
①两试管中均产生气体,_______(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,_______(填“Ⅰ”或“Ⅱ”)的气球体积较大。
20.(12分)铁是人类较早使用的金属之一,运用所学知识,回答下列问题。电子工业常用 30%的 FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中存在Fe3+的试剂是_______(填化学式)溶液,证明 Fe3+存在的现象是_______。
(2)写出 FeCl3溶液与金属铜发生反应的离子方程式_______。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:
回答下列问题:
①试剂a是_______,操作I用到的玻璃仪器有烧杯、玻璃棒和_______。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为_______。
③上述流程中操作III包括_______、过滤、洗涤。
参考答案:
1.D
【详解】A.食盐水、糖水都是溶液,都属于混合物,冰水是由一种物质组成的纯净物,故A错误;
B.盐酸是氯化氢的水溶液,属于混合物,显酸性;硫酸、硝酸都能电离出氢离子,故都属于酸,硫酸氢钠电离出的阳离子有硫酸根离子、钠离子、氢离子,属于盐,故B错误;
C.氯化氢溶于水电离出阴阳离子,能导电,故属于电解质,氨气不能电离,属于非电解质,故C错误;
D.能与碱反应生成盐和水的氧化物是酸性氧化物,二氧化碳、二氧化硫都能与氢氧化钠溶液反应生成盐和水,故都属于酸性氧化物,故D正确;
故选D。
2.A
【详解】A.、、、相互之间不反应,且没有颜色,可以共存,A正确;
B.含铜离子的溶液为蓝色,B错误;
C.含亚铁离子的溶液为浅绿色,且、相互之间反应生成氢氧化亚铁沉淀,不能共存,C错误;
D.、相互反应生成硫酸钡沉淀,不能共存,D错误;
故选A。
3.A
【详解】的质子数等于核外电子数等于67,质量数为166,中子数为166-67=99,故中子数与核外电子数之差为99-67=32,故选A。
4.C
【详解】A、N2中含有同种非金属元素形成的非极性共价键,故A错误;
B、CH4中只有C、H元素之间形成的极性共价键,故B错误;
C、NaCl中钠离子与氯离子以离子键结合,故C正确;
D、HCl中只有H、Cl元素之间形成的极性共价键,故D错误;
故选:C。
5.C
【详解】氯水作漂白剂和杀菌剂主要是氯水中含有HClO的缘故,综上所述故选C。
6.D
【详解】A.Na2O 阴阳离子个数比为1:2,Na2O2中阴阳离子个数比为1:2,两者相等,A错误;
B.钾离子焰色在不透过蓝色钴玻璃观察时也是黄色的,B错误;
C.相同条件下,在水中溶解度:Na2CO3>NaHCO3,C错误;
D.可通过相互滴加的方式鉴别盐酸和Na2CO3 溶液,盐酸加入Na2CO3 溶液产生二氧化碳的时间大于Na2CO3 溶液加入盐酸中的时间,D正确;
答案选D。
7.B
【详解】A.Cu与稀硝酸反应生成NO,3Cu+2+8H+=3Cu2++2NO↑+4H2O,A错误;
B.Cl2与KI溶液反应:Cl2+2I =2Cl +I2,B正确;
C.Fe与FeCl3溶液反应,电荷不守恒,Fe++2Fe3+=3Fe2+,C错误;
D.Mg(OH)2与H2SO4溶液反应,Mg(OH)2难溶物不能拆,Mg(OH)2+2H+=Mg2++2H2O, D错误;
故答案为:B。
8.A
【详解】A.钠和氯气反应生成氯化钠,,钠和盐酸反应生成氯化钠和氢气,,A符合;
B.铁和氯气反应生成氯化铁,,铁和盐酸反应生成氯化亚铁和氢气,,B不符合;
C.铜和氯气反应生成氯化铜,,铜和盐酸不反应,C不符合;
D.铁和氯气反应生成氯化铁,,铁和盐酸反应生成氯化亚铁和氢气,,D不符合;
故本题选A。
9.B
【详解】A.操作①中,应称取12.5g胆矾晶体,并于烧杯中加水溶解,故A错误;
B.操作①中玻璃棒作用为搅拌,操作②中玻璃棒作用为引流,故B正确;
C.定容时俯视刻度线,导致溶液体积偏小,所配溶液浓度偏高,故C错误;
D.摇匀后静置,发现液面低于刻度线,属于正常现象,再加水则溶液的体积偏大,导致溶液浓度偏小,故D错误;
故答案选B。
10.C
【详解】A.NaHCO3是弱酸强碱盐,溶液呈弱碱性,可用于中和胃酸过多,故A正确;
B.Al2O3的离子键强,导致其熔点高,可用作耐火、耐高温材料,故B正确;
C.Na2O2能与二氧化碳、水反应生成氧气,可作潜艇中的供氧剂,与Na2O2为淡黄色固体无关,故C错误;
D.NaClO具有强氧化性,能杀灭细菌,所以NaClO可作杀菌、消毒剂,故D正确;
故选C。
11.A
【分析】该反应中Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,得电子化合价降低的反应物是氧化剂,所以氧化剂是KMnO4,盐酸是还原剂;
【详解】A.该反应中发生了还原反应,HCl发生了氧化反应,故A正确;
B.16molHCl只有10molHCl被氧化为5mol的氯气,体现了HCl的还原性,另外的6molHCl化合价没变,体现的是HCl的酸性,则氧化剂与还原剂的物质的量比为2:10=1:5,故B错误;
C.还原剂失去电子被氧化的产物为氧化产物,所以氧化产物为Cl2,氧化剂的氧化性大于氧化产物,则氧化性:KMnO4>Cl2,故C错误;
D.当标准状况下产生22.4L氯气,每生成1mol氯气转移电子数为2NA个,未指明标准状况就难以计算,故D错误;
故选A。
12.C
【详解】A.地壳中含量最多的非金属元素是氧,含量最多的金属元素是铝,A错误;
B.铝在常温下与空气中氧气反应,表面生成一层致密的氧化膜,B错误;
C.常温下可以用铁、铝制容器盛装冷的浓硫酸,是因为铁、铝遇冷的浓硫酸发生钝化,是因为浓硫酸的强氧化性,C正确;
D.氧化铝为两性氧化物,既能与强酸反应有能与强碱反应,D错误;
故选C。
13.B
【详解】A.铁粉和FeCl3发生反应:2FeCl3+Fe=3FeCl2,过滤除去过量铁粉,A正确;
B.溶液与足量反应生成NaHCO3,将主物质除去,不符合除杂原则,B错误;
C.CO与NaOH溶液不反应,CO2与NaOH溶液反应,生成碳酸钠和水,所以混有CO2的CO气体可通过NaOH溶液洗气后干燥,得到纯净干燥的CO2,C正确;
D.Fe2O3和氢氧化钠溶液不反应,Al2O3和氢氧化钠发生反应如下:Al2O3+2NaOH=2NaAlO2+H2O,生成可溶性钠盐,过滤将其除去,D正确;
答案为:B。
14.B
【详解】A.钠与水反应生成氢氧化钠,氢氧化钠与盐酸反应生成氯化钠,电解熔融的氯化钠生成金属钠,均可一步实现转化,选项A不符合题意;
B.铝与氢氧化钠溶液反应生成偏铝酸钠,偏铝酸铝溶液与适量强酸或二氧化碳作用生成氢氧化铝,不能直接转化为氧化铝,不能一步实现转化,选项B符合题意;
C.铁在氯气中燃烧生成氯化铁,氯化铁与铁反应生成氯化亚铁,氯化亚铁被锌置换生成铁,均可一步实现转化,故C不符合题意;
D.氯化铜与氢氧化钠反应生成氢氧化铜,氢氧化铜受热分解成氧化铜,氧化铜和盐酸反应生成氯化铜,均可一步实现转化,选项D不符合题意;
答案选B。
15.B
【详解】A.同主族元素自上而下金属性逐渐增强,金属性:,选项A错误;
B.Cl、S、P为同周期元素,根据元素周期律可知,非金属性:,故其单质与氢气化合由易到难的顺序:,选项B正确;
C.非金属性:,所以简单氢化物的稳定性:,选项C错误;
D.同主族自上而下金属性逐渐增强,最高价氧化物对应的水化物的碱性增强,所以碱性:,选项D错误;
答案选B。
16.D
【分析】Y的一种单质在空气中含量最高,Y为N;W、X、Z组成的一种化合物与蒸馏水按体积比3∶1混合后可用于杀灭新型冠状病毒,化合物为乙醇,则W、X、Z分别为H、C、O,因此W、X、Y、Z分别为H、C、N、O。
【详解】A.简单离子半径:,选项A错误;
B.非金属性越强简单气态氢化物的稳定性越强,则简单氢化物的稳定性:,选项B错误;
C.最高价氧化物对应水化物的酸性:,选项C错误;
D.H、N、O能形成共价化合物、离子化合物,选项D正确;
答案选D。
17.(1) ②⑥ ③④⑤
(2)
(3) HNO3=H++ Ba(OH)2=Ba2++2OH- Fe2(SO4)3=2Fe3++3 NaHSO4=Na++H++
(4)2Na2O2+2H2O=4Na++4OH-+O2↑
(5)取样于试管中,加硝酸酸化的硝酸银/先加硝酸酸化后加硝酸银,出现白色沉淀则证明溶液中含Cl-;先加硝酸银,出现白色沉淀,加硝酸,仍有白色沉淀存在,则证明溶液中含Cl-
(6) 白色沉淀迅速转变为灰绿色,最终生成红褐色沉淀 4Fe(OH)2+2H2O+O2=4Fe(OH)3
【解析】(1)
判断能导电的物质,要看物质在熔融状态下是否有自由移动的离子,在溶液状态下是否出现离子。固体物质导电是由于存在可自由移动的电子,如金属单质。0.1mol/LNa2CO3溶液中有自由移动的阴阳离子;石墨中存在自由移动的电子。③NaOH固体;④液态氯化氢;⑤冰醋酸都是化合物且其在水溶液中能电离出离子导电是电解质,故答案为:②⑥;③④⑤。
(2)
氯气与氢氧化钠反应发生歧化反应,生成氯化钠和次氯酸钠和水,由氯气到氯化钠,氯元素化合价由0价变为-1价,由氯气到次氯酸钠,氯元素化合价由0价变为+1价,电子转移方向和数目表示为:。
(3)
注意强电解质电离方程式的书写用“=”且强酸的酸式盐需把酸式酸根拆开。四种物质的电离方程式:HNO3=H++;Ba(OH)2=Ba2++2OH-;Fe2(SO4)3=2Fe3++3;NaHSO4=Na++H++。
(4)
过氧化钠和水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,注意过氧化钠不能拆。
(5)
取样于试管中,加硝酸酸化的硝酸银/先加硝酸酸化后加硝酸银,出现白色沉淀则证明溶液中含Cl-;先加硝酸银,出现白色沉淀,加硝酸,仍有白色沉淀存在,则证明溶液中含Cl-
(6)
氢氧化亚铁在空气中发生反应迅速转变为氢氧化铁
4Fe(OH)2+2H2O+O2=4Fe(OH)3,现象为白色沉淀迅速转变为灰绿色,最终生成红褐色沉淀。
18.(1) 第四周期ⅣA族
(2)
(3) HF KOH
(4)
【分析】根据元素在周期表中的位置,①是H元素;②是O元素;③是F元素;④是Na元素;⑤是Al元素;⑥是Cl元素;⑦是K元素;⑧是Se元素。
(1)
⑧是Se元素,在周期表中的位置是第四周期ⅣA族,最高价为+6,其最高价氧化物的水化物化学式为。
(2)
一般离子的电子层数越多,半径越大,若离子电子层数相同,质子数越多半径越小,元素④⑤⑥简单离子半径从小到大的顺序为Al3+ Na+ Cl-。
(3)
8种元素中,K的金属性最强,最高价氧化物对应水化物的碱性最强的是KOH;最高价氧化物对应水化物的酸性最强的是,F的非金属性最强,简单氢化物最稳定的是HF。
(4)
H和Na可以按原子个数比1:1形成离子化合物NaH,NaH的电子式子为。NaH是一种良好的储氢材料,遇水后生成氢气和氢氧化钠,反应的化学方程式。若NA表示阿伏伽德罗常数,则该反应每生成标况下的氢气11.2L即0.5molH2,转移电子数目为0.5NA。
19.(1) B
(2) 相同温度下比易溶于水或相同温度下的溶解度大于的 bd
(3) Ⅰ Ⅰ
【分析】本实验为探究和的性质,根据实验现象,得出相应的结论。
【详解】(1)碳酸钠较稳定,受热难分解,碳酸氢钠热稳定性差,受热易分解,生成CO2使澄清石灰水变浑浊,则物质B为碳酸氢钠;
(2)①固体完全溶解,而固体有剩余,说明在相同的温度下,的溶解度大于的;
②碳酸钠溶解过程为放热过程,温度升高;碳酸钠溶液的碱性较强,滴入酚酞后溶液呈红色;碳酸氢钠溶液的碱性较弱,滴入酚酞后溶液呈浅红色,故选bd;
(3)将气球内的固体同时倒入试管中发生反应:,;
①同等条件下,碳酸钠与盐酸反应的速率较碳酸氢钠与盐酸反应的速率慢,所以Ⅰ的反应程度更为剧烈;
②的相对分子质量为106,的相对分子质量为84,根据反应的化学方程式可知,生成等质量的二氧化碳需要消耗碳酸钠的质量更多,因此等质量的和与足量的稀盐酸反应,反应生成的二氧化碳多,所以Ⅰ的气球体积较大。
20.(1) KSCN 溶液变成红色
(2)Cu+2Fe3+=2Fe2++Cu2+
(3) 铁() 漏斗 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 蒸发浓缩、冷却结晶
【分析】腐蚀废液中含有氯化铁、氯化铜、氯化亚铁,加入过量的铁可以和氯化铁、氯化铜反应生成金属铜和氯化亚铁,经过滤所得滤液X是氯化亚铁,滤渣Y是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量盐酸可以将铜分离,得到氯化亚铁溶液,滤液合并后通入氯气,能将氯化亚铁氧化为氯化铁,以此解题。
【详解】(1)检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液与试管中,滴加KSCN溶液,溶液变红说明Fe3+存在,故答案为:KSCN溶液;溶液变成红色;
(2)三价铁可以和单质铜反应生成二价铁和铜离子,离子方程式为:Cu+2Fe3+=2Fe2++Cu2+;
(3)①腐蚀废液中含有氯化铁、氯化铜、氯化亚铁,加入过量的铁可以和氯化铁、氯化铜反应生成金属铜和氯化亚铁,所以试剂a是铁,操作I是过滤,用到的玻璃仪器有烧杯、玻璃棒和漏斗;
②滤液X、Z中都有氯化亚铁,氯化亚铁溶液中通入氯气,转化为氯化铁,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl 。
③操作III是氯化铁溶液蒸发浓缩、冷却结晶、过滤、洗涤得到氯化铁晶体。
同课章节目录
