广西省柳州市第三中学2022-2023学年高一下学期1月开学联摸底考试化学试卷(含答案)
文档属性
| 名称 | 广西省柳州市第三中学2022-2023学年高一下学期1月开学联摸底考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 370.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 08:44:31 | ||
图片预览


文档简介
柳州市第三中学2022-2023学年高一下学期1月开学联摸底考试
化学
(考试范围:人教版2019必修一 考试时间:75分钟 试卷满分:100分)
一、选择题:本题共16个小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列物质按混合物、纯净物、碱、盐分类排序正确的是
A.氢氧化钠、液氯、碱石灰、纯碱 B.碱石灰、液氯、氢氧化钠、纯碱
C.碱石灰、液氯、纯碱、氢氧化钠 D.液氯、氢氧化钠、纯碱、碱石灰
2.世界上有名的“鬼谷”马沃山谷,每当下雨电闪雷鸣时,山谷中就会传出战场厮杀的声音,甚至还有人影。但是天晴之后,山谷中就不会出现这种现象。经过相关人员研究发现是山谷中存在大量的磁铁矿导致了这种异常现象的产生,磁铁的主要成分是
A. B. C. D.
3.当光束通过下列分散系时,能观察到丁达尔效应的是
A.盐酸 B.NaOH溶液 C.Fe(OH)3胶体 D.硫酸铜溶液
4.下列有关和的说法错误的是
A.和原子中均含有6个质子
B.的原子结构示意图:
C.和互为同位素
D.和原子的核外电子排布相同
5.在pH=2的无色溶液中可以大量共存的是
A.K+、、、Cl- B.、Na+、HS-、S2-
C.Na+、Fe3+、Cl-、 D.K+、Mg2+、、
6.下列变化一定要加入还原剂才能实现的是
A.Cl2→Cl- B.MnO→Mn2+
C.H2S→SO2 D.Fe→Fe2+
7.下列关于某无色溶液中离子检验的说法正确的是
A.加入AgNO3溶液,生成白色沉淀,可确定有氯离子的存在
B.加入足量的盐酸,产生无色气体,可确定含有CO
C.用足量稀盐酸,无明显现象,再加氯化钡溶液,生成白色沉淀,可确定为SO
D.用洁净的铂丝蘸取溶液,在火焰上灼烧,焰色为黄色,可确定含有Na+,不含K+
8.下列化合物中,既含离子键又含非极性共价键的是
A. B. C. D.
9.NA代表阿伏加德罗常数的值,下列说法正确的是
A.2.3 g钠原子变成钠离子时,失去的电子数为0.1NA
B.常温常压下,11.2 L氯气气体含有的氯气分子数为0.5NA
C.1 L0.5 mol·L 1Na2SO4溶液中,含有的离子数为NA
D.NA个氧分子与NA个氢分子的质量比为8:1
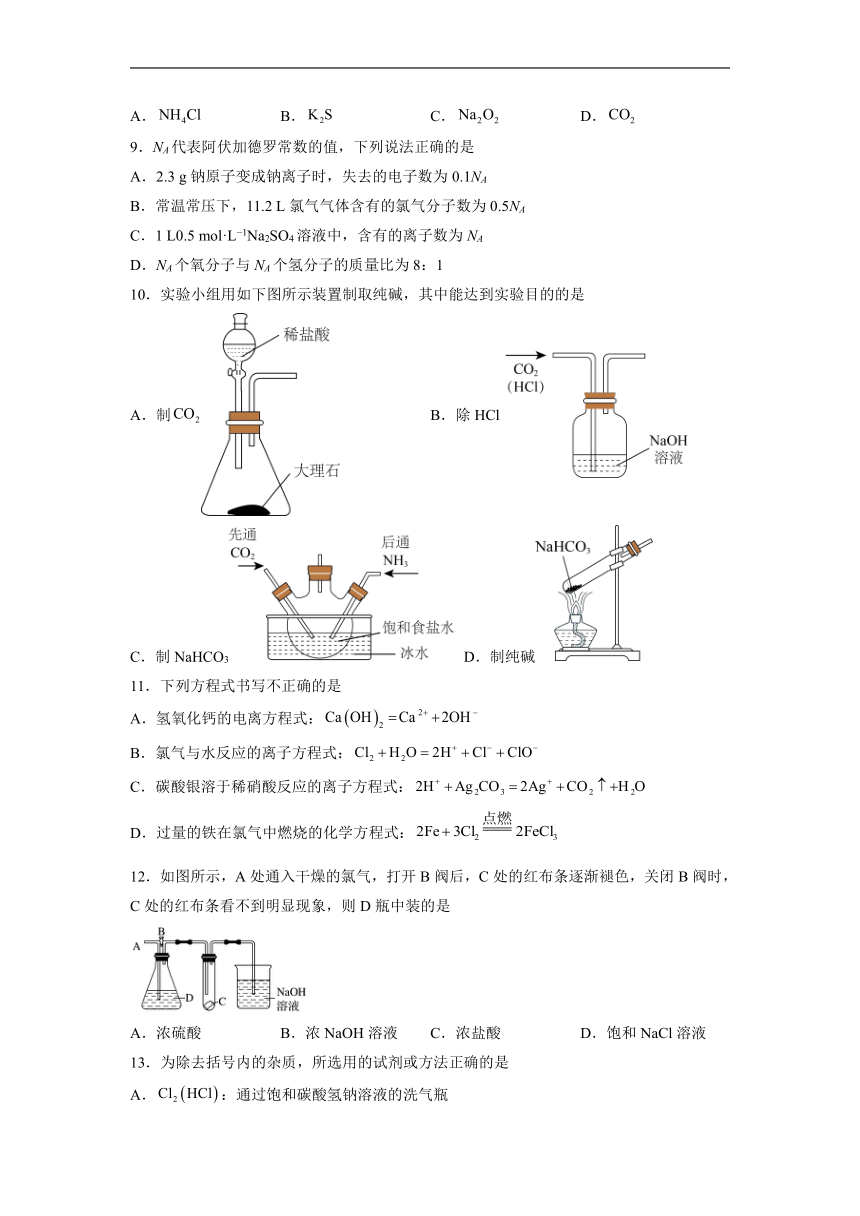
10.实验小组用如下图所示装置制取纯碱,其中能达到实验目的的是
A.制 B.除HCl
C.制NaHCO3 D.制纯碱
11.下列方程式书写不正确的是
A.氢氧化钙的电离方程式:
B.氯气与水反应的离子方程式:
C.碳酸银溶于稀硝酸反应的离子方程式:
D.过量的铁在氯气中燃烧的化学方程式:
12.如图所示,A处通入干燥的氯气,打开B阀后,C处的红布条逐渐褪色,关闭B阀时,C处的红布条看不到明显现象,则D瓶中装的是
A.浓硫酸 B.浓NaOH溶液 C.浓盐酸 D.饱和NaCl溶液
13.为除去括号内的杂质,所选用的试剂或方法正确的是
A.:通过饱和碳酸氢钠溶液的洗气瓶
B.:通入足量的氯气
C.:用点燃的方法除去
D.溶液:加入过量溶液
14.足量的铝粉投入到100mLNaOH溶液中,充分反应后放出标准状况下H26.72L,则NaOH溶液的物质的量浓度为
A.1mol/L B.2mol/L C.3mol/L D.1.5mol/L
15.已知 5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是
A.KClO3 是氧化剂
B.被氧化与被还原的氯元素的质量比为 5∶1
C.H2SO4 既不是氧化剂又不是还原剂
D.Cl2 既不是氧化产物又不是还原产物
16.2023年是门捷列夫发现元素周期表154周年。图中是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8,下列说法错误的是
W
X Y Z
A.Y的氧化物的分子式为
B.Z的某种氧化物能用来作干燥剂
C.W的最简单氢化物能与其最高价氧化物的水化物发生化合反应
D.X的单质既能与盐酸反应也能与氢氧化钠溶液反应
二、非选择题:包括第17题~第20题4个大题,共52分。
17.(13分)Ⅰ.掌握电解质和非电解质的概念,能熟练判断一种物质是否是电解质,是认识电解质的性质的前提:以下有①~⑩种物质:①石墨②液氯③氨水④⑤⑥⑦红褐色的氢氧化铁胶体⑧稀硫酸⑨熔融⑩蔗糖 银
(1)上述物质导电的是_______;(填序号,多写不给分,下同),属于非电解质的是_______。
(2)下列制备⑦的操作方法正确的是_______。(填字母)
A.向饱和氯化铁溶液中滴加适量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至出现红褐色液体
(3)向盛有⑦的烧杯中还滴加入盐酸至过量,会出现一系列变化,现象为:_______。
(4)写出⑥溶液中加入⑨溶液至溶液呈中性的离子反应方程式_______。
Ⅱ.请配平以下化学方程式:(未配平)
(5)配平上述方程式________
(6)若反应过程中转移,则生成标准状况下的体积为_______。
18.(13分)下表列出了七种短周期元素在周期表中的位置:
(1)单质的结构式为_______。
(2)化合物的电子式为_______,该化合物与水反应的化学方程式为_______。
(3)元素c在周期表中的位置是_______,c的两种同素异形体的化学式为_______。
(4)元素d、e、f、g形成的简单离子中,离子半径最小的是_______(填离子符号)。
(5)单质通入d元素最高价氧化物的水化物中可制备“84消毒液”,该反应的离子方程式为_______。
(6)下列事实不能说明g的非金属性比f的非金属性强的是_______。
A.将g的单质通入f的气态氢化物形成的溶液中,有淡黄色沉淀产生
B.气态氢化物稳定性:
C.f单质与化合时产物中为价,g单质与化合时产物中为价
D.氧化物对应水化物的酸性:
19.(12分)电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。为改善环境,废物利用,可从腐蚀废液(主要含FeCl3、FeCl2、CuCl2)中回收铜并使腐蚀液再生。处理流程如下图:
(1)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______。
(2)废液中加入过量金属A时发生置换反应的离子反应方程式为:_______。
(3)检验废液中是否含有Fe3+所需要试剂名称为_______;
试剂F宜选用下列试剂中的_______(填选项序号),
A.酸性KMnO4溶液 B.氯水 C.溴水 D.稀硝酸
若将上面所选试剂F换成H2O2,也能达到同样目的。请写出试剂F为H2O2时反应的离子方程式:_______。
(4)若要检验Fe2(SO4)3溶液中是否含有FeSO4,可选用的最佳试剂为______(填选项序号)
A.氢氧化钠溶液 B.氯水 C.酸性KMnO4溶液 D.稀硝酸
(5)若向滤液B中加入氢氧化钠溶液并在空气中放置一段时间,沉淀转化的化学方程式为:_______。
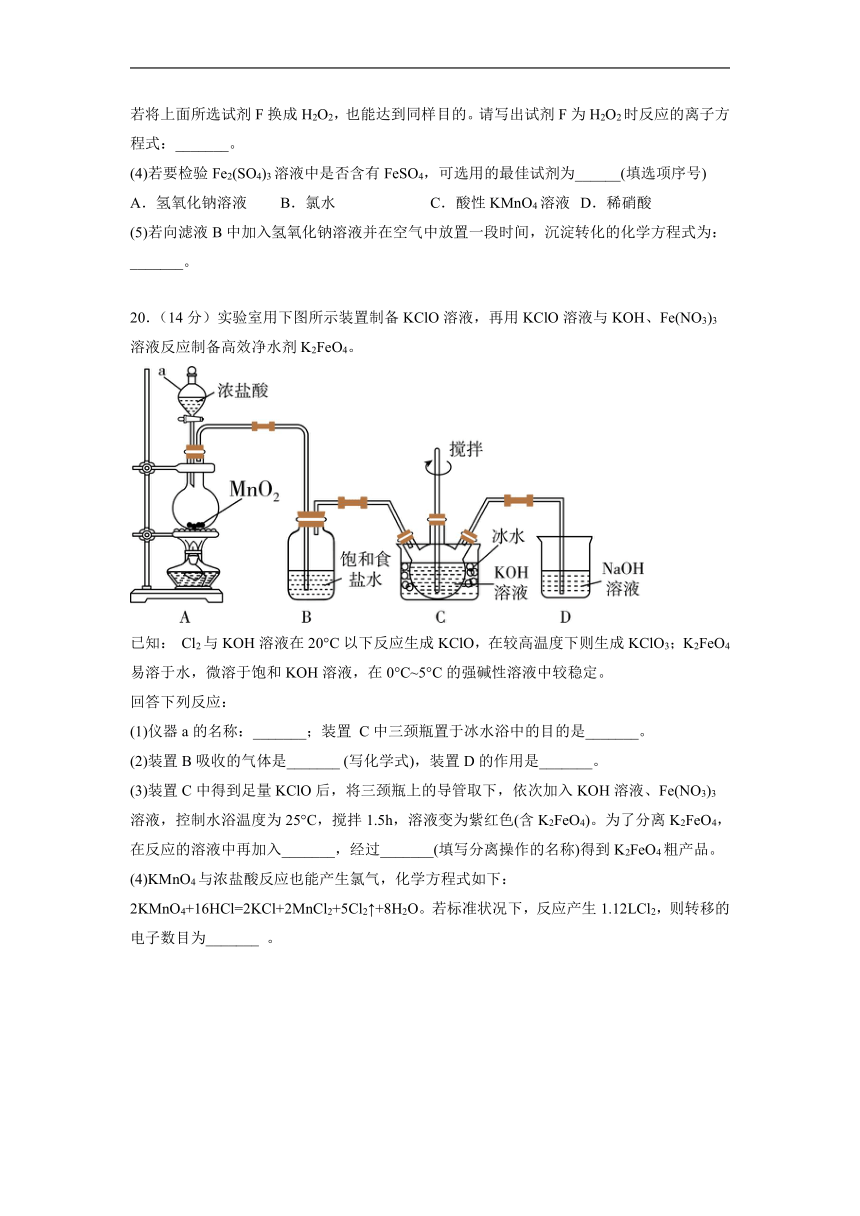
20.(14分)实验室用下图所示装置制备KClO溶液,再用KClO溶液与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
已知: Cl2与KOH溶液在20°C以下反应生成KClO,在较高温度下则生成KClO3;K2FeO4易溶于水,微溶于饱和KOH溶液,在0°C~5°C的强碱性溶液中较稳定。
回答下列反应:
(1)仪器a的名称:_______;装置 C中三颈瓶置于冰水浴中的目的是_______。
(2)装置B吸收的气体是_______ (写化学式),装置D的作用是_______。
(3)装置C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,控制水浴温度为25°C,搅拌1.5h,溶液变为紫红色(含K2FeO4)。为了分离K2FeO4,在反应的溶液中再加入_______,经过_______(填写分离操作的名称)得到K2FeO4粗产品。
(4)KMnO4与浓盐酸反应也能产生氯气,化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。若标准状况下,反应产生1.12LCl2,则转移的电子数目为_______ 。
参考答案:
1.B
【详解】A.碱石灰含CaO、NaOH、KOH等物质,属于混合物,A错误;
B.碱石灰属于混合物;液氯是液态单质氯,属于纯净物;氢氧化钠属于碱;纯碱为碳酸钠,属于盐,B正确;
C.纯碱为,属于盐类,C错误;
D.碱石灰属于混合物,D错误;
故选B。
2.C
【详解】磁铁的主要成分是四氧化三铁,化学式为;
答案选C。
3.C
【详解】A.盐酸是氯化氢的水溶液,分散质粒子直径小于1nm,不能产生丁达尔效应,A不符合题意;
B.NaOH溶液中,分散质粒子直径小于1nm,不能产生丁达尔效应,B不符合题意;
C.Fe(OH)3胶体中,分散质粒子直径介于1nm~100nm之间,能产生丁达尔效应,C符合题意;
D.硫酸铜溶液中,分散质粒子直径小于1nm,对光不能产生散射作用,不能产生丁达尔效应,D不符合题意;
故选C。
4.B
【详解】A.和互为同位素,原子中均含有6个质子,选项A正确;
B.质子数为6,原子结构示意图为 ,选项B错误;
C.和质子数相同、中子数不同,碳元素形成的不同核素,互为同位素,选项C正确;
D.和原子的核外电子排布相同,均为两个电子层,各层电子数分别为2、4,选项D正确;
答案选B。
5.A
【详解】在pH=2的无色溶液中含有大量的H+,据此分析解题:
A. K+、、、Cl-、H+相互之间不反应,能够大量共存,A符合题意;
B. H+与HS-、S2-均能反应生成H2S,B不合题意;
C. 无色溶液中不可能含大量的Fe3+,且Fe3+与之间能够发生氧化还原反应而不能大量共存,C不合题意;
D. 无色溶液中不可能含大量的,D不合题意;
故答案为:A。
6.B
【详解】A.氯元素的化合价降低,但不一定要加入还原剂,可加入H2O(既不是氧化剂,也不是还原剂)实现该转化,A不符合题意;
B.锰元素的化合价降低,需要加入还原剂实现该转化,B符合题意;
C.硫元素的化合价升高,需要加入氧化剂实现该转化,C不符合题意;
D.铁元素的化合价升高,需要加入氧化剂实现该转化,D不符合题意;
故选B。
7.C
【详解】A.加入AgNO3溶液,生成白色沉淀,也可能有碳酸根存在,碳酸银也是白色沉淀,A错误;
B.加入足量的盐酸,产生无色气体,也可能含有HCO,B错误;
C.用足量稀盐酸,无明显现象,可排除碳酸根影响,再加氯化钡溶液,生成白色沉淀,可确定为SO,C正确;
D.用洁净的铂丝蘸取溶液,在火焰上灼烧,焰色为黄色,可确定含有Na+,K+的焰色需要透过蓝色钴玻璃观察,D错误;
答案选C。
8.C
【详解】A.NH4Cl是铵盐,含有离子键和极性键,A错误;
B .K2S只含有离子键,B错误;
C .Na2O2是离子化合物,既含离子键又含非极性共价键(氧原子与氧原子之间),C正确;
D .CO2是共价化合物,只有极性键,D错误,
答案选C。
9.A
【详解】A.Na是+1价的金属,2.3 g钠的物质的量是0.1 mol,该原子变成钠离子时,失去的电子数为0.1NA,A正确;
B.常温常压下,11.2 L氯气的物质的量小于0.5 mol,则该气体含有的氯气分子数小于0.5NA,B错误;
C.1个Na2SO4在溶液中电离产生2个Na+和1个,1 L0.5 mol·L 1Na2SO4溶液中含有溶质的物质的量是0.5 mol,则该溶液中含有的离子数为1.5NA,C错误;
D.NA个氧分子与NA个氢分子的物质的量都是1 mol,二者的质量比为32 g:2 g=16:1,D错误;
故合理选项是A。
10.A
【详解】A.实验室常用大理石和稀盐酸制备CO2,可以达到实验装置,A正确;
B.NaOH均可吸收HCl、CO2,不能利用NaOH溶液吸收CO2中的HCl气体,应该用饱和NaHCO3溶液,B错误;
C.应先使氨气通入饱和食盐水中而成氨盐水,因氨气在溶液中的溶解度更大,再通入CO2,得到NaHCO3固体,C错误;
D.加热固体,试管口应稍向下倾斜,防止在试管口凝成的水珠流回试管底部致使试管骤冷而炸裂,D错误;
答案选A。
11.B
【详解】A.氢氧化钙属于强电解质,完全电离成Ca2+和OH-,A正确;
B.氯气与水反应生成盐酸和次氯酸,HCl属于强酸,HClO属于弱酸:,B错误;
C.碳酸银与稀硝酸反应生成硝酸银、水和二氧化碳,碳酸银难溶于水,应以化学式保留,C正确;
D.无论铁是否过量,铁在氯气中燃烧生成氯化铁,D正确;
答案选B。
12.B
【分析】A处通入干燥的Cl2,打开B阀后,C处的红布条逐渐褪色,说明C处布条是湿润的;关闭B阀时,C处的红布条看不到明显现象,说明洗气瓶D中装的物质能完全吸收氯气。
【详解】A.浓硫酸与氯气不反应,不能吸收氯气,故A不选;
B.氢氧化钠溶液能吸收氯气,故B选;
C.浓盐酸不与氯气反应,不能吸收氯气,故C不选;
D.饱和食盐水不能吸收氯气,故D不选;
故答案选B。
13.B
【详解】A.Cl2(HCl):通过饱和食盐水溶液的洗气瓶,若通过饱和碳酸氢钠溶液,盐酸被吸收会释放出二氧化碳,且氯气也会和碳酸氢钠反应,故A错误;
B.FeCl3(FeCl2):通入足量的氯气会将FeCl2氧化为FeCl3,故B正确;
C.用点燃的方法需要通入空气,又引入新的杂质,而且容易燃烧不完全,故C错误;
D.加入过量Ba(OH)2溶液,过量的那部分Ba(OH)2是新的杂质,故D错误;
故选B。
14.B
【详解】铝与NaOH溶液反应,,,则n(NaOH)=0.2mol,;
故答案为:B。
15.D
【分析】由方程式可知,反应中氯酸钾中氯元素的化合价降低被还原,是反应的氧化剂,氯化钾中氯元素的化合价升高被氧化,是反应的还原剂,则氯气既是氧化产物又是还原产物。
【详解】A.由分析可知,氯酸钾是反应的氧化剂,故A正确;
B.由分析可知,反应中氯酸钾中氯元素的化合价降低被还原,氯化钾中氯元素的化合价升高被氧化,则被氧化与被还原的氯元素的质量比为 5:1,故B正确;
C.由方程式可知,反应中硫酸分子中没有元素发生化合价变化,既不是氧化剂又不是还原剂,故C正确;
D.由分析可知,氯气既是氧化产物又是还原产物,故D错误;
故选D。
16.A
【分析】W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8,设X的最高价为a,W的最高价为a+2,a+2+a=8,a=3,所以W是N元素、X是Al元素、Y是Si元素、Z是P元素。
【详解】A.二氧化硅是由原子构成的,没有分子式,是二氧化硅的化学式,A错误;
B.五氧化二磷能用来作干燥剂,B正确;
C.N的最简单氢化物为氨气,N的最高价氧化物的水化物为硝酸,二者能发生化合反应生成硝酸铵,C正确;
D.Al的单质既能与盐酸反应也能与氢氧化钠溶液反应,D正确;
故选A。
17.(1) ①③⑦⑧⑨ ④⑩
(2)D
(3)先产生红褐色沉淀,后沉淀溶解,溶液变为黄色
(4)
(5)
(6)11.2
【分析】石墨、银含有自由移动的电子能导电,氨水、氢氧化铁胶体、稀硫酸和熔融含有自由移动的离子能导电。电解质是指在水溶液中或者熔融状态下能导电的化合物,其中酸、碱、盐、金属氧化物均属于电解质。石墨、液氯、银属于单质,既不是电解质也不是非电解质;氨水、氢氧化铁胶体、稀硫酸是混合物;、蔗糖自身不能电离属于非电解质;、、熔融属于电解质。
【详解】(1)根据分析,石墨、银含有自由移动的电子能导电,氨水、氢氧化铁胶体、稀硫酸和熔融含有自由移动的离子能导电,则能导电的物质是①③⑦⑧⑨ ;、蔗糖自身不能电离属于非电解质,即属于非电解质的是④⑩;
(2)A.滴加适量的氢氧化钠稀溶液,生成的是氢氧化铁沉淀,而不是胶体,A不符合题意;
B.氯化铁在溶液中水解生成氢氧化铁,加热促进水解,煮沸会出现红褐色沉淀,得到的是氢氧化铁沉淀,B不符合题意;
C.在氨水中滴加氯化铁浓溶液,生成的是氢氧化铁沉淀,而不是胶体,C不符合题意;
D.往沸水中滴加几滴饱和氯化铁溶液,煮沸至出现红褐色液体停止加热,可得到氢氧化铁胶体,D符合题意;
故选D。
(3)向氢氧化铁胶体中加入电解质HCl会使胶体先发生聚沉,之后Fe(OH)3与HCl发生酸碱中和反应,沉淀溶解,溶液呈黄色,则向盛有红褐色的氢氧化铁胶体的烧杯中还滴加入盐酸至过量的现象为:先产生红褐色沉淀,后沉淀溶解,溶液变为黄色;
(4)向溶液中加入,至溶液呈中性,则和按1:2反应,反应的离子方程式为;
(5)该反应中Al元素化合价由0价升高到NaAlO2中的+3价,N元素由NaNO3中+5价降低到N2中0价,根据得失电子守恒、原子守恒,可配平该化学方程式为;
(6)由第(5)问分析知,该反应化学方程式为,则反应过程中转移,生成,其标准状况下的体积为11.2L。
18.(1)NN
(2)
(3) O2和O3 O3
(4)Al3+
(5)Cl2+2OH-=Cl-+ClO-+H2O
(6)D
【分析】根据元素在周期表中的位置可知,元素a为H,b为N,c为O,d为Na,e为Al,为f为S,g为Cl,以此解题。
【详解】(1)由分析可知,b为N,则氮气的结构式为:NN;
(2)由分析可知,c为O,d为Na,则为,其电子式为:;过氧化钠与水反应的化学方程式为:;
(3)由分析可知,c为O,其在周期表中的位置是第2周期ⅥA族;氧元素的两种同素异形体分别为氧气和臭氧,其化学式分别为:O2和O3;
(4)由分析可知,d为Na,e为Al,为f为S,g为Cl,在这些元素前两种元素形成的简单离子的电子层数较少,半径较小,且当核外电子排布相同时,原子序数越大,半径越小,故离子半径最小的是Al3+;
(5)由分析可知,d为Na,g为Cl,则氯气和氢氧化钠反应制备“84消毒液”的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
(6)由分析可知,f为S,g为Cl,以此解题;
A.可以通过置换反应证明非金属性强弱,非金属性强的元素可以置换出非金属性弱的元素,A正确;
B.非金属性越强,氢化物越稳定,反之,氢化物越稳定,非金属性越强,B正确;
C.和同种还原剂反应时,非金属性强的元素,对应的氧化产物中的元素化合价越高,C正确;
D.应该通过最高价氧化物对应水化物的酸性强弱来证明,D错误;
故选D。
19.(1)2Fe3++Cu=2Fe2++Cu2+
(2)Fe+Cu2+=Fe2++Cu
(3) 硫氰酸钾 B 2Fe2++H2O2+2H+=2Fe3++2H2O
(4)C
(5)4Fe(OH)2+O2+2H2O=4Fe(OH)3
【分析】腐蚀废液(主要含FeCl3、FeCl2、CuCl2)加入足量的铁粉,铁粉先和铁离子反应生成亚铁离子,再和铜离子反应生成铜单质和亚铁离子,过滤,得到沉淀C为铜和未反应的铁,向C中加入过量稀盐酸,生成氯化亚铁和氢气,铜不与稀盐酸反应,过滤,滤液合并后通入足量氯气,将氯化亚铁氧化生成氯化铁,据此作答。
【详解】(1)FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板的反应原理是强氧化性的Fe3+与Cu反应,生成Fe2+和Cu2+,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;
(2)根据分析可知,过量金属A是Fe,铁粉先和铁离子反应生成亚铁离子,再和铜离子反应生成铜单质和亚铁离子,其中发生置换的方程式为:Fe+Cu2+=Fe2++Cu;
(3)铁离子常用KSCN溶液检验,溶液变为红色,因此检验废液中是否含有Fe3+所需要的试剂为硫氰化钾;根据分析,试剂F的作用是将Fe2+氧化为Fe3+,又不引入新的杂质:
A.引入Mn元素和K元素,A不选;
B.不会引入杂质,B选;
C.引入Br元素,C不选;
D.引入N元素,D不选;
故选B;
H2O2能将Fe2+氧化为Fe3+,离子方程式:2H++H2O2+2Fe2+=2Fe3++2H2O;
(4)若要检验Fe2(SO4)3溶液中是否含有FeSO4,可选用的最佳试剂应该满足能与Fe2+反应,且有明显现象变化:
A.加入氢氧化钠溶液,两者均会产生沉淀,无法检验,A不选;
B.氯水会与Fe2+反应,不与Fe3+反应,但是现象变化不明显,无法检验,B不选;
C.酸性KMnO4溶液会与Fe2+反应,不与Fe3+反应,从而使酸性KMnO4溶液褪色,现象变化明显,C选;
D.稀硝酸会与Fe2+反应,不与Fe3+反应,但是现象变化不明显,无法检验,D不选;
故选C;
(5)根据分析,滤液B为FeCl2溶液,向滤液B中加入氢氧化钠溶液并在空气中放置一段时间,会生成Fe(OH)3沉淀,沉淀转化的化学方程式为: 4Fe(OH)2+O2+2H2O=4Fe(OH)3。
20.(1) 分液漏斗 防止Cl2与KOH反应生成KClO3
(2) HCl 吸收多余的Cl2,防止污染空气
(3) 饱和KOH溶液 过滤
(4)6.02×1022
【分析】A中浓盐酸和二氧化锰在加热条件下反应生成Cl2,浓盐酸易挥发,所以生成的氯气中含有HCl,饱和食盐水除去氯气中的HCl,氯气和KOH在冷水中反应生成KClO,氯气有毒,不能直接排入空气中,用NaOH溶液吸收尾气,据此解答。
【详解】(1)仪器a的名称为分液漏斗,由于Cl2与KOH溶液在20°C以下反应生成KClO,在较高温度下则生成KClO3,所以装置C中三颈烧瓶置于冰水浴中的目的是防止Cl2与KOH反应生成KClO3,故答案为:分液漏斗;防止Cl2与KOH反应生成KClO3;
(2)装置B吸收的气体是HCl,装置D的作用是吸收多余的Cl2,防止污染空气,故答案为:HCl;吸收多余的Cl2,防止污染空气;
(3)K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定,为了分离出K2FeO4,在反应的溶液中再加入饱和KOH溶液,经过过滤得到K2FeO4粗产品,故答案为:加入饱和KOH溶液;过滤。
(4)根据2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O可知Mn元素化合价从+7价降低到+2价,得到5个电子,因此生成5mol氯气转移10mol电子,若标准状况下,反应产生1.12LCl2,物质的量是1.12L÷22.4L/mol=0.05mol,则转移的电子数目为0.1mol×6.02×1023/mol=6.02×1022。
化学
(考试范围:人教版2019必修一 考试时间:75分钟 试卷满分:100分)
一、选择题:本题共16个小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列物质按混合物、纯净物、碱、盐分类排序正确的是
A.氢氧化钠、液氯、碱石灰、纯碱 B.碱石灰、液氯、氢氧化钠、纯碱
C.碱石灰、液氯、纯碱、氢氧化钠 D.液氯、氢氧化钠、纯碱、碱石灰
2.世界上有名的“鬼谷”马沃山谷,每当下雨电闪雷鸣时,山谷中就会传出战场厮杀的声音,甚至还有人影。但是天晴之后,山谷中就不会出现这种现象。经过相关人员研究发现是山谷中存在大量的磁铁矿导致了这种异常现象的产生,磁铁的主要成分是
A. B. C. D.
3.当光束通过下列分散系时,能观察到丁达尔效应的是
A.盐酸 B.NaOH溶液 C.Fe(OH)3胶体 D.硫酸铜溶液
4.下列有关和的说法错误的是
A.和原子中均含有6个质子
B.的原子结构示意图:
C.和互为同位素
D.和原子的核外电子排布相同
5.在pH=2的无色溶液中可以大量共存的是
A.K+、、、Cl- B.、Na+、HS-、S2-
C.Na+、Fe3+、Cl-、 D.K+、Mg2+、、
6.下列变化一定要加入还原剂才能实现的是
A.Cl2→Cl- B.MnO→Mn2+
C.H2S→SO2 D.Fe→Fe2+
7.下列关于某无色溶液中离子检验的说法正确的是
A.加入AgNO3溶液,生成白色沉淀,可确定有氯离子的存在
B.加入足量的盐酸,产生无色气体,可确定含有CO
C.用足量稀盐酸,无明显现象,再加氯化钡溶液,生成白色沉淀,可确定为SO
D.用洁净的铂丝蘸取溶液,在火焰上灼烧,焰色为黄色,可确定含有Na+,不含K+
8.下列化合物中,既含离子键又含非极性共价键的是
A. B. C. D.
9.NA代表阿伏加德罗常数的值,下列说法正确的是
A.2.3 g钠原子变成钠离子时,失去的电子数为0.1NA
B.常温常压下,11.2 L氯气气体含有的氯气分子数为0.5NA
C.1 L0.5 mol·L 1Na2SO4溶液中,含有的离子数为NA
D.NA个氧分子与NA个氢分子的质量比为8:1
10.实验小组用如下图所示装置制取纯碱,其中能达到实验目的的是
A.制 B.除HCl
C.制NaHCO3 D.制纯碱
11.下列方程式书写不正确的是
A.氢氧化钙的电离方程式:
B.氯气与水反应的离子方程式:
C.碳酸银溶于稀硝酸反应的离子方程式:
D.过量的铁在氯气中燃烧的化学方程式:
12.如图所示,A处通入干燥的氯气,打开B阀后,C处的红布条逐渐褪色,关闭B阀时,C处的红布条看不到明显现象,则D瓶中装的是
A.浓硫酸 B.浓NaOH溶液 C.浓盐酸 D.饱和NaCl溶液
13.为除去括号内的杂质,所选用的试剂或方法正确的是
A.:通过饱和碳酸氢钠溶液的洗气瓶
B.:通入足量的氯气
C.:用点燃的方法除去
D.溶液:加入过量溶液
14.足量的铝粉投入到100mLNaOH溶液中,充分反应后放出标准状况下H26.72L,则NaOH溶液的物质的量浓度为
A.1mol/L B.2mol/L C.3mol/L D.1.5mol/L
15.已知 5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是
A.KClO3 是氧化剂
B.被氧化与被还原的氯元素的质量比为 5∶1
C.H2SO4 既不是氧化剂又不是还原剂
D.Cl2 既不是氧化产物又不是还原产物
16.2023年是门捷列夫发现元素周期表154周年。图中是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8,下列说法错误的是
W
X Y Z
A.Y的氧化物的分子式为
B.Z的某种氧化物能用来作干燥剂
C.W的最简单氢化物能与其最高价氧化物的水化物发生化合反应
D.X的单质既能与盐酸反应也能与氢氧化钠溶液反应
二、非选择题:包括第17题~第20题4个大题,共52分。
17.(13分)Ⅰ.掌握电解质和非电解质的概念,能熟练判断一种物质是否是电解质,是认识电解质的性质的前提:以下有①~⑩种物质:①石墨②液氯③氨水④⑤⑥⑦红褐色的氢氧化铁胶体⑧稀硫酸⑨熔融⑩蔗糖 银
(1)上述物质导电的是_______;(填序号,多写不给分,下同),属于非电解质的是_______。
(2)下列制备⑦的操作方法正确的是_______。(填字母)
A.向饱和氯化铁溶液中滴加适量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至出现红褐色液体
(3)向盛有⑦的烧杯中还滴加入盐酸至过量,会出现一系列变化,现象为:_______。
(4)写出⑥溶液中加入⑨溶液至溶液呈中性的离子反应方程式_______。
Ⅱ.请配平以下化学方程式:(未配平)
(5)配平上述方程式________
(6)若反应过程中转移,则生成标准状况下的体积为_______。
18.(13分)下表列出了七种短周期元素在周期表中的位置:
(1)单质的结构式为_______。
(2)化合物的电子式为_______,该化合物与水反应的化学方程式为_______。
(3)元素c在周期表中的位置是_______,c的两种同素异形体的化学式为_______。
(4)元素d、e、f、g形成的简单离子中,离子半径最小的是_______(填离子符号)。
(5)单质通入d元素最高价氧化物的水化物中可制备“84消毒液”,该反应的离子方程式为_______。
(6)下列事实不能说明g的非金属性比f的非金属性强的是_______。
A.将g的单质通入f的气态氢化物形成的溶液中,有淡黄色沉淀产生
B.气态氢化物稳定性:
C.f单质与化合时产物中为价,g单质与化合时产物中为价
D.氧化物对应水化物的酸性:
19.(12分)电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。为改善环境,废物利用,可从腐蚀废液(主要含FeCl3、FeCl2、CuCl2)中回收铜并使腐蚀液再生。处理流程如下图:
(1)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______。
(2)废液中加入过量金属A时发生置换反应的离子反应方程式为:_______。
(3)检验废液中是否含有Fe3+所需要试剂名称为_______;
试剂F宜选用下列试剂中的_______(填选项序号),
A.酸性KMnO4溶液 B.氯水 C.溴水 D.稀硝酸
若将上面所选试剂F换成H2O2,也能达到同样目的。请写出试剂F为H2O2时反应的离子方程式:_______。
(4)若要检验Fe2(SO4)3溶液中是否含有FeSO4,可选用的最佳试剂为______(填选项序号)
A.氢氧化钠溶液 B.氯水 C.酸性KMnO4溶液 D.稀硝酸
(5)若向滤液B中加入氢氧化钠溶液并在空气中放置一段时间,沉淀转化的化学方程式为:_______。
20.(14分)实验室用下图所示装置制备KClO溶液,再用KClO溶液与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
已知: Cl2与KOH溶液在20°C以下反应生成KClO,在较高温度下则生成KClO3;K2FeO4易溶于水,微溶于饱和KOH溶液,在0°C~5°C的强碱性溶液中较稳定。
回答下列反应:
(1)仪器a的名称:_______;装置 C中三颈瓶置于冰水浴中的目的是_______。
(2)装置B吸收的气体是_______ (写化学式),装置D的作用是_______。
(3)装置C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,控制水浴温度为25°C,搅拌1.5h,溶液变为紫红色(含K2FeO4)。为了分离K2FeO4,在反应的溶液中再加入_______,经过_______(填写分离操作的名称)得到K2FeO4粗产品。
(4)KMnO4与浓盐酸反应也能产生氯气,化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。若标准状况下,反应产生1.12LCl2,则转移的电子数目为_______ 。
参考答案:
1.B
【详解】A.碱石灰含CaO、NaOH、KOH等物质,属于混合物,A错误;
B.碱石灰属于混合物;液氯是液态单质氯,属于纯净物;氢氧化钠属于碱;纯碱为碳酸钠,属于盐,B正确;
C.纯碱为,属于盐类,C错误;
D.碱石灰属于混合物,D错误;
故选B。
2.C
【详解】磁铁的主要成分是四氧化三铁,化学式为;
答案选C。
3.C
【详解】A.盐酸是氯化氢的水溶液,分散质粒子直径小于1nm,不能产生丁达尔效应,A不符合题意;
B.NaOH溶液中,分散质粒子直径小于1nm,不能产生丁达尔效应,B不符合题意;
C.Fe(OH)3胶体中,分散质粒子直径介于1nm~100nm之间,能产生丁达尔效应,C符合题意;
D.硫酸铜溶液中,分散质粒子直径小于1nm,对光不能产生散射作用,不能产生丁达尔效应,D不符合题意;
故选C。
4.B
【详解】A.和互为同位素,原子中均含有6个质子,选项A正确;
B.质子数为6,原子结构示意图为 ,选项B错误;
C.和质子数相同、中子数不同,碳元素形成的不同核素,互为同位素,选项C正确;
D.和原子的核外电子排布相同,均为两个电子层,各层电子数分别为2、4,选项D正确;
答案选B。
5.A
【详解】在pH=2的无色溶液中含有大量的H+,据此分析解题:
A. K+、、、Cl-、H+相互之间不反应,能够大量共存,A符合题意;
B. H+与HS-、S2-均能反应生成H2S,B不合题意;
C. 无色溶液中不可能含大量的Fe3+,且Fe3+与之间能够发生氧化还原反应而不能大量共存,C不合题意;
D. 无色溶液中不可能含大量的,D不合题意;
故答案为:A。
6.B
【详解】A.氯元素的化合价降低,但不一定要加入还原剂,可加入H2O(既不是氧化剂,也不是还原剂)实现该转化,A不符合题意;
B.锰元素的化合价降低,需要加入还原剂实现该转化,B符合题意;
C.硫元素的化合价升高,需要加入氧化剂实现该转化,C不符合题意;
D.铁元素的化合价升高,需要加入氧化剂实现该转化,D不符合题意;
故选B。
7.C
【详解】A.加入AgNO3溶液,生成白色沉淀,也可能有碳酸根存在,碳酸银也是白色沉淀,A错误;
B.加入足量的盐酸,产生无色气体,也可能含有HCO,B错误;
C.用足量稀盐酸,无明显现象,可排除碳酸根影响,再加氯化钡溶液,生成白色沉淀,可确定为SO,C正确;
D.用洁净的铂丝蘸取溶液,在火焰上灼烧,焰色为黄色,可确定含有Na+,K+的焰色需要透过蓝色钴玻璃观察,D错误;
答案选C。
8.C
【详解】A.NH4Cl是铵盐,含有离子键和极性键,A错误;
B .K2S只含有离子键,B错误;
C .Na2O2是离子化合物,既含离子键又含非极性共价键(氧原子与氧原子之间),C正确;
D .CO2是共价化合物,只有极性键,D错误,
答案选C。
9.A
【详解】A.Na是+1价的金属,2.3 g钠的物质的量是0.1 mol,该原子变成钠离子时,失去的电子数为0.1NA,A正确;
B.常温常压下,11.2 L氯气的物质的量小于0.5 mol,则该气体含有的氯气分子数小于0.5NA,B错误;
C.1个Na2SO4在溶液中电离产生2个Na+和1个,1 L0.5 mol·L 1Na2SO4溶液中含有溶质的物质的量是0.5 mol,则该溶液中含有的离子数为1.5NA,C错误;
D.NA个氧分子与NA个氢分子的物质的量都是1 mol,二者的质量比为32 g:2 g=16:1,D错误;
故合理选项是A。
10.A
【详解】A.实验室常用大理石和稀盐酸制备CO2,可以达到实验装置,A正确;
B.NaOH均可吸收HCl、CO2,不能利用NaOH溶液吸收CO2中的HCl气体,应该用饱和NaHCO3溶液,B错误;
C.应先使氨气通入饱和食盐水中而成氨盐水,因氨气在溶液中的溶解度更大,再通入CO2,得到NaHCO3固体,C错误;
D.加热固体,试管口应稍向下倾斜,防止在试管口凝成的水珠流回试管底部致使试管骤冷而炸裂,D错误;
答案选A。
11.B
【详解】A.氢氧化钙属于强电解质,完全电离成Ca2+和OH-,A正确;
B.氯气与水反应生成盐酸和次氯酸,HCl属于强酸,HClO属于弱酸:,B错误;
C.碳酸银与稀硝酸反应生成硝酸银、水和二氧化碳,碳酸银难溶于水,应以化学式保留,C正确;
D.无论铁是否过量,铁在氯气中燃烧生成氯化铁,D正确;
答案选B。
12.B
【分析】A处通入干燥的Cl2,打开B阀后,C处的红布条逐渐褪色,说明C处布条是湿润的;关闭B阀时,C处的红布条看不到明显现象,说明洗气瓶D中装的物质能完全吸收氯气。
【详解】A.浓硫酸与氯气不反应,不能吸收氯气,故A不选;
B.氢氧化钠溶液能吸收氯气,故B选;
C.浓盐酸不与氯气反应,不能吸收氯气,故C不选;
D.饱和食盐水不能吸收氯气,故D不选;
故答案选B。
13.B
【详解】A.Cl2(HCl):通过饱和食盐水溶液的洗气瓶,若通过饱和碳酸氢钠溶液,盐酸被吸收会释放出二氧化碳,且氯气也会和碳酸氢钠反应,故A错误;
B.FeCl3(FeCl2):通入足量的氯气会将FeCl2氧化为FeCl3,故B正确;
C.用点燃的方法需要通入空气,又引入新的杂质,而且容易燃烧不完全,故C错误;
D.加入过量Ba(OH)2溶液,过量的那部分Ba(OH)2是新的杂质,故D错误;
故选B。
14.B
【详解】铝与NaOH溶液反应,,,则n(NaOH)=0.2mol,;
故答案为:B。
15.D
【分析】由方程式可知,反应中氯酸钾中氯元素的化合价降低被还原,是反应的氧化剂,氯化钾中氯元素的化合价升高被氧化,是反应的还原剂,则氯气既是氧化产物又是还原产物。
【详解】A.由分析可知,氯酸钾是反应的氧化剂,故A正确;
B.由分析可知,反应中氯酸钾中氯元素的化合价降低被还原,氯化钾中氯元素的化合价升高被氧化,则被氧化与被还原的氯元素的质量比为 5:1,故B正确;
C.由方程式可知,反应中硫酸分子中没有元素发生化合价变化,既不是氧化剂又不是还原剂,故C正确;
D.由分析可知,氯气既是氧化产物又是还原产物,故D错误;
故选D。
16.A
【分析】W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8,设X的最高价为a,W的最高价为a+2,a+2+a=8,a=3,所以W是N元素、X是Al元素、Y是Si元素、Z是P元素。
【详解】A.二氧化硅是由原子构成的,没有分子式,是二氧化硅的化学式,A错误;
B.五氧化二磷能用来作干燥剂,B正确;
C.N的最简单氢化物为氨气,N的最高价氧化物的水化物为硝酸,二者能发生化合反应生成硝酸铵,C正确;
D.Al的单质既能与盐酸反应也能与氢氧化钠溶液反应,D正确;
故选A。
17.(1) ①③⑦⑧⑨ ④⑩
(2)D
(3)先产生红褐色沉淀,后沉淀溶解,溶液变为黄色
(4)
(5)
(6)11.2
【分析】石墨、银含有自由移动的电子能导电,氨水、氢氧化铁胶体、稀硫酸和熔融含有自由移动的离子能导电。电解质是指在水溶液中或者熔融状态下能导电的化合物,其中酸、碱、盐、金属氧化物均属于电解质。石墨、液氯、银属于单质,既不是电解质也不是非电解质;氨水、氢氧化铁胶体、稀硫酸是混合物;、蔗糖自身不能电离属于非电解质;、、熔融属于电解质。
【详解】(1)根据分析,石墨、银含有自由移动的电子能导电,氨水、氢氧化铁胶体、稀硫酸和熔融含有自由移动的离子能导电,则能导电的物质是①③⑦⑧⑨ ;、蔗糖自身不能电离属于非电解质,即属于非电解质的是④⑩;
(2)A.滴加适量的氢氧化钠稀溶液,生成的是氢氧化铁沉淀,而不是胶体,A不符合题意;
B.氯化铁在溶液中水解生成氢氧化铁,加热促进水解,煮沸会出现红褐色沉淀,得到的是氢氧化铁沉淀,B不符合题意;
C.在氨水中滴加氯化铁浓溶液,生成的是氢氧化铁沉淀,而不是胶体,C不符合题意;
D.往沸水中滴加几滴饱和氯化铁溶液,煮沸至出现红褐色液体停止加热,可得到氢氧化铁胶体,D符合题意;
故选D。
(3)向氢氧化铁胶体中加入电解质HCl会使胶体先发生聚沉,之后Fe(OH)3与HCl发生酸碱中和反应,沉淀溶解,溶液呈黄色,则向盛有红褐色的氢氧化铁胶体的烧杯中还滴加入盐酸至过量的现象为:先产生红褐色沉淀,后沉淀溶解,溶液变为黄色;
(4)向溶液中加入,至溶液呈中性,则和按1:2反应,反应的离子方程式为;
(5)该反应中Al元素化合价由0价升高到NaAlO2中的+3价,N元素由NaNO3中+5价降低到N2中0价,根据得失电子守恒、原子守恒,可配平该化学方程式为;
(6)由第(5)问分析知,该反应化学方程式为,则反应过程中转移,生成,其标准状况下的体积为11.2L。
18.(1)NN
(2)
(3) O2和O3 O3
(4)Al3+
(5)Cl2+2OH-=Cl-+ClO-+H2O
(6)D
【分析】根据元素在周期表中的位置可知,元素a为H,b为N,c为O,d为Na,e为Al,为f为S,g为Cl,以此解题。
【详解】(1)由分析可知,b为N,则氮气的结构式为:NN;
(2)由分析可知,c为O,d为Na,则为,其电子式为:;过氧化钠与水反应的化学方程式为:;
(3)由分析可知,c为O,其在周期表中的位置是第2周期ⅥA族;氧元素的两种同素异形体分别为氧气和臭氧,其化学式分别为:O2和O3;
(4)由分析可知,d为Na,e为Al,为f为S,g为Cl,在这些元素前两种元素形成的简单离子的电子层数较少,半径较小,且当核外电子排布相同时,原子序数越大,半径越小,故离子半径最小的是Al3+;
(5)由分析可知,d为Na,g为Cl,则氯气和氢氧化钠反应制备“84消毒液”的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
(6)由分析可知,f为S,g为Cl,以此解题;
A.可以通过置换反应证明非金属性强弱,非金属性强的元素可以置换出非金属性弱的元素,A正确;
B.非金属性越强,氢化物越稳定,反之,氢化物越稳定,非金属性越强,B正确;
C.和同种还原剂反应时,非金属性强的元素,对应的氧化产物中的元素化合价越高,C正确;
D.应该通过最高价氧化物对应水化物的酸性强弱来证明,D错误;
故选D。
19.(1)2Fe3++Cu=2Fe2++Cu2+
(2)Fe+Cu2+=Fe2++Cu
(3) 硫氰酸钾 B 2Fe2++H2O2+2H+=2Fe3++2H2O
(4)C
(5)4Fe(OH)2+O2+2H2O=4Fe(OH)3
【分析】腐蚀废液(主要含FeCl3、FeCl2、CuCl2)加入足量的铁粉,铁粉先和铁离子反应生成亚铁离子,再和铜离子反应生成铜单质和亚铁离子,过滤,得到沉淀C为铜和未反应的铁,向C中加入过量稀盐酸,生成氯化亚铁和氢气,铜不与稀盐酸反应,过滤,滤液合并后通入足量氯气,将氯化亚铁氧化生成氯化铁,据此作答。
【详解】(1)FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板的反应原理是强氧化性的Fe3+与Cu反应,生成Fe2+和Cu2+,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;
(2)根据分析可知,过量金属A是Fe,铁粉先和铁离子反应生成亚铁离子,再和铜离子反应生成铜单质和亚铁离子,其中发生置换的方程式为:Fe+Cu2+=Fe2++Cu;
(3)铁离子常用KSCN溶液检验,溶液变为红色,因此检验废液中是否含有Fe3+所需要的试剂为硫氰化钾;根据分析,试剂F的作用是将Fe2+氧化为Fe3+,又不引入新的杂质:
A.引入Mn元素和K元素,A不选;
B.不会引入杂质,B选;
C.引入Br元素,C不选;
D.引入N元素,D不选;
故选B;
H2O2能将Fe2+氧化为Fe3+,离子方程式:2H++H2O2+2Fe2+=2Fe3++2H2O;
(4)若要检验Fe2(SO4)3溶液中是否含有FeSO4,可选用的最佳试剂应该满足能与Fe2+反应,且有明显现象变化:
A.加入氢氧化钠溶液,两者均会产生沉淀,无法检验,A不选;
B.氯水会与Fe2+反应,不与Fe3+反应,但是现象变化不明显,无法检验,B不选;
C.酸性KMnO4溶液会与Fe2+反应,不与Fe3+反应,从而使酸性KMnO4溶液褪色,现象变化明显,C选;
D.稀硝酸会与Fe2+反应,不与Fe3+反应,但是现象变化不明显,无法检验,D不选;
故选C;
(5)根据分析,滤液B为FeCl2溶液,向滤液B中加入氢氧化钠溶液并在空气中放置一段时间,会生成Fe(OH)3沉淀,沉淀转化的化学方程式为: 4Fe(OH)2+O2+2H2O=4Fe(OH)3。
20.(1) 分液漏斗 防止Cl2与KOH反应生成KClO3
(2) HCl 吸收多余的Cl2,防止污染空气
(3) 饱和KOH溶液 过滤
(4)6.02×1022
【分析】A中浓盐酸和二氧化锰在加热条件下反应生成Cl2,浓盐酸易挥发,所以生成的氯气中含有HCl,饱和食盐水除去氯气中的HCl,氯气和KOH在冷水中反应生成KClO,氯气有毒,不能直接排入空气中,用NaOH溶液吸收尾气,据此解答。
【详解】(1)仪器a的名称为分液漏斗,由于Cl2与KOH溶液在20°C以下反应生成KClO,在较高温度下则生成KClO3,所以装置C中三颈烧瓶置于冰水浴中的目的是防止Cl2与KOH反应生成KClO3,故答案为:分液漏斗;防止Cl2与KOH反应生成KClO3;
(2)装置B吸收的气体是HCl,装置D的作用是吸收多余的Cl2,防止污染空气,故答案为:HCl;吸收多余的Cl2,防止污染空气;
(3)K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定,为了分离出K2FeO4,在反应的溶液中再加入饱和KOH溶液,经过过滤得到K2FeO4粗产品,故答案为:加入饱和KOH溶液;过滤。
(4)根据2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O可知Mn元素化合价从+7价降低到+2价,得到5个电子,因此生成5mol氯气转移10mol电子,若标准状况下,反应产生1.12LCl2,物质的量是1.12L÷22.4L/mol=0.05mol,则转移的电子数目为0.1mol×6.02×1023/mol=6.02×1022。
同课章节目录
