化学人教版九下:8.2金属的化学性质(第二课时)教案
文档属性
| 名称 | 化学人教版九下:8.2金属的化学性质(第二课时)教案 |

|
|
| 格式 | zip | ||
| 文件大小 | 61.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 00:00:00 | ||
图片预览

文档简介
8.2 金属的化学性质(第二课时)
一、学习目标
1.能用金属活动性顺序对有关的置换反应进行简单地判断,并能利用金属活动性顺序解释一些与日常生活有关的化学反应。
2.组织、引导和点拨学生通过实验探究和讨论交流,认识金属的化学性质及其活动性顺序。
3.培养学生的合作意识以及勤于思考、勇于创新实践、严谨求实的科学精神。
二、教学重难点
重点:金属活动性顺序
难点:对金属活动性顺序的初步探究及利用金属活动性顺序对置换反应的判断
三、教学方法
讲授法、推演法
四、教学过程
(一)新课导入:
情景导入:
某实验小组在天平两端托盘上各放两只质量和大小都相同的烧杯,在两个烧杯中分别倒入等质量的硫酸铜和硫酸镁溶液。接着又分别加入等质量的铝片,此时天平仍然平衡。等一段时间,取出铝片,发现天平不再平衡。是天平出现了毛病还是其他什么原因?
(二)新知探究
知识点1 金属活动性顺序
教师演示实验:铁和硫酸铜反应
该反应的化学方程式:Fe + CuSO4 ==== Cu + FeSO4
教师总结:活动性强的金属可以把活动性弱的金属从它的化合物溶液中置换出来。
教师讲解:金属活动性顺序表
金属活动性顺序由强逐渐减弱
①金属活动性从前到后逐渐减弱;
②位于(H)前的金属可以置换出酸中的氢;
③位于前面的金属能把位于后面的金属从它的化合物溶液中置换出来。(K、Ca、Na除外!)
学生讨论:判断常见金属活泼性的方法
①金属与酸反应的剧烈程度;
②金属能否与金属化合物的溶液反应;
③金属与氧气反应的难易程度。
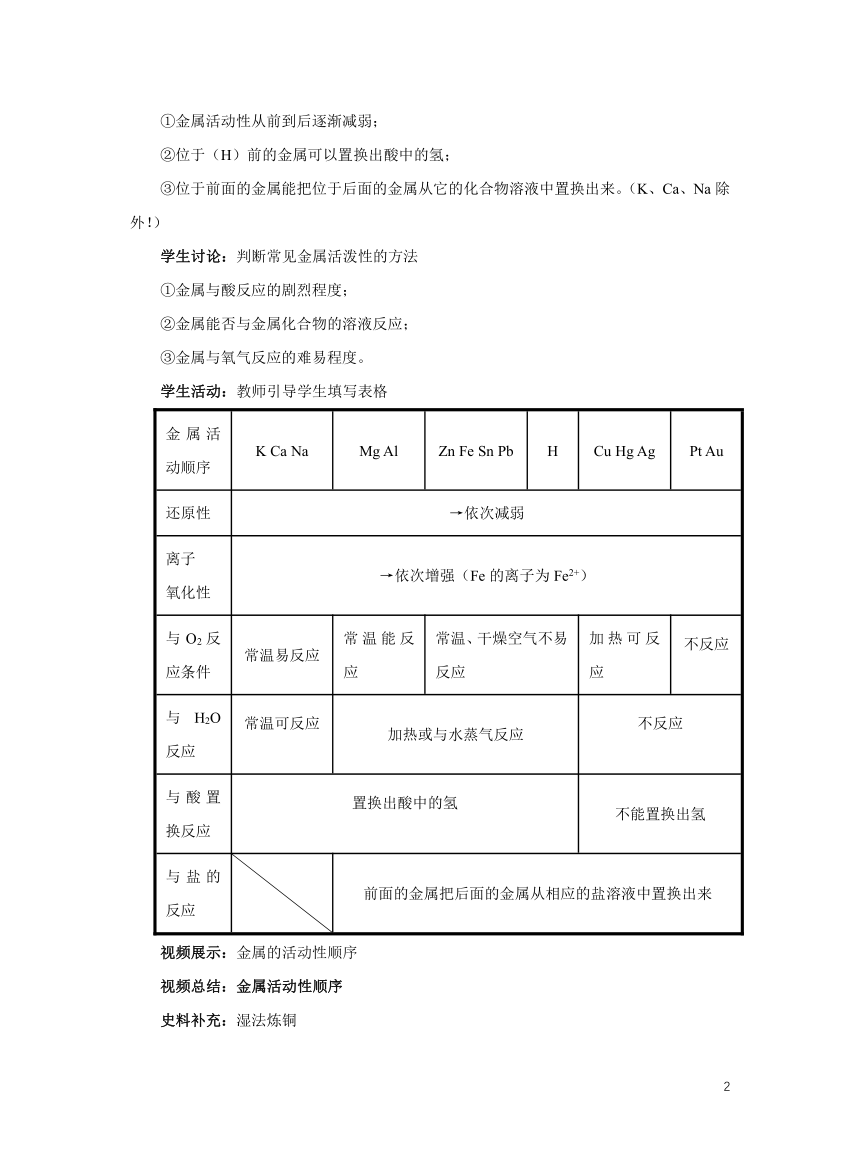
学生活动:教师引导学生填写表格
金属活动顺序 K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
还原性 →依次减弱
离子 氧化性 →依次增强(Fe的离子为Fe2+)
与O2反应条件 常温易反应 常温能反应 常温、干燥空气不易反应 加热可反应 不反应
与H2O反应 常温可反应 加热或与水蒸气反应 不反应
与酸置换反应 置换出酸中的氢 不能置换出氢
与盐的反应 前面的金属把后面的金属从相应的盐溶液中置换出来
视频展示:金属的活动性顺序
视频总结:金属活动性顺序
史料补充:湿法炼铜
湿法炼铜的原理是:CuSO4+Fe=Cu+FeSO4
在汉代许多著作里有记载“石胆能化铁为铜”,晋葛洪《抱朴子内篇·黄白》中也有“以曾青涂铁,铁赤色如铜”的记载。南北朝时更进一步认识到不仅硫酸铜,其它可溶性铜盐也能与铁发生置换反应。南北朝的陶弘景说:“鸡屎矾投苦洒(醋)中涂铁,皆作铜色”,即不纯的碱式硫酸铜或碱式碳酸铜不溶于水,但可溶于醋,用醋溶解后也可与铁起置换反应。到唐末五代间,水法炼铜的原理应用到生产中去,至宋代更有发展,成为大量生产铜的重要方法之一。
除了湿法炼铜外,还有火法炼铜,火法炼铜的主要原料是硫化铜精矿,一般包括焙烧、熔炼、吹炼、精炼等工序。
(三)课堂练习
1.X、Y、Z三重金属中,只有Z能和稀硫酸反应,将Y放到X的盐溶液中,Y表面有X析出。则X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.Y>X>Z C.Y>Z>X D.Z>Y>X
解析:X、Y、Z三种金属中,只有Z能和稀硫酸反应,说明Z在氢前,X、Y在氢后,当把Y放入X的盐溶液中,Y表面有X析出,说明Y在X的前面。故选D。
2.下列有关事实不能用金属活动性顺序解释的是( )
A.铁能将铜从硫酸铜溶液中置换出来
B.铝制品抗腐蚀能力比铁制品强
C.不能用金属铜与稀硫酸反应制取氢气
D.相同条件下,镁和锌与稀盐酸反应的剧烈程度
解析:铝的化学性质比较活泼,易与空气中的氧气反应生成一层致密的氧化铝薄膜,使得铝制品的抗腐蚀能力强于铁制品,这与金属活动性顺序无关。故本题选B。
(四)课堂小结
本节课我们知道了多数金属能与氧气反应,且不同金属的活动性各不相同,根据金属与酸或金属与另一个金属化合物的反应,可判断出金属活动性的相对强弱。
(五)作业布置
学完本课题后,你们能否想出另外的办法来鉴别黄铜和黄金?
五、板书设计
金属的化学性质
五、金属活动性顺序
1.金属活动顺序表
2.金属活动性顺序的应用
六、教学反思
教师在观念上必须真正转变,找准自己在教学过程中的角色;在教学设计上,要切实以“学生发展”为本,利用一切条件创设情景,让学生主动参与到学习过程中,通过师生互动、生生互动,不断建构和丰富自己的知识。最终达到使教师的专业水平和学生的学习方法共同发展的双赢效果。
1
一、学习目标
1.能用金属活动性顺序对有关的置换反应进行简单地判断,并能利用金属活动性顺序解释一些与日常生活有关的化学反应。
2.组织、引导和点拨学生通过实验探究和讨论交流,认识金属的化学性质及其活动性顺序。
3.培养学生的合作意识以及勤于思考、勇于创新实践、严谨求实的科学精神。
二、教学重难点
重点:金属活动性顺序
难点:对金属活动性顺序的初步探究及利用金属活动性顺序对置换反应的判断
三、教学方法
讲授法、推演法
四、教学过程
(一)新课导入:
情景导入:
某实验小组在天平两端托盘上各放两只质量和大小都相同的烧杯,在两个烧杯中分别倒入等质量的硫酸铜和硫酸镁溶液。接着又分别加入等质量的铝片,此时天平仍然平衡。等一段时间,取出铝片,发现天平不再平衡。是天平出现了毛病还是其他什么原因?
(二)新知探究
知识点1 金属活动性顺序
教师演示实验:铁和硫酸铜反应
该反应的化学方程式:Fe + CuSO4 ==== Cu + FeSO4
教师总结:活动性强的金属可以把活动性弱的金属从它的化合物溶液中置换出来。
教师讲解:金属活动性顺序表
金属活动性顺序由强逐渐减弱
①金属活动性从前到后逐渐减弱;
②位于(H)前的金属可以置换出酸中的氢;
③位于前面的金属能把位于后面的金属从它的化合物溶液中置换出来。(K、Ca、Na除外!)
学生讨论:判断常见金属活泼性的方法
①金属与酸反应的剧烈程度;
②金属能否与金属化合物的溶液反应;
③金属与氧气反应的难易程度。
学生活动:教师引导学生填写表格
金属活动顺序 K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
还原性 →依次减弱
离子 氧化性 →依次增强(Fe的离子为Fe2+)
与O2反应条件 常温易反应 常温能反应 常温、干燥空气不易反应 加热可反应 不反应
与H2O反应 常温可反应 加热或与水蒸气反应 不反应
与酸置换反应 置换出酸中的氢 不能置换出氢
与盐的反应 前面的金属把后面的金属从相应的盐溶液中置换出来
视频展示:金属的活动性顺序
视频总结:金属活动性顺序
史料补充:湿法炼铜
湿法炼铜的原理是:CuSO4+Fe=Cu+FeSO4
在汉代许多著作里有记载“石胆能化铁为铜”,晋葛洪《抱朴子内篇·黄白》中也有“以曾青涂铁,铁赤色如铜”的记载。南北朝时更进一步认识到不仅硫酸铜,其它可溶性铜盐也能与铁发生置换反应。南北朝的陶弘景说:“鸡屎矾投苦洒(醋)中涂铁,皆作铜色”,即不纯的碱式硫酸铜或碱式碳酸铜不溶于水,但可溶于醋,用醋溶解后也可与铁起置换反应。到唐末五代间,水法炼铜的原理应用到生产中去,至宋代更有发展,成为大量生产铜的重要方法之一。
除了湿法炼铜外,还有火法炼铜,火法炼铜的主要原料是硫化铜精矿,一般包括焙烧、熔炼、吹炼、精炼等工序。
(三)课堂练习
1.X、Y、Z三重金属中,只有Z能和稀硫酸反应,将Y放到X的盐溶液中,Y表面有X析出。则X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.Y>X>Z C.Y>Z>X D.Z>Y>X
解析:X、Y、Z三种金属中,只有Z能和稀硫酸反应,说明Z在氢前,X、Y在氢后,当把Y放入X的盐溶液中,Y表面有X析出,说明Y在X的前面。故选D。
2.下列有关事实不能用金属活动性顺序解释的是( )
A.铁能将铜从硫酸铜溶液中置换出来
B.铝制品抗腐蚀能力比铁制品强
C.不能用金属铜与稀硫酸反应制取氢气
D.相同条件下,镁和锌与稀盐酸反应的剧烈程度
解析:铝的化学性质比较活泼,易与空气中的氧气反应生成一层致密的氧化铝薄膜,使得铝制品的抗腐蚀能力强于铁制品,这与金属活动性顺序无关。故本题选B。
(四)课堂小结
本节课我们知道了多数金属能与氧气反应,且不同金属的活动性各不相同,根据金属与酸或金属与另一个金属化合物的反应,可判断出金属活动性的相对强弱。
(五)作业布置
学完本课题后,你们能否想出另外的办法来鉴别黄铜和黄金?
五、板书设计
金属的化学性质
五、金属活动性顺序
1.金属活动顺序表
2.金属活动性顺序的应用
六、教学反思
教师在观念上必须真正转变,找准自己在教学过程中的角色;在教学设计上,要切实以“学生发展”为本,利用一切条件创设情景,让学生主动参与到学习过程中,通过师生互动、生生互动,不断建构和丰富自己的知识。最终达到使教师的专业水平和学生的学习方法共同发展的双赢效果。
1
同课章节目录
