人教版化学九下:9.2 溶解度(第2课时)课件(共30张PPT)
文档属性
| 名称 | 人教版化学九下:9.2 溶解度(第2课时)课件(共30张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 20:58:10 | ||
图片预览







文档简介
(共30张PPT)
第九单 溶液
课题2 溶解度
第2课时
溶解度曲线
2
气体的溶解度
3
固体的溶解度
1
本节重点
本节难点
生活中常见到这样的现象,在夏天,打开汽水瓶盖时,汽水会自动喷出来。
你知道这是什么原理吗?
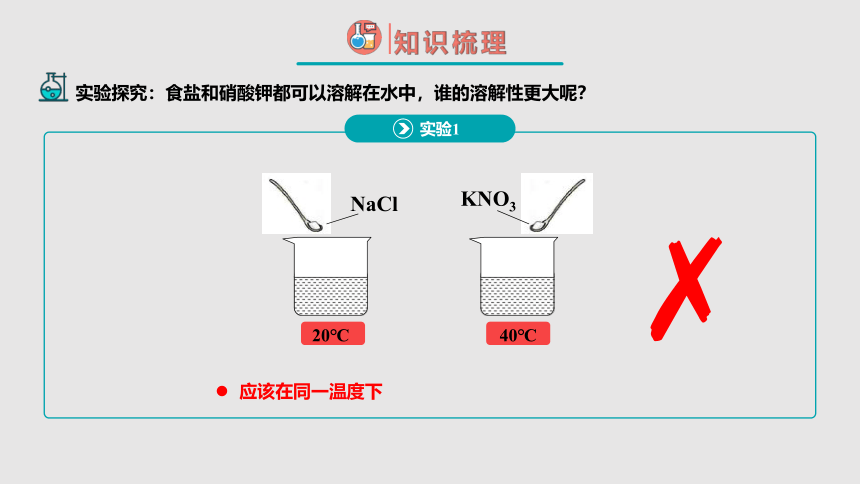
根据氯化钠和硝酸钾的两个溶解实验,比较不同物质的溶解能力,应该控制哪些条件呢?
NaCl
KNO3
20℃
40℃
应该在同一温度下
实验1
实验探究:食盐和硝酸钾都可以溶解在水中,谁的溶解性更大呢?
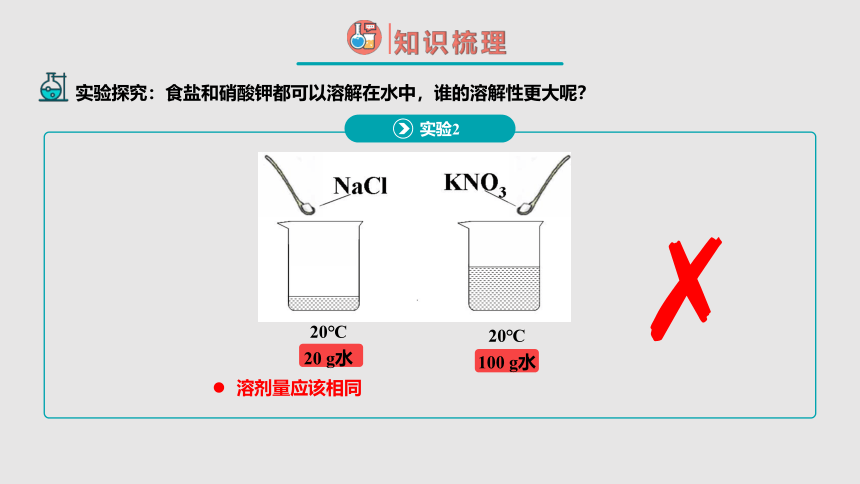
溶剂量应该相同
20℃
20 g水
20℃
100 g水
实验2
实验探究:食盐和硝酸钾都可以溶解在水中,谁的溶解性更大呢?
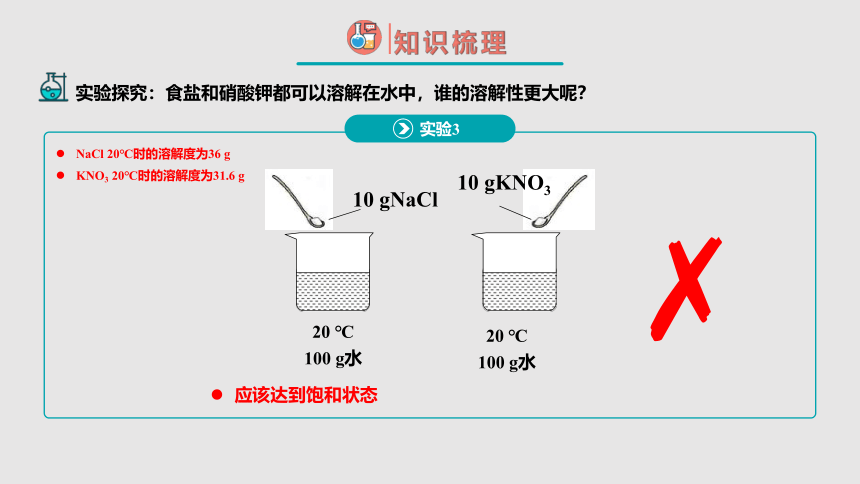
应该达到饱和状态
10 gNaCl
10 gKNO3
20 ℃
100 g水
20 ℃
100 g水
实验3
实验探究:食盐和硝酸钾都可以溶解在水中,谁的溶解性更大呢?
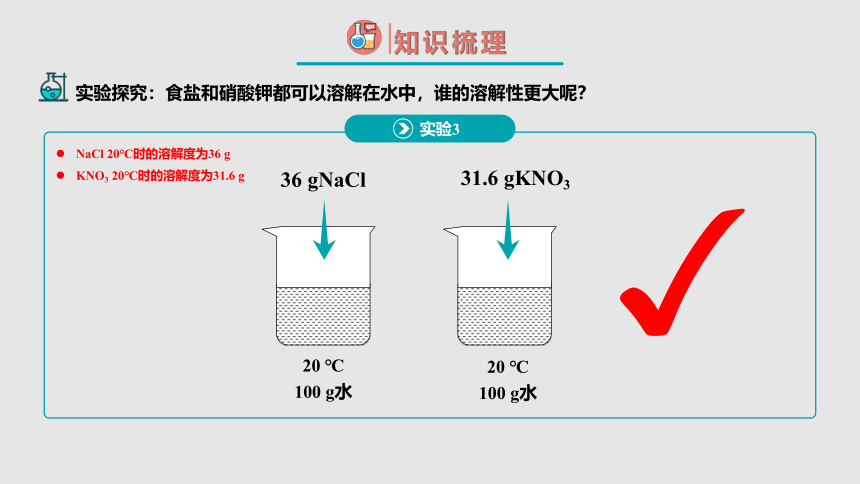
NaCl 20℃时的溶解度为36 g
KNO3 20℃时的溶解度为31.6 g
20 ℃
100 g水
20 ℃
100 g水
36 gNaCl
31.6 gKNO3
实验3
实验探究:食盐和硝酸钾都可以溶解在水中,谁的溶解性更大呢?
NaCl 20℃时的溶解度为36 g
KNO3 20℃时的溶解度为31.6 g
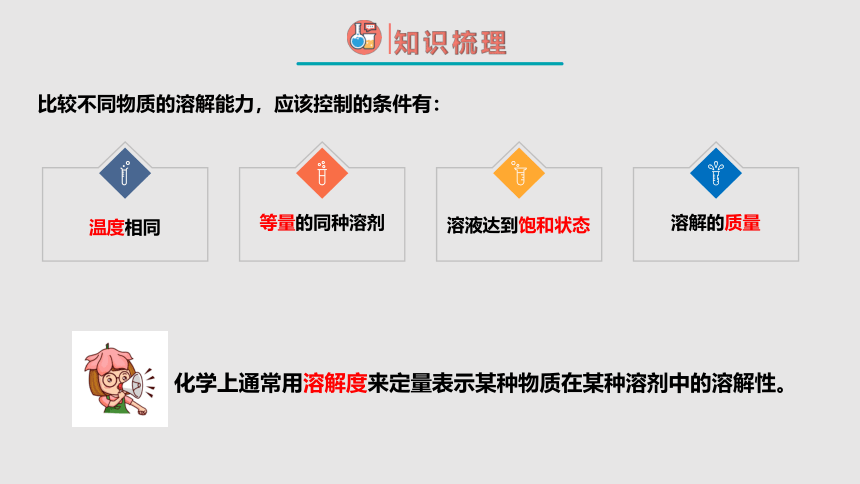
比较不同物质的溶解能力,应该控制的条件有:
温度相同
等量的同种溶剂
溶液达到饱和状态
溶解的质量
化学上通常用溶解度来定量表示某种物质在某种溶剂中的溶解性。
固体溶解度
一定温度
100 g溶剂(水)
饱和状态
单位:g
固体物质的溶解度是指在一定温度下,某固体物质在100 g溶剂(通常为水)里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
20 ℃时硝酸钾的溶解度为31.6 g。表达的含义是:
__________________________________________________
__________________________________________________
例如:
20 ℃时,100 g水中最多溶解31.6 g硝酸钾。
20 ℃时,100 g水中溶解31.6 g硝酸钾,达到饱和状态。
溶解度四要素
一定温度下,固体的溶解度与溶质、溶剂的质量无关。
判断下列说法是否正确。若不正确,则指明错误原因。
20℃时,10 g食盐溶解在100 g水中,所以 20 ℃时,食盐的溶解度是10 g。
100 g水中溶解了36 g食盐刚好达到饱和,所以食盐的溶解度是36 g。
在20℃时,100 g水里最多溶解了33.3 g氯化铵,所以20℃时氯化铵的溶解度是33.3。
在20℃时,100 g硝酸钾的饱和溶液里含硝酸钾24 g,则20℃时硝酸钾的溶解度是24 g。
饱和
温度
单位:g
100 g 水
易溶物质
可溶物质
微溶物质
难溶物质
20℃物质的溶解度
0.01 g
1 g
10 g
溶解度的相对大小
如何表示不同温度下的溶解度呢
?
溶解度的表示方法:
探究——认识溶解度曲线
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
硝酸钾在不同温度时的溶解度
固体物质溶解度的表示法——列表法
不能表示某物质在任意温度时的溶解度;
不能直观表示某物质溶解度随温度变化的趋向。
不足之处
溶解度(克)
80
70
60
50
40
30
20
10
固体物质溶解度的表示法——溶解度曲线
KNO3
温度(℃)
60
50
40
30
20
10
0
物质的溶解度随温度变化的趋势;
能查到0 ℃~60 ℃范围内任意温度下某物质的溶解度。
观察几种物质的溶解度曲线,总结一下物质的溶解度随温度变化而变化的规律?
硝酸钾
氯化铵
氯化钠
温度/℃
10
100
90
80
70
60
50
40
30
20
溶解度/g
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
0
氯化钾
硝酸铵
碳酸氢钠
硼酸
硝酸钠
氢氧化钙的溶解度曲线
大多数固体物质的溶解度随着温度的升高而增大,如硝酸钾。
少数物质的溶解度受温度影响变化不大,如氯化钠。
极少数物质的溶解度随着温度的升高而减小,如氢氧化钙。
变化规律
溶解度曲线上点、线的理解
硝酸钾
温度/℃
10
100
90
80
70
60
50
40
30
20
溶解度/g
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
0
硝酸钠
氯化钠
交点所对应的温度下,不同物质的溶解度相同。
曲线的变化趋势表明了该物质的溶解度受温度的影响大小。
曲线上的点,表示点所对应温度下的该物质的溶解度。
曲线越陡,该物质的溶解度受温度影响越大,如硝酸钾;
曲线比较平缓,该物质的溶解度受温度影响较小,如氯化钠。
溶解度受温度影响变化不大的物质可用蒸发结晶提纯。
曲线上面的点A:
是过饱和溶液,且有未溶解的物质。
曲线下面的点C:
是不饱和溶液。
硝酸钾
温度/℃
10
100
90
80
70
60
50
40
30
20
溶解度/g
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
0
A
C
曲线上的点B:
表示物质在某温度下的溶解度,溶液恰好饱和。
B
溶液状态的判断
对于溶解度受温度影响变化较大的物质,可采取冷却热饱和溶液的方法,使溶质从溶液中结晶析出,这种方法称为降温结晶。
硝酸钾溶液中混有一定量的氯化钠溶液,如何提纯硝酸钾呢?
(冷却热饱和溶液法)
【例1】如图为甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线。下列相关说法中正确的是( )
A.甲和乙两物质的饱和溶液温度从t3℃降至t2℃时,析出晶体质量甲>乙
B.将接近饱和的丙溶液变为饱和溶液,可以采用升高溶液温度的方法
C.甲中含少量乙时,采用蒸发溶剂的方法提纯甲
D.t1℃时,30 g丙物质加入到50 g水中形成溶液的质量为80 g
B
生活中常见到这样的现象,在夏天,打开汽水瓶盖时,汽水会自动喷出来。
原理:打开汽水瓶盖,汽水会自动喷出的原因是压强变小,气体在水中的溶解度变小。
指在压强为101 kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
条件 —— 一定温度和压强
标准 —— 1体积水
状态 —— 饱和溶液
单位 —— 气体体积
气体溶解度
气体溶解度四要素
影响气体物质溶解度的因素:温度和压强
气体溶解度一般随压强增大而增大
增大气体物质的溶解度的方法:____________________。
气体溶解度一般随温度升高而减小
降低温度、增大压强
【例1】夏季,鱼塘内常设置一些水泵,把水喷向空中,从化学角度分析,喷水的目的是( )
A.降低养殖池内水的温度 B.增大与空气的接触面积,便于氧气溶解
C.增加观赏性 D.便于太阳照射,杀灭水中的病菌
B
我国有许多盐碱湖,湖水中溶有大量的氯化钠和纯碱(碳酸钠)。那里的人们冬天捞碱,夏天晒盐。
氯化钠的溶解度受温度影响小,夏天时,温度高,水分蒸发后,氯化钠以晶体形式析出,得粗盐,这就是夏天晒盐。
碳酸钠的溶解度受温度影响大,夏天温度高,它以溶液的形式存在,冬天时,温度降低,它以晶体形式析出,沉于湖底,可打捞得到,这就是冬天捞碱。
1 .如图是KNO3和NH4Cl的溶解度曲线。下列说法正确的是( )
A.t1°C时,KNO3的溶解度大于NH4Cl
B.t2°C时,KNO3和NH4Cl的溶解度相等
C.t3°C时,两溶液中KNO3的质量分数一定大于NH4Cl
D.NH4Cl的溶解度受温度的影响大于KNO3
B
2. a、b、c三种固体物质的溶解度曲线如图所示,下列叙述正确的是( )
A.a物质的溶解度大于b物质的溶解度
B.t1 ℃时,a、c两种物质的溶解度相等
C.t2 ℃时,30 g a物质加入50 g水中得到80 g溶液
D.t2 ℃时,c物质的饱和溶液降温到t1 ℃时有晶体析出
B
3.如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
A.20 ℃时,100 g甲溶液中含甲物质的质量小于25 g
B.20 ℃时,等质量甲、乙饱和溶液中含溶质的质量相等
C.30 ℃时,甲物质的溶解度大于乙物质的溶解度
D.50 ℃时,将甲、乙两种物质的饱和溶液分别降温至20 ℃,析出晶体的质量甲大于乙
D
4.甲、乙、丙三种物质的溶解度曲线如图所示。
(1)t1℃时,甲、乙、丙三种物质的溶解度由大到小顺序为 ;
(2)t2℃时,乙物质的溶解度为 g;
(3)将t2℃时180 g甲的饱和溶液降温到t1℃,析出晶体的质量为 g;
(4)取等质量的甲、乙、丙三种物质,分别配制成t2℃时的恰好饱和溶液,所得三种溶液的质量由大到小顺序为 。
80
55
丙>甲=乙
乙>甲=丙
课题2 溶解度
第2课时
固体物质溶解度
概念
影响因素
表示方法
气体物质溶解度
概念
影响因素
第九单 溶液
课题2 溶解度
第2课时
溶解度曲线
2
气体的溶解度
3
固体的溶解度
1
本节重点
本节难点
生活中常见到这样的现象,在夏天,打开汽水瓶盖时,汽水会自动喷出来。
你知道这是什么原理吗?
根据氯化钠和硝酸钾的两个溶解实验,比较不同物质的溶解能力,应该控制哪些条件呢?
NaCl
KNO3
20℃
40℃
应该在同一温度下
实验1
实验探究:食盐和硝酸钾都可以溶解在水中,谁的溶解性更大呢?
溶剂量应该相同
20℃
20 g水
20℃
100 g水
实验2
实验探究:食盐和硝酸钾都可以溶解在水中,谁的溶解性更大呢?
应该达到饱和状态
10 gNaCl
10 gKNO3
20 ℃
100 g水
20 ℃
100 g水
实验3
实验探究:食盐和硝酸钾都可以溶解在水中,谁的溶解性更大呢?
NaCl 20℃时的溶解度为36 g
KNO3 20℃时的溶解度为31.6 g
20 ℃
100 g水
20 ℃
100 g水
36 gNaCl
31.6 gKNO3
实验3
实验探究:食盐和硝酸钾都可以溶解在水中,谁的溶解性更大呢?
NaCl 20℃时的溶解度为36 g
KNO3 20℃时的溶解度为31.6 g
比较不同物质的溶解能力,应该控制的条件有:
温度相同
等量的同种溶剂
溶液达到饱和状态
溶解的质量
化学上通常用溶解度来定量表示某种物质在某种溶剂中的溶解性。
固体溶解度
一定温度
100 g溶剂(水)
饱和状态
单位:g
固体物质的溶解度是指在一定温度下,某固体物质在100 g溶剂(通常为水)里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
20 ℃时硝酸钾的溶解度为31.6 g。表达的含义是:
__________________________________________________
__________________________________________________
例如:
20 ℃时,100 g水中最多溶解31.6 g硝酸钾。
20 ℃时,100 g水中溶解31.6 g硝酸钾,达到饱和状态。
溶解度四要素
一定温度下,固体的溶解度与溶质、溶剂的质量无关。
判断下列说法是否正确。若不正确,则指明错误原因。
20℃时,10 g食盐溶解在100 g水中,所以 20 ℃时,食盐的溶解度是10 g。
100 g水中溶解了36 g食盐刚好达到饱和,所以食盐的溶解度是36 g。
在20℃时,100 g水里最多溶解了33.3 g氯化铵,所以20℃时氯化铵的溶解度是33.3。
在20℃时,100 g硝酸钾的饱和溶液里含硝酸钾24 g,则20℃时硝酸钾的溶解度是24 g。
饱和
温度
单位:g
100 g 水
易溶物质
可溶物质
微溶物质
难溶物质
20℃物质的溶解度
0.01 g
1 g
10 g
溶解度的相对大小
如何表示不同温度下的溶解度呢
?
溶解度的表示方法:
探究——认识溶解度曲线
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
硝酸钾在不同温度时的溶解度
固体物质溶解度的表示法——列表法
不能表示某物质在任意温度时的溶解度;
不能直观表示某物质溶解度随温度变化的趋向。
不足之处
溶解度(克)
80
70
60
50
40
30
20
10
固体物质溶解度的表示法——溶解度曲线
KNO3
温度(℃)
60
50
40
30
20
10
0
物质的溶解度随温度变化的趋势;
能查到0 ℃~60 ℃范围内任意温度下某物质的溶解度。
观察几种物质的溶解度曲线,总结一下物质的溶解度随温度变化而变化的规律?
硝酸钾
氯化铵
氯化钠
温度/℃
10
100
90
80
70
60
50
40
30
20
溶解度/g
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
0
氯化钾
硝酸铵
碳酸氢钠
硼酸
硝酸钠
氢氧化钙的溶解度曲线
大多数固体物质的溶解度随着温度的升高而增大,如硝酸钾。
少数物质的溶解度受温度影响变化不大,如氯化钠。
极少数物质的溶解度随着温度的升高而减小,如氢氧化钙。
变化规律
溶解度曲线上点、线的理解
硝酸钾
温度/℃
10
100
90
80
70
60
50
40
30
20
溶解度/g
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
0
硝酸钠
氯化钠
交点所对应的温度下,不同物质的溶解度相同。
曲线的变化趋势表明了该物质的溶解度受温度的影响大小。
曲线上的点,表示点所对应温度下的该物质的溶解度。
曲线越陡,该物质的溶解度受温度影响越大,如硝酸钾;
曲线比较平缓,该物质的溶解度受温度影响较小,如氯化钠。
溶解度受温度影响变化不大的物质可用蒸发结晶提纯。
曲线上面的点A:
是过饱和溶液,且有未溶解的物质。
曲线下面的点C:
是不饱和溶液。
硝酸钾
温度/℃
10
100
90
80
70
60
50
40
30
20
溶解度/g
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
0
A
C
曲线上的点B:
表示物质在某温度下的溶解度,溶液恰好饱和。
B
溶液状态的判断
对于溶解度受温度影响变化较大的物质,可采取冷却热饱和溶液的方法,使溶质从溶液中结晶析出,这种方法称为降温结晶。
硝酸钾溶液中混有一定量的氯化钠溶液,如何提纯硝酸钾呢?
(冷却热饱和溶液法)
【例1】如图为甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线。下列相关说法中正确的是( )
A.甲和乙两物质的饱和溶液温度从t3℃降至t2℃时,析出晶体质量甲>乙
B.将接近饱和的丙溶液变为饱和溶液,可以采用升高溶液温度的方法
C.甲中含少量乙时,采用蒸发溶剂的方法提纯甲
D.t1℃时,30 g丙物质加入到50 g水中形成溶液的质量为80 g
B
生活中常见到这样的现象,在夏天,打开汽水瓶盖时,汽水会自动喷出来。
原理:打开汽水瓶盖,汽水会自动喷出的原因是压强变小,气体在水中的溶解度变小。
指在压强为101 kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
条件 —— 一定温度和压强
标准 —— 1体积水
状态 —— 饱和溶液
单位 —— 气体体积
气体溶解度
气体溶解度四要素
影响气体物质溶解度的因素:温度和压强
气体溶解度一般随压强增大而增大
增大气体物质的溶解度的方法:____________________。
气体溶解度一般随温度升高而减小
降低温度、增大压强
【例1】夏季,鱼塘内常设置一些水泵,把水喷向空中,从化学角度分析,喷水的目的是( )
A.降低养殖池内水的温度 B.增大与空气的接触面积,便于氧气溶解
C.增加观赏性 D.便于太阳照射,杀灭水中的病菌
B
我国有许多盐碱湖,湖水中溶有大量的氯化钠和纯碱(碳酸钠)。那里的人们冬天捞碱,夏天晒盐。
氯化钠的溶解度受温度影响小,夏天时,温度高,水分蒸发后,氯化钠以晶体形式析出,得粗盐,这就是夏天晒盐。
碳酸钠的溶解度受温度影响大,夏天温度高,它以溶液的形式存在,冬天时,温度降低,它以晶体形式析出,沉于湖底,可打捞得到,这就是冬天捞碱。
1 .如图是KNO3和NH4Cl的溶解度曲线。下列说法正确的是( )
A.t1°C时,KNO3的溶解度大于NH4Cl
B.t2°C时,KNO3和NH4Cl的溶解度相等
C.t3°C时,两溶液中KNO3的质量分数一定大于NH4Cl
D.NH4Cl的溶解度受温度的影响大于KNO3
B
2. a、b、c三种固体物质的溶解度曲线如图所示,下列叙述正确的是( )
A.a物质的溶解度大于b物质的溶解度
B.t1 ℃时,a、c两种物质的溶解度相等
C.t2 ℃时,30 g a物质加入50 g水中得到80 g溶液
D.t2 ℃时,c物质的饱和溶液降温到t1 ℃时有晶体析出
B
3.如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
A.20 ℃时,100 g甲溶液中含甲物质的质量小于25 g
B.20 ℃时,等质量甲、乙饱和溶液中含溶质的质量相等
C.30 ℃时,甲物质的溶解度大于乙物质的溶解度
D.50 ℃时,将甲、乙两种物质的饱和溶液分别降温至20 ℃,析出晶体的质量甲大于乙
D
4.甲、乙、丙三种物质的溶解度曲线如图所示。
(1)t1℃时,甲、乙、丙三种物质的溶解度由大到小顺序为 ;
(2)t2℃时,乙物质的溶解度为 g;
(3)将t2℃时180 g甲的饱和溶液降温到t1℃,析出晶体的质量为 g;
(4)取等质量的甲、乙、丙三种物质,分别配制成t2℃时的恰好饱和溶液,所得三种溶液的质量由大到小顺序为 。
80
55
丙>甲=乙
乙>甲=丙
课题2 溶解度
第2课时
固体物质溶解度
概念
影响因素
表示方法
气体物质溶解度
概念
影响因素
同课章节目录
