人教版化学九下:11.1 生活中常见的盐(第1课时)课件(共24张PPT)
文档属性
| 名称 | 人教版化学九下:11.1 生活中常见的盐(第1课时)课件(共24张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 44.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 21:13:16 | ||
图片预览








文档简介
(共24张PPT)
第十一单元 盐 化肥
课题1 生活中常见的盐
第1课时
1
盐的概念
2
本节重点
氯化钠的构成及其主要用途
3
本节难点
粗盐初步提纯的操作方法
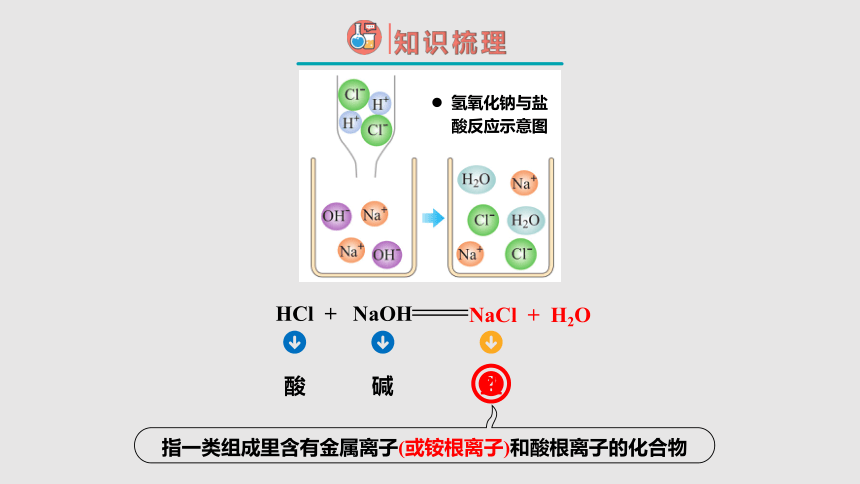
HCl + NaOH
NaCl + H2O
氢氧化钠与盐酸反应示意图
酸
碱
盐
指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物
日常生活中所说的盐,通常指食盐(主要成分是NaCl);而化学中的盐不仅仅指食盐,是一类物质。
“食盐是盐,盐就是食盐”这句话对吗
生活中主要成分属于盐类的物质
氯化钠
NaCl
碳酸钠
Na2CO3
碳酸氢钠
NaHCO3
碳酸钙
CaCO3
食盐与我们的生活密不可分,是重要的调味品。
氯化钠
红烧鱼
烤鸡
白灼菜心
排骨青菜面
氯化钠与人体健康
人体内所含的氯化钠大部分以离子形式存在于体液中。
人体每天需摄入的氯化钠的量大约为多少?过多食用会如何?
人体每天需摄入的氯化钠的量大约为3~5 g,过多食用会不利于人体健康。
钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用;
钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用;
氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。
氯化钠的用途
盐水选种
工业原料
腌制蔬菜
道路融雪
氯化钠注射液
氯化钠在自然界中的分布广泛
盐湖
盐井
盐矿
海水
精盐
粗盐
含泥沙、 MgCl2 、CaCl2等难溶性和可溶性杂质
氯化钠的制取
生活中使用的食盐
粗盐制取
海水
盐井水
盐湖水
初步提纯的精盐
溶解
沉淀
过滤
蒸发
结晶
煮
粗盐提纯
食盐制取流程
晾晒
粗盐
——粗盐中难溶性杂质的去除
实验用品
烧杯
漏斗
药匙
量筒
托盘天平
滤纸
玻璃棒
蒸发皿
坩埚钳
酒精灯
铁架台
火柴
实验探究
实验步骤
称取5.0 g粗盐,加入盛有10 mL水的烧杯中,边加边用玻璃棒搅拌,一直加到粗盐不再溶解为止。观察是否浑浊,并称量剩下的食盐。
溶解
称量
溶解
步骤一:
过滤
步骤二:
滤纸紧贴漏斗内壁。
滤纸边缘低于漏斗边缘;
液面低于滤纸边缘。
烧杯口紧靠玻璃棒;
玻璃棒斜靠三层滤纸处;
漏斗下端管口紧靠烧杯内壁。
一贴:
二低:
三靠:
操作要领
蒸发
步骤三:
当蒸发皿中出现较多的固体时,停止加热;利用余热使滤液蒸发。
把所得的澄清滤液倒入蒸发皿,并用酒精灯加热。
加热过程中,用玻璃棒不断搅拌,防止因局部温度过高,造成液滴飞溅
步骤四:
粗盐的产率= ×100%
精盐质量
溶解的粗盐质量
计算产率
称量
转移
用玻璃棒把固体转移到纸上,称量后,回收到指定的容器中。将提纯后的氯化钠与粗盐作比较,并计算精盐的产率。
回顾实验并思考:在整个提纯过程中,玻璃棒的作用有哪些?
加快溶解
引流
搅拌,防止局部过热
转移固体
溶解
过滤
蒸发
转移
实验完成后,产率偏低的原因有哪些?
溶解时搅拌不充分
01
转移固体不彻底或有洒落
03
蒸发时滤液或固体溅出
02
科普:亚硝酸盐中毒
亚硝酸盐类食物中毒又称肠原性青紫病、紫绀症、乌嘴病。
亚硝酸盐中毒是指由于食用硝酸盐或亚硝酸盐含量较高的腌制肉制品、泡菜及变质的蔬菜引起中毒,或者误将亚硝酸钠作为食盐食用而引起,也可见于饮用含有硝酸盐或亚硝酸盐苦井水、蒸锅水后,亚硝酸盐能使血液中正常携氧的低铁血红蛋白氧化成高铁血红蛋白,因而失去携氧能力而引起组织缺氧。亚硝酸盐是剧毒物质,成人摄入0.2一0.5克即可引起中毒,3克即可致死。
1.下列物质中属于盐的是( )
A.NaOH B.Na2O C.Na2SO4 D.Na
C
B
3.氯化钠是日常生活中最常见的一种盐,下列有关氯化钠的描述正确的是( )
A.氯化钠是重要的调味品,可以腌渍蔬菜、鱼、肉、蛋等
B.氯化钠是人体正常生理活动所必需的,所以摄入量越多越好
C.氯化钠可以用来配制农药波尔多液
D.通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到纯净的氯化钠
A
2.我国海水晒盐具有悠久的历史,所得“盐”的主要成分是( )
A.Na2SO4 B.NaCl C.CaCl2 D.Na2CO3
4.有关粗盐提纯的实验操作合理的是( )
A. 溶解时为了加快溶解速率,可以用玻璃棒研碎大颗粒粗盐
B. 过滤时为了节省过滤时间,可以将悬浊液直接倒入漏斗
C. 蒸发时为了防止物质溅出要不断搅拌,直至实验结束
D. 实验结束随即用坩埚钳将热的蒸发皿取下放在实验桌上
C
5.据报道,常州警方在凌家塘配送中心查获一起用工业盐亚硝酸钠(NaNO2)加工肉制品的案件。亚硝酸钠是一种( )
A.酸 B.碱 C.盐 D.氧化物
C
盐的定义
氯化钠及其用途
溶解
过滤
蒸发
计算产率
课题1
生活中常见的盐
第1课时
粗盐提纯
第十一单元 盐 化肥
课题1 生活中常见的盐
第1课时
1
盐的概念
2
本节重点
氯化钠的构成及其主要用途
3
本节难点
粗盐初步提纯的操作方法
HCl + NaOH
NaCl + H2O
氢氧化钠与盐酸反应示意图
酸
碱
盐
指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物
日常生活中所说的盐,通常指食盐(主要成分是NaCl);而化学中的盐不仅仅指食盐,是一类物质。
“食盐是盐,盐就是食盐”这句话对吗
生活中主要成分属于盐类的物质
氯化钠
NaCl
碳酸钠
Na2CO3
碳酸氢钠
NaHCO3
碳酸钙
CaCO3
食盐与我们的生活密不可分,是重要的调味品。
氯化钠
红烧鱼
烤鸡
白灼菜心
排骨青菜面
氯化钠与人体健康
人体内所含的氯化钠大部分以离子形式存在于体液中。
人体每天需摄入的氯化钠的量大约为多少?过多食用会如何?
人体每天需摄入的氯化钠的量大约为3~5 g,过多食用会不利于人体健康。
钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用;
钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用;
氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。
氯化钠的用途
盐水选种
工业原料
腌制蔬菜
道路融雪
氯化钠注射液
氯化钠在自然界中的分布广泛
盐湖
盐井
盐矿
海水
精盐
粗盐
含泥沙、 MgCl2 、CaCl2等难溶性和可溶性杂质
氯化钠的制取
生活中使用的食盐
粗盐制取
海水
盐井水
盐湖水
初步提纯的精盐
溶解
沉淀
过滤
蒸发
结晶
煮
粗盐提纯
食盐制取流程
晾晒
粗盐
——粗盐中难溶性杂质的去除
实验用品
烧杯
漏斗
药匙
量筒
托盘天平
滤纸
玻璃棒
蒸发皿
坩埚钳
酒精灯
铁架台
火柴
实验探究
实验步骤
称取5.0 g粗盐,加入盛有10 mL水的烧杯中,边加边用玻璃棒搅拌,一直加到粗盐不再溶解为止。观察是否浑浊,并称量剩下的食盐。
溶解
称量
溶解
步骤一:
过滤
步骤二:
滤纸紧贴漏斗内壁。
滤纸边缘低于漏斗边缘;
液面低于滤纸边缘。
烧杯口紧靠玻璃棒;
玻璃棒斜靠三层滤纸处;
漏斗下端管口紧靠烧杯内壁。
一贴:
二低:
三靠:
操作要领
蒸发
步骤三:
当蒸发皿中出现较多的固体时,停止加热;利用余热使滤液蒸发。
把所得的澄清滤液倒入蒸发皿,并用酒精灯加热。
加热过程中,用玻璃棒不断搅拌,防止因局部温度过高,造成液滴飞溅
步骤四:
粗盐的产率= ×100%
精盐质量
溶解的粗盐质量
计算产率
称量
转移
用玻璃棒把固体转移到纸上,称量后,回收到指定的容器中。将提纯后的氯化钠与粗盐作比较,并计算精盐的产率。
回顾实验并思考:在整个提纯过程中,玻璃棒的作用有哪些?
加快溶解
引流
搅拌,防止局部过热
转移固体
溶解
过滤
蒸发
转移
实验完成后,产率偏低的原因有哪些?
溶解时搅拌不充分
01
转移固体不彻底或有洒落
03
蒸发时滤液或固体溅出
02
科普:亚硝酸盐中毒
亚硝酸盐类食物中毒又称肠原性青紫病、紫绀症、乌嘴病。
亚硝酸盐中毒是指由于食用硝酸盐或亚硝酸盐含量较高的腌制肉制品、泡菜及变质的蔬菜引起中毒,或者误将亚硝酸钠作为食盐食用而引起,也可见于饮用含有硝酸盐或亚硝酸盐苦井水、蒸锅水后,亚硝酸盐能使血液中正常携氧的低铁血红蛋白氧化成高铁血红蛋白,因而失去携氧能力而引起组织缺氧。亚硝酸盐是剧毒物质,成人摄入0.2一0.5克即可引起中毒,3克即可致死。
1.下列物质中属于盐的是( )
A.NaOH B.Na2O C.Na2SO4 D.Na
C
B
3.氯化钠是日常生活中最常见的一种盐,下列有关氯化钠的描述正确的是( )
A.氯化钠是重要的调味品,可以腌渍蔬菜、鱼、肉、蛋等
B.氯化钠是人体正常生理活动所必需的,所以摄入量越多越好
C.氯化钠可以用来配制农药波尔多液
D.通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到纯净的氯化钠
A
2.我国海水晒盐具有悠久的历史,所得“盐”的主要成分是( )
A.Na2SO4 B.NaCl C.CaCl2 D.Na2CO3
4.有关粗盐提纯的实验操作合理的是( )
A. 溶解时为了加快溶解速率,可以用玻璃棒研碎大颗粒粗盐
B. 过滤时为了节省过滤时间,可以将悬浊液直接倒入漏斗
C. 蒸发时为了防止物质溅出要不断搅拌,直至实验结束
D. 实验结束随即用坩埚钳将热的蒸发皿取下放在实验桌上
C
5.据报道,常州警方在凌家塘配送中心查获一起用工业盐亚硝酸钠(NaNO2)加工肉制品的案件。亚硝酸钠是一种( )
A.酸 B.碱 C.盐 D.氧化物
C
盐的定义
氯化钠及其用途
溶解
过滤
蒸发
计算产率
课题1
生活中常见的盐
第1课时
粗盐提纯
同课章节目录
