第五章 第二节 第2课时 氨和铵盐 课件(共82张PPT)
文档属性
| 名称 | 第五章 第二节 第2课时 氨和铵盐 课件(共82张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 00:00:00 | ||
图片预览










文档简介
(共82张PPT)
DIERKESHI
氨的性质 / 铵盐的性质、 的检验 / 随堂演练 知识落实 / 课时对点练
氨和铵盐
第五章
第2课时
核心素养
发展目标
1.能从物质类别、氮元素价态的角度,认识氨、铵盐的性质与转化,促进“证据推理与模型认知”化学核心素养的发展。
2.设计实验,如氨的性质实验、制备实验,铵盐的性质实验及铵离子的检验等,实现氨的转化与生成,增强“科学探究”意识。
内容索引
随堂演练 知识落实
课时对点练
一、氨的性质
二、铵盐的性质、 的检验
氨的性质
一
1.物理性质
颜色 气味 状态 密度 溶解性 沸点
____ __________气味 气体 比空气 的___ _____溶于水(常温常压1∶700) 较低,易液化
无色
有刺激
性
小
极易
2.化学性质
(1)实验探究
实验装置 操作及现象 结论
①打开止水夹,并挤压滴管的胶头,使水进入烧瓶; ②烧杯中的溶液由玻璃管进入烧瓶,形成_____,烧瓶内液体呈___色 氨_____溶于水,其水溶液(俗称氨水)呈_____性
将分别蘸有浓盐酸和浓氨水的玻璃棒靠近,产生_____ 氨与氯化氢反应生成_________
喷泉
红
极易
弱碱
白烟
白色晶体
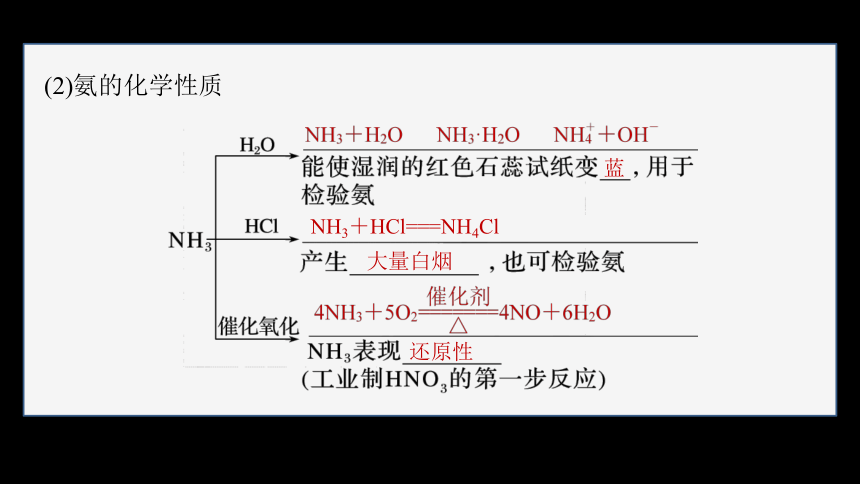
(2)氨的化学性质
蓝
NH3+HCl===NH4Cl
大量白烟
还原性
(3)氨水
氨水呈弱碱性,且不稳定,加热时易分解成NH3,NH3·H2O
_____________。
3.用途
(1)氨易_____,液氨常用作制冷剂。
(2)氨是氮肥工业和硝酸工业的重要原料。
NH3↑+H2O
液化
(1)液氨可用作制冷剂,是因为其汽化时吸收大量的热( )
(2)氨水呈碱性,是因为NH3溶于水发生反应:NH3+H2O +OH-
( )
(3)氨溶于水,溶液可以导电,因此NH3为电解质( )
(4)将蘸有浓氨水的玻璃棒靠近浓硫酸有白烟产生( )
(5)氨水与液氨一样都是混合物( )
(6)新制饱和氨水中含氮粒子物质的量浓度最大的是 ( )
×
正误判断
√
×
×
×
×
应用体验
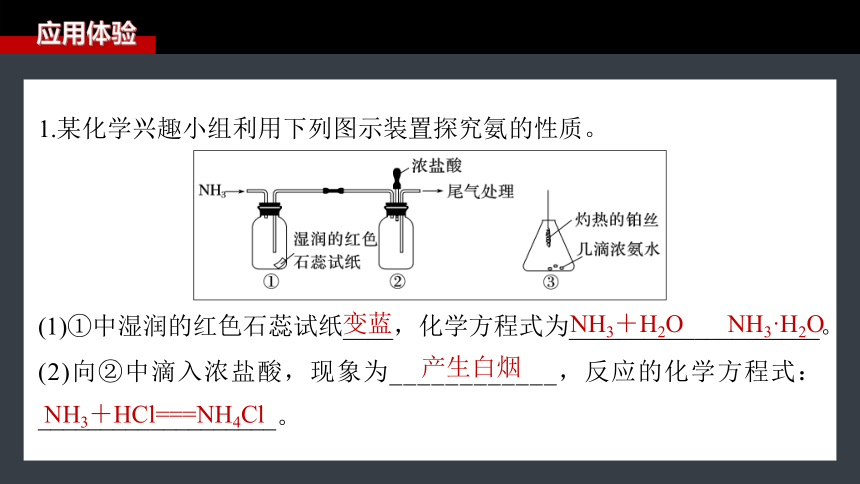
1.某化学兴趣小组利用下列图示装置探究氨的性质。
(1)①中湿润的红色石蕊试纸____,化学方程式为____________________。
(2)向②中滴入浓盐酸,现象为____________,反应的化学方程式:___________________。
变蓝
NH3+H2O NH3·H2O
产生白烟
NH3+HCl===NH4Cl
(3)将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催化氧
化的化学方程式:___________________________,该反应______(填
“吸热”或“放热”),锥形瓶中出现白烟,该物质的化学式为________。
放热
NH4NO3
NH3和O2反应能使铂丝保持红热,说明反应放热,生成的NO和O2再生成NO2,NO2又和H2O生成HNO3,HNO3遇到NH3生成NH4NO3小颗粒,故白烟成分为NH4NO3。
2.喷泉是一种常见的自然现象,其产生的原因是存在压强差。
(1)装置图1中的气体a可能为①氯气、②氢气、③氨、
④氯化氢、⑤二氧化碳。打开装置中的止水夹,挤压胶头滴管,若液体b为水时,能产生喷泉现象的气体a可能是_____(填序号,下同);若液体b为浓氢氧化钠溶液时,能产生喷泉现象的气体a可能是_______。
③④
①④⑤
氨和氯化氢极易溶于水;氯气、氯化氢、二氧化碳都可以与浓NaOH溶液反应,使圆底烧瓶内压强减小。
(2)如果只提供如图2的装置(气体为氨,液体为水),请说明引发喷泉的方法:________________________________
_______________________________。
图2则需先打开止水夹,再用热毛巾捂住圆底烧瓶,发现有气泡冒出后,移去热毛巾即可,烧瓶温度降低,会使少量水进入烧瓶,从而引发喷泉。
打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中冒出,移去热毛巾
(3)某同学用图1所示装置,在圆底烧瓶中盛放不同的气体
进行喷泉实验。
请帮助分析实验后圆底烧瓶中所得溶液的浓度(假设是在
标准状况下完成实验,且溶质不扩散)。
①若用HCl气体,则c(HCl)=_____________。
②若用NO2气体,则c(HNO3)=_____________。
归纳总结
喷泉实验
喷泉产生的原因是烧瓶内外形成压强差,由于烧瓶内气体的压强小于烧瓶外的压强,所以液体会被压入烧瓶内形成喷泉。
归纳总结
(1)如图甲(或乙)烧瓶内的气体极易溶于水(或易与溶液中的溶质发生化学反应),从而使烧瓶内压强迅速降低,在大气压作用下,烧杯中的液体迅速向上流动,从而形成喷泉。
(2)如图丙锥形瓶内发生化学
反应,产生气体,从而使锥
形瓶内压强迅速增大,促使
锥形瓶内液体迅速向上流动,
形成喷泉。
归纳总结
(3)常见能形成喷泉的物质组合
气体 HCl NH3 CO2、Cl2、SO2、H2S、NO2 NO2与O2
吸收剂 水或NaOH溶液 水或盐酸 NaOH溶液 水
返回
铵盐的性质、 的检验
二
1.铵盐
(1)概念:由铵根离子( )和酸根离子构成的化合物,如_________、_________、________等。铵盐是农业上常用的化肥。
(2)物理性质:绝大多数铵盐都是白色或无色晶体,且___溶于水。
(3)化学性质
①受热易分解
NH4Cl _____________(生成的NH3和HCl遇冷又结合生成NH4Cl);
(NH4)2SO4
NH4HCO3
NH4NO3
易
NH3↑+HCl↑
NH4HCO3 ____________________________。
②与碱反应
与碱溶液在不加热条件下反应: +OH-===_________;
与碱溶液在加热条件下反应: +OH- ____________。
如NH4Cl和Ca(OH)2在加热条件下反应的化学方程式为_______________
____________________________。
NH3↑+H2O+CO2↑
NH3·H2O
NH3↑+H2O
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
(1)实验探究
实验操作
[三支试管中分别盛有少量NH4Cl溶液、NH4NO3溶液和(NH4)2SO4溶液]
实验现象 三支试管中均有无色气体放出,湿润的红色石蕊试纸变____
实验原理 离子方程式: NH3↑+H2O
应用 检验 的存在和制取氨
蓝色
红色
石蕊试纸
变蓝
(1)铵盐都易溶于水,且都易分解( )
(2)铵盐都不稳定,受热分解都生成NH3( )
(3)向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶液中一定无 ( )
(4)NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl( )
(5)NH4HCO3与足量NaOH溶液共热时,发生反应的离子方程式为 +
OH- NH3↑+H2O( )
×
正误判断
√
×
×
×
应用体验
1.下列关于铵盐的叙述正确的是_______(填序号)。
①所有铵盐中,氮元素化合价都是-3价 ②绝大多数铵盐易溶于水 ③铵态氮肥不宜与碱性肥料混合施用 ④铵盐都是由离子构成的化合物 ⑤铵盐都能与碱反应,不能与酸反应 ⑥铵盐受热分解一定都会产生氨气
②③④
①硝酸铵中氮元素既有-3价又有+5价,错误;
②绝大多数铵盐易溶于水,正确;
③铵态氮肥中含有 ,能与OH-结合形成NH3·H2O,NH3·H2O受热分解产生氨并逸出,使铵态氮肥的肥效降低,因此不应与碱性肥料混合施用,正确;
④铵盐都是由铵根离子与酸根离子构成的,属于离子化合物,正确;
⑤弱酸的铵盐(如碳酸铵等)能与酸反应,错误;
⑥铵盐受热分解不一定生成氨气,如硝酸铵等,错误。
2.为检验一种氮肥的成分,某学习小组的同学进行了以下实验:
①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊;
②取少量该氮肥样品溶于水,并加入少量BaCl2溶液没有明显变化。
由此可知该氮肥的主要成分是__________。
NH4HCO3
返回
随堂演练 知识落实
1.下列关于氨水的叙述正确的是
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1 mol·L-1的氨水指在1 L溶液中含NH3、NH3·H2O、 物质的量之和
为1 mol
1
2
3
4
√
溶于水的氨大部分与水反应生成NH3·H2O,所以除水外物质的量浓度最大的粒子是NH3·H2O;NH3·H2O是一种弱碱,在水中发生部分电离使溶液呈碱性;氨水中共含有六种粒子,分别是H2O、NH3、NH3·H2O、 、OH-和少量的H+,是一种混合物,液氨是纯净物。
1
2
3
4
2.试管中盛有少量白色固体,可能是铵盐,检验的方法是
A.加水,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
C.加氢氧化钠溶液,加热,滴入酚酞溶液
D.加氢氧化钠溶液,加热,滴入石蕊溶液
√
1
2
3
4
铵盐和水混合不会产生氨,将湿润的红色石蕊试纸放在试管口无任何变化,不能检验,故A错误;
加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口,湿润的红色石蕊试纸会变蓝色,证明产生的气体是氨,证明该盐中含有铵根离子,这是检验铵盐的方法,故B正确;
氢氧化钠和氨水均呈碱性,均能使酚酞溶液变红色或使石蕊溶液变蓝色,故C、D错误。
1
2
3
4
3.(2022·沈阳高一期中)喷泉是一种常见的现象,其产生原因是存在压强差。下面是某同学设计的四个不同的喷泉装置,则下列说法不正确的是
A.若向图1烧瓶中充满HI(与HCl水溶性相似)气体,烧杯和胶头滴管中加入AgNO3溶
液,则挤压胶头滴管可以产生黄色喷泉
B.若向图2锥形瓶中加水,烧瓶中充满NH3,引发喷泉的操作是捂热上方的圆底烧瓶
C.向图3装置的水槽中加入冰块或慢慢滴入浓硫酸都可以形成喷泉
D.图4所示的装置,若要在该
装置中产生双喷现象,其操
作方法可以是关闭活塞c,
打开活塞a、b,再挤压胶头
滴管,当产生大量的白烟时,
再打开活塞c
1
2
3
4
√
HI极易溶于水,可使
烧瓶中压强减小,形
成喷泉,由于HI和硝
酸银反应生成黄色的
碘化银沉淀,因此可
以产生黄色喷泉,A项正确;
若向图2锥形瓶中加水,烧瓶中充满NH3,氨极易溶于水,捂热上方的圆底烧瓶可形成喷泉,B项正确;
向图3装置的水槽中加入冰块会降低温度,不会引发喷泉,C项错误;
1
2
3
4
关闭活塞c,打开活塞a、b,再挤压胶头滴管,可使盛氨的烧瓶中压强减小,氯化氢与氨反应产生白烟,盛氯化氢的烧瓶中压强也减小,此时打开活塞c,可看到双喷泉,D项正确。
1
2
3
4
4.物质A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B,用圆底烧瓶收集干燥的气体B。按如图所示组装仪器,打开
止水夹,挤压胶头滴管后,可以得到蓝色喷泉。向放出气
体B的溶液中加入稀硝酸酸化,再加入硝酸银溶液,产生
白色沉淀。
(1)A的化学式是_______。
由溶液变蓝可知溶液显碱性,B为NH3,由白色沉淀可知A中含有Cl-,所以A为NH4Cl。
1
2
3
4
NH4Cl
(2)可用于除去B中水分的干燥剂是____________________
_____________________________________。收集气体B的方法是_____________。
NH3为碱性气体,只能用碱石灰或生石灰、KOH固体等不与氨反应的干燥剂干燥;氨气的密度比空气小,应用向下排空气法收集。
1
2
3
4
碱石灰(或生石灰、
种不与氨反应的干燥剂)
向下排空气法
KOH固体等任一
(3)溶液显蓝色的原因是______________________(用化学用语表示)。
1
2
3
4
(4)取实验后烧瓶中的溶液加热,观察到的现象是____________________
_____________________。
氨水不稳定,在加热条件下NH3·H2O分解生成氨和水,碱性逐渐减弱,溶液由蓝色又变为紫色。
1
2
3
4
有刺激性气味气体产生,
溶液由蓝色又变为紫色
返回
课时对点练
题组一 氨的性质与喷泉实验
1.下列关于氨的叙述中,错误的是
A.液氨汽化时吸收热量,因此可用作制冷剂
B.氨极易溶于水,因此可用来做喷泉实验
C.氨极易溶于水,因此氨水比较稳定(不容易分解)
D.氨溶于水显弱碱性,因此可使酚酞溶液变为红色
NH3极易溶于水,部分NH3和水反应生成不稳定的NH3·H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
2.(2022·宁波高一下月考)合成氨大大提高了农作物的产量,同时也是制取硝酸、炸药等的原料。下列说法中正确的是
A.N2和H2在点燃或光照条件下可合成NH3
B.NH3和HNO3溶于水后都能导电,故二者都是电解质
C.NH3遇到浓硝酸会发生反应产生大量白烟
D.由NH3制HNO3的过程中,氮元素被还原
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
N2和H2合成氨的条件是高温、高压、催化剂,在点燃或光照条件下,N2和H2不发生反应,故A错误;
NH3溶于水,其水溶液虽然导电,但导电的离子不是NH3本身电离产生的,因此NH3是非电解质,HNO3属于电解质,故B错误;
浓硝酸易挥发,NH3与挥发的硝酸反应生成NH4NO3固体,即二者反应时产生大量的白烟,故C正确;
由氨制备硝酸的过程中N的化合价由-3→+5,化合价升高,被氧化,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
3.(2022·济南高一期末)喷泉实验装置如图所示。应用下列各组气体和溶液,能出现喷泉现象的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
气体 溶液
A Cl2 饱和氯化钠溶液
B NO 稀H2SO4
C CO2 饱和NaHCO3溶液
D NH3 稀盐酸
√
Cl2在饱和氯化钠溶液中溶解度不大,因此不能形成
压强差,所以不能形成喷泉,A项错误;
NO不溶于稀硫酸中,因此不能形成压强差,所以不
能形成喷泉,B项错误;
CO2与饱和NaHCO3溶液不反应,也不溶解,因此不
能形成喷泉,C项错误;
NH3与稀盐酸会发生反应生成NH4Cl,且氨也极易溶于水,能形成压强差,可以形成喷泉,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 铵盐的性质及 的检验
4.下列化合物既能与硫酸反应,又能与氢氧化钠反应的是
①NaHCO3 ②NaHSO4 ③(NH4)2CO3 ④NaNO3 ⑤NH4HCO3
A.只有① B.只有③
C.①②③ D.①③⑤
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
碳酸氢钠既能与硫酸反应生成二氧化碳,又能与氢氧化钠反应生成碳酸钠和水,故①正确;
硫酸氢钠只与氢氧化钠反应生成硫酸钠和水,故②错误;
碳酸铵、碳酸氢铵既能与硫酸反应生成二氧化碳,又能与氢氧化钠反应生成一水合氨或放出氨,故③、⑤正确;
硝酸钠与硫酸、氢氧化钠都不反应,故④错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
5.能把Na2SO4溶液、NH4NO3溶液、KCl溶液、(NH4)2SO4溶液这四种无色溶液区分开的一种试剂是(必要时可加热)
A.Ba(OH)2溶液 B.NaOH溶液
C.NaCl溶液 D.Ba(NO3)2溶液
Na2SO4溶液与Ba(OH)2溶液反应有白色沉淀产生,NH4NO3溶液、(NH4)2SO4溶液分别与Ba(OH)2溶液混合加热,前者有氨放出,后者既有氨放出,又产生白色沉淀,由此可鉴别出Na2SO4溶液、NH4NO3溶液和(NH4)2SO4溶液,则剩余的一种为KCl溶液,A项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
6.实验小组同学探究NH3与Cl2的反应,装置如图所示。常温常压下,将氨收集在薄膜保鲜袋(无弹性)中,氯气收集在反应管中,关闭K,按图连接好装置;将氨压入反应管,充分反应后打开K,下列说法错误的是
A.反应开始后,保鲜袋逐渐被吸入反应管
B.反应过程中,反应管中产生白烟
C.打开K后,水会倒吸入反应管
D.上述反应原理可用于检验输送氯气的管道是否泄漏
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
由上面分析可知,反应开始后,反应管内
气体压强减小,保鲜袋逐渐被吸入反应管,
故A正确;
反应过程中,反应管中生成NH4Cl固体,悬浮于气体中,从而产生白烟,故B正确;
利用上述反应原理,可将蘸有浓氨水的玻璃棒靠近输送氯气管道中怀疑漏气的部位,从而根据有无白烟产生,判断管道是否泄漏,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
7.(2022·盐城高一月考)“封管实验”具有简易、方便、节约、绿色等优点,下列关于如图三个“封管实验”(夹持装置未画出)的说法正确的是
A.加热时,①中上部汇集了NH4Cl固体
B.加热时,②中溶液变红,冷却后又变为无色
C.加热时,③中溶液红色褪去,冷却
后溶液变红,体现SO2的漂白性
D.三个“封管实验”中所发生的化学
反应都是可逆反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
A项,加热时,①中上部汇集了NH4Cl
固体,是由于氯化铵不稳定,受热易
分解,分解生成的氨和HCl遇冷重新
反应生成氯化铵,正确;
B项,加热时氨逸出,②中颜色变为无色,冷却后NH3溶解,②中为红色,错误;
C项,二氧化硫与有机色素化合生成无色物质而具有漂白性,受热又分解,恢复颜色,所以加热时,③中溶液变红,冷却后又变为无色,错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
D项,可逆反应应在同一条件下进行,题中实验分别在加热条件下和冷却后进行,不是可逆反应,错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
8.某同学进行如图所示实验:先在培养皿中央的NaOH固体上滴几滴浓氨水,立即用一个表面皿扣在上面。下列对实验现象所作的解释不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项 实验现象 解释
A 浓盐酸附近产生白烟 NH3与HCl反应生成NH4Cl固体
B 浓硫酸附近无白烟 NH3与浓硫酸不发生反应
C 湿润的红色石蕊试纸变蓝 NH3与水反应生成的NH3·H2O显碱性
D CuSO4溶液变浑浊 反应生成Cu(OH)2沉淀
√
NH3与挥发出来的HCl反应生成白色固
体氯化铵,现象为产生大量白烟,故A
正确;
浓硫酸附近无白烟,是因为浓硫酸难挥发,NH3与浓硫酸反应生成硫酸铵,故B错误;
氨气与水反应生成一水合氨,一水合氨电离产生OH-,溶液显碱性,所以湿润的红色石蕊试纸变蓝,故C正确;
NH3与硫酸铜溶液反应生成硫酸铵和氢氧化铜沉淀,现象为CuSO4溶液变浑浊,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
9.氨溶于水得到氨水,氯气溶于水得到氯水,下列关于新制氨水、氯水描述中正确的是
A.“两水”都是混合物,溶液中含有的粒子种类、数目不同
B.“两水”都能导电,因此NH3和Cl2都是电解质
C.氨水与氯化亚铁反应的离子方程式为2OH-+Fe2+===Fe(OH)2↓,新
制氯水与氯化亚铁反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-
D.“两水”长时间放置后都会因为相同的原理变质
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A选项,氨水中含有的分子有NH3、H2O、NH3·H2O,离子有 、H+、OH-,氯水中的分子有Cl2、H2O、HClO,离子有Cl-、ClO-、H+和OH-;
B选项,电解质和非电解质是对化合物的分类,且电解质溶于水时本身发生电离;
C选项,NH3·H2O书写离子方程式时应写化学式,不能写成离子形式;
D选项,新制氯水长时间放置,因HClO分解最终变成稀盐酸(化学变化),新制的氨水长时间放置,因NH3挥发而变质(物理变化),二者变质的原理不同。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.氢化铵(NH4H)与氯化铵结构相似,又已知NH4H与水反应有氢气产生。下列叙述中不正确的是
A.NH4H是由 和H-构成的
B.NH4H固体投入少量水中,加热有两种气体产生
C.NH4H中的H-半径比锂离子半径大
D.NH4H溶于水后,形成的溶液显酸性
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
NH4H是离子化合物,由 和H-构成,A项正确;
NH4H固体投入少量水中加热生成NH3和H2,B项正确;
H-与锂离子的电子层结构相同,核电荷数越大,离子半径越小,所以H-半径比锂离子半径大,C项正确;
NH4H溶于水后与水发生反应生成NH3·H2O使溶液显碱性,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.某溶液中只可能含有Na+、 Cl-中的几种。取200 mL该溶液,分为等体积的两份分别做以下实验:
(1)第一份加入足量的烧碱溶液并加热,产生的气体在标准状况下的体积为224 mL。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,过滤,得固体2.33 g。
(3)在(2)的滤液中滴入AgNO3溶液,产生白色沉淀,加稀硝酸,沉淀不溶解。
下列说法正确的是
A.该溶液中可能含有Na+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
(3)在(2)的滤液中滴入AgNO3溶液,产生白色沉淀,加稀硝酸,沉淀不溶解,白色沉淀是氯化银,但由于前面加入了盐酸和氯化钡溶液,所以不能确定溶液中是否含有氯离子。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.某同学仿照“喷泉”实验的原理,在实验室做了一个“喷烟”实验,如图所示。他在甲、乙两个烧瓶中分别充入X、Y两种无色气体,胶头滴管中装有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是HCl、NH3、Cl2、O2、CO2、H2、NO七种气体中的两种,则下列判断中,
正确的是
A.X是NH3,Y是HCl B.X是Cl2,Y是H2
C.X是CO2,Y是O2 D.X是NO,Y是O2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
X必须是一种易溶于NaOH溶液的气体,才能使甲烧瓶内气压减小,导致乙中的气体进入甲,可排除D项;
乙中的气体进入甲后反应产生白烟,因Cl2与H2在光照条件下能反应但无白烟产生,CO2与O2不反应,可排除B、C项。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.实验室模拟氨催化氧化法制硝酸的装置如图所示(无水CaCl2可用于吸收氨),下列说法错误的是
A.装置①②⑤依次盛装碱石灰、
无水CaCl2、NaOH溶液
B.装置③中气体呈红棕色
C.装置④中溶液可使紫色石蕊溶液变红,说明有HNO3生成
D.通空气的主要作用是鼓出氨气,空气可用N2代替
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
空气通入浓氨水后,氨挥发出来,
空气和氨的混合气体经过干燥后进
入装有催化剂并加热的硬质玻璃管
中,发生催化氧化反应:4NH3+
5O2 4NO+6H2O,生成的气体经过无水CaCl2,除去氨和水蒸气,
在装置③中NO与空气中的氧气反应生成NO2,装置④中的水可以吸收二氧化氮并生成HNO3,尾气中的NO、NO2在装置⑤中被吸收,防止污染,因此⑤中可以选用氢氧化钠溶液。根据上述分析,装置①②⑤依次盛装碱石灰、无水CaCl2、NaOH溶液,A项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
装置③中NO被氧化生成NO2,气
体呈红棕色,B项正确;
装置④中发生反应:3NO2+H2O
===2HNO3+NO,溶液显酸性,
可使紫色石蕊溶液变红,C项正确;
通空气的主要作用是鼓出氨并提供氧气,空气不能用N2代替,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.NH3与NO2是常见的氮的化合物,研究它们的综合利用有重要意义。
(1)NO2产生的环境问题有_____________________(填一种)。
(2)热电厂通常用NH3消除燃煤烟气中的NO2,写出该反应的化学方程式:__________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
光化学烟雾(或酸雨等)
8NH3+6NO2===7N2+12H2O
(3)氨与氯化氢气体混合的现象是__________,该反应可用于__________
_____________________________。
(4)若将少量氨与过量氯气混合,则生成一种酸性气体和另一种化合物A,
A中所有原子均满足8电子稳定结构,试写出A的电子式:____________,
A在一定条件下能与水反应,可产生用于饮用水消毒的物质和氨。试写出此反应的化学方程式:___________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
产生白烟
气体验满或
检验管道中氨或氯化氢是否泄漏
NCl3+3H2O===NH3+3HClO
15.(2022·辽宁康平县高级中学高一期中)如图是工业合成氨以及氨氧化制硝酸的流程示意图:
某实验室模拟合成氨和氨催化氧化的部分装置如图:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
已知:实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从图中选择制取气体的合适装置:氮气___、氢气___(填“a”“b”或“c”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
a
b
实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,属于固液加热制取气体,制取氮气选用装置a;
锌和稀硫酸反应制取氢气,属于固液不加热制取气体,制取氢气选用装置b。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)氮气和氢气通过甲装置,甲装置的作用有___________、___________
_____________________(写两条)。
氮气和氢气通过盛有浓硫酸的甲装置,甲装置的作用是将氮气、氢气混合,干燥气体,根据气泡流速控制氢气和氮气的流速。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
将气体混合
控制氢气和氮气的流速
干燥气体、
(3)写出合成塔中发生反应的化学方程式:________________________,
用某氨合成器模拟合成塔,出来经冷却的气体连续通入乙装置的水中吸收氨,却没有发生倒吸,猜测可能的原因是________________________
_________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
混合气体中含有大量难溶
于水的氮气、氢气
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,此时乙装置相当于氧化炉,写出氨氧化反应的化学
方程式:__________________________,一段时间后,铂丝仍保持红热
的原因是____________________________,锥形瓶中还可观察到的现象是_________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
氨的氧化反应是一个放热反应
有红棕色气体产生
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(5)反应结束后锥形瓶内的溶液中含有的离子为H+、OH-、_____、_____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
返回
本课结束
第五章
DIERKESHI
氨的性质 / 铵盐的性质、 的检验 / 随堂演练 知识落实 / 课时对点练
氨和铵盐
第五章
第2课时
核心素养
发展目标
1.能从物质类别、氮元素价态的角度,认识氨、铵盐的性质与转化,促进“证据推理与模型认知”化学核心素养的发展。
2.设计实验,如氨的性质实验、制备实验,铵盐的性质实验及铵离子的检验等,实现氨的转化与生成,增强“科学探究”意识。
内容索引
随堂演练 知识落实
课时对点练
一、氨的性质
二、铵盐的性质、 的检验
氨的性质
一
1.物理性质
颜色 气味 状态 密度 溶解性 沸点
____ __________气味 气体 比空气 的___ _____溶于水(常温常压1∶700) 较低,易液化
无色
有刺激
性
小
极易
2.化学性质
(1)实验探究
实验装置 操作及现象 结论
①打开止水夹,并挤压滴管的胶头,使水进入烧瓶; ②烧杯中的溶液由玻璃管进入烧瓶,形成_____,烧瓶内液体呈___色 氨_____溶于水,其水溶液(俗称氨水)呈_____性
将分别蘸有浓盐酸和浓氨水的玻璃棒靠近,产生_____ 氨与氯化氢反应生成_________
喷泉
红
极易
弱碱
白烟
白色晶体
(2)氨的化学性质
蓝
NH3+HCl===NH4Cl
大量白烟
还原性
(3)氨水
氨水呈弱碱性,且不稳定,加热时易分解成NH3,NH3·H2O
_____________。
3.用途
(1)氨易_____,液氨常用作制冷剂。
(2)氨是氮肥工业和硝酸工业的重要原料。
NH3↑+H2O
液化
(1)液氨可用作制冷剂,是因为其汽化时吸收大量的热( )
(2)氨水呈碱性,是因为NH3溶于水发生反应:NH3+H2O +OH-
( )
(3)氨溶于水,溶液可以导电,因此NH3为电解质( )
(4)将蘸有浓氨水的玻璃棒靠近浓硫酸有白烟产生( )
(5)氨水与液氨一样都是混合物( )
(6)新制饱和氨水中含氮粒子物质的量浓度最大的是 ( )
×
正误判断
√
×
×
×
×
应用体验
1.某化学兴趣小组利用下列图示装置探究氨的性质。
(1)①中湿润的红色石蕊试纸____,化学方程式为____________________。
(2)向②中滴入浓盐酸,现象为____________,反应的化学方程式:___________________。
变蓝
NH3+H2O NH3·H2O
产生白烟
NH3+HCl===NH4Cl
(3)将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催化氧
化的化学方程式:___________________________,该反应______(填
“吸热”或“放热”),锥形瓶中出现白烟,该物质的化学式为________。
放热
NH4NO3
NH3和O2反应能使铂丝保持红热,说明反应放热,生成的NO和O2再生成NO2,NO2又和H2O生成HNO3,HNO3遇到NH3生成NH4NO3小颗粒,故白烟成分为NH4NO3。
2.喷泉是一种常见的自然现象,其产生的原因是存在压强差。
(1)装置图1中的气体a可能为①氯气、②氢气、③氨、
④氯化氢、⑤二氧化碳。打开装置中的止水夹,挤压胶头滴管,若液体b为水时,能产生喷泉现象的气体a可能是_____(填序号,下同);若液体b为浓氢氧化钠溶液时,能产生喷泉现象的气体a可能是_______。
③④
①④⑤
氨和氯化氢极易溶于水;氯气、氯化氢、二氧化碳都可以与浓NaOH溶液反应,使圆底烧瓶内压强减小。
(2)如果只提供如图2的装置(气体为氨,液体为水),请说明引发喷泉的方法:________________________________
_______________________________。
图2则需先打开止水夹,再用热毛巾捂住圆底烧瓶,发现有气泡冒出后,移去热毛巾即可,烧瓶温度降低,会使少量水进入烧瓶,从而引发喷泉。
打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中冒出,移去热毛巾
(3)某同学用图1所示装置,在圆底烧瓶中盛放不同的气体
进行喷泉实验。
请帮助分析实验后圆底烧瓶中所得溶液的浓度(假设是在
标准状况下完成实验,且溶质不扩散)。
①若用HCl气体,则c(HCl)=_____________。
②若用NO2气体,则c(HNO3)=_____________。
归纳总结
喷泉实验
喷泉产生的原因是烧瓶内外形成压强差,由于烧瓶内气体的压强小于烧瓶外的压强,所以液体会被压入烧瓶内形成喷泉。
归纳总结
(1)如图甲(或乙)烧瓶内的气体极易溶于水(或易与溶液中的溶质发生化学反应),从而使烧瓶内压强迅速降低,在大气压作用下,烧杯中的液体迅速向上流动,从而形成喷泉。
(2)如图丙锥形瓶内发生化学
反应,产生气体,从而使锥
形瓶内压强迅速增大,促使
锥形瓶内液体迅速向上流动,
形成喷泉。
归纳总结
(3)常见能形成喷泉的物质组合
气体 HCl NH3 CO2、Cl2、SO2、H2S、NO2 NO2与O2
吸收剂 水或NaOH溶液 水或盐酸 NaOH溶液 水
返回
铵盐的性质、 的检验
二
1.铵盐
(1)概念:由铵根离子( )和酸根离子构成的化合物,如_________、_________、________等。铵盐是农业上常用的化肥。
(2)物理性质:绝大多数铵盐都是白色或无色晶体,且___溶于水。
(3)化学性质
①受热易分解
NH4Cl _____________(生成的NH3和HCl遇冷又结合生成NH4Cl);
(NH4)2SO4
NH4HCO3
NH4NO3
易
NH3↑+HCl↑
NH4HCO3 ____________________________。
②与碱反应
与碱溶液在不加热条件下反应: +OH-===_________;
与碱溶液在加热条件下反应: +OH- ____________。
如NH4Cl和Ca(OH)2在加热条件下反应的化学方程式为_______________
____________________________。
NH3↑+H2O+CO2↑
NH3·H2O
NH3↑+H2O
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
(1)实验探究
实验操作
[三支试管中分别盛有少量NH4Cl溶液、NH4NO3溶液和(NH4)2SO4溶液]
实验现象 三支试管中均有无色气体放出,湿润的红色石蕊试纸变____
实验原理 离子方程式: NH3↑+H2O
应用 检验 的存在和制取氨
蓝色
红色
石蕊试纸
变蓝
(1)铵盐都易溶于水,且都易分解( )
(2)铵盐都不稳定,受热分解都生成NH3( )
(3)向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶液中一定无 ( )
(4)NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl( )
(5)NH4HCO3与足量NaOH溶液共热时,发生反应的离子方程式为 +
OH- NH3↑+H2O( )
×
正误判断
√
×
×
×
应用体验
1.下列关于铵盐的叙述正确的是_______(填序号)。
①所有铵盐中,氮元素化合价都是-3价 ②绝大多数铵盐易溶于水 ③铵态氮肥不宜与碱性肥料混合施用 ④铵盐都是由离子构成的化合物 ⑤铵盐都能与碱反应,不能与酸反应 ⑥铵盐受热分解一定都会产生氨气
②③④
①硝酸铵中氮元素既有-3价又有+5价,错误;
②绝大多数铵盐易溶于水,正确;
③铵态氮肥中含有 ,能与OH-结合形成NH3·H2O,NH3·H2O受热分解产生氨并逸出,使铵态氮肥的肥效降低,因此不应与碱性肥料混合施用,正确;
④铵盐都是由铵根离子与酸根离子构成的,属于离子化合物,正确;
⑤弱酸的铵盐(如碳酸铵等)能与酸反应,错误;
⑥铵盐受热分解不一定生成氨气,如硝酸铵等,错误。
2.为检验一种氮肥的成分,某学习小组的同学进行了以下实验:
①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊;
②取少量该氮肥样品溶于水,并加入少量BaCl2溶液没有明显变化。
由此可知该氮肥的主要成分是__________。
NH4HCO3
返回
随堂演练 知识落实
1.下列关于氨水的叙述正确的是
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1 mol·L-1的氨水指在1 L溶液中含NH3、NH3·H2O、 物质的量之和
为1 mol
1
2
3
4
√
溶于水的氨大部分与水反应生成NH3·H2O,所以除水外物质的量浓度最大的粒子是NH3·H2O;NH3·H2O是一种弱碱,在水中发生部分电离使溶液呈碱性;氨水中共含有六种粒子,分别是H2O、NH3、NH3·H2O、 、OH-和少量的H+,是一种混合物,液氨是纯净物。
1
2
3
4
2.试管中盛有少量白色固体,可能是铵盐,检验的方法是
A.加水,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
C.加氢氧化钠溶液,加热,滴入酚酞溶液
D.加氢氧化钠溶液,加热,滴入石蕊溶液
√
1
2
3
4
铵盐和水混合不会产生氨,将湿润的红色石蕊试纸放在试管口无任何变化,不能检验,故A错误;
加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口,湿润的红色石蕊试纸会变蓝色,证明产生的气体是氨,证明该盐中含有铵根离子,这是检验铵盐的方法,故B正确;
氢氧化钠和氨水均呈碱性,均能使酚酞溶液变红色或使石蕊溶液变蓝色,故C、D错误。
1
2
3
4
3.(2022·沈阳高一期中)喷泉是一种常见的现象,其产生原因是存在压强差。下面是某同学设计的四个不同的喷泉装置,则下列说法不正确的是
A.若向图1烧瓶中充满HI(与HCl水溶性相似)气体,烧杯和胶头滴管中加入AgNO3溶
液,则挤压胶头滴管可以产生黄色喷泉
B.若向图2锥形瓶中加水,烧瓶中充满NH3,引发喷泉的操作是捂热上方的圆底烧瓶
C.向图3装置的水槽中加入冰块或慢慢滴入浓硫酸都可以形成喷泉
D.图4所示的装置,若要在该
装置中产生双喷现象,其操
作方法可以是关闭活塞c,
打开活塞a、b,再挤压胶头
滴管,当产生大量的白烟时,
再打开活塞c
1
2
3
4
√
HI极易溶于水,可使
烧瓶中压强减小,形
成喷泉,由于HI和硝
酸银反应生成黄色的
碘化银沉淀,因此可
以产生黄色喷泉,A项正确;
若向图2锥形瓶中加水,烧瓶中充满NH3,氨极易溶于水,捂热上方的圆底烧瓶可形成喷泉,B项正确;
向图3装置的水槽中加入冰块会降低温度,不会引发喷泉,C项错误;
1
2
3
4
关闭活塞c,打开活塞a、b,再挤压胶头滴管,可使盛氨的烧瓶中压强减小,氯化氢与氨反应产生白烟,盛氯化氢的烧瓶中压强也减小,此时打开活塞c,可看到双喷泉,D项正确。
1
2
3
4
4.物质A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B,用圆底烧瓶收集干燥的气体B。按如图所示组装仪器,打开
止水夹,挤压胶头滴管后,可以得到蓝色喷泉。向放出气
体B的溶液中加入稀硝酸酸化,再加入硝酸银溶液,产生
白色沉淀。
(1)A的化学式是_______。
由溶液变蓝可知溶液显碱性,B为NH3,由白色沉淀可知A中含有Cl-,所以A为NH4Cl。
1
2
3
4
NH4Cl
(2)可用于除去B中水分的干燥剂是____________________
_____________________________________。收集气体B的方法是_____________。
NH3为碱性气体,只能用碱石灰或生石灰、KOH固体等不与氨反应的干燥剂干燥;氨气的密度比空气小,应用向下排空气法收集。
1
2
3
4
碱石灰(或生石灰、
种不与氨反应的干燥剂)
向下排空气法
KOH固体等任一
(3)溶液显蓝色的原因是______________________(用化学用语表示)。
1
2
3
4
(4)取实验后烧瓶中的溶液加热,观察到的现象是____________________
_____________________。
氨水不稳定,在加热条件下NH3·H2O分解生成氨和水,碱性逐渐减弱,溶液由蓝色又变为紫色。
1
2
3
4
有刺激性气味气体产生,
溶液由蓝色又变为紫色
返回
课时对点练
题组一 氨的性质与喷泉实验
1.下列关于氨的叙述中,错误的是
A.液氨汽化时吸收热量,因此可用作制冷剂
B.氨极易溶于水,因此可用来做喷泉实验
C.氨极易溶于水,因此氨水比较稳定(不容易分解)
D.氨溶于水显弱碱性,因此可使酚酞溶液变为红色
NH3极易溶于水,部分NH3和水反应生成不稳定的NH3·H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
2.(2022·宁波高一下月考)合成氨大大提高了农作物的产量,同时也是制取硝酸、炸药等的原料。下列说法中正确的是
A.N2和H2在点燃或光照条件下可合成NH3
B.NH3和HNO3溶于水后都能导电,故二者都是电解质
C.NH3遇到浓硝酸会发生反应产生大量白烟
D.由NH3制HNO3的过程中,氮元素被还原
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
N2和H2合成氨的条件是高温、高压、催化剂,在点燃或光照条件下,N2和H2不发生反应,故A错误;
NH3溶于水,其水溶液虽然导电,但导电的离子不是NH3本身电离产生的,因此NH3是非电解质,HNO3属于电解质,故B错误;
浓硝酸易挥发,NH3与挥发的硝酸反应生成NH4NO3固体,即二者反应时产生大量的白烟,故C正确;
由氨制备硝酸的过程中N的化合价由-3→+5,化合价升高,被氧化,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
3.(2022·济南高一期末)喷泉实验装置如图所示。应用下列各组气体和溶液,能出现喷泉现象的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
气体 溶液
A Cl2 饱和氯化钠溶液
B NO 稀H2SO4
C CO2 饱和NaHCO3溶液
D NH3 稀盐酸
√
Cl2在饱和氯化钠溶液中溶解度不大,因此不能形成
压强差,所以不能形成喷泉,A项错误;
NO不溶于稀硫酸中,因此不能形成压强差,所以不
能形成喷泉,B项错误;
CO2与饱和NaHCO3溶液不反应,也不溶解,因此不
能形成喷泉,C项错误;
NH3与稀盐酸会发生反应生成NH4Cl,且氨也极易溶于水,能形成压强差,可以形成喷泉,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 铵盐的性质及 的检验
4.下列化合物既能与硫酸反应,又能与氢氧化钠反应的是
①NaHCO3 ②NaHSO4 ③(NH4)2CO3 ④NaNO3 ⑤NH4HCO3
A.只有① B.只有③
C.①②③ D.①③⑤
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
碳酸氢钠既能与硫酸反应生成二氧化碳,又能与氢氧化钠反应生成碳酸钠和水,故①正确;
硫酸氢钠只与氢氧化钠反应生成硫酸钠和水,故②错误;
碳酸铵、碳酸氢铵既能与硫酸反应生成二氧化碳,又能与氢氧化钠反应生成一水合氨或放出氨,故③、⑤正确;
硝酸钠与硫酸、氢氧化钠都不反应,故④错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
5.能把Na2SO4溶液、NH4NO3溶液、KCl溶液、(NH4)2SO4溶液这四种无色溶液区分开的一种试剂是(必要时可加热)
A.Ba(OH)2溶液 B.NaOH溶液
C.NaCl溶液 D.Ba(NO3)2溶液
Na2SO4溶液与Ba(OH)2溶液反应有白色沉淀产生,NH4NO3溶液、(NH4)2SO4溶液分别与Ba(OH)2溶液混合加热,前者有氨放出,后者既有氨放出,又产生白色沉淀,由此可鉴别出Na2SO4溶液、NH4NO3溶液和(NH4)2SO4溶液,则剩余的一种为KCl溶液,A项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
6.实验小组同学探究NH3与Cl2的反应,装置如图所示。常温常压下,将氨收集在薄膜保鲜袋(无弹性)中,氯气收集在反应管中,关闭K,按图连接好装置;将氨压入反应管,充分反应后打开K,下列说法错误的是
A.反应开始后,保鲜袋逐渐被吸入反应管
B.反应过程中,反应管中产生白烟
C.打开K后,水会倒吸入反应管
D.上述反应原理可用于检验输送氯气的管道是否泄漏
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
由上面分析可知,反应开始后,反应管内
气体压强减小,保鲜袋逐渐被吸入反应管,
故A正确;
反应过程中,反应管中生成NH4Cl固体,悬浮于气体中,从而产生白烟,故B正确;
利用上述反应原理,可将蘸有浓氨水的玻璃棒靠近输送氯气管道中怀疑漏气的部位,从而根据有无白烟产生,判断管道是否泄漏,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
7.(2022·盐城高一月考)“封管实验”具有简易、方便、节约、绿色等优点,下列关于如图三个“封管实验”(夹持装置未画出)的说法正确的是
A.加热时,①中上部汇集了NH4Cl固体
B.加热时,②中溶液变红,冷却后又变为无色
C.加热时,③中溶液红色褪去,冷却
后溶液变红,体现SO2的漂白性
D.三个“封管实验”中所发生的化学
反应都是可逆反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
A项,加热时,①中上部汇集了NH4Cl
固体,是由于氯化铵不稳定,受热易
分解,分解生成的氨和HCl遇冷重新
反应生成氯化铵,正确;
B项,加热时氨逸出,②中颜色变为无色,冷却后NH3溶解,②中为红色,错误;
C项,二氧化硫与有机色素化合生成无色物质而具有漂白性,受热又分解,恢复颜色,所以加热时,③中溶液变红,冷却后又变为无色,错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
D项,可逆反应应在同一条件下进行,题中实验分别在加热条件下和冷却后进行,不是可逆反应,错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
8.某同学进行如图所示实验:先在培养皿中央的NaOH固体上滴几滴浓氨水,立即用一个表面皿扣在上面。下列对实验现象所作的解释不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项 实验现象 解释
A 浓盐酸附近产生白烟 NH3与HCl反应生成NH4Cl固体
B 浓硫酸附近无白烟 NH3与浓硫酸不发生反应
C 湿润的红色石蕊试纸变蓝 NH3与水反应生成的NH3·H2O显碱性
D CuSO4溶液变浑浊 反应生成Cu(OH)2沉淀
√
NH3与挥发出来的HCl反应生成白色固
体氯化铵,现象为产生大量白烟,故A
正确;
浓硫酸附近无白烟,是因为浓硫酸难挥发,NH3与浓硫酸反应生成硫酸铵,故B错误;
氨气与水反应生成一水合氨,一水合氨电离产生OH-,溶液显碱性,所以湿润的红色石蕊试纸变蓝,故C正确;
NH3与硫酸铜溶液反应生成硫酸铵和氢氧化铜沉淀,现象为CuSO4溶液变浑浊,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
9.氨溶于水得到氨水,氯气溶于水得到氯水,下列关于新制氨水、氯水描述中正确的是
A.“两水”都是混合物,溶液中含有的粒子种类、数目不同
B.“两水”都能导电,因此NH3和Cl2都是电解质
C.氨水与氯化亚铁反应的离子方程式为2OH-+Fe2+===Fe(OH)2↓,新
制氯水与氯化亚铁反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-
D.“两水”长时间放置后都会因为相同的原理变质
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A选项,氨水中含有的分子有NH3、H2O、NH3·H2O,离子有 、H+、OH-,氯水中的分子有Cl2、H2O、HClO,离子有Cl-、ClO-、H+和OH-;
B选项,电解质和非电解质是对化合物的分类,且电解质溶于水时本身发生电离;
C选项,NH3·H2O书写离子方程式时应写化学式,不能写成离子形式;
D选项,新制氯水长时间放置,因HClO分解最终变成稀盐酸(化学变化),新制的氨水长时间放置,因NH3挥发而变质(物理变化),二者变质的原理不同。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.氢化铵(NH4H)与氯化铵结构相似,又已知NH4H与水反应有氢气产生。下列叙述中不正确的是
A.NH4H是由 和H-构成的
B.NH4H固体投入少量水中,加热有两种气体产生
C.NH4H中的H-半径比锂离子半径大
D.NH4H溶于水后,形成的溶液显酸性
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
NH4H是离子化合物,由 和H-构成,A项正确;
NH4H固体投入少量水中加热生成NH3和H2,B项正确;
H-与锂离子的电子层结构相同,核电荷数越大,离子半径越小,所以H-半径比锂离子半径大,C项正确;
NH4H溶于水后与水发生反应生成NH3·H2O使溶液显碱性,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.某溶液中只可能含有Na+、 Cl-中的几种。取200 mL该溶液,分为等体积的两份分别做以下实验:
(1)第一份加入足量的烧碱溶液并加热,产生的气体在标准状况下的体积为224 mL。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,过滤,得固体2.33 g。
(3)在(2)的滤液中滴入AgNO3溶液,产生白色沉淀,加稀硝酸,沉淀不溶解。
下列说法正确的是
A.该溶液中可能含有Na+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
(3)在(2)的滤液中滴入AgNO3溶液,产生白色沉淀,加稀硝酸,沉淀不溶解,白色沉淀是氯化银,但由于前面加入了盐酸和氯化钡溶液,所以不能确定溶液中是否含有氯离子。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.某同学仿照“喷泉”实验的原理,在实验室做了一个“喷烟”实验,如图所示。他在甲、乙两个烧瓶中分别充入X、Y两种无色气体,胶头滴管中装有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是HCl、NH3、Cl2、O2、CO2、H2、NO七种气体中的两种,则下列判断中,
正确的是
A.X是NH3,Y是HCl B.X是Cl2,Y是H2
C.X是CO2,Y是O2 D.X是NO,Y是O2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
X必须是一种易溶于NaOH溶液的气体,才能使甲烧瓶内气压减小,导致乙中的气体进入甲,可排除D项;
乙中的气体进入甲后反应产生白烟,因Cl2与H2在光照条件下能反应但无白烟产生,CO2与O2不反应,可排除B、C项。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.实验室模拟氨催化氧化法制硝酸的装置如图所示(无水CaCl2可用于吸收氨),下列说法错误的是
A.装置①②⑤依次盛装碱石灰、
无水CaCl2、NaOH溶液
B.装置③中气体呈红棕色
C.装置④中溶液可使紫色石蕊溶液变红,说明有HNO3生成
D.通空气的主要作用是鼓出氨气,空气可用N2代替
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
空气通入浓氨水后,氨挥发出来,
空气和氨的混合气体经过干燥后进
入装有催化剂并加热的硬质玻璃管
中,发生催化氧化反应:4NH3+
5O2 4NO+6H2O,生成的气体经过无水CaCl2,除去氨和水蒸气,
在装置③中NO与空气中的氧气反应生成NO2,装置④中的水可以吸收二氧化氮并生成HNO3,尾气中的NO、NO2在装置⑤中被吸收,防止污染,因此⑤中可以选用氢氧化钠溶液。根据上述分析,装置①②⑤依次盛装碱石灰、无水CaCl2、NaOH溶液,A项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
装置③中NO被氧化生成NO2,气
体呈红棕色,B项正确;
装置④中发生反应:3NO2+H2O
===2HNO3+NO,溶液显酸性,
可使紫色石蕊溶液变红,C项正确;
通空气的主要作用是鼓出氨并提供氧气,空气不能用N2代替,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.NH3与NO2是常见的氮的化合物,研究它们的综合利用有重要意义。
(1)NO2产生的环境问题有_____________________(填一种)。
(2)热电厂通常用NH3消除燃煤烟气中的NO2,写出该反应的化学方程式:__________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
光化学烟雾(或酸雨等)
8NH3+6NO2===7N2+12H2O
(3)氨与氯化氢气体混合的现象是__________,该反应可用于__________
_____________________________。
(4)若将少量氨与过量氯气混合,则生成一种酸性气体和另一种化合物A,
A中所有原子均满足8电子稳定结构,试写出A的电子式:____________,
A在一定条件下能与水反应,可产生用于饮用水消毒的物质和氨。试写出此反应的化学方程式:___________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
产生白烟
气体验满或
检验管道中氨或氯化氢是否泄漏
NCl3+3H2O===NH3+3HClO
15.(2022·辽宁康平县高级中学高一期中)如图是工业合成氨以及氨氧化制硝酸的流程示意图:
某实验室模拟合成氨和氨催化氧化的部分装置如图:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
已知:实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从图中选择制取气体的合适装置:氮气___、氢气___(填“a”“b”或“c”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
a
b
实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,属于固液加热制取气体,制取氮气选用装置a;
锌和稀硫酸反应制取氢气,属于固液不加热制取气体,制取氢气选用装置b。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)氮气和氢气通过甲装置,甲装置的作用有___________、___________
_____________________(写两条)。
氮气和氢气通过盛有浓硫酸的甲装置,甲装置的作用是将氮气、氢气混合,干燥气体,根据气泡流速控制氢气和氮气的流速。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
将气体混合
控制氢气和氮气的流速
干燥气体、
(3)写出合成塔中发生反应的化学方程式:________________________,
用某氨合成器模拟合成塔,出来经冷却的气体连续通入乙装置的水中吸收氨,却没有发生倒吸,猜测可能的原因是________________________
_________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
混合气体中含有大量难溶
于水的氮气、氢气
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,此时乙装置相当于氧化炉,写出氨氧化反应的化学
方程式:__________________________,一段时间后,铂丝仍保持红热
的原因是____________________________,锥形瓶中还可观察到的现象是_________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
氨的氧化反应是一个放热反应
有红棕色气体产生
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(5)反应结束后锥形瓶内的溶液中含有的离子为H+、OH-、_____、_____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
返回
本课结束
第五章
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
