第五章 化工生产中的重要非金属元素 实验活动5 不同价态含硫物质的转化 课件(共21张PPT)
文档属性
| 名称 | 第五章 化工生产中的重要非金属元素 实验活动5 不同价态含硫物质的转化 课件(共21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 444.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 00:00:00 | ||
图片预览





文档简介
(共21张PPT)
实验活动5 不同价态含硫物质的转化
第五章
[实验目的]
1.通过实验加深对硫及其化合物性质的认识。
2.应用氧化还原反应的原理实现不同价态含硫物质的转化。
[实验步骤]
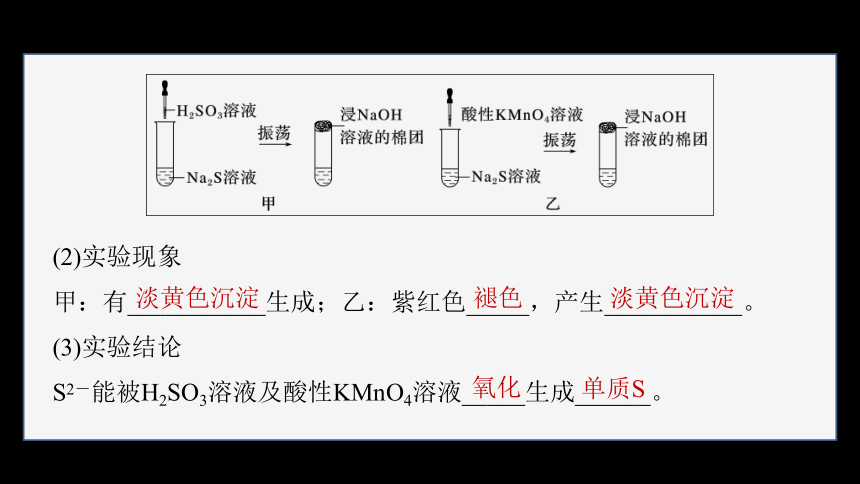
1.硫化钠转化为单质硫
(1)实验操作
(2)实验现象
甲:有___________生成;乙:紫红色_____,产生___________。
(3)实验结论
S2-能被H2SO3溶液及酸性KMnO4溶液_____生成______。
淡黄色沉淀
褪色
淡黄色沉淀
氧化
单质S
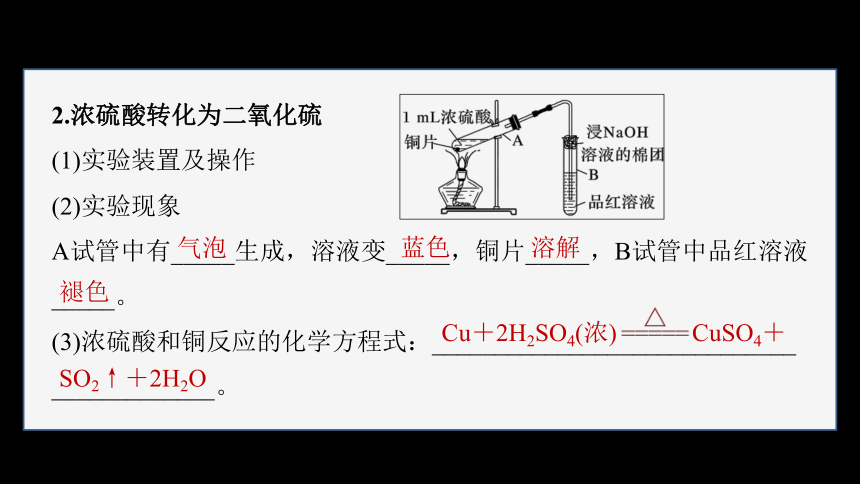
2.浓硫酸转化为二氧化硫
(1)实验装置及操作
(2)实验现象
A试管中有_____生成,溶液变_____,铜片_____,B试管中品红溶液_____。
(3)浓硫酸和铜反应的化学方程式:_____________________________
_____________。
气泡
蓝色
溶解
褪色
Cu+2H2SO4(浓) CuSO4+
SO2↑+2H2O
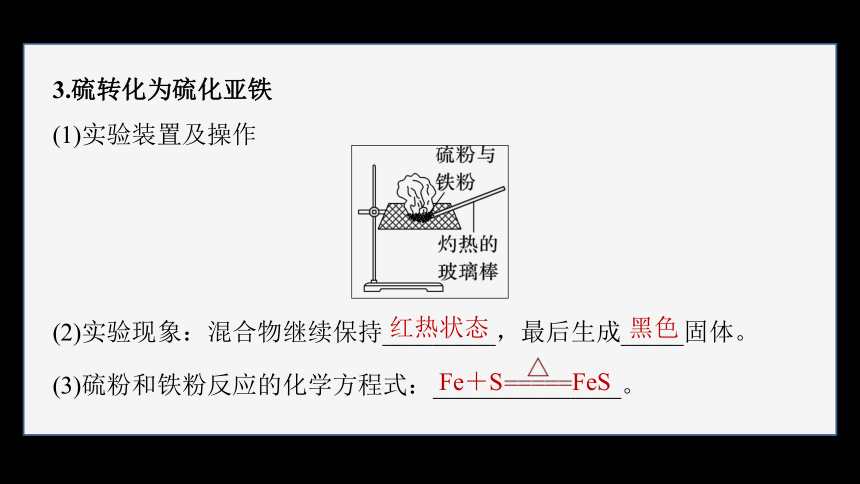
3.硫转化为硫化亚铁
(1)实验装置及操作
(2)实验现象:混合物继续保持_________,最后生成_____固体。
(3)硫粉和铁粉反应的化学方程式:_______________。
红热状态
黑色
Fe+S FeS
[问题讨论]
1.在上述实验中,含硫物质中硫元素的价态发生了怎样的变化?
提示
转化前的含硫物质 转化后的含硫物质 价态变化
Na2S S -2→0
H2SO3 S +4→0
H2SO4 SO2 +6→+4
S FeS 0→-2
2.实验1中用浸NaOH溶液的棉团塞住试管口的作用是什么?
提示 吸收实验过程中可能产生的有毒气体硫化氢和二氧化硫。
3.铁粉与硫粉在空气中混合燃烧时,可能发生哪些反应?
1
2
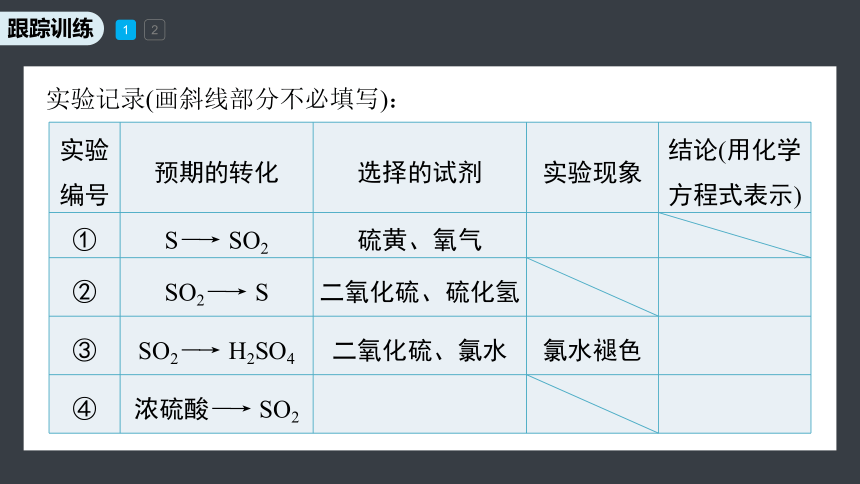
1.(2022·成都高一检测)某化学小组欲探究不同价态硫元素间的转化,请回答下列问题:
(1)请帮他们完成以下实验报告:
实验目的:探究三种价态(0、+4、+6)硫元素间的相互转化。
选用试剂:硫黄、浓硫酸、二氧化硫、氯水、硫化氢、铜片、氧气。
1
2
实验编号 预期的转化 选择的试剂 实验现象 结论(用化学方程式表示)
① S―→ SO2 硫黄、氧气
② SO2―→ S 二氧化硫、硫化氢
③ SO2―→ H2SO4 二氧化硫、氯水 氯水褪色
④ 浓硫酸―→ SO2
实验记录(画斜线部分不必填写):
1
2
答案 如表所示
① 蓝紫色火焰
② SO2+2H2S===3S+2H2O
③ SO2+Cl2+2H2O===H2SO4+2HCl
④ 铜片、浓硫酸 Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
1
2
问题讨论:从三种价态(0、+4、+6)硫元素间的相互转化还可得到规律:当硫元素处于最低价时只有_____性,处于最高价时只有_____性,处于中间价时既有____________性,又有____________性。
还原
氧化
氧化(或还原)
还原(或氧化)
1
2
①硫黄在氧气中燃烧,产生蓝紫色火焰;
②SO2具有弱氧化性,可氧化H2S中-2价的硫元素,SO2+2H2S===3S+2H2O;
③SO2具有较强还原性,可被Cl2氧化:SO2+Cl2+2H2O===H2SO4+2HCl;
④浓硫酸具有强氧化性,可被Cu还原而生成SO2。
1
2
(2)根据以上规律判断,下列物质中既有氧化性,又有还原性的有____(填字母)。
A.Cl2 B.Na C.Na+ D.Cl- E.SO2
AE
Cl2中氯元素为0价,处于中间价态;SO2中硫元素为+4价,处于中间价态,因而Cl2和SO2既有氧化性,又有还原性。
1
2
2.(2022·兰州一中高一检测)亚硫酸钠(Na2SO3)是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究 Na2SO3 的性质,进行了如下实验。
[性质预测]
(1)Na2SO3 中硫元素的化合价是____,属于 S 元素的中间价态,既具有氧化性,又具有还原性。
+4
Na2SO3中氧元素为-2价,钠元素为+1价,故硫元素的化合价是+4。
1
2
[实验验证]
实验序号 实验试剂X 实验现象
ⅰ 酸性KMnO4溶液、稀硫酸 紫红色褪去,变为无色
ⅱ Na2S 溶液、稀硫酸
资料:酸性条件下,KMnO4 被还原为无色的 Mn2+。
1
2
[分析解释]
(2)实验ⅰ中,反应的离子方程式是_______________________________
_____________。
2Mn2++3H2O
1
2
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是________
____________________________________________________。
加入
Na2S溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊
向Na2SO3溶液中加入Na2S溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊,生成S,说明Na2S在酸性条件下被氧化。
1
2
[继续探究]
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设a:酸性溶液中的 具有氧化性,可产生S;
假设b:空气中存在O2,在酸性条件下,由于______________________
_______(用离子方程式表示),可产生S;
假设c:酸性溶液中的 具有氧化性,可产生S。
4H++2S2-+O2===2S↓
+2H2O
空气中存在O2,在酸性条件下,反应的离子方程式为4H++2S2-+O2===2S↓+2H2O。
1
2
②设计实验ⅲ证实了假设a和b不是产生S的主要原因。
实验ⅲ:向Na2S溶液中加入_______(填试剂名称),产生有臭鸡蛋气味的气体,溶液未变浑浊。
稀硫酸
1
2
(5)结合实验ⅱ和ⅲ,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:______________________________。
本课结束
第五章
实验活动5 不同价态含硫物质的转化
第五章
[实验目的]
1.通过实验加深对硫及其化合物性质的认识。
2.应用氧化还原反应的原理实现不同价态含硫物质的转化。
[实验步骤]
1.硫化钠转化为单质硫
(1)实验操作
(2)实验现象
甲:有___________生成;乙:紫红色_____,产生___________。
(3)实验结论
S2-能被H2SO3溶液及酸性KMnO4溶液_____生成______。
淡黄色沉淀
褪色
淡黄色沉淀
氧化
单质S
2.浓硫酸转化为二氧化硫
(1)实验装置及操作
(2)实验现象
A试管中有_____生成,溶液变_____,铜片_____,B试管中品红溶液_____。
(3)浓硫酸和铜反应的化学方程式:_____________________________
_____________。
气泡
蓝色
溶解
褪色
Cu+2H2SO4(浓) CuSO4+
SO2↑+2H2O
3.硫转化为硫化亚铁
(1)实验装置及操作
(2)实验现象:混合物继续保持_________,最后生成_____固体。
(3)硫粉和铁粉反应的化学方程式:_______________。
红热状态
黑色
Fe+S FeS
[问题讨论]
1.在上述实验中,含硫物质中硫元素的价态发生了怎样的变化?
提示
转化前的含硫物质 转化后的含硫物质 价态变化
Na2S S -2→0
H2SO3 S +4→0
H2SO4 SO2 +6→+4
S FeS 0→-2
2.实验1中用浸NaOH溶液的棉团塞住试管口的作用是什么?
提示 吸收实验过程中可能产生的有毒气体硫化氢和二氧化硫。
3.铁粉与硫粉在空气中混合燃烧时,可能发生哪些反应?
1
2
1.(2022·成都高一检测)某化学小组欲探究不同价态硫元素间的转化,请回答下列问题:
(1)请帮他们完成以下实验报告:
实验目的:探究三种价态(0、+4、+6)硫元素间的相互转化。
选用试剂:硫黄、浓硫酸、二氧化硫、氯水、硫化氢、铜片、氧气。
1
2
实验编号 预期的转化 选择的试剂 实验现象 结论(用化学方程式表示)
① S―→ SO2 硫黄、氧气
② SO2―→ S 二氧化硫、硫化氢
③ SO2―→ H2SO4 二氧化硫、氯水 氯水褪色
④ 浓硫酸―→ SO2
实验记录(画斜线部分不必填写):
1
2
答案 如表所示
① 蓝紫色火焰
② SO2+2H2S===3S+2H2O
③ SO2+Cl2+2H2O===H2SO4+2HCl
④ 铜片、浓硫酸 Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
1
2
问题讨论:从三种价态(0、+4、+6)硫元素间的相互转化还可得到规律:当硫元素处于最低价时只有_____性,处于最高价时只有_____性,处于中间价时既有____________性,又有____________性。
还原
氧化
氧化(或还原)
还原(或氧化)
1
2
①硫黄在氧气中燃烧,产生蓝紫色火焰;
②SO2具有弱氧化性,可氧化H2S中-2价的硫元素,SO2+2H2S===3S+2H2O;
③SO2具有较强还原性,可被Cl2氧化:SO2+Cl2+2H2O===H2SO4+2HCl;
④浓硫酸具有强氧化性,可被Cu还原而生成SO2。
1
2
(2)根据以上规律判断,下列物质中既有氧化性,又有还原性的有____(填字母)。
A.Cl2 B.Na C.Na+ D.Cl- E.SO2
AE
Cl2中氯元素为0价,处于中间价态;SO2中硫元素为+4价,处于中间价态,因而Cl2和SO2既有氧化性,又有还原性。
1
2
2.(2022·兰州一中高一检测)亚硫酸钠(Na2SO3)是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究 Na2SO3 的性质,进行了如下实验。
[性质预测]
(1)Na2SO3 中硫元素的化合价是____,属于 S 元素的中间价态,既具有氧化性,又具有还原性。
+4
Na2SO3中氧元素为-2价,钠元素为+1价,故硫元素的化合价是+4。
1
2
[实验验证]
实验序号 实验试剂X 实验现象
ⅰ 酸性KMnO4溶液、稀硫酸 紫红色褪去,变为无色
ⅱ Na2S 溶液、稀硫酸
资料:酸性条件下,KMnO4 被还原为无色的 Mn2+。
1
2
[分析解释]
(2)实验ⅰ中,反应的离子方程式是_______________________________
_____________。
2Mn2++3H2O
1
2
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是________
____________________________________________________。
加入
Na2S溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊
向Na2SO3溶液中加入Na2S溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊,生成S,说明Na2S在酸性条件下被氧化。
1
2
[继续探究]
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设a:酸性溶液中的 具有氧化性,可产生S;
假设b:空气中存在O2,在酸性条件下,由于______________________
_______(用离子方程式表示),可产生S;
假设c:酸性溶液中的 具有氧化性,可产生S。
4H++2S2-+O2===2S↓
+2H2O
空气中存在O2,在酸性条件下,反应的离子方程式为4H++2S2-+O2===2S↓+2H2O。
1
2
②设计实验ⅲ证实了假设a和b不是产生S的主要原因。
实验ⅲ:向Na2S溶液中加入_______(填试剂名称),产生有臭鸡蛋气味的气体,溶液未变浑浊。
稀硫酸
1
2
(5)结合实验ⅱ和ⅲ,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:______________________________。
本课结束
第五章
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
