第五章 化工生产中的重要非金属元素 微专题二 硝酸与金属反应的相关计算 课件(共25张PPT)
文档属性
| 名称 | 第五章 化工生产中的重要非金属元素 微专题二 硝酸与金属反应的相关计算 课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 568.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 17:13:18 | ||
图片预览








文档简介
(共25张PPT)
微专题二
WEIZHUANTIER
硝酸与金属反应的相关计算
第五章
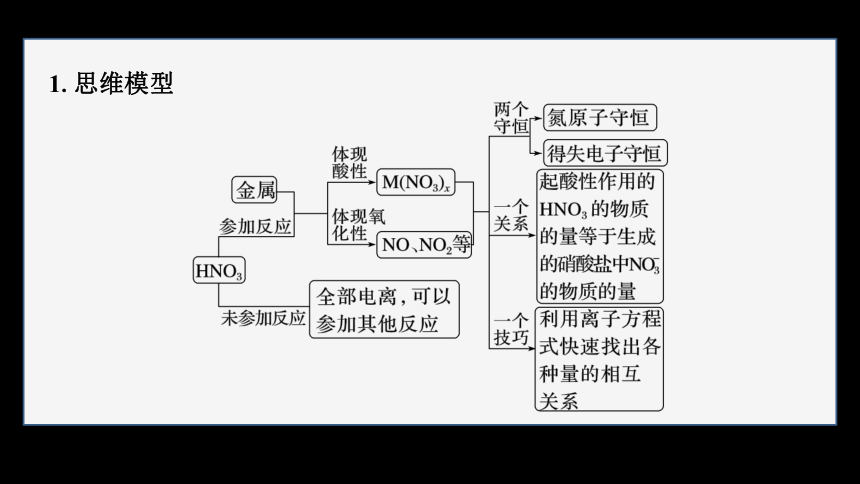
1.思维模型
2.计算方法(以Cu与硝酸反应为例)
(1)原子守恒法:反应前所有的N元素只存在于HNO3中,反应后含N元素的物质有HNO3的还原产物(假设有NO2、NO)和Cu(NO3)2,则有n(HNO3)消耗=n(NO2)+n(NO)+2n[Cu(NO3)2]。
(2)得失电子守恒法:反应中失去电子的是参加反应的Cu,Cu-2e-―→ Cu2+;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),
+e-―→ NO2、 +3e-―→ NO。根据得失电子守恒,则有2n(Cu)
=n(NO2)+3n(NO)。若将生成的氮的氧化物气体与一定量的氧气共同通入水中,氮的氧化物完全生成硝酸,由于开始反应物为硝酸,中间生成了氮的氧化物,但最终又变回了硝酸,所以相当于铜失的电子最终由氧气得到,则有2n(Cu)=n(O2)。
3.常见的两种计算
(1)硝酸与铜反应
浓硝酸与足量的铜反应,开始浓硝酸被还原为NO2,随着反应的进行,浓硝酸变稀,稀硝酸被还原为NO,向反应后的溶液中加稀硫酸,
又被还原为NO。
(2)稀硝酸与铁反应
Fe(少量)+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O;
3Fe(过量)+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O。
1
2
3
4
5
6
1.(2022·吉林省实验中学高一期中)a mol FeS与b mol FeO投入到V L c mol·
L-1硝酸中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63 g ②(a+b)×189 g
A.①④ B.②③ C.①③ D.②④
√
1
2
3
4
5
6
1
2
3
4
5
6
2.将14 g铜银合金与足量的硝酸反应,放出的气体与标准状况下体积为1.12 L的O2混合后再通入水中,恰好全部吸收,则合金中铜的质量为
A.4.8 g B.3.2 g C.6.4 g D.10.8 g
√
1
2
3
4
5
6
3.(2022·长春实验中学高一检测)将3.84 g Cu和一定量的浓HNO3反应,当Cu反应完全时,共收集到气体2.24 L NO2和NO(标准状况,不考虑NO2转化为N2O4),则反应中消耗HNO3的物质的量为
A.0.1 mol B.0.24 mol
C.0.16 mol D.0.22 mol
√
1
2
3
4
5
6
1
2
3
4
5
6
4.(2022·河南信阳高中高一检测)某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g铜(已知硝酸只被还原为NO气体)。向另一份
中逐渐加入铁粉,产生气体的量随铁粉
质量增加的变化如图所示。下列分析或
结果不正确的是
A.原混合酸中H2SO4物质的量为0.4 mol
B.AB段发生的离子反应为Fe+2Fe3+===3Fe2+
C.混合酸中HNO3物质的量浓度为2 mol·L-1
D.第二份溶液中最终溶质为FeSO4
√
1
2
3
4
5
6
1
2
3
4
5
6
AB段发生的离子反应为Fe+2Fe3+===3Fe2+,故B项正确;
1
2
3
4
5
6
硝酸根离子全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根离子,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故D项正确。
1
2
3
4
5
6
5.某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L-1和0.1 mol·L-1,向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中Cu2+的物质的量浓度(忽略体积变化)为
A.0.15 mol·L-1 B.0.225 mol·L-1
C.0.35 mol·L-1 D.0.45 mol·L-1
√
1
2
3
4
5
6
Cu与稀硝酸发生反应:
3Cu +8H+ + ===3Cu2++2NO↑+4H2O
3 8 2
0.03 mol 0.06 mol 0.04 mol
1
2
3
4
5
6
H+量不足,应根据H+的物质的量来计算。
1
2
3
4
5
6
6.将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生标准状况下的一氧化氮和二氧化氮混合气体共11.2 L。请回答下列问题:
(1)产生一氧化氮的体积为______L(标准状况下)。
5.824
1
2
3
4
该过程发生两个反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。设生成的NO和NO2的物质的量分别为x、y,则x+y=0.5 mol,1.5x+0.5y=0.51 mol,解得x=0.26 mol,y=0.24 mol,故标准状况下V(NO)=0.26 mol×22.4 L·mol-1=5.824 L。
5
6
1
2
3
4
5
6
(2)待反应结束后,向溶液中加入V mL a mol·L-1氢氧化钠溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸的浓度为
______________mol·L-1(不必化简)。
1
2
3
4
在反应过程中,HNO3一部分表现酸性,另一部分表现氧化性。由溶液中的Cu2+恰好全部转化为沉淀,则表现酸性的HNO3的物质的量为n(HNO3)=n(NaOH),表现氧化性的HNO3的物质量为n(HNO3)=n(NO)+n(NO2),故原硝酸中HNO3的物质的量n(HNO3)=n(NaOH)+n(NO)+
n(NO2)=(aV×10-3+0.5)mol,则c(HNO3)= mol·L-1。
5
6
1
2
3
4
5
6
(3)欲使铜与硝酸反应生成的气体在氢氧化钠溶液中全部转化为硝酸钠,至少需要氧气_____mol。
通入氧气的目的是将0.26 mol NO和0.24 mol NO2全部转化为HNO3。根据得失电子守恒:4n(O2)=3n(NO)+n(NO2)=3×0.26 mol+0.24 mol=1.02 mol,则n(O2)=0.255 mol。
0.255
第五章
本课结束
微专题二
WEIZHUANTIER
硝酸与金属反应的相关计算
第五章
1.思维模型
2.计算方法(以Cu与硝酸反应为例)
(1)原子守恒法:反应前所有的N元素只存在于HNO3中,反应后含N元素的物质有HNO3的还原产物(假设有NO2、NO)和Cu(NO3)2,则有n(HNO3)消耗=n(NO2)+n(NO)+2n[Cu(NO3)2]。
(2)得失电子守恒法:反应中失去电子的是参加反应的Cu,Cu-2e-―→ Cu2+;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),
+e-―→ NO2、 +3e-―→ NO。根据得失电子守恒,则有2n(Cu)
=n(NO2)+3n(NO)。若将生成的氮的氧化物气体与一定量的氧气共同通入水中,氮的氧化物完全生成硝酸,由于开始反应物为硝酸,中间生成了氮的氧化物,但最终又变回了硝酸,所以相当于铜失的电子最终由氧气得到,则有2n(Cu)=n(O2)。
3.常见的两种计算
(1)硝酸与铜反应
浓硝酸与足量的铜反应,开始浓硝酸被还原为NO2,随着反应的进行,浓硝酸变稀,稀硝酸被还原为NO,向反应后的溶液中加稀硫酸,
又被还原为NO。
(2)稀硝酸与铁反应
Fe(少量)+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O;
3Fe(过量)+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O。
1
2
3
4
5
6
1.(2022·吉林省实验中学高一期中)a mol FeS与b mol FeO投入到V L c mol·
L-1硝酸中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63 g ②(a+b)×189 g
A.①④ B.②③ C.①③ D.②④
√
1
2
3
4
5
6
1
2
3
4
5
6
2.将14 g铜银合金与足量的硝酸反应,放出的气体与标准状况下体积为1.12 L的O2混合后再通入水中,恰好全部吸收,则合金中铜的质量为
A.4.8 g B.3.2 g C.6.4 g D.10.8 g
√
1
2
3
4
5
6
3.(2022·长春实验中学高一检测)将3.84 g Cu和一定量的浓HNO3反应,当Cu反应完全时,共收集到气体2.24 L NO2和NO(标准状况,不考虑NO2转化为N2O4),则反应中消耗HNO3的物质的量为
A.0.1 mol B.0.24 mol
C.0.16 mol D.0.22 mol
√
1
2
3
4
5
6
1
2
3
4
5
6
4.(2022·河南信阳高中高一检测)某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g铜(已知硝酸只被还原为NO气体)。向另一份
中逐渐加入铁粉,产生气体的量随铁粉
质量增加的变化如图所示。下列分析或
结果不正确的是
A.原混合酸中H2SO4物质的量为0.4 mol
B.AB段发生的离子反应为Fe+2Fe3+===3Fe2+
C.混合酸中HNO3物质的量浓度为2 mol·L-1
D.第二份溶液中最终溶质为FeSO4
√
1
2
3
4
5
6
1
2
3
4
5
6
AB段发生的离子反应为Fe+2Fe3+===3Fe2+,故B项正确;
1
2
3
4
5
6
硝酸根离子全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根离子,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故D项正确。
1
2
3
4
5
6
5.某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L-1和0.1 mol·L-1,向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中Cu2+的物质的量浓度(忽略体积变化)为
A.0.15 mol·L-1 B.0.225 mol·L-1
C.0.35 mol·L-1 D.0.45 mol·L-1
√
1
2
3
4
5
6
Cu与稀硝酸发生反应:
3Cu +8H+ + ===3Cu2++2NO↑+4H2O
3 8 2
0.03 mol 0.06 mol 0.04 mol
1
2
3
4
5
6
H+量不足,应根据H+的物质的量来计算。
1
2
3
4
5
6
6.将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生标准状况下的一氧化氮和二氧化氮混合气体共11.2 L。请回答下列问题:
(1)产生一氧化氮的体积为______L(标准状况下)。
5.824
1
2
3
4
该过程发生两个反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。设生成的NO和NO2的物质的量分别为x、y,则x+y=0.5 mol,1.5x+0.5y=0.51 mol,解得x=0.26 mol,y=0.24 mol,故标准状况下V(NO)=0.26 mol×22.4 L·mol-1=5.824 L。
5
6
1
2
3
4
5
6
(2)待反应结束后,向溶液中加入V mL a mol·L-1氢氧化钠溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸的浓度为
______________mol·L-1(不必化简)。
1
2
3
4
在反应过程中,HNO3一部分表现酸性,另一部分表现氧化性。由溶液中的Cu2+恰好全部转化为沉淀,则表现酸性的HNO3的物质的量为n(HNO3)=n(NaOH),表现氧化性的HNO3的物质量为n(HNO3)=n(NO)+n(NO2),故原硝酸中HNO3的物质的量n(HNO3)=n(NaOH)+n(NO)+
n(NO2)=(aV×10-3+0.5)mol,则c(HNO3)= mol·L-1。
5
6
1
2
3
4
5
6
(3)欲使铜与硝酸反应生成的气体在氢氧化钠溶液中全部转化为硝酸钠,至少需要氧气_____mol。
通入氧气的目的是将0.26 mol NO和0.24 mol NO2全部转化为HNO3。根据得失电子守恒:4n(O2)=3n(NO)+n(NO2)=3×0.26 mol+0.24 mol=1.02 mol,则n(O2)=0.255 mol。
0.255
第五章
本课结束
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
