第五章 化工生产中的重要非金属元素 章末整合 重点突破 课件(共40张PPT)
文档属性
| 名称 | 第五章 化工生产中的重要非金属元素 章末整合 重点突破 课件(共40张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 17:39:57 | ||
图片预览








文档简介
(共40张PPT)
体系构建 理清脉络 / 重点突破 素养提升
章末整合 重点突破
第五章
内容索引
体系构建 理清脉络
重点突破 素养提升
体系构建 理清脉络
硫及其化合物
单质
氧化物
酸
与金属(Fe、Cu) FeS、Cu2S
与非金属
加热,与H2反应生成H2S
点燃,与O2反应生成SO2
二氧
化硫
具有酸性氧化物的通性
还原性:能使氯水、酸性高锰酸钾溶液褪色
氧化性:与H2S反应生成硫单质
漂白性:具有可逆性
三氧化硫
具有酸性氧化物的通性
稀硫酸
具有酸的通性
浓硫酸
吸水性:干燥剂,使胆矾晶体变白
脱水性:蔗糖炭化
强氧化性:在加热条件下能氧化铜、碳等反应
1.硫及其化合物
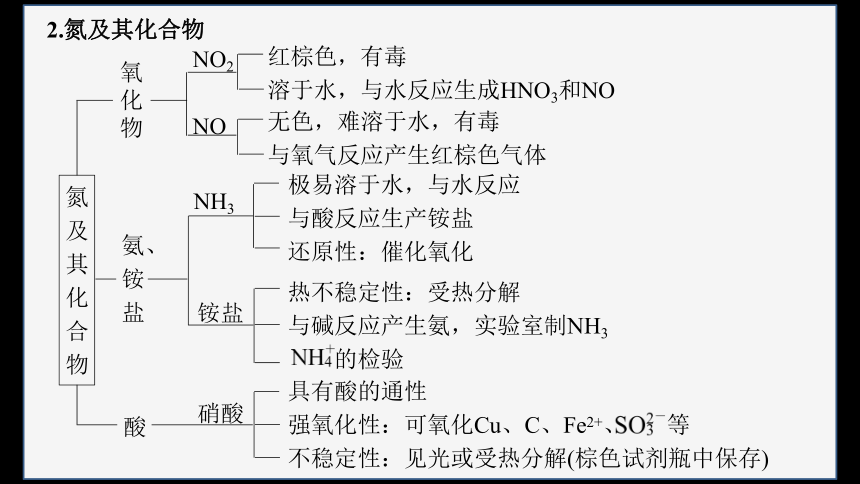
氮及其化合物
氧化物
氨、铵盐
酸
NO2
无色,难溶于水,有毒
与氧气反应产生红棕色气体
NH3
极易溶于水,与水反应
与酸反应生产铵盐
还原性:催化氧化
铵盐
热不稳定性:受热分解
与碱反应产生氨,实验室制NH3
的检验
硝酸
具有酸的通性
强氧化性:可氧化Cu、C、Fe2+、 等
不稳定性:见光或受热分解(棕色试剂瓶中保存)
NO
红棕色,有毒
溶于水,与水反应生成HNO3和NO
2.氮及其化合物
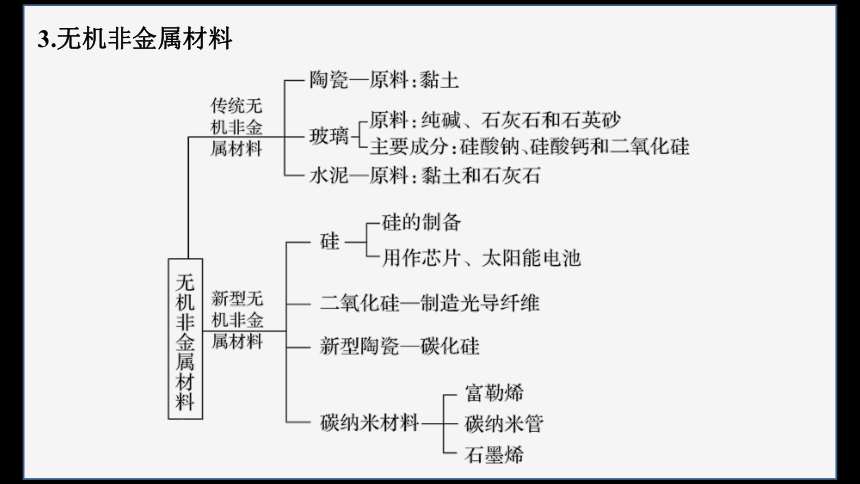
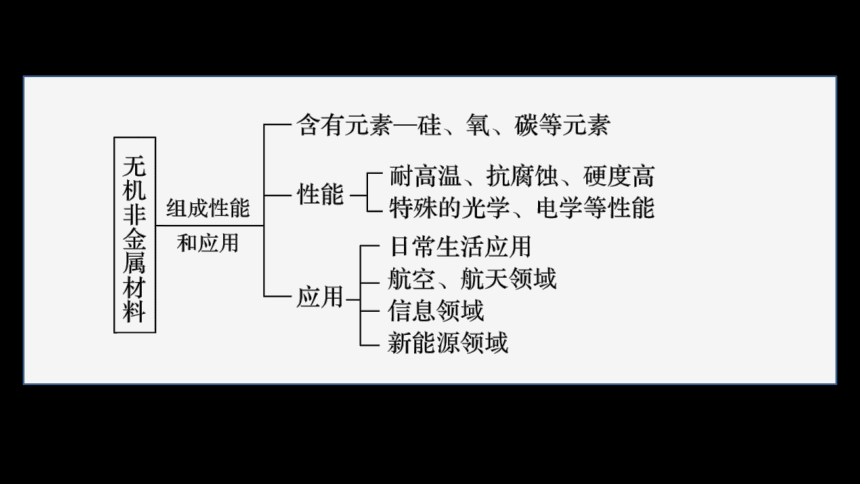
3.无机非金属材料
1.(2021·全国甲卷,9)实验室制备下列气体的方法可行的是
1
2
3
4
选项 气体 方法
A 氨气 加热氯化铵固体
B 二氧化氮 将铝片加到冷浓硝酸中
C 硫化氢 向硫化钠固体滴加浓硫酸
D 氧气 加热氯酸钾和二氧化锰的混合物
√
1
2
3
4
氯化铵不稳定,加热易分解生成氨气和氯化氢,但两者遇冷又会化合生成氯化铵固体,所以不能用于制备氨气,A不可行;
将铝片加到冷浓硝酸中会发生钝化,不能用于制备二氧化氮,B不可行;
硫化氢为还原性气体,浓硫酸具有强氧化性,不能用浓硫酸与硫化钠固体反应制备硫化氢气体,因为该气体会与浓硫酸发生氧化还原反应,C不可行;
实验室加热氯酸钾和二氧化锰的混合物,生成氯化钾和氧气,二氧化锰作催化剂,可用此方法制备氧气,D可行。
2.(2020·浙江1月选考,24)100%硫酸吸收SO3可生成焦硫酸(分子式为H2S2O7或H2SO4·SO3)。下列说法不正确的是
A.焦硫酸具有强氧化性
B.Na2S2O7水溶液呈中性
C.Na2S2O7可与碱性氧化物反应生成新盐
D.100%硫酸吸收SO3生成焦硫酸的变化是化学变化
1
2
3
4
√
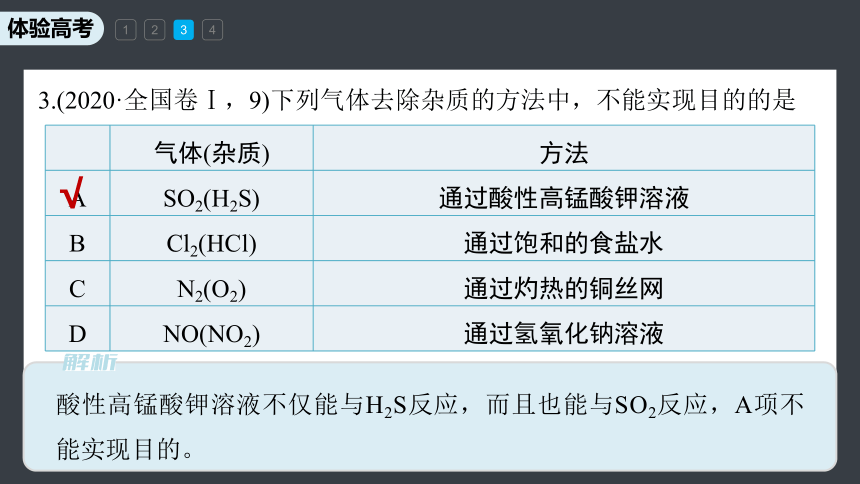
3.(2020·全国卷Ⅰ,9)下列气体去除杂质的方法中,不能实现目的的是
酸性高锰酸钾溶液不仅能与H2S反应,而且也能与SO2反应,A项不能实现目的。
1
2
3
4
气体(杂质) 方法
A SO2(H2S) 通过酸性高锰酸钾溶液
B Cl2(HCl) 通过饱和的食盐水
C N2(O2) 通过灼热的铜丝网
D NO(NO2) 通过氢氧化钠溶液
√
4.[2014·天津理综,9(1)(2)(3)(4)]Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
制备Na2S2O3·5H2O
1
2
3
4
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水;另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是______________________。
硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇湿润是使硫粉易于分散到溶液中。
1
2
3
4
使硫粉易于分散到溶液中
(2)仪器a的名称是_____________,其作用是_________。
1
2
3
4
(球形)冷凝管
冷凝回流
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是_______,检验是否存在该杂质的方法是____________________
______________________________________________________________________。
1
2
3
4
Na2SO4
取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:______________________________。
1
2
3
4
返回
重点突破 素养提升
突破一 S、N、Si及其化合物的转化关系
1.硫及其化合物的转化
完成下列序号表示的化学方程式或离子方程式:
③_________________;
④______________;
⑤_______________;
⑥______________________;
⑦__________________________;
2H2S+SO2===3S+2H2O
⑨________________________;
____________________________;
_________________________;
____________________;
______________________________;
________________________________________。
FeS+2H+===Fe2++H2S↑
SO2+2NaOH===Na2SO3+H2O
SO2+Cl2+2H2O===H2SO4+2HCl
2.氮及其化合物的转化
完成下列序号表示的化学方程式:
①___________________;
②_____________________;
③___________________________;
④__________________________________________;
⑤_________________________;
⑥________________________;
NH3+HCl===NH4Cl
NH3+H2O NH3·H2O
⑦___________________;
⑧_____________________;
⑨_________________;
⑩_________________________;
_________________________________________;
_________________________;
__________________________________________。
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
3NO2+H2O===2HNO3+NO
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
3.硅及其重要化合物之间的转化
完成下列序号表示的化学方程式:
⑤________________________;
⑥________________________;
⑦__________________________;
⑧____________________________;
⑨______________________________________________________;
____________________________________________________________
_________________。
SiCl4+2H2 Si+4HCl
SiO2+2C 2CO↑+Si
SiO2+4HF===SiF4↑+2H2O
SiO2+2NaOH===Na2SiO3+H2O
CaO+SiO2 CaSiO3或CaCO3+SiO2 CaSiO3+CO2↑
Na2SiO3+2HCl===H2SiO3↓+2NaCl或Na2SiO3+CO2+H2O===
Na2CO3+H2SiO3↓
1.(2022·广东江门高一期末)部分含硫物质的分类与相应化合价关系如图所示。下列推断不合理的是
A.a可与O2反应直接生成c
B.b既可被氧化,也可被还原
C.可向H2O2中加入b制得d
D.可存在b→c→d→b的转化关系
√
1
2
1
2
a是S单质,c是SO3。S与O2在点燃时发生
反应生成SO2,不能生成SO3,A错误;
b是SO2,S元素化合价为+4价,介于S元
素的最高+6价和最低-2价之间,因此
SO2既有氧化性,又有还原性,也就是说该物质既可被氧化,也可被还原,B正确;
H2O2具有氧化性,b是SO2,该物质具有还原性,向H2O2中加入SO2,二者发生氧化还原反应产生H2SO4,C正确;
1
2
SO2与O2在催化剂存在条件下被氧化为SO3,SO3与H2O反应产生H2SO4,H2SO4与Na2SO3在溶液中发生反应产生SO2气体,故存在b→c→d→b的转化关系,D正确。
2.结合氮及其化合物“价—类”二维图及氧化还原反应的基本规律,下列分析或预测正确的是
A.N2O3、NO2、N2O5均能与水反应生成
酸,三者均为酸性氧化物
B.HNO3、HNO2、NaNO3、NH3的水溶
液均可以导电,四者均属于电解质
C.联氨(N2H4)可能被亚硝酸(HNO2)氧化生成氢叠氮酸(HN3)
D.硝酸具有较强的氧化性,可用稀硝酸溶解Au、Ag、Cu
1
2
√
1
2
N2O3、N2O5属于酸性氧化物,与水反
应只生成酸,二氧化氮和水反应生成
硝酸和NO,所以二氧化氮不是酸性
氧化物,故A错误;
HNO3、HNO2、NaNO3均是电解质,
NH3的水溶液可以导电,但是NH3在水中不能电离,不是电解质,故B错误;
依据价态归中原理,N2H4(氮为-2价)和HNO2(氮是+3价)反应可能
生成HN3(氮是- 价),故C正确;
1
2
Au的金属活动性很弱,与硝酸不反应,Ag、Cu能与稀硝酸反应,故D错误。
突破二 无机框图推断题解题技巧
1.解题方法
2.常用“突破口”
(1)物质的颜色
淡黄色固体—__、______;红棕色粉末—______;
红褐色沉淀—________;蓝色沉淀—________;
黑色固体—Fe3O4、CuO等;红色溶液—Fe(SCN)3;
红棕色气体—____;黄绿色气体—___。
S
Na2O2
Fe2O3
Fe(OH)3
Cu(OH)2
NO2
Cl2
(2)常见物质检验的现象
①焰色试验:钠为_____、钾为_____(透过蓝色钴玻璃)。
②Fe2+遇碱出现沉淀颜色变化:_____________________;Fe3+遇SCN-显_____,遇碱生成_______沉淀。
③高中阶段所学的气体中溶于水显碱性的只有_____;在空气中迅速由无色变为红棕色的气体只有____。
④能与盐酸、稀硫酸作用产生有刺激性气味的无色气体,且该气体能使溴水、品红溶液、酸性高锰酸钾溶液褪色的一般为含_____或______的物质。
黄色
紫色
白色→灰绿色→红褐色
红色
红褐色
氨气
NO
(3)物质的特殊性质
①能使品红溶液褪色的气体:____(加热后品红溶液又恢复红色)、____(加热后品红溶液不恢复红色)。
②使湿润的红色石蕊试纸变蓝的气体:____。
③使湿润的淀粉-KI试纸变蓝:NO2、___、Br2、 FeCl3溶液等。
④能与SO2、Cl2、O2等气体(或其水溶液)反应析出淡黄色沉淀:H2S。
⑤在一定条件下具有漂白性的物质:Na2O2、_____、SO2、氯水、活性炭等。
⑥___可作半导体材料,_____可制作光导纤维。
⑦与水反应放出气体的物质:___、K、Na2O2等。
SO2
Cl2
NH3
Cl2
H2O2
Si
SiO2
Na
1.如图为火山喷发时硫元素的转化示意图,其中甲、乙在常温下均为气体,丙为液体,丁为固体。下列关于甲、乙、丙、丁的判断不正确的是
A.甲只具有还原性
B.乙、丙均为酸性氧化物
C.乙既有氧化性,又有还原性
D.丁为黄色或淡黄色固体
1
2
√
甲、乙、丙、丁分别为H2S、SO2、
SO3、S。H2S中-2价的S只有还原
性,但其中的H为+1价,具有氧化
性,如H2S与活泼金属反应可表现出
氧化性,A项错误;
SO2中的S为+4价,处于S的中间价态,C项正确;
单质S为黄色或淡黄色固体,D项正确。
2
1
2.A、B、C、D均为中学化学常见的纯净物,A是单
质,它们之间有如下的反应关系:
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸
雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:_______________________________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程
式:______________________________。
2
1
漂白、防腐、作为生产硫酸的原料等(任写两个即可)
(3)若D物质具有两性,②③反应均要用强碱溶
液,④反应时通入过量的一种能引起温室效应
的主要气体。判断单质A的元素在周期表中的
位置:________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素为同一主族,且溶液均显碱性,写出②反应的化学方程式:_________________________________,D的化学式是________。
2
1
第三周期第ⅢA族
Si+2NaOH+H2O===Na2SiO3+2H2↑
Na2CO3
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于刻蚀印刷铜电路板,写出该反应的离子方程式:_________________________。
2
1
Cu+2Fe3+===Cu2++2Fe2+
返回
本课结束
第五章
体系构建 理清脉络 / 重点突破 素养提升
章末整合 重点突破
第五章
内容索引
体系构建 理清脉络
重点突破 素养提升
体系构建 理清脉络
硫及其化合物
单质
氧化物
酸
与金属(Fe、Cu) FeS、Cu2S
与非金属
加热,与H2反应生成H2S
点燃,与O2反应生成SO2
二氧
化硫
具有酸性氧化物的通性
还原性:能使氯水、酸性高锰酸钾溶液褪色
氧化性:与H2S反应生成硫单质
漂白性:具有可逆性
三氧化硫
具有酸性氧化物的通性
稀硫酸
具有酸的通性
浓硫酸
吸水性:干燥剂,使胆矾晶体变白
脱水性:蔗糖炭化
强氧化性:在加热条件下能氧化铜、碳等反应
1.硫及其化合物
氮及其化合物
氧化物
氨、铵盐
酸
NO2
无色,难溶于水,有毒
与氧气反应产生红棕色气体
NH3
极易溶于水,与水反应
与酸反应生产铵盐
还原性:催化氧化
铵盐
热不稳定性:受热分解
与碱反应产生氨,实验室制NH3
的检验
硝酸
具有酸的通性
强氧化性:可氧化Cu、C、Fe2+、 等
不稳定性:见光或受热分解(棕色试剂瓶中保存)
NO
红棕色,有毒
溶于水,与水反应生成HNO3和NO
2.氮及其化合物
3.无机非金属材料
1.(2021·全国甲卷,9)实验室制备下列气体的方法可行的是
1
2
3
4
选项 气体 方法
A 氨气 加热氯化铵固体
B 二氧化氮 将铝片加到冷浓硝酸中
C 硫化氢 向硫化钠固体滴加浓硫酸
D 氧气 加热氯酸钾和二氧化锰的混合物
√
1
2
3
4
氯化铵不稳定,加热易分解生成氨气和氯化氢,但两者遇冷又会化合生成氯化铵固体,所以不能用于制备氨气,A不可行;
将铝片加到冷浓硝酸中会发生钝化,不能用于制备二氧化氮,B不可行;
硫化氢为还原性气体,浓硫酸具有强氧化性,不能用浓硫酸与硫化钠固体反应制备硫化氢气体,因为该气体会与浓硫酸发生氧化还原反应,C不可行;
实验室加热氯酸钾和二氧化锰的混合物,生成氯化钾和氧气,二氧化锰作催化剂,可用此方法制备氧气,D可行。
2.(2020·浙江1月选考,24)100%硫酸吸收SO3可生成焦硫酸(分子式为H2S2O7或H2SO4·SO3)。下列说法不正确的是
A.焦硫酸具有强氧化性
B.Na2S2O7水溶液呈中性
C.Na2S2O7可与碱性氧化物反应生成新盐
D.100%硫酸吸收SO3生成焦硫酸的变化是化学变化
1
2
3
4
√
3.(2020·全国卷Ⅰ,9)下列气体去除杂质的方法中,不能实现目的的是
酸性高锰酸钾溶液不仅能与H2S反应,而且也能与SO2反应,A项不能实现目的。
1
2
3
4
气体(杂质) 方法
A SO2(H2S) 通过酸性高锰酸钾溶液
B Cl2(HCl) 通过饱和的食盐水
C N2(O2) 通过灼热的铜丝网
D NO(NO2) 通过氢氧化钠溶液
√
4.[2014·天津理综,9(1)(2)(3)(4)]Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
制备Na2S2O3·5H2O
1
2
3
4
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水;另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是______________________。
硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇湿润是使硫粉易于分散到溶液中。
1
2
3
4
使硫粉易于分散到溶液中
(2)仪器a的名称是_____________,其作用是_________。
1
2
3
4
(球形)冷凝管
冷凝回流
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是_______,检验是否存在该杂质的方法是____________________
______________________________________________________________________。
1
2
3
4
Na2SO4
取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:______________________________。
1
2
3
4
返回
重点突破 素养提升
突破一 S、N、Si及其化合物的转化关系
1.硫及其化合物的转化
完成下列序号表示的化学方程式或离子方程式:
③_________________;
④______________;
⑤_______________;
⑥______________________;
⑦__________________________;
2H2S+SO2===3S+2H2O
⑨________________________;
____________________________;
_________________________;
____________________;
______________________________;
________________________________________。
FeS+2H+===Fe2++H2S↑
SO2+2NaOH===Na2SO3+H2O
SO2+Cl2+2H2O===H2SO4+2HCl
2.氮及其化合物的转化
完成下列序号表示的化学方程式:
①___________________;
②_____________________;
③___________________________;
④__________________________________________;
⑤_________________________;
⑥________________________;
NH3+HCl===NH4Cl
NH3+H2O NH3·H2O
⑦___________________;
⑧_____________________;
⑨_________________;
⑩_________________________;
_________________________________________;
_________________________;
__________________________________________。
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
3NO2+H2O===2HNO3+NO
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
3.硅及其重要化合物之间的转化
完成下列序号表示的化学方程式:
⑤________________________;
⑥________________________;
⑦__________________________;
⑧____________________________;
⑨______________________________________________________;
____________________________________________________________
_________________。
SiCl4+2H2 Si+4HCl
SiO2+2C 2CO↑+Si
SiO2+4HF===SiF4↑+2H2O
SiO2+2NaOH===Na2SiO3+H2O
CaO+SiO2 CaSiO3或CaCO3+SiO2 CaSiO3+CO2↑
Na2SiO3+2HCl===H2SiO3↓+2NaCl或Na2SiO3+CO2+H2O===
Na2CO3+H2SiO3↓
1.(2022·广东江门高一期末)部分含硫物质的分类与相应化合价关系如图所示。下列推断不合理的是
A.a可与O2反应直接生成c
B.b既可被氧化,也可被还原
C.可向H2O2中加入b制得d
D.可存在b→c→d→b的转化关系
√
1
2
1
2
a是S单质,c是SO3。S与O2在点燃时发生
反应生成SO2,不能生成SO3,A错误;
b是SO2,S元素化合价为+4价,介于S元
素的最高+6价和最低-2价之间,因此
SO2既有氧化性,又有还原性,也就是说该物质既可被氧化,也可被还原,B正确;
H2O2具有氧化性,b是SO2,该物质具有还原性,向H2O2中加入SO2,二者发生氧化还原反应产生H2SO4,C正确;
1
2
SO2与O2在催化剂存在条件下被氧化为SO3,SO3与H2O反应产生H2SO4,H2SO4与Na2SO3在溶液中发生反应产生SO2气体,故存在b→c→d→b的转化关系,D正确。
2.结合氮及其化合物“价—类”二维图及氧化还原反应的基本规律,下列分析或预测正确的是
A.N2O3、NO2、N2O5均能与水反应生成
酸,三者均为酸性氧化物
B.HNO3、HNO2、NaNO3、NH3的水溶
液均可以导电,四者均属于电解质
C.联氨(N2H4)可能被亚硝酸(HNO2)氧化生成氢叠氮酸(HN3)
D.硝酸具有较强的氧化性,可用稀硝酸溶解Au、Ag、Cu
1
2
√
1
2
N2O3、N2O5属于酸性氧化物,与水反
应只生成酸,二氧化氮和水反应生成
硝酸和NO,所以二氧化氮不是酸性
氧化物,故A错误;
HNO3、HNO2、NaNO3均是电解质,
NH3的水溶液可以导电,但是NH3在水中不能电离,不是电解质,故B错误;
依据价态归中原理,N2H4(氮为-2价)和HNO2(氮是+3价)反应可能
生成HN3(氮是- 价),故C正确;
1
2
Au的金属活动性很弱,与硝酸不反应,Ag、Cu能与稀硝酸反应,故D错误。
突破二 无机框图推断题解题技巧
1.解题方法
2.常用“突破口”
(1)物质的颜色
淡黄色固体—__、______;红棕色粉末—______;
红褐色沉淀—________;蓝色沉淀—________;
黑色固体—Fe3O4、CuO等;红色溶液—Fe(SCN)3;
红棕色气体—____;黄绿色气体—___。
S
Na2O2
Fe2O3
Fe(OH)3
Cu(OH)2
NO2
Cl2
(2)常见物质检验的现象
①焰色试验:钠为_____、钾为_____(透过蓝色钴玻璃)。
②Fe2+遇碱出现沉淀颜色变化:_____________________;Fe3+遇SCN-显_____,遇碱生成_______沉淀。
③高中阶段所学的气体中溶于水显碱性的只有_____;在空气中迅速由无色变为红棕色的气体只有____。
④能与盐酸、稀硫酸作用产生有刺激性气味的无色气体,且该气体能使溴水、品红溶液、酸性高锰酸钾溶液褪色的一般为含_____或______的物质。
黄色
紫色
白色→灰绿色→红褐色
红色
红褐色
氨气
NO
(3)物质的特殊性质
①能使品红溶液褪色的气体:____(加热后品红溶液又恢复红色)、____(加热后品红溶液不恢复红色)。
②使湿润的红色石蕊试纸变蓝的气体:____。
③使湿润的淀粉-KI试纸变蓝:NO2、___、Br2、 FeCl3溶液等。
④能与SO2、Cl2、O2等气体(或其水溶液)反应析出淡黄色沉淀:H2S。
⑤在一定条件下具有漂白性的物质:Na2O2、_____、SO2、氯水、活性炭等。
⑥___可作半导体材料,_____可制作光导纤维。
⑦与水反应放出气体的物质:___、K、Na2O2等。
SO2
Cl2
NH3
Cl2
H2O2
Si
SiO2
Na
1.如图为火山喷发时硫元素的转化示意图,其中甲、乙在常温下均为气体,丙为液体,丁为固体。下列关于甲、乙、丙、丁的判断不正确的是
A.甲只具有还原性
B.乙、丙均为酸性氧化物
C.乙既有氧化性,又有还原性
D.丁为黄色或淡黄色固体
1
2
√
甲、乙、丙、丁分别为H2S、SO2、
SO3、S。H2S中-2价的S只有还原
性,但其中的H为+1价,具有氧化
性,如H2S与活泼金属反应可表现出
氧化性,A项错误;
SO2中的S为+4价,处于S的中间价态,C项正确;
单质S为黄色或淡黄色固体,D项正确。
2
1
2.A、B、C、D均为中学化学常见的纯净物,A是单
质,它们之间有如下的反应关系:
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸
雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:_______________________________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程
式:______________________________。
2
1
漂白、防腐、作为生产硫酸的原料等(任写两个即可)
(3)若D物质具有两性,②③反应均要用强碱溶
液,④反应时通入过量的一种能引起温室效应
的主要气体。判断单质A的元素在周期表中的
位置:________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素为同一主族,且溶液均显碱性,写出②反应的化学方程式:_________________________________,D的化学式是________。
2
1
第三周期第ⅢA族
Si+2NaOH+H2O===Na2SiO3+2H2↑
Na2CO3
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于刻蚀印刷铜电路板,写出该反应的离子方程式:_________________________。
2
1
Cu+2Fe3+===Cu2++2Fe2+
返回
本课结束
第五章
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
