第五章 第二节 第4课时 硝酸 酸雨及防治 课件(共81张PPT)
文档属性
| 名称 | 第五章 第二节 第4课时 硝酸 酸雨及防治 课件(共81张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 18:12:29 | ||
图片预览










文档简介
(共81张PPT)
第4课时
DISIKESHI
硝酸 / 酸雨及防治 / 随堂演练 知识落实 / 课时对点练
硝酸 酸雨及防治
第五章
核心素养
发展目标
1.能从物质类别、氮元素化合价的角度认识硝酸的性质及含氮物质间的相互转化,促进“证据推理与模型认知”化学核心素养的发展。
2.认识二氧化硫、氮氧化物为大气污染物,了解酸雨的形成、危害及其防治,增强环保意识和培养社会责任感。
内容索引
随堂演练 知识落实
课时对点练
一、硝酸
二、酸雨及防治
硝酸
一
1.硝酸的物理性质
硝酸是___色、___挥发、有_______气味的液体。
2.硝酸的化学性质
(1)酸的通性
写出HNO3与下列物质反应的离子方程式
①与碱(如NaOH):_________________。
②与碱性氧化物(如Na2O):_________________________。
③与弱酸盐(如CaCO3):__________________________________。
无
易
刺激性
H++OH-===H2O
2H++Na2O===2Na++H2O
CaCO3+2H+===Ca2++CO2↑+H2O
(2)不稳定性
浓硝酸见光或受热易分解,化学方程式为_________________________
_______;长期存放的浓硝酸呈黄色是因为其分解生成的_____溶于硝酸中,实验室常将浓硝酸保存在_____试剂瓶中,并放置在_____处。
4HNO3 4NO2↑+O2↑
+2H2O
NO2
棕色
阴凉
(3)强氧化性
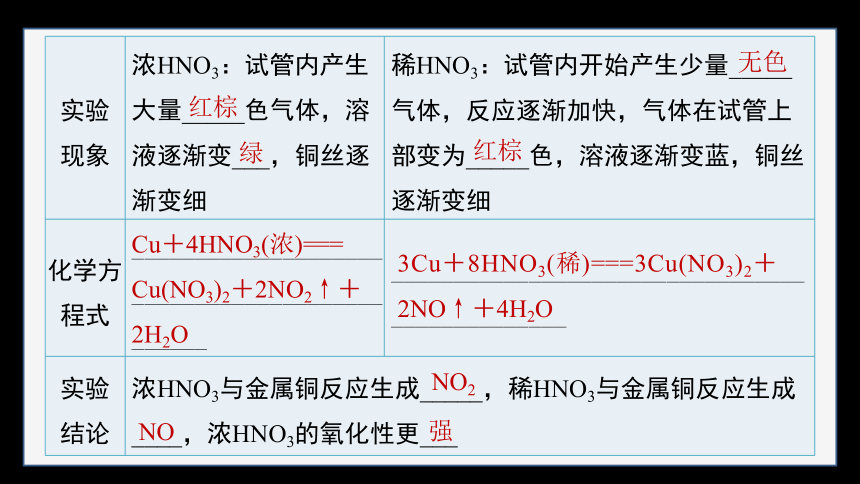
①实验探究:浓HNO3和稀HNO3与铜的反应
实验 装置
向两支具支试管中分别加入浓硝酸和稀硝酸
实验 现象 浓HNO3:试管内产生大量_____色气体,溶液逐渐变___,铜丝逐渐变细 稀HNO3:试管内开始产生少量_____气体,反应逐渐加快,气体在试管上部变为_____色,溶液逐渐变蓝,铜丝逐渐变细
化学方程式 ______________________________________________ _______________________________________________
实验 结论 浓HNO3与金属铜反应生成_____,稀HNO3与金属铜反应生成____,浓HNO3的氧化性更___ 红棕
绿
无色
红棕
Cu+4HNO3(浓)===
Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)===3Cu(NO3)2+
2NO↑+4H2O
NO2
NO
强
②钝化
常温下,铁、铝的表面被________或________氧化,生成一层致密的氧化物薄膜,阻止了酸与内层金属的进一步反应。所以常温下可以用铁或铝制容器来盛装________或________。当_____时,铁、铝会与浓HNO3或浓H2SO4发生反应。
③浓HNO3与非金属(碳)的反应
化学方程式:_________________________________________。
浓HNO3
浓H2SO4
浓HNO3
浓H2SO4
加热
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
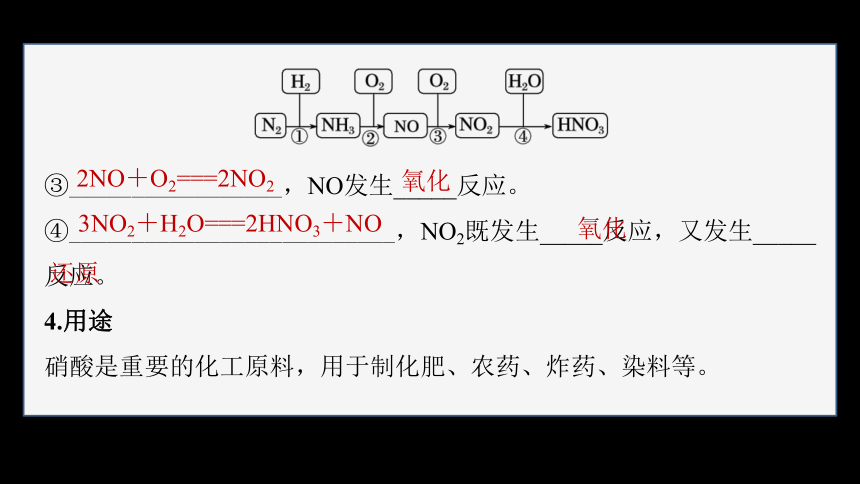
3.硝酸的工业制法
写出上述转化的化学方程式,并指出含氮物质发生的是氧化反应还是还原反应:
①_______________________,N2发生_____反应。
②___________________________,NH3发生_____反应。
还原
氧化
③_________________,NO发生_____反应。
④__________________________,NO2既发生_____反应,又发生_____反应。
4.用途
硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。
2NO+O2===2NO2
氧化
3NO2+H2O===2HNO3+NO
氧化
还原
(1)硝酸具有很强的氧化性,硝酸的浓度不同,与金属反应的产物也不同( )
(2)浓HNO3使紫色石蕊溶液先变红后褪色( )
(3)稀硝酸可溶解Fe(OH)2生成Fe(NO3)2和水( )
(4)碳、铜与浓硝酸反应时,浓硝酸只表现强氧化性( )
(5)过量的铜和一定量浓硝酸反应,生成的气体只有二氧化氮( )
(6)常温下,将铝片放入浓硝酸,无明显现象,是因为铝和浓硝酸不反应( )
×
正误判断
√
×
×
×
√
深度思考
1.(1)将铁粉溶于稀硝酸,铁元素的存在形式可能为①___________、
②_________、③___________________。
(2)其原因为____________________________________________________
__________________________________________________________________________________________________________________________________________________________________________________________。
Fe(NO3)3
Fe(NO3)2
Fe(NO3)3和Fe(NO3)2
硝酸与变价金属(如Fe)反应,根据硝酸量的多少分别得到高价、低价或两种价态共存的混合物。
Fe(少量)+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O;
3Fe(过量)+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O
深度思考
2.某研究小组为了探究硝酸的性质,进行如下实验操作。
(1)从试剂柜中取一瓶浓硝酸,发现其保存在___色试剂瓶中,取少量浓硝酸于试管中,发现其溶液呈“黄色”,其原因是__________________
______________________________________________________________
_____________(用化学方程式和适当文字描述)。该研究小组尝试将显“黄色”的浓硝酸恢复到原本的无色。下列措施合理的是__(填字母)。
a.向浓硝酸中加水 b.向浓硝酸中通入适量空气
c.加热浓硝酸 d.向浓硝酸中加入适量的NaOH固体
棕
浓硝酸不稳定,见
光或受热易分解,4HNO3 4NO2↑+O2↑+2H2O,NO2溶于浓HNO3
使溶液呈黄色
b
深度思考
(2)向浓硝酸中加入稍过量铜片,该小组同学发现,生成的气体开始呈红棕色后逐渐变浅,最终气体变为无色,试写出上述反应的化学方程式:
_______________________________________________________________________________________,在上述反应中,硝酸体现的性质为_______________。
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)===
3Cu(NO3)2+2NO↑+4H2O
强氧化性和酸性
深度思考
(3)当实验完毕,该小组同学向试管中滴入少量稀H2SO4,发现铜片又逐渐溶解,产生无色气体,试写出上述反应的离子方程式:____________
____________________________。
(4)该小组同学向浓硝酸中加入少量碳粉,无明显现象,缓慢加热,发现碳粉逐渐溶解,产生红棕色气体,试写出上述反应的化学方程式:________________________________________,在该反应中硝酸体现的性质为_________。
3Cu+8H++
强氧化性
归纳总结
(1)硝酸与金属反应不能生成氢气。硝酸浓度不同,其还原产物不同,一般情况下,浓硝酸被还原为NO2,稀硝酸被还原为NO。
(2)硝酸能与大多数金属(金、铂等除外)反应,将金属氧化为高价态金属的硝酸盐。将浓硝酸与浓盐酸以1∶3的体积比混合,所得混合物称为王水,它能溶解一些不溶于硝酸的金属,如Pt、Au等。但在常温下,浓硝酸能使铁、铝钝化。
归纳总结
(3)热的浓硝酸可将非金属单质(碳、硫、磷等)氧化为最高价氧化物或最高价含氧酸。
(4)硝酸的强氧化性还表现在可以氧化具有还原性的化合物或离子,如SO2、FeO、Fe2+、Br-、I-、S2-、 等均能被硝酸氧化。
返回
酸雨及防治
二
1.酸雨
(1)二氧化硫和氮氧化物的来源
SO2:___、_____和某些_________的燃烧和冶炼;
NOx:机动车发动机中,燃料燃烧产生的高温条件会使空气中的N2与O2反应生成NOx。
(2)酸雨的形成
_________、_________以及它们在大气中发生反应后的生成物溶于雨水会形成酸雨。正常雨水由于溶解了CO2,其pH约为5.6,而酸雨的pH_____5.6。
煤
石油
金属矿物
二氧化硫
氮氧化物
小于
a.硫酸型酸雨的形成过程如图:
写出图中标号所对应的化学方程式:
①___________________。
②__________________。
③___________________。
④_____________________。
SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
b.硝酸型酸雨的形成过程如图:
写出图中标号所对应的化学方程式:
①_________________。
②_________________________。
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
2.酸雨的危害与防治
(1)危害:酸雨能直接_____农作物,_____森林和草原,使土壤、湖泊_____,加速建筑物、桥梁、工业设备、运输工具和电缆的腐蚀。
(2)防治
①消除_______,改变能源结构,开发利用清洁能源。
②对_________的排放加以控制,对排放的二氧化硫、氮氧化物等物质采取吸收、回收处理等措施。
损伤
破坏
酸化
污染源
酸性物质
(1)酸雨是指pH小于7的降雨( )
(2)化石燃料燃烧产生大量CO2,是形成酸雨的主要原因( )
(3)氮氧化物、硫的氧化物都可以形成酸雨( )
(4)防治酸雨的根本途径是减少人为SO2、NOx的排放( )
×
正误判断
√
×
√
应用体验
1.以下非金属氧化物与其引起的环境问题及主要来源对应正确的是
选项 氧化物 环境问题 主要来源
A CO2 破坏臭氧层 化石燃料的燃烧
B SO2 温室效应 工厂废气的排放
C NO2 光化学烟雾 汽车尾气的排放
D CO 酸雨 汽车尾气和化石燃料的不完全燃烧
√
2.(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h 0 1 2 3 4
雨水的pH 4.73 4.63 4.56 4.55 4.55
分析数据,回答下列问题:
①雨水样品的pH变化的原因是____________________________________
________(用化学方程式表示)。
SO2+H2O H2SO3、2H2SO3+O2===
2H2SO4
酸雨放置时pH变小,其原因是雨水中的H2SO3被空气中的氧气氧化所致:SO2+H2O H2SO3、2H2SO3+O2===2H2SO4。
②如果将刚取样的上述雨水与自来水相混合,pH将变___,原因是_____
_______________________________________________________(用化学方程式表示)。
雨水与自来水混合,应考虑SO2与Cl2或H2SO3与HClO的反应:SO2+2H2O+Cl2===H2SO4+2HCl或H2SO3+HClO===H2SO4+HCl。因此雨水与自来水混合后溶液pH将变小。
小
2H2O+SO2===H2SO4+2HCl(或H2SO3+HClO===H2SO4+HCl)
Cl2+
(2)下列可以减少酸雨产生的途径是___(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤
C
减少酸雨的产生需减少SO2的排放,将煤转化为清洁能源(如煤的气化和液化),燃料脱硫、固硫,开发不含硫的新能源(如氢能、核能等),都是有力措施,因此①③⑤正确。
知识拓展
SO2和NOx的吸收与处理
(1)含有SO2废气的两种处理方法
①钙基固硫法
工业上常用生石灰和含硫的煤混合后燃烧,燃烧时硫、生石灰、O2共同反应生成硫酸钙,从而使硫转移到煤渣中,反应的化学
方程式为CaO+SO2 CaSO3、2CaSO3+O2 2CaSO4,
总反应的化学方程式为2CaO+2SO2+O2 2CaSO4。
知识拓展
②氨水脱硫法
该脱硫法采用喷雾吸收法,雾化的氨水与烟气中的SO2直接接触吸收SO2,其反应的化学方程式为2NH3+SO2+H2O===
(NH4)2SO3、2(NH4)2SO3+O2===2(NH4)2SO4。
知识拓展
(2)含有NOx尾气的处理方法
①碱液吸收法
硝酸工业产生的废气中含有较多的NO、NO2,可用强碱溶液进行吸收,同时获得副产品。如:
2NO2+2NaOH===NaNO3+NaNO2+H2O;
NO2+NO+2NaOH===2NaNO2+H2O。
注意:NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是n(NO2)≥n(NO)。
知识拓展
②催化转化法
在催化剂、加热条件下,氮氧化物通过与氨或CO反应转化为无毒气体(N2),一般适用于汽车尾气的处理。如:6NO+4NH3
5N2+6H2O;6NO2+8NH3 7N2+12H2O。
返回
随堂演练 知识落实
1.下列反应中硝酸既表现出酸性又表现出氧化性的是
A.使石蕊溶液变红
B.与铜反应放出NO气体,生成Cu(NO3)2
C.与Na2CO3反应放出CO2气体,生成NaNO3
D.与S单质混合共热时生成H2SO4和NO2
√
1
2
3
在A、C项反应中HNO3均表现出酸性;
在B、D项反应中HNO3中氮元素的化合价均降低,表现出氧化性,并且在B项中又有Cu(NO3)2生成,说明此反应中HNO3还表现出酸性。
2.(2022·广东中山高一月考)酸雨是对pH小于5.6的降水的统称。下列说法错误的是
A.空气中的SO2溶于水,最终形成酸雨
B.工业废水任意排放是造成酸雨的主要原因
C.汽车排放的尾气、硝酸厂和化肥厂的废气都含有能形成酸雨的氮氧化物
D.为了减少酸雨的形成,必须减少SO2的排放量,可对燃料进行脱硫处理
1
2
3
√
二氧化硫与水反应生成亚硫酸,亚硫酸能被氧化为硫酸,从而形成酸雨,A项正确;
工业废水任意排放会造成水污染,与酸雨的形成无必然关系,B项错误;
汽车排放的尾气、硝酸厂和化肥厂的废气中都含有氮氧化物,C项正确;
燃料脱硫可减少二氧化硫的排放量,D项正确。
1
2
3
3.(2022·济南高一检测)某校课外活动小组为了探究铜与稀硝酸反应产生的气体是NO,设计了如图实验,实验过程中同时用石灰水吸收产生的氮氧化物获得应用广泛的Ca(NO2)2,实验装置如图所示。(已知:NO+
1
2
3
(1)实验之前通入N2的目的是________
_______________________________。
赶走装
置中的空气,防止对实验造成干扰
NO容易被氧气氧化为NO2,所以需要在反应前通入氮气赶走装置中的空气,防止对实验造成干扰。
1
2
3
(2)在(1)操作后将装置A中铜丝插入稀硝酸,溶液显蓝色,有无色气体生成,该反应中表现氧化性的硝酸与参与反应的硝酸物质的量之比为_____。
铜和稀硝酸反应的化学方程式为3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O,若有8 mol硝酸参加反应,表现氧化性的硝酸即生成NO的硝酸为2 mol,所以表现氧化性的硝酸与参与反应的硝酸物质的量之比为1∶4。
1
2
3
1∶4
(3)装置B中用注射器压入空气之后现象是_______________________。
生成的无色的NO和空气中的氧气反应生成红棕色的NO2:2NO+O2===2NO2。
1
2
3
烧瓶E中气体变为红棕色
(4)D装置的作用是__________________
______________。
D装置不但可以吸收多余的氮氧化物,球形干燥管还可以起到防止倒吸的作用。
1
2
3
吸收处理尾气NO2、
NO;防止倒吸
返回
课时对点练
题组一 硝酸的性质及实验探究
1.下列关于硝酸的叙述正确的是
A.NO2溶于水生成硝酸,所以NO2是酸性氧化物
B.硝酸可与活泼金属反应生成盐和氢气
C.浓硝酸显黄色是因为溶有NO2
D.硝酸与木炭的反应既表现出氧化性又表现出酸性
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
NO2溶于水生成硝酸,同时还生成了NO,所以NO2不是酸性氧化物,A项错误;
硝酸可与活泼金属反应生成盐、水和氮氧化物,不生成氢气,B项错误;
浓硝酸显黄色是因为浓硝酸分解生成的NO2溶解在浓硝酸中,C项正确;
硝酸与木炭反应,生成物中没有硝酸盐,硝酸只表现出氧化性,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
2.以下关于铜与浓硝酸、稀硝酸反应的说法错误的是
A.1 mol浓硝酸被还原转移2 mol电子
B.铜与浓硝酸反应比与稀硝酸反应剧烈
C.铜与浓、稀硝酸反应都不需要加热
D.生成等量的硝酸铜,消耗浓硝酸的量多
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1 mol浓HNO3被还原生成1 mol NO2,转移1 mol电子,A项错误;
浓硝酸的氧化性强于稀硝酸,Cu与浓HNO3反应比与稀HNO3反应剧烈,B项正确;
Cu与浓、稀HNO3反应都不需要加热,C项正确;
浓硝酸的还原产物是NO2,稀硝酸的还原产物是NO,根据得失电子守恒可判断生成等量的Cu(NO3)2,消耗浓HNO3的量多,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
3.(2022·青岛高一期末)下列事实不能说明浓硝酸氧化性比稀硝酸强的是
A.浓硝酸遇石蕊溶液先变红后褪色,稀硝酸遇石蕊溶液只变红不褪色
B.浓硝酸能与NO反应生成NO2,而稀硝酸不与NO反应
C.浓硝酸在加热条件下可与碳单质反应,而稀硝酸则不能
D.足量的铜分别还原含1 mol HNO3的浓硝酸和稀硝酸转移电子数分别为
NA和3NA
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A项,浓硝酸具有强氧化性,能将有色物质氧化,可以使石蕊溶液先变红后褪色,而稀硝酸只能使石蕊溶液变红,能说明浓硝酸的氧化性强于稀硝酸;
B项,浓硝酸能将NO氧化成NO2,体现浓硝酸的强氧化性,而稀硝酸不能将NO氧化成NO2,能说明浓硝酸的氧化性强于稀硝酸;
C项,浓硝酸在加热条件下能与碳单质反应,体现浓硝酸的强氧化性,而稀硝酸不与碳单质发生反应,能说明浓硝酸的氧化性强于稀硝酸;
D项,不能以转移电子多少判断氧化性的强弱,因此足量的铜分别还原含1 mol HNO3的浓硝酸和稀硝酸转移电子数分别为NA和3NA,不能说明浓硝酸的氧化性比稀硝酸的强。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4.向两支分别盛有浅绿色的Fe(NO3)2和FeSO4溶液的试管中分别逐滴加入稀盐酸时,溶液的颜色变化应该是
A.前者基本没有改变,后者变棕黄色
B.前者变棕黄色,后者也变棕黄色
C.前者变棕黄色,后者基本没有改变
D.前者、后者都基本没有改变
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
四种离子相互之间不反应,能在溶液中大量共存,D项正确。
题组二 酸雨及防治
6.在碳、氮、硫的氧化物中,许多是工业上重要的化工原料,但是当它们分散到空气中时,会带来很多环境问题。下列有关这些元素的氧化物的说法,不正确的是
A.开发太阳能、水能、风能、氢能等新能源将有利于减少这些氧化物的
产生
B.这些氧化物使雨水的pH<7,我们把pH<7的雨水称之为酸雨
C.氮与硫的氧化物还能直接危害人的身体健康,引发呼吸道疾病
D.“温室效应”与二氧化碳的排放有着直接的关系
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
正常雨水由于溶解了二氧化碳,其pH约为5.6,pH小于5.6的雨水才叫酸雨。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
7.中办、国办在第二轮中央生态环保督察启动之际印发了《中央生态环境保护督察工作规定》。可见国家对环境保护的重视程度。下列环境问题与产生的主要原因不相符的是
①“光化学烟雾”主要是由汽车排放的氮氧化物所引起的
②“酸雨”主要是由空气中CO2的浓度增大引起的
③“温室效应”主要是由空气中CO2浓度增大引起的
④“赤潮”主要是由于水体中N、P等元素含量过高而引起的
A.只有①② B.只有②③
C.全部 D.只有②
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
“酸雨”主要是由空气中SO2或NOx的浓度增大引起的。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
9.把铜粉和过量的铁粉加入热的浓硝酸中,充分反应后溶液中大量存在的金属阳离子是
A.只有Fe2+ B.只有Fe3+
C.有Fe2+和Cu2+ D.有Fe3+和Cu2+
√
铁的金属性强于铜,铁先与浓硝酸发生反应,铁被氧化为Fe3+;因为铁过量,硝酸完全被消耗,因此Cu不参与反应;过量的铁与Fe3+发生反应:Fe+2Fe3+===3Fe2+,因此充分反应后溶液中大量存在的金属阳离子是Fe2+,A项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
10.同学们在做铜与浓硝酸反应的实验时,发现反应后的溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种说法是否正确,这些方案中不可行的是
A.加水稀释该绿色溶液,观察溶液颜色变化
B.加热该绿色溶液,观察溶液颜色变化
C.向该绿色溶液中通入氮气,观察溶液颜色变化
D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察溶液颜色
变化
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A项,加入水,c(Cu2+)变小,同时水也会与溶液中可能溶有的NO2反应生成HNO3,故不能得出溶液呈绿色的原因,不可行;
B、C项操作都是赶出溶液中可能溶有的NO2,对c(Cu2+)大小无影响,可行;
D项,向无NO2的饱和硝酸铜溶液中通入NO2后,通过观察溶液颜色变化,可得出结论,可行。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
11.下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
A.由①中的红棕色气体,推
断产生的气体一定是混合
气体
B.红棕色气体不能表明②中
木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
① ② ③
①中浓HNO3受热分解,发生反应4HNO3(浓) 4NO2↑+O2↑+2H2O,产生的气体为混合气体,故A正确;
由①可知,浓硝酸受热分解可生成红棕色气体NO2,所以“产生红棕色气体”不能说明②中木炭与浓硝酸发生了反应,故B正确;
根据①和②,浓硝酸反应产生红棕色NO2时需要加热,所以浓硝酸具有挥发性才可与上方红热木炭接触,同时,氮元素化合价降低,所以生成的NO2为还原产物,故C正确;
红热木炭可与空气中的O2反应生成CO2,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
12.一定温度下,探究铜与稀HNO3的
反应过程如图,下列说法不正确的是
A.步骤Ⅰ中生成无色气体的离子方程
式是3Cu+ +8H+===3Cu2++2NO↑+4H2O
B.步骤Ⅲ反应速率比Ⅰ快的原因是NO2溶于水,使c(HNO3)增大
C.由实验可知,NO2可能对该反应具有催化作用
D.当活塞不再移动时,再抽入空气,铜可以继续溶解
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
步骤Ⅰ的反应是Cu和稀HNO3的反
应,离子方程式为3Cu+ +8H+
===3Cu2++2NO↑+4H2O,A项
正确;
随着反应的进行,溶液中生成Cu(NO3)2,根据氮原子守恒,c(HNO3)不会增大,B项错误;
生成NO2后,反应速率加快,说明NO2可能对该反应具有催化作用,C项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
再抽入空气,NO和O2反应生成NO2,NO2和水反应生成HNO3,铜可以与HNO3继续反应而溶解,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13.下表是部分城市某日空气质量日报:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
城市 污染指数 首要污染物 空气质量等级
SO2 NO2 PM10 A 98 23 67 SO2 Ⅱ
B 47 29 35 SO2 Ⅰ
C 62 80 113 PM10 Ⅲ
D 52 76 59 NO2 Ⅰ
(1)由题表可知,空气质量日报中涉及的污染物主要是__________和可吸入颗粒物(PM10)。
分析图表中的物质和数据可知涉及的污染物主要是SO2、NO2和可吸入颗粒物(PM10)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
SO2、NO2
(2)SO2的排放是造成酸雨的主要因素。形成酸雨的原因之一可简单表示如下:
酸雨的pH<5.6。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
请回答下列问题:
①酸雨的pH___(填“>”“<”或“=”)5.6。
<
②反应b的化学方程式为____________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
③在一段时间内连续不断测定溶液D的pH,发现pH变小,表示该变化的化学方程式是_____________________。
亚硫酸能够被空气中的氧气氧化生成硫酸,弱酸转化为强酸,pH变小。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
2H2SO3+O2===2H2SO4
④若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:_______________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
14.某化学学习小组采用下列装置,对浓硝酸与木炭的反应进行探究[已知:4HNO3(浓) 4NO2↑+O2↑+
2H2O]。
请回答下列问题。
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,立即伸入三颈烧瓶中,并塞紧瓶塞,滴加浓硝酸,可观察到三颈烧瓶中气体的颜色为________,产生该气体的化学方程式是________________
____________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
红棕色
4NO2↑+CO2↑+2H2O
C+4HNO3(浓)
装置A中发生的是浓硝酸与木炭的反应,生成NO2、CO2、H2O,由于NO2为红棕色气体,故三颈烧瓶中气体的颜色为红棕色。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)装置C中盛有足量Ba(OH)2溶液,反应一段时间后可观察到C中出现白色沉淀,该白色沉淀为_______(写化学
式)。其中的Ba(OH)2溶液____(填“能”
或“不能”)用Ca(OH)2溶液代替,理由
是___________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
BaCO3
不能
Ca(OH)2溶液中Ca(OH)2的浓度较低,不能形成CaCO3沉淀
将NO2、CO2通入Ba(OH)2溶液中分
别生成Ba(NO3)2和BaCO3,由于
Ba(OH)2溶液足量,故溶液为碱性
环境,BaCO3不溶解以沉淀形式析出。Ba(OH)2溶液不能用Ca(OH)2溶液代替,因为Ca(OH)2微溶于水,Ca(OH)2溶液中Ca(OH)2含量太少,浓度太低,不足以完全吸收生成的酸性气体,导致溶液呈酸性,从而不能生成CaCO3沉淀。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(3)装置B的作用是_______。
装置B可以防止装置C中酸性气体因溶解速率太快而出现倒吸。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
防倒吸
(4)装置D中收集到了无色气体,部分同学认为是NO,还有部分同学认为是O2。
①下列对该气体的检验方法合理的是
____(填字母)。
A.敞口观察集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
1
2
3
4
5
6
7
8
9
10
11
12
13
14
AC
NO与空气中的O2反应生成红棕色的NO2,A正确;
NO和O2均不具有酸性,B错误;
O2能使带火星的木条复燃,而NO不能,C正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
②如果集气瓶中收集到的无色气体是氧气,则氧气的来源是_____________。
装置A中除发生木炭与浓硝酸的反应外,还可能发生浓硝酸的分解反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
浓硝酸的分解
返回
本课结束
第五章
第4课时
DISIKESHI
硝酸 / 酸雨及防治 / 随堂演练 知识落实 / 课时对点练
硝酸 酸雨及防治
第五章
核心素养
发展目标
1.能从物质类别、氮元素化合价的角度认识硝酸的性质及含氮物质间的相互转化,促进“证据推理与模型认知”化学核心素养的发展。
2.认识二氧化硫、氮氧化物为大气污染物,了解酸雨的形成、危害及其防治,增强环保意识和培养社会责任感。
内容索引
随堂演练 知识落实
课时对点练
一、硝酸
二、酸雨及防治
硝酸
一
1.硝酸的物理性质
硝酸是___色、___挥发、有_______气味的液体。
2.硝酸的化学性质
(1)酸的通性
写出HNO3与下列物质反应的离子方程式
①与碱(如NaOH):_________________。
②与碱性氧化物(如Na2O):_________________________。
③与弱酸盐(如CaCO3):__________________________________。
无
易
刺激性
H++OH-===H2O
2H++Na2O===2Na++H2O
CaCO3+2H+===Ca2++CO2↑+H2O
(2)不稳定性
浓硝酸见光或受热易分解,化学方程式为_________________________
_______;长期存放的浓硝酸呈黄色是因为其分解生成的_____溶于硝酸中,实验室常将浓硝酸保存在_____试剂瓶中,并放置在_____处。
4HNO3 4NO2↑+O2↑
+2H2O
NO2
棕色
阴凉
(3)强氧化性
①实验探究:浓HNO3和稀HNO3与铜的反应
实验 装置
向两支具支试管中分别加入浓硝酸和稀硝酸
实验 现象 浓HNO3:试管内产生大量_____色气体,溶液逐渐变___,铜丝逐渐变细 稀HNO3:试管内开始产生少量_____气体,反应逐渐加快,气体在试管上部变为_____色,溶液逐渐变蓝,铜丝逐渐变细
化学方程式 ______________________________________________ _______________________________________________
实验 结论 浓HNO3与金属铜反应生成_____,稀HNO3与金属铜反应生成____,浓HNO3的氧化性更___ 红棕
绿
无色
红棕
Cu+4HNO3(浓)===
Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)===3Cu(NO3)2+
2NO↑+4H2O
NO2
NO
强
②钝化
常温下,铁、铝的表面被________或________氧化,生成一层致密的氧化物薄膜,阻止了酸与内层金属的进一步反应。所以常温下可以用铁或铝制容器来盛装________或________。当_____时,铁、铝会与浓HNO3或浓H2SO4发生反应。
③浓HNO3与非金属(碳)的反应
化学方程式:_________________________________________。
浓HNO3
浓H2SO4
浓HNO3
浓H2SO4
加热
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
3.硝酸的工业制法
写出上述转化的化学方程式,并指出含氮物质发生的是氧化反应还是还原反应:
①_______________________,N2发生_____反应。
②___________________________,NH3发生_____反应。
还原
氧化
③_________________,NO发生_____反应。
④__________________________,NO2既发生_____反应,又发生_____反应。
4.用途
硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。
2NO+O2===2NO2
氧化
3NO2+H2O===2HNO3+NO
氧化
还原
(1)硝酸具有很强的氧化性,硝酸的浓度不同,与金属反应的产物也不同( )
(2)浓HNO3使紫色石蕊溶液先变红后褪色( )
(3)稀硝酸可溶解Fe(OH)2生成Fe(NO3)2和水( )
(4)碳、铜与浓硝酸反应时,浓硝酸只表现强氧化性( )
(5)过量的铜和一定量浓硝酸反应,生成的气体只有二氧化氮( )
(6)常温下,将铝片放入浓硝酸,无明显现象,是因为铝和浓硝酸不反应( )
×
正误判断
√
×
×
×
√
深度思考
1.(1)将铁粉溶于稀硝酸,铁元素的存在形式可能为①___________、
②_________、③___________________。
(2)其原因为____________________________________________________
__________________________________________________________________________________________________________________________________________________________________________________________。
Fe(NO3)3
Fe(NO3)2
Fe(NO3)3和Fe(NO3)2
硝酸与变价金属(如Fe)反应,根据硝酸量的多少分别得到高价、低价或两种价态共存的混合物。
Fe(少量)+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O;
3Fe(过量)+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O
深度思考
2.某研究小组为了探究硝酸的性质,进行如下实验操作。
(1)从试剂柜中取一瓶浓硝酸,发现其保存在___色试剂瓶中,取少量浓硝酸于试管中,发现其溶液呈“黄色”,其原因是__________________
______________________________________________________________
_____________(用化学方程式和适当文字描述)。该研究小组尝试将显“黄色”的浓硝酸恢复到原本的无色。下列措施合理的是__(填字母)。
a.向浓硝酸中加水 b.向浓硝酸中通入适量空气
c.加热浓硝酸 d.向浓硝酸中加入适量的NaOH固体
棕
浓硝酸不稳定,见
光或受热易分解,4HNO3 4NO2↑+O2↑+2H2O,NO2溶于浓HNO3
使溶液呈黄色
b
深度思考
(2)向浓硝酸中加入稍过量铜片,该小组同学发现,生成的气体开始呈红棕色后逐渐变浅,最终气体变为无色,试写出上述反应的化学方程式:
_______________________________________________________________________________________,在上述反应中,硝酸体现的性质为_______________。
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)===
3Cu(NO3)2+2NO↑+4H2O
强氧化性和酸性
深度思考
(3)当实验完毕,该小组同学向试管中滴入少量稀H2SO4,发现铜片又逐渐溶解,产生无色气体,试写出上述反应的离子方程式:____________
____________________________。
(4)该小组同学向浓硝酸中加入少量碳粉,无明显现象,缓慢加热,发现碳粉逐渐溶解,产生红棕色气体,试写出上述反应的化学方程式:________________________________________,在该反应中硝酸体现的性质为_________。
3Cu+8H++
强氧化性
归纳总结
(1)硝酸与金属反应不能生成氢气。硝酸浓度不同,其还原产物不同,一般情况下,浓硝酸被还原为NO2,稀硝酸被还原为NO。
(2)硝酸能与大多数金属(金、铂等除外)反应,将金属氧化为高价态金属的硝酸盐。将浓硝酸与浓盐酸以1∶3的体积比混合,所得混合物称为王水,它能溶解一些不溶于硝酸的金属,如Pt、Au等。但在常温下,浓硝酸能使铁、铝钝化。
归纳总结
(3)热的浓硝酸可将非金属单质(碳、硫、磷等)氧化为最高价氧化物或最高价含氧酸。
(4)硝酸的强氧化性还表现在可以氧化具有还原性的化合物或离子,如SO2、FeO、Fe2+、Br-、I-、S2-、 等均能被硝酸氧化。
返回
酸雨及防治
二
1.酸雨
(1)二氧化硫和氮氧化物的来源
SO2:___、_____和某些_________的燃烧和冶炼;
NOx:机动车发动机中,燃料燃烧产生的高温条件会使空气中的N2与O2反应生成NOx。
(2)酸雨的形成
_________、_________以及它们在大气中发生反应后的生成物溶于雨水会形成酸雨。正常雨水由于溶解了CO2,其pH约为5.6,而酸雨的pH_____5.6。
煤
石油
金属矿物
二氧化硫
氮氧化物
小于
a.硫酸型酸雨的形成过程如图:
写出图中标号所对应的化学方程式:
①___________________。
②__________________。
③___________________。
④_____________________。
SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
b.硝酸型酸雨的形成过程如图:
写出图中标号所对应的化学方程式:
①_________________。
②_________________________。
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
2.酸雨的危害与防治
(1)危害:酸雨能直接_____农作物,_____森林和草原,使土壤、湖泊_____,加速建筑物、桥梁、工业设备、运输工具和电缆的腐蚀。
(2)防治
①消除_______,改变能源结构,开发利用清洁能源。
②对_________的排放加以控制,对排放的二氧化硫、氮氧化物等物质采取吸收、回收处理等措施。
损伤
破坏
酸化
污染源
酸性物质
(1)酸雨是指pH小于7的降雨( )
(2)化石燃料燃烧产生大量CO2,是形成酸雨的主要原因( )
(3)氮氧化物、硫的氧化物都可以形成酸雨( )
(4)防治酸雨的根本途径是减少人为SO2、NOx的排放( )
×
正误判断
√
×
√
应用体验
1.以下非金属氧化物与其引起的环境问题及主要来源对应正确的是
选项 氧化物 环境问题 主要来源
A CO2 破坏臭氧层 化石燃料的燃烧
B SO2 温室效应 工厂废气的排放
C NO2 光化学烟雾 汽车尾气的排放
D CO 酸雨 汽车尾气和化石燃料的不完全燃烧
√
2.(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h 0 1 2 3 4
雨水的pH 4.73 4.63 4.56 4.55 4.55
分析数据,回答下列问题:
①雨水样品的pH变化的原因是____________________________________
________(用化学方程式表示)。
SO2+H2O H2SO3、2H2SO3+O2===
2H2SO4
酸雨放置时pH变小,其原因是雨水中的H2SO3被空气中的氧气氧化所致:SO2+H2O H2SO3、2H2SO3+O2===2H2SO4。
②如果将刚取样的上述雨水与自来水相混合,pH将变___,原因是_____
_______________________________________________________(用化学方程式表示)。
雨水与自来水混合,应考虑SO2与Cl2或H2SO3与HClO的反应:SO2+2H2O+Cl2===H2SO4+2HCl或H2SO3+HClO===H2SO4+HCl。因此雨水与自来水混合后溶液pH将变小。
小
2H2O+SO2===H2SO4+2HCl(或H2SO3+HClO===H2SO4+HCl)
Cl2+
(2)下列可以减少酸雨产生的途径是___(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤
C
减少酸雨的产生需减少SO2的排放,将煤转化为清洁能源(如煤的气化和液化),燃料脱硫、固硫,开发不含硫的新能源(如氢能、核能等),都是有力措施,因此①③⑤正确。
知识拓展
SO2和NOx的吸收与处理
(1)含有SO2废气的两种处理方法
①钙基固硫法
工业上常用生石灰和含硫的煤混合后燃烧,燃烧时硫、生石灰、O2共同反应生成硫酸钙,从而使硫转移到煤渣中,反应的化学
方程式为CaO+SO2 CaSO3、2CaSO3+O2 2CaSO4,
总反应的化学方程式为2CaO+2SO2+O2 2CaSO4。
知识拓展
②氨水脱硫法
该脱硫法采用喷雾吸收法,雾化的氨水与烟气中的SO2直接接触吸收SO2,其反应的化学方程式为2NH3+SO2+H2O===
(NH4)2SO3、2(NH4)2SO3+O2===2(NH4)2SO4。
知识拓展
(2)含有NOx尾气的处理方法
①碱液吸收法
硝酸工业产生的废气中含有较多的NO、NO2,可用强碱溶液进行吸收,同时获得副产品。如:
2NO2+2NaOH===NaNO3+NaNO2+H2O;
NO2+NO+2NaOH===2NaNO2+H2O。
注意:NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是n(NO2)≥n(NO)。
知识拓展
②催化转化法
在催化剂、加热条件下,氮氧化物通过与氨或CO反应转化为无毒气体(N2),一般适用于汽车尾气的处理。如:6NO+4NH3
5N2+6H2O;6NO2+8NH3 7N2+12H2O。
返回
随堂演练 知识落实
1.下列反应中硝酸既表现出酸性又表现出氧化性的是
A.使石蕊溶液变红
B.与铜反应放出NO气体,生成Cu(NO3)2
C.与Na2CO3反应放出CO2气体,生成NaNO3
D.与S单质混合共热时生成H2SO4和NO2
√
1
2
3
在A、C项反应中HNO3均表现出酸性;
在B、D项反应中HNO3中氮元素的化合价均降低,表现出氧化性,并且在B项中又有Cu(NO3)2生成,说明此反应中HNO3还表现出酸性。
2.(2022·广东中山高一月考)酸雨是对pH小于5.6的降水的统称。下列说法错误的是
A.空气中的SO2溶于水,最终形成酸雨
B.工业废水任意排放是造成酸雨的主要原因
C.汽车排放的尾气、硝酸厂和化肥厂的废气都含有能形成酸雨的氮氧化物
D.为了减少酸雨的形成,必须减少SO2的排放量,可对燃料进行脱硫处理
1
2
3
√
二氧化硫与水反应生成亚硫酸,亚硫酸能被氧化为硫酸,从而形成酸雨,A项正确;
工业废水任意排放会造成水污染,与酸雨的形成无必然关系,B项错误;
汽车排放的尾气、硝酸厂和化肥厂的废气中都含有氮氧化物,C项正确;
燃料脱硫可减少二氧化硫的排放量,D项正确。
1
2
3
3.(2022·济南高一检测)某校课外活动小组为了探究铜与稀硝酸反应产生的气体是NO,设计了如图实验,实验过程中同时用石灰水吸收产生的氮氧化物获得应用广泛的Ca(NO2)2,实验装置如图所示。(已知:NO+
1
2
3
(1)实验之前通入N2的目的是________
_______________________________。
赶走装
置中的空气,防止对实验造成干扰
NO容易被氧气氧化为NO2,所以需要在反应前通入氮气赶走装置中的空气,防止对实验造成干扰。
1
2
3
(2)在(1)操作后将装置A中铜丝插入稀硝酸,溶液显蓝色,有无色气体生成,该反应中表现氧化性的硝酸与参与反应的硝酸物质的量之比为_____。
铜和稀硝酸反应的化学方程式为3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O,若有8 mol硝酸参加反应,表现氧化性的硝酸即生成NO的硝酸为2 mol,所以表现氧化性的硝酸与参与反应的硝酸物质的量之比为1∶4。
1
2
3
1∶4
(3)装置B中用注射器压入空气之后现象是_______________________。
生成的无色的NO和空气中的氧气反应生成红棕色的NO2:2NO+O2===2NO2。
1
2
3
烧瓶E中气体变为红棕色
(4)D装置的作用是__________________
______________。
D装置不但可以吸收多余的氮氧化物,球形干燥管还可以起到防止倒吸的作用。
1
2
3
吸收处理尾气NO2、
NO;防止倒吸
返回
课时对点练
题组一 硝酸的性质及实验探究
1.下列关于硝酸的叙述正确的是
A.NO2溶于水生成硝酸,所以NO2是酸性氧化物
B.硝酸可与活泼金属反应生成盐和氢气
C.浓硝酸显黄色是因为溶有NO2
D.硝酸与木炭的反应既表现出氧化性又表现出酸性
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
NO2溶于水生成硝酸,同时还生成了NO,所以NO2不是酸性氧化物,A项错误;
硝酸可与活泼金属反应生成盐、水和氮氧化物,不生成氢气,B项错误;
浓硝酸显黄色是因为浓硝酸分解生成的NO2溶解在浓硝酸中,C项正确;
硝酸与木炭反应,生成物中没有硝酸盐,硝酸只表现出氧化性,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
2.以下关于铜与浓硝酸、稀硝酸反应的说法错误的是
A.1 mol浓硝酸被还原转移2 mol电子
B.铜与浓硝酸反应比与稀硝酸反应剧烈
C.铜与浓、稀硝酸反应都不需要加热
D.生成等量的硝酸铜,消耗浓硝酸的量多
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1 mol浓HNO3被还原生成1 mol NO2,转移1 mol电子,A项错误;
浓硝酸的氧化性强于稀硝酸,Cu与浓HNO3反应比与稀HNO3反应剧烈,B项正确;
Cu与浓、稀HNO3反应都不需要加热,C项正确;
浓硝酸的还原产物是NO2,稀硝酸的还原产物是NO,根据得失电子守恒可判断生成等量的Cu(NO3)2,消耗浓HNO3的量多,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
3.(2022·青岛高一期末)下列事实不能说明浓硝酸氧化性比稀硝酸强的是
A.浓硝酸遇石蕊溶液先变红后褪色,稀硝酸遇石蕊溶液只变红不褪色
B.浓硝酸能与NO反应生成NO2,而稀硝酸不与NO反应
C.浓硝酸在加热条件下可与碳单质反应,而稀硝酸则不能
D.足量的铜分别还原含1 mol HNO3的浓硝酸和稀硝酸转移电子数分别为
NA和3NA
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A项,浓硝酸具有强氧化性,能将有色物质氧化,可以使石蕊溶液先变红后褪色,而稀硝酸只能使石蕊溶液变红,能说明浓硝酸的氧化性强于稀硝酸;
B项,浓硝酸能将NO氧化成NO2,体现浓硝酸的强氧化性,而稀硝酸不能将NO氧化成NO2,能说明浓硝酸的氧化性强于稀硝酸;
C项,浓硝酸在加热条件下能与碳单质反应,体现浓硝酸的强氧化性,而稀硝酸不与碳单质发生反应,能说明浓硝酸的氧化性强于稀硝酸;
D项,不能以转移电子多少判断氧化性的强弱,因此足量的铜分别还原含1 mol HNO3的浓硝酸和稀硝酸转移电子数分别为NA和3NA,不能说明浓硝酸的氧化性比稀硝酸的强。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4.向两支分别盛有浅绿色的Fe(NO3)2和FeSO4溶液的试管中分别逐滴加入稀盐酸时,溶液的颜色变化应该是
A.前者基本没有改变,后者变棕黄色
B.前者变棕黄色,后者也变棕黄色
C.前者变棕黄色,后者基本没有改变
D.前者、后者都基本没有改变
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
四种离子相互之间不反应,能在溶液中大量共存,D项正确。
题组二 酸雨及防治
6.在碳、氮、硫的氧化物中,许多是工业上重要的化工原料,但是当它们分散到空气中时,会带来很多环境问题。下列有关这些元素的氧化物的说法,不正确的是
A.开发太阳能、水能、风能、氢能等新能源将有利于减少这些氧化物的
产生
B.这些氧化物使雨水的pH<7,我们把pH<7的雨水称之为酸雨
C.氮与硫的氧化物还能直接危害人的身体健康,引发呼吸道疾病
D.“温室效应”与二氧化碳的排放有着直接的关系
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
正常雨水由于溶解了二氧化碳,其pH约为5.6,pH小于5.6的雨水才叫酸雨。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
7.中办、国办在第二轮中央生态环保督察启动之际印发了《中央生态环境保护督察工作规定》。可见国家对环境保护的重视程度。下列环境问题与产生的主要原因不相符的是
①“光化学烟雾”主要是由汽车排放的氮氧化物所引起的
②“酸雨”主要是由空气中CO2的浓度增大引起的
③“温室效应”主要是由空气中CO2浓度增大引起的
④“赤潮”主要是由于水体中N、P等元素含量过高而引起的
A.只有①② B.只有②③
C.全部 D.只有②
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
“酸雨”主要是由空气中SO2或NOx的浓度增大引起的。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
9.把铜粉和过量的铁粉加入热的浓硝酸中,充分反应后溶液中大量存在的金属阳离子是
A.只有Fe2+ B.只有Fe3+
C.有Fe2+和Cu2+ D.有Fe3+和Cu2+
√
铁的金属性强于铜,铁先与浓硝酸发生反应,铁被氧化为Fe3+;因为铁过量,硝酸完全被消耗,因此Cu不参与反应;过量的铁与Fe3+发生反应:Fe+2Fe3+===3Fe2+,因此充分反应后溶液中大量存在的金属阳离子是Fe2+,A项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
10.同学们在做铜与浓硝酸反应的实验时,发现反应后的溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种说法是否正确,这些方案中不可行的是
A.加水稀释该绿色溶液,观察溶液颜色变化
B.加热该绿色溶液,观察溶液颜色变化
C.向该绿色溶液中通入氮气,观察溶液颜色变化
D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察溶液颜色
变化
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A项,加入水,c(Cu2+)变小,同时水也会与溶液中可能溶有的NO2反应生成HNO3,故不能得出溶液呈绿色的原因,不可行;
B、C项操作都是赶出溶液中可能溶有的NO2,对c(Cu2+)大小无影响,可行;
D项,向无NO2的饱和硝酸铜溶液中通入NO2后,通过观察溶液颜色变化,可得出结论,可行。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
11.下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
A.由①中的红棕色气体,推
断产生的气体一定是混合
气体
B.红棕色气体不能表明②中
木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
① ② ③
①中浓HNO3受热分解,发生反应4HNO3(浓) 4NO2↑+O2↑+2H2O,产生的气体为混合气体,故A正确;
由①可知,浓硝酸受热分解可生成红棕色气体NO2,所以“产生红棕色气体”不能说明②中木炭与浓硝酸发生了反应,故B正确;
根据①和②,浓硝酸反应产生红棕色NO2时需要加热,所以浓硝酸具有挥发性才可与上方红热木炭接触,同时,氮元素化合价降低,所以生成的NO2为还原产物,故C正确;
红热木炭可与空气中的O2反应生成CO2,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
12.一定温度下,探究铜与稀HNO3的
反应过程如图,下列说法不正确的是
A.步骤Ⅰ中生成无色气体的离子方程
式是3Cu+ +8H+===3Cu2++2NO↑+4H2O
B.步骤Ⅲ反应速率比Ⅰ快的原因是NO2溶于水,使c(HNO3)增大
C.由实验可知,NO2可能对该反应具有催化作用
D.当活塞不再移动时,再抽入空气,铜可以继续溶解
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
步骤Ⅰ的反应是Cu和稀HNO3的反
应,离子方程式为3Cu+ +8H+
===3Cu2++2NO↑+4H2O,A项
正确;
随着反应的进行,溶液中生成Cu(NO3)2,根据氮原子守恒,c(HNO3)不会增大,B项错误;
生成NO2后,反应速率加快,说明NO2可能对该反应具有催化作用,C项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
再抽入空气,NO和O2反应生成NO2,NO2和水反应生成HNO3,铜可以与HNO3继续反应而溶解,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13.下表是部分城市某日空气质量日报:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
城市 污染指数 首要污染物 空气质量等级
SO2 NO2 PM10 A 98 23 67 SO2 Ⅱ
B 47 29 35 SO2 Ⅰ
C 62 80 113 PM10 Ⅲ
D 52 76 59 NO2 Ⅰ
(1)由题表可知,空气质量日报中涉及的污染物主要是__________和可吸入颗粒物(PM10)。
分析图表中的物质和数据可知涉及的污染物主要是SO2、NO2和可吸入颗粒物(PM10)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
SO2、NO2
(2)SO2的排放是造成酸雨的主要因素。形成酸雨的原因之一可简单表示如下:
酸雨的pH<5.6。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
请回答下列问题:
①酸雨的pH___(填“>”“<”或“=”)5.6。
<
②反应b的化学方程式为____________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
③在一段时间内连续不断测定溶液D的pH,发现pH变小,表示该变化的化学方程式是_____________________。
亚硫酸能够被空气中的氧气氧化生成硫酸,弱酸转化为强酸,pH变小。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
2H2SO3+O2===2H2SO4
④若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:_______________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
14.某化学学习小组采用下列装置,对浓硝酸与木炭的反应进行探究[已知:4HNO3(浓) 4NO2↑+O2↑+
2H2O]。
请回答下列问题。
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,立即伸入三颈烧瓶中,并塞紧瓶塞,滴加浓硝酸,可观察到三颈烧瓶中气体的颜色为________,产生该气体的化学方程式是________________
____________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
红棕色
4NO2↑+CO2↑+2H2O
C+4HNO3(浓)
装置A中发生的是浓硝酸与木炭的反应,生成NO2、CO2、H2O,由于NO2为红棕色气体,故三颈烧瓶中气体的颜色为红棕色。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)装置C中盛有足量Ba(OH)2溶液,反应一段时间后可观察到C中出现白色沉淀,该白色沉淀为_______(写化学
式)。其中的Ba(OH)2溶液____(填“能”
或“不能”)用Ca(OH)2溶液代替,理由
是___________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
BaCO3
不能
Ca(OH)2溶液中Ca(OH)2的浓度较低,不能形成CaCO3沉淀
将NO2、CO2通入Ba(OH)2溶液中分
别生成Ba(NO3)2和BaCO3,由于
Ba(OH)2溶液足量,故溶液为碱性
环境,BaCO3不溶解以沉淀形式析出。Ba(OH)2溶液不能用Ca(OH)2溶液代替,因为Ca(OH)2微溶于水,Ca(OH)2溶液中Ca(OH)2含量太少,浓度太低,不足以完全吸收生成的酸性气体,导致溶液呈酸性,从而不能生成CaCO3沉淀。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(3)装置B的作用是_______。
装置B可以防止装置C中酸性气体因溶解速率太快而出现倒吸。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
防倒吸
(4)装置D中收集到了无色气体,部分同学认为是NO,还有部分同学认为是O2。
①下列对该气体的检验方法合理的是
____(填字母)。
A.敞口观察集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
1
2
3
4
5
6
7
8
9
10
11
12
13
14
AC
NO与空气中的O2反应生成红棕色的NO2,A正确;
NO和O2均不具有酸性,B错误;
O2能使带火星的木条复燃,而NO不能,C正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
②如果集气瓶中收集到的无色气体是氧气,则氧气的来源是_____________。
装置A中除发生木炭与浓硝酸的反应外,还可能发生浓硝酸的分解反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
浓硝酸的分解
返回
本课结束
第五章
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
