第六章 第一节 第1课时 化学反应与热能 课件(共82张PPT)
文档属性
| 名称 | 第六章 第一节 第1课时 化学反应与热能 课件(共82张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 18:51:44 | ||
图片预览











文档简介
(共82张PPT)
第1课时
DIYIKESHI
吸热反应和放热反应 / 化学反应中能量变化的原因 / 化学能与热能相互转化的应用 / 随堂演练 知识落实 / 课时对点练
化学反应与热能
第六章
核心素养
发展目标
1.知道化学反应可以实现化学能与热能的转化,认识吸热反应和放热反应。
2.能从化学键变化的角度解释某些吸热反应和放热反应。
3.认识燃料的燃烧效率、保护环境、开发清洁燃料的必要性和重要性。
内容索引
一、吸热反应和放热反应
二、化学反应中能量变化的原因
三、化学能与热能相互转化的应用
课时对点练
随堂演练 知识落实
吸热反应和放热反应
一
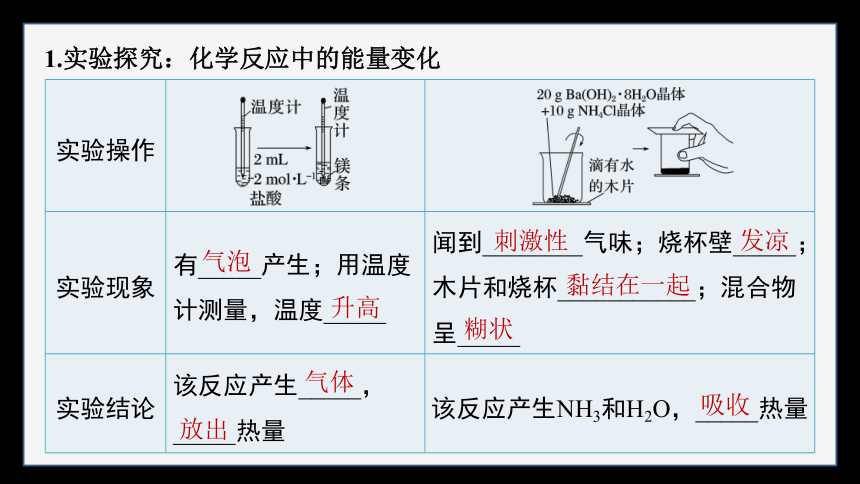
1.实验探究:化学反应中的能量变化
实验操作
实验现象 有_____产生;用温度计测量,温度_____ 闻到________气味;烧杯壁_____;木片和烧杯___________;混合物呈_____
实验结论 该反应产生_____,_____热量 该反应产生NH3和H2O,_____热量
气泡
升高
刺激性
发凉
黏结在一起
糊状
气体
放出
吸收
化学方 程式 __________________________ ________________________________________________
Mg+2HCl===MgCl2
+H2↑
Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O
结论:化学反应除了有新物质生成以外,还总会伴随着能量变化,通常主要表现为热量的_____或_____。
释放
吸收
2.放热反应和吸热反应
(1)概念
①放热反应:_____热量的化学反应。
②吸热反应:_____热量的化学反应。
释放
吸收
(2)常见的放热反应和吸热反应
放热反应 吸热反应
①所有燃烧反应 ②酸碱中和反应 ③大多数化合反应 ④活泼金属跟水或酸的反应 ⑤物质的缓慢氧化 ⑥铝热反应(见第八章) ①大多数分解反应
②铵盐与碱的反应,如Ba(OH)2·8H2O晶体或Ca(OH)2与NH4Cl晶体反应
③以C、H2、CO为还原剂的部分氧化还原反应,如C与H2O(g)反应,C与CO2反应
④NaHCO3与盐酸的反应
(1)硝酸铵固体溶于水,溶液的温度降低,该变化为吸热反应( )
(2)氢气燃烧,浓硫酸溶于水,都放出热量,这些变化都为放热反应( )
(3)镁条在空气中燃烧是放热反应,反应过程中所释放的能量全部转化为热能( )
(4)吸热反应需要加热才能进行,放热反应都不需要加热就可以进行( )
×
正误判断
×
×
×
应用体验
1.下列反应既属于氧化还原反应,又属于吸热反应的是
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2的反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
锌粒与稀硫酸的反应、甲烷的燃烧反应均是放热反应,A、C项错误;
Ba(OH)2·8H2O晶体与NH4Cl晶体的反应是吸热反应,但反应前后所含元素的化合价均无变化,是非氧化还原反应,D项错误。
√
2.把下列物质分别加入装有水的锥形瓶中,立即塞紧带U形管的塞子,已知U形管内预先装有少量水(为便于观察,预先将水染成红色),如图所示,结果U形管左边液面升高,则加入的物质可能是
A.NaOH固体
B.浓H2SO4
C.NH4NO3晶体
D.Na2O2固体
√
U形管左边液面升高,原因只能是锥形瓶内气体压强减小,造成压强减小的原因可能是温度降低。NaOH固体溶于水、浓H2SO4稀释溶液温度均升高,NH4NO3晶体溶于水温度降低,Na2O2和水反应放热且有气体生成。
归纳总结
有关吸热反应和放热反应理解的三个“不一定”
(1)放热反应不一定容易发生,如合成氨反应需要在高温、高压和催化剂作用下才能发生;吸热反应不一定难发生,如盐酸与碳酸氢钠的反应在常温下就能发生。
(2)需要加热才能发生的反应不一定是吸热反应,如硫与铁的反应;吸热反应不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
归纳总结
(3)放热过程不一定是放热反应,如NaOH固体的溶解和浓硫酸的稀释是放热过程,但不是放热反应;吸热过程不一定是吸热反应,如升华、蒸发等过程是吸热过程,但不是吸热反应。
返回
化学反应中能量变化的原因
二
1.从化学键变化的角度理解能量变化的原因(微观探析)
(1)原因
吸收
释放
吸热
放热
(2)实例
H2(g)+Cl2(g)===2HCl(g)的反应过程如图所示:
吸收
释放
吸收
根据上图计算1 mol H2和1 mol Cl2断键吸收的总能量为_____ kJ,形成
2 mol HCl共释放_____ kJ能量,断键吸收的总能量___成键释放的总能量,因此该反应为_____反应。
679
862
放热
<
2.从反应物及生成物总能量高低理解能量变化的原因(宏观辨识)
物质的组成、结构与_____不同,所具有的能量不同。因此,一个化学反应的能量变化取决于_____________和_____________的相对大小。
状态
反应物总能量
生成物总能量
放热反应 吸热反应
化学能转化为_____ 热能转化为_______被生成物“储存”
释放
吸收
热能
化学能
(1)对于一个化学反应来说,当化学键断裂时吸收的总能量大于化学键形成时放出的总能量,则反应放热( )
(2)相同条件下形成1 mol H—Cl放出的能量与断开1 mol H—Cl吸收的能量相等( )
(3)任何化学反应,都有物质变化,同时伴随着能量变化( )
(4)放热反应为“贮存”能量的过程,吸热反应为“释放”能量的过程( )
(5)已知Fe与稀盐酸的反应为放热反应,即Fe的能量大于H2的能量( )
(6)石墨转化为金刚石需要吸收热量,所以石墨更稳定( )
×
正误判断
√
√
×
×
√
应用体验
1.已知某化学反应A2(g)+2B2(g)===2AB2(g)(A2、B2、AB2的结构式分别为A===A、B—B、B—A—B),反应过程中的能量变化如图所示,下列有关叙述正确的是
A.该反应的进行一定需要加热或点燃
B.该反应若生成2 mol AB2(g),则放出的热量为
(E1-E2) kJ
C.该反应断开反应物中化学键吸收的总能量大
于形成生成物中化学键释放的总能量
D.生成2 mol B—A放出E2 kJ能量
√
根据图示可知,该反应断开反应物中化学键吸
收的总能量大于形成生成物中化学键释放的总
能量,为吸热反应;若生成2 mol AB2(g),则
吸收的热量为(E1-E2) kJ,C项正确、B项错误;
该反应的进行不一定需要加热或点燃,A项错误;
生成4 mol B—A放出E2 kJ能量,D项错误。
2.已知N2(g)和O2(g)反应生成2 mol NO(g)吸收180 kJ能量,反应过程中能量变化如图所示。
根据图示回答下列问题:
(1)该反应中反应物所具有的总能量_____
(填“高于”或“低于”)生成物所具有的
总能量。
(2)1 mol NO(g)分子中的化学键断裂时要吸收____ kJ能量。
(3)断裂1 mol N≡N吸收的能量值x为____。
低于
632
946
根据图示,断裂旧化学键所吸收的能
量为(x+498) kJ,形成新化学键所释
放的能量为2×632 kJ=1 264 kJ,每
生成2 mol NO(g)所吸收能量为180 kJ,
因此有180 kJ=(x+498) kJ-1 264 kJ,故x为946。
练后反思
判断吸热反应和放热反应的两种方法
(1)根据反应物和生成物的总能量的相对大小判断——反应物的总能量高于生成物的总能量的反应为放热反应,反之为吸热反应(宏观角度)。
(2)根据化学键断裂和形成时能量变化大小关系判断——断裂反应物中化学键吸收的能量大于形成生成物中化学键放出的能量的反应为吸热反应,反之为放热反应(微观角度)。
返回
化学能与热能相互转化的应用
三
1.现阶段人类获取热能的主要途径是___________;使用最多的常规能源是__________________________。
2.化石燃料获取能量面临的问题
(1)储量有限,短期内不可再生。
(2)影响环境:煤、石油产品燃烧排放的_____________________等是大气污染物的主要来源。
物质的燃烧
化石燃料(煤、石油和天然气)
粉尘、SO2、NOx、CO
3.节能减排的措施
(1)燃料燃烧阶段提高燃料的燃烧效率。
通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率。
(2)能量利用阶段提高能源的利用率。如使用节能灯,发电厂、钢铁厂余热与城市供热联产等。
(3)开发使用新能源,目前人们比较关注的新能源有_______、风能、地热能、海洋能和_____等。
太阳能
氢能
应用体验
1.下列有关新能源的说法不正确的是
A.绿色植物通过光合作用,将光能转化为化学能
B.风能、太阳能是清洁能源
C.氢能还未进入实用阶段的主要原因是其燃烧所释放热量低于相同质量
的矿物燃料
D.共享单车利用太阳能发电完成卫星定位,有利于节能环保
√
2.在人类生产、生活对能量的需求日益增长的今天,研究化学反应及其能量变化,对合理利用常规能源和开发新能源具有十分重要的意义。能源是人类赖以生存和发展不可缺少的因素。请完成下列问题:
(1)矿物能源是现代人类社会赖以生存的重要物质基础。目前,全球仍主要处于化石能源时期。下列不属于化石能源的是___(填字母,下同)。
A.石油 B.煤
C.天然气 D.生物质能
D
(2)下列对能源的看法合理的是_______。
A.化石能源属于不可再生能源,只会越用越少
B.生物质能是一种可再生能源,有广阔的应用前景
C.太阳能、氢能、风能、地热能都属于新能源
D.我国人口众多、资源相对匮乏、环境承载能力较弱,因此要建设节约
型社会
ABCD
归纳总结
返回
随堂演练 知识落实
1.(2022·黑龙江大庆中学高一期中)下列关于化学反应与能量的说法中,不正确的是
A.盐酸与碳酸氢钠的反应属于吸热反应
B.化学变化中,反应物断裂化学键释放能量,生成物形成化学键吸收能量
C.一个化学反应是吸热还是放热,与反应物总能量和生成物总能量的相
对大小有关
D.钠与水的反应属于放热反应
1
2
3
4
5
√
盐酸与碳酸氢钠反应生成氯化钠、二氧化碳和水,该反应属于吸热反应,A正确;
化学变化中,反应物断裂化学键吸收能量,生成物形成化学键释放能量,B错误;
一个化学反应是吸热还是放热,与反应物总能量和生成物总能量的相对大小有关,若反应物的总能量大于生成物的总能量,则该反应是放热反应;若反应物的总能量小于生成物的总能量,则该反应是吸热反应,C正确;
钠与水反应生成氢氧化钠和氢气,反应过程中钠会融化成光亮的小球,该反应属于放热反应,D正确。
1
2
3
4
5
2.(2022·江苏淮安高一期中)下列反应或过程中能量的变化符合图像的是
A.H+H―→ H—H
B.2NH4Cl+Ba(OH)2·8H2O===BaCl2+2NH3↑+10H2O
C.Mg+2HCl===MgCl2+H2↑
D.H2SO4+2KOH===K2SO4+2H2O
1
2
3
4
5
√
根据图像,生成物的总能量大于反应物的总能量,说明反应是吸热反应或过程。A项,形成化学键的过程中会放出能量,错误;
C项,属于金属与酸的反应,是放热反应,错误;
D项,属于酸碱中和反应,是放热反应,错误。
1
2
3
4
5
3.如图是某化学反应过程中能量变化的曲线图。下列叙述正确的是
A.该反应为吸热反应
B.该图可以表示Zn与盐酸反应的能量变化
C.该反应先发生物质变化后发生能量变化
D.断开反应物中化学键吸收的能量大于形
成生成物中化学键放出的能量
1
2
3
4
5
√
A错,由图可知,反应物的总能量高于生成物的
总能量,则该反应是放热反应;
B对,Zn和盐酸反应生成ZnCl2和H2,并放出热
量,符合图示能量变化;
C错,化学反应过程中,物质变化和能量变化同时发生;
D错,该反应是放热反应,断开反应物中化学键吸收的能量小于形成生成物中化学键放出的能量。
1
2
3
4
5
4.液态储氢技术就是在常温常压下将氢气融入到一种化合物“储油”中,形成“氢油”,便于储存和运输。下列有关说法错误的是
A.“氢油”不稳定
B.氢能源属于可再生能源
C.该技术实现了常温常压下储氢技术的新突破
D.液态储氢项目有利于发展氢能源电动机,从而带来新能源汽车的升级
√
1
2
3
4
5
“氢油”便于储存和运输,说明它比较稳定,故A错误;
氢气燃烧生成水,水分解又生成氢气,故氢能源属于可再生能源,故B正确;
常温常压下可以将氢气融入到一种化合物“储油”中,故该技术实现了常温常压下储氢技术的新突破,故C正确;
液态储氢解决了氢能储存难、运输难的问题,能实现氢能的广泛应用,故有利于发展氢能源电动机,从而带来新能源汽车的升级,故D正确。
1
2
3
4
5
5.化学反应N2(g)+3H2(g) 2NH3(g)的能量变化如图所示,请回答下列问题:
(1)图中A、C分别表示______________________
_________、____________________,反应____
(填“吸收”或“释放”)能量。
A、C分别表示1 mol N2(g)和3 mol H2(g)(反应物)的总能量、2 mol NH3(g)(生成物)的总能量,由于反应物总能量高于生成物总能量,因此反应放出能量。
1
2
3
4
5
1 mol N2(g)和3 mol H2(g)
的总能量
2 mol NH3(g)的总能量
释放
(2)反应过程中断裂的化学键为______________
___________,_____(填“吸收”或“释放”)的能量为___;形成的化学键为____________,_____(填“吸收”或“释放”)的能量为___。
反应过程中断裂的化学键为1 mol N≡N和3 mol H—H,吸收的能量为E1;形成的化学键为6 mol N—H,释放的能量为E3。
1
2
3
4
5
1 mol N≡N和
吸收
E1
6 mol N—H
释放
E3
3 mol H—H
(3)E2=______或_______(用A、C或E1、E3表示)。
1
2
3
4
5
A—C E3-E1
返回
课时对点练
题组一 化学反应与能量变化的关系
1.下列对于化学反应过程的理解,错误的是
A.化学反应过程中同时存在物质和能量的变化
B.凡是能量变化一定发生在化学变化中
C.化学反应中同时存在质量守恒和能量守恒
D.能量的释放和吸收以发生变化的物质为基础
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
化学反应过程中都会伴随着物质变化和能量变化,A正确;
化学变化过程中往往伴随着能量的变化,而有能量变化时不一定发生化学变化,如灯泡通电发光放热,B错误;
化学反应的实质是原子的重新组合,符合质量守恒定律;化学反应过程中往往伴随着能量的变化,符合能量守恒定律,C正确;
化学反应过程中同时存在物质和能量的变化,且能量的释放和吸收是以发生变化的物质为基础的,二者密不可分,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2.(2022·重庆市育才中学高一期中)下列说法不正确的是
A.在常温下可以发生的反应不一定是放热反应
B.化学反应必然伴随能量变化,原因是化学反应中旧键断裂所吸收的能
量与新键形成所释放的能量不相等
C.一定条件下,石墨转化为金刚石要吸收能量,说明石墨比金刚石稳定,
等质量的金刚石和石墨完全燃烧石墨释放的能量更多
D.化学反应中能量变化的大小与反应物的质量多少有关
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
化学反应中旧键断裂所吸收的能量与新键形成所释放的能量不相等,使得化学反应的过程中伴随着能量的变化,B正确;
一定条件下,石墨转化为金刚石要吸收能量,说明等质量的情况下,石墨所含能量更低,则石墨比金刚石稳定,且等质量的金刚石和石墨完全燃烧,金刚石释放的能量更多,C错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组二 吸热反应和放热反应
3.(2022·黑龙江鸡西市第四中学高一期中)下列过程属于吸热反应的是
A.水的分解
B.盐酸与氢氧化钠溶液反应
C.金属镁与盐酸反应
D.铁丝在氧气中燃烧
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
常见的放热反应有:所有的物质燃烧的反应、所有金属与酸或与水的反应、所有中和反应、绝大多数化合反应、铝热反应;常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解反应(如某些铵盐和强碱的反应)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
4.(2022·河南商丘市第一高级中学高一阶段检测)下列各组变化中,前者属于吸热反应,后者属于放热反应的是
A.生石灰与水反应;醋酸与氢氧化钠反应
B.煅烧石灰石;碳酸氢钠与盐酸反应
C.Ba(OH)2·8H2O与NH4Cl反应;钠与水反应
D.甲烷的燃烧;过氧化氢的分解
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
生石灰与水反应为放热反应,醋酸与氢氧化钠反应即酸碱中和反应为放热反应,故A错误;
煅烧石灰石属于吸热反应,碳酸氢钠与盐酸的反应属于吸热反应,故B错误;
Ba(OH)2·8H2O与NH4Cl的反应属于吸热反应,钠与水反应是放热反应,故C正确;
甲烷的燃烧属于放热反应,过氧化氢的分解反应属于放热反应,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组三 化学反应中能量变化的实质
5.(2022·合肥高一期中)已知反应A+B===C+D的能量变化如图所示,下列说法不正确的是
A.该反应为吸热反应
B.该反应吸收的能量为E1-E2
C.该图可表示为酸和碱的反应图像
D.该反应中反应物的总能量低于生成物的总能量
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由图可知,该反应中反应物的总能量低于生成物的总能量,为吸热反应,A、D正确;
酸碱中和反应为放热反应,图为吸热反应,C错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
6.100 kPa时,1 mol石墨转化为金刚石的能量变化如图所示,下列说法正确的是
A.石墨比金刚石更稳定
B.金刚石比石墨更稳定
C.石墨转化为金刚石的反应为放热反应
D.破坏1 mol石墨中的化学键所吸收的能量小于形成1 mol金刚石中的化
学键所放出的能量
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由图可知,石墨转化为金刚石要吸收能量,说
明石墨的能量低,更稳定,选项A正确,选项B
错误;
由图可知,石墨转化为金刚石要吸收能量,反应为吸热反应,选项C错误;
由图可知,反应为吸热反应,故破坏1 mol石墨中的化学键所吸收的能量大于形成1 mol金刚石中的化学键所放出的能量,选项D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
7.化学家证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
下列关于合成氨反应的叙述不正确的是
A.该过程表明,在化学反应中存在化学键的断裂与形成
B.在催化剂的作用下,反应物的化学键变得容易断裂
C.过程②需吸收能量,过程③则放出能量
D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
由图可知,每3个氢气分子和
1个氮气分子断键得到原子,
然后氢原子和氮原子生成2个
氨分子,A项正确;
催化剂能改变化学反应的速率,合成氨的反应在催化剂作用下,反应速率加快,意味着反应物中化学键的断裂和生成物中化学键的形成变得更容易,B项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
化学键的断裂需要吸收能
量,而化学键的形成则放
出能量,从图中可看出②
为化学键断裂过程,③为新化学键形成过程,C项正确;
化学键的断裂需要吸收能量,所以该反应在常温下难以进行,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组四 人类对能源的利用及能源现状
8.人类将在未来几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能的转换形态),人们将适应“低碳经济”和“低碳生活”。下列说法不正确的是
A.研究菠菜蛋白质“发电”不属于“太阳能文明”
B.发展太阳能经济有助于减缓温室效应
C.太阳能电池可将太阳能直接转化为电能
D.石油和天然气都属于碳素燃料
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
菠菜蛋白质“发电”属于“太阳能文明”,A错误;
发展太阳能经济有助于减缓温室效应,B正确;
太阳能电池可将太阳能直接转化为电能,C正确;
石油和天然气都属于碳素燃料,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
9.下列关于能源和作为能源使用的物质的叙述错误的是
A.化石能源物质内部蕴含着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在一定条件下转化为热能、电能,为人类所利用
D.吸热反应没有利用价值
光合作用、水煤气的制取都是吸热反应,都具有很高的利用价值。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
10.下列叙述正确的是
A.生成物总能量一定低于反应物总能量
B.酒精可用作燃料,说明酒精燃烧是放热反应
C.硝酸铵溶于水温度降低,这个变化是吸热反应
D.在H2与Cl2的反应过程中,释放的能量小于吸收的能量
√
E生成物>E反应物为吸热反应,E生成物燃烧放热,故B正确;
硝酸铵溶于水是物理变化,故C错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.(2022·昆明市第三中学高一期中)下列变化过程符合如图能量变化规律的是
①金属铝与氢氧化钠溶液反应
②NH4Cl固体与Ca(OH)2固体制备NH3
③Na在Cl2中燃烧
④水蒸气变成液态水
⑤硫酸和氢氧化钡溶液反应
⑥碳酸氢钠热分解
A.①②⑤ B.①③⑤ C.③④⑤ D.②④⑥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
根据图示可知,反应物的总能量比生成物的总能量
高,发生的反应为放热反应。金属铝与氢氧化钠溶
液反应是放热反应,①符合题意;
NH4Cl固体与Ca(OH)2固体制备NH3的反应是吸热反
应,②不符合题意;
Na在Cl2中燃烧放出热量,反应为放热反应,③符合题意;
水蒸气变成液态水放出热量,但为物质的状态变化,不是化学反应,④不符合题意;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
硫酸和氢氧化钡溶液发生中和反应放出热量,该反应为放热反应,⑤符合题意;
碳酸氢钠热分解反应是吸热反应,⑥不符合题意;综上所述,属于放热反应的是①③⑤。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
12.(2022·江西临川一中高一阶段检测)某反应由两步反应A B C构成,反应过程中的能量变化曲线如图,下列叙述正确的是
A.A与C的能量差为E1
B.两步反应均为吸热反应
C.三种化合物中C最稳定
D.反应A B,反应条件一定要加热
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由图像可知,A和C的能量差为E4+E2-E1
-E3,A项错误;
A到B为吸热反应,B到C为放热反应,B项
错误;
物质的能量越低越稳定,从图中可知C能量最低,故C最稳定,C项正确;
反应吸、放热由反应物和生成物的总能量决定,与反应条件无关,故吸热反应不一定需要加热,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.NF3是一种温室气体,其储存能量的能力是CO2的12 000~20 000倍。已知:断开1 mol N≡N吸收的能量为946 kJ,断开1 mol F—F吸收的能量为154.8 kJ,断开1 mol N—F吸收的能量为283 kJ。下列说法正确的是
A.N2(g)―→ 2N(g)的过程会放出能量
B.N(g)+3F(g)―→ NF3(g)的过程会放出能量
C.N2(g)+3F2(g)===2NF3(g)的反应为吸热反应
D.如果NF3吸收能量后没有化学键的断裂与形成,仍可能会发生化学反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
N2(g)―→ 2N(g)的过程是化学键断裂的过程,需要吸收能量,A项错误;
N(g)+3F(g)―→ NF3(g)的过程为形成化学键的过程,会放出能量,B项正确;
在反应N2(g)+3F2(g)===2NF3(g)中,形成2 mol NF3中的化学键释放的能量为6×283 kJ=1 698 kJ,断裂1 mol N2和3 mol F2中的化学键需吸收的能量为1×946 kJ+3×154.8 kJ=1 410.4 kJ,放出的能量>吸收的能量,该反应为放热反应,C项错误;
化学反应的实质是旧化学键的断裂和新化学键的形成,如果NF3吸收能量后没有化学键的断裂与生成,则不可能发生化学反应,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
14.在一定条件下A与B反应可生成C和D,其能量变化如下:
(1)若E1>E2,反应体系的总能量_____(填“升高”或“降低”),为____
(填“吸热”或“放热”)反应,其原
因是___________________________
_________________________。
若E1>E2,反应体系的总能量降低,故反应物的部分化学能通过化学反应转化为热能释放给环境,则生成物的总能量小于反应物的总能量,依据反应前后能量守恒可知反应是放热反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
降低
放热
反应物的部分化学能通过化学
反应转化为热能释放给环境
(2)若E1<E2,反应体系的总能量______(填“升高”或“降低”),为_____(填“吸热”或“放热”)反应,其原因是______________________。
若E1<E2,反应体系的总能量升高,故反应物从环境中吸收能量,则生成物的总能量大于反应物的总能量,依据反应前后能量守恒可知反应是吸热反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
升高
吸热
反应物从环境中吸收能量
15.为探究Na2CO3、NaHCO3与盐酸的反应是吸热反应还是放热反应,某同学进行了下列实验(盐酸浓度相同,每项实验各做3次,取平均值)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
实验序号 试剂 固体 混合前温度/℃ 混合后温度/℃
a 35 mL水 2.5 g NaHCO3 20.0 18.5
b 35 mL水 3.2 g Na2CO3 20.0 24.3
c 35 mL盐酸 2.5 g NaHCO3 20.0 16.2
d 35 mL盐酸 3.2 g Na2CO3 20.0 25.1
(1)设计a、b组实验的目的是______________________________________
________。
作为对照实验,排除物质溶解而造成的热
量变化
(2)通过上述实验可得出结论:Na2CO3溶液和盐酸的反应是______(填“吸热”或“放热”,下同)反应;NaHCO3溶液和盐酸的反应是_____反应,NaHCO3溶液和盐酸反应的能量变化对应的图像是___(填字母)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
吸热
放热
A
由实验b、d可知,当Na2CO3与盐酸反应后,混合溶液的温度比Na2CO3在相同量水中溶解后的温度高,说明Na2CO3与盐酸的反应为放热反应;由实验a、c可知,当NaHCO3与盐酸反应后,混合溶液的温度比NaHCO3在相同量水中溶解后的温度低,说明碳酸氢钠与盐酸的反应为吸热反应,反应物的总能量小于生成物的总能量,A项图示能量变化符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.Ⅰ.下表中的数据是破坏1 mol物质中的化学键所吸收的能量:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
物质 Cl2 Br2 I2 HCl HBr HI H2
能量/kJ 243 193 151 432 366 298 436
根据上述数据,回答下列问题:
(1)下列物质本身具有的能量最低的是___(填字母,下同)。
A.H2 B.Cl2 C.Br2 D.I2
A
(2)下列氢化物中最稳定的是___。
A.HCl B.HBr C.HI
破坏1 mol 物质中的化学键所吸收的能量越大,则物质越稳定,所具有的能量越低。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Cl2
(3)X2(g)+H2(g)===2HX(g)(X代表Cl、Br、I)的反应是_________(填“吸热反应”或“放热反应”)。
放热反应
以氯元素为例计算断开1 mol Cl—Cl和H—H需吸收能量:243 kJ+436 kJ=679 kJ,而形成2 mol HCl放出的能量为2×432 kJ=864 kJ,所以在Cl2(g)+H2(g)===2HCl(g)反应中放出864 kJ-679 kJ=185 kJ的热量,同理可计算在Br2(g)+H2(g)===2HBr(g)、I2(g)+H2(g) 2HI(g)反应中,分别放出103 kJ、9 kJ的热量。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Ⅱ.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能[通常把拆开(或形成)1 mol化学键吸收(或放出)的能量称为键能]:P—P为198 kJ·mol-1、P—O为360 kJ·mol-1、O==O为498 kJ·mol-1。则P4(白磷,s)+3O2(g)===P4O6(s)的反应是_____(填“吸热”或“放热”)反应,生成1 mol P4O6放出的热量为________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
放热
1 638 kJ
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
返回
断开旧键吸收的能量为6×198 kJ+3×498 kJ=2 682 kJ,形成新键放出的能量为12×360 kJ=4 320 kJ,故该反应为放热反应,生成1 mol P4O6放出的热量为4 320 kJ-2 682 kJ=1 638 kJ。
本课结束
第六章
第1课时
DIYIKESHI
吸热反应和放热反应 / 化学反应中能量变化的原因 / 化学能与热能相互转化的应用 / 随堂演练 知识落实 / 课时对点练
化学反应与热能
第六章
核心素养
发展目标
1.知道化学反应可以实现化学能与热能的转化,认识吸热反应和放热反应。
2.能从化学键变化的角度解释某些吸热反应和放热反应。
3.认识燃料的燃烧效率、保护环境、开发清洁燃料的必要性和重要性。
内容索引
一、吸热反应和放热反应
二、化学反应中能量变化的原因
三、化学能与热能相互转化的应用
课时对点练
随堂演练 知识落实
吸热反应和放热反应
一
1.实验探究:化学反应中的能量变化
实验操作
实验现象 有_____产生;用温度计测量,温度_____ 闻到________气味;烧杯壁_____;木片和烧杯___________;混合物呈_____
实验结论 该反应产生_____,_____热量 该反应产生NH3和H2O,_____热量
气泡
升高
刺激性
发凉
黏结在一起
糊状
气体
放出
吸收
化学方 程式 __________________________ ________________________________________________
Mg+2HCl===MgCl2
+H2↑
Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O
结论:化学反应除了有新物质生成以外,还总会伴随着能量变化,通常主要表现为热量的_____或_____。
释放
吸收
2.放热反应和吸热反应
(1)概念
①放热反应:_____热量的化学反应。
②吸热反应:_____热量的化学反应。
释放
吸收
(2)常见的放热反应和吸热反应
放热反应 吸热反应
①所有燃烧反应 ②酸碱中和反应 ③大多数化合反应 ④活泼金属跟水或酸的反应 ⑤物质的缓慢氧化 ⑥铝热反应(见第八章) ①大多数分解反应
②铵盐与碱的反应,如Ba(OH)2·8H2O晶体或Ca(OH)2与NH4Cl晶体反应
③以C、H2、CO为还原剂的部分氧化还原反应,如C与H2O(g)反应,C与CO2反应
④NaHCO3与盐酸的反应
(1)硝酸铵固体溶于水,溶液的温度降低,该变化为吸热反应( )
(2)氢气燃烧,浓硫酸溶于水,都放出热量,这些变化都为放热反应( )
(3)镁条在空气中燃烧是放热反应,反应过程中所释放的能量全部转化为热能( )
(4)吸热反应需要加热才能进行,放热反应都不需要加热就可以进行( )
×
正误判断
×
×
×
应用体验
1.下列反应既属于氧化还原反应,又属于吸热反应的是
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2的反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
锌粒与稀硫酸的反应、甲烷的燃烧反应均是放热反应,A、C项错误;
Ba(OH)2·8H2O晶体与NH4Cl晶体的反应是吸热反应,但反应前后所含元素的化合价均无变化,是非氧化还原反应,D项错误。
√
2.把下列物质分别加入装有水的锥形瓶中,立即塞紧带U形管的塞子,已知U形管内预先装有少量水(为便于观察,预先将水染成红色),如图所示,结果U形管左边液面升高,则加入的物质可能是
A.NaOH固体
B.浓H2SO4
C.NH4NO3晶体
D.Na2O2固体
√
U形管左边液面升高,原因只能是锥形瓶内气体压强减小,造成压强减小的原因可能是温度降低。NaOH固体溶于水、浓H2SO4稀释溶液温度均升高,NH4NO3晶体溶于水温度降低,Na2O2和水反应放热且有气体生成。
归纳总结
有关吸热反应和放热反应理解的三个“不一定”
(1)放热反应不一定容易发生,如合成氨反应需要在高温、高压和催化剂作用下才能发生;吸热反应不一定难发生,如盐酸与碳酸氢钠的反应在常温下就能发生。
(2)需要加热才能发生的反应不一定是吸热反应,如硫与铁的反应;吸热反应不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
归纳总结
(3)放热过程不一定是放热反应,如NaOH固体的溶解和浓硫酸的稀释是放热过程,但不是放热反应;吸热过程不一定是吸热反应,如升华、蒸发等过程是吸热过程,但不是吸热反应。
返回
化学反应中能量变化的原因
二
1.从化学键变化的角度理解能量变化的原因(微观探析)
(1)原因
吸收
释放
吸热
放热
(2)实例
H2(g)+Cl2(g)===2HCl(g)的反应过程如图所示:
吸收
释放
吸收
根据上图计算1 mol H2和1 mol Cl2断键吸收的总能量为_____ kJ,形成
2 mol HCl共释放_____ kJ能量,断键吸收的总能量___成键释放的总能量,因此该反应为_____反应。
679
862
放热
<
2.从反应物及生成物总能量高低理解能量变化的原因(宏观辨识)
物质的组成、结构与_____不同,所具有的能量不同。因此,一个化学反应的能量变化取决于_____________和_____________的相对大小。
状态
反应物总能量
生成物总能量
放热反应 吸热反应
化学能转化为_____ 热能转化为_______被生成物“储存”
释放
吸收
热能
化学能
(1)对于一个化学反应来说,当化学键断裂时吸收的总能量大于化学键形成时放出的总能量,则反应放热( )
(2)相同条件下形成1 mol H—Cl放出的能量与断开1 mol H—Cl吸收的能量相等( )
(3)任何化学反应,都有物质变化,同时伴随着能量变化( )
(4)放热反应为“贮存”能量的过程,吸热反应为“释放”能量的过程( )
(5)已知Fe与稀盐酸的反应为放热反应,即Fe的能量大于H2的能量( )
(6)石墨转化为金刚石需要吸收热量,所以石墨更稳定( )
×
正误判断
√
√
×
×
√
应用体验
1.已知某化学反应A2(g)+2B2(g)===2AB2(g)(A2、B2、AB2的结构式分别为A===A、B—B、B—A—B),反应过程中的能量变化如图所示,下列有关叙述正确的是
A.该反应的进行一定需要加热或点燃
B.该反应若生成2 mol AB2(g),则放出的热量为
(E1-E2) kJ
C.该反应断开反应物中化学键吸收的总能量大
于形成生成物中化学键释放的总能量
D.生成2 mol B—A放出E2 kJ能量
√
根据图示可知,该反应断开反应物中化学键吸
收的总能量大于形成生成物中化学键释放的总
能量,为吸热反应;若生成2 mol AB2(g),则
吸收的热量为(E1-E2) kJ,C项正确、B项错误;
该反应的进行不一定需要加热或点燃,A项错误;
生成4 mol B—A放出E2 kJ能量,D项错误。
2.已知N2(g)和O2(g)反应生成2 mol NO(g)吸收180 kJ能量,反应过程中能量变化如图所示。
根据图示回答下列问题:
(1)该反应中反应物所具有的总能量_____
(填“高于”或“低于”)生成物所具有的
总能量。
(2)1 mol NO(g)分子中的化学键断裂时要吸收____ kJ能量。
(3)断裂1 mol N≡N吸收的能量值x为____。
低于
632
946
根据图示,断裂旧化学键所吸收的能
量为(x+498) kJ,形成新化学键所释
放的能量为2×632 kJ=1 264 kJ,每
生成2 mol NO(g)所吸收能量为180 kJ,
因此有180 kJ=(x+498) kJ-1 264 kJ,故x为946。
练后反思
判断吸热反应和放热反应的两种方法
(1)根据反应物和生成物的总能量的相对大小判断——反应物的总能量高于生成物的总能量的反应为放热反应,反之为吸热反应(宏观角度)。
(2)根据化学键断裂和形成时能量变化大小关系判断——断裂反应物中化学键吸收的能量大于形成生成物中化学键放出的能量的反应为吸热反应,反之为放热反应(微观角度)。
返回
化学能与热能相互转化的应用
三
1.现阶段人类获取热能的主要途径是___________;使用最多的常规能源是__________________________。
2.化石燃料获取能量面临的问题
(1)储量有限,短期内不可再生。
(2)影响环境:煤、石油产品燃烧排放的_____________________等是大气污染物的主要来源。
物质的燃烧
化石燃料(煤、石油和天然气)
粉尘、SO2、NOx、CO
3.节能减排的措施
(1)燃料燃烧阶段提高燃料的燃烧效率。
通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率。
(2)能量利用阶段提高能源的利用率。如使用节能灯,发电厂、钢铁厂余热与城市供热联产等。
(3)开发使用新能源,目前人们比较关注的新能源有_______、风能、地热能、海洋能和_____等。
太阳能
氢能
应用体验
1.下列有关新能源的说法不正确的是
A.绿色植物通过光合作用,将光能转化为化学能
B.风能、太阳能是清洁能源
C.氢能还未进入实用阶段的主要原因是其燃烧所释放热量低于相同质量
的矿物燃料
D.共享单车利用太阳能发电完成卫星定位,有利于节能环保
√
2.在人类生产、生活对能量的需求日益增长的今天,研究化学反应及其能量变化,对合理利用常规能源和开发新能源具有十分重要的意义。能源是人类赖以生存和发展不可缺少的因素。请完成下列问题:
(1)矿物能源是现代人类社会赖以生存的重要物质基础。目前,全球仍主要处于化石能源时期。下列不属于化石能源的是___(填字母,下同)。
A.石油 B.煤
C.天然气 D.生物质能
D
(2)下列对能源的看法合理的是_______。
A.化石能源属于不可再生能源,只会越用越少
B.生物质能是一种可再生能源,有广阔的应用前景
C.太阳能、氢能、风能、地热能都属于新能源
D.我国人口众多、资源相对匮乏、环境承载能力较弱,因此要建设节约
型社会
ABCD
归纳总结
返回
随堂演练 知识落实
1.(2022·黑龙江大庆中学高一期中)下列关于化学反应与能量的说法中,不正确的是
A.盐酸与碳酸氢钠的反应属于吸热反应
B.化学变化中,反应物断裂化学键释放能量,生成物形成化学键吸收能量
C.一个化学反应是吸热还是放热,与反应物总能量和生成物总能量的相
对大小有关
D.钠与水的反应属于放热反应
1
2
3
4
5
√
盐酸与碳酸氢钠反应生成氯化钠、二氧化碳和水,该反应属于吸热反应,A正确;
化学变化中,反应物断裂化学键吸收能量,生成物形成化学键释放能量,B错误;
一个化学反应是吸热还是放热,与反应物总能量和生成物总能量的相对大小有关,若反应物的总能量大于生成物的总能量,则该反应是放热反应;若反应物的总能量小于生成物的总能量,则该反应是吸热反应,C正确;
钠与水反应生成氢氧化钠和氢气,反应过程中钠会融化成光亮的小球,该反应属于放热反应,D正确。
1
2
3
4
5
2.(2022·江苏淮安高一期中)下列反应或过程中能量的变化符合图像的是
A.H+H―→ H—H
B.2NH4Cl+Ba(OH)2·8H2O===BaCl2+2NH3↑+10H2O
C.Mg+2HCl===MgCl2+H2↑
D.H2SO4+2KOH===K2SO4+2H2O
1
2
3
4
5
√
根据图像,生成物的总能量大于反应物的总能量,说明反应是吸热反应或过程。A项,形成化学键的过程中会放出能量,错误;
C项,属于金属与酸的反应,是放热反应,错误;
D项,属于酸碱中和反应,是放热反应,错误。
1
2
3
4
5
3.如图是某化学反应过程中能量变化的曲线图。下列叙述正确的是
A.该反应为吸热反应
B.该图可以表示Zn与盐酸反应的能量变化
C.该反应先发生物质变化后发生能量变化
D.断开反应物中化学键吸收的能量大于形
成生成物中化学键放出的能量
1
2
3
4
5
√
A错,由图可知,反应物的总能量高于生成物的
总能量,则该反应是放热反应;
B对,Zn和盐酸反应生成ZnCl2和H2,并放出热
量,符合图示能量变化;
C错,化学反应过程中,物质变化和能量变化同时发生;
D错,该反应是放热反应,断开反应物中化学键吸收的能量小于形成生成物中化学键放出的能量。
1
2
3
4
5
4.液态储氢技术就是在常温常压下将氢气融入到一种化合物“储油”中,形成“氢油”,便于储存和运输。下列有关说法错误的是
A.“氢油”不稳定
B.氢能源属于可再生能源
C.该技术实现了常温常压下储氢技术的新突破
D.液态储氢项目有利于发展氢能源电动机,从而带来新能源汽车的升级
√
1
2
3
4
5
“氢油”便于储存和运输,说明它比较稳定,故A错误;
氢气燃烧生成水,水分解又生成氢气,故氢能源属于可再生能源,故B正确;
常温常压下可以将氢气融入到一种化合物“储油”中,故该技术实现了常温常压下储氢技术的新突破,故C正确;
液态储氢解决了氢能储存难、运输难的问题,能实现氢能的广泛应用,故有利于发展氢能源电动机,从而带来新能源汽车的升级,故D正确。
1
2
3
4
5
5.化学反应N2(g)+3H2(g) 2NH3(g)的能量变化如图所示,请回答下列问题:
(1)图中A、C分别表示______________________
_________、____________________,反应____
(填“吸收”或“释放”)能量。
A、C分别表示1 mol N2(g)和3 mol H2(g)(反应物)的总能量、2 mol NH3(g)(生成物)的总能量,由于反应物总能量高于生成物总能量,因此反应放出能量。
1
2
3
4
5
1 mol N2(g)和3 mol H2(g)
的总能量
2 mol NH3(g)的总能量
释放
(2)反应过程中断裂的化学键为______________
___________,_____(填“吸收”或“释放”)的能量为___;形成的化学键为____________,_____(填“吸收”或“释放”)的能量为___。
反应过程中断裂的化学键为1 mol N≡N和3 mol H—H,吸收的能量为E1;形成的化学键为6 mol N—H,释放的能量为E3。
1
2
3
4
5
1 mol N≡N和
吸收
E1
6 mol N—H
释放
E3
3 mol H—H
(3)E2=______或_______(用A、C或E1、E3表示)。
1
2
3
4
5
A—C E3-E1
返回
课时对点练
题组一 化学反应与能量变化的关系
1.下列对于化学反应过程的理解,错误的是
A.化学反应过程中同时存在物质和能量的变化
B.凡是能量变化一定发生在化学变化中
C.化学反应中同时存在质量守恒和能量守恒
D.能量的释放和吸收以发生变化的物质为基础
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
化学反应过程中都会伴随着物质变化和能量变化,A正确;
化学变化过程中往往伴随着能量的变化,而有能量变化时不一定发生化学变化,如灯泡通电发光放热,B错误;
化学反应的实质是原子的重新组合,符合质量守恒定律;化学反应过程中往往伴随着能量的变化,符合能量守恒定律,C正确;
化学反应过程中同时存在物质和能量的变化,且能量的释放和吸收是以发生变化的物质为基础的,二者密不可分,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2.(2022·重庆市育才中学高一期中)下列说法不正确的是
A.在常温下可以发生的反应不一定是放热反应
B.化学反应必然伴随能量变化,原因是化学反应中旧键断裂所吸收的能
量与新键形成所释放的能量不相等
C.一定条件下,石墨转化为金刚石要吸收能量,说明石墨比金刚石稳定,
等质量的金刚石和石墨完全燃烧石墨释放的能量更多
D.化学反应中能量变化的大小与反应物的质量多少有关
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
化学反应中旧键断裂所吸收的能量与新键形成所释放的能量不相等,使得化学反应的过程中伴随着能量的变化,B正确;
一定条件下,石墨转化为金刚石要吸收能量,说明等质量的情况下,石墨所含能量更低,则石墨比金刚石稳定,且等质量的金刚石和石墨完全燃烧,金刚石释放的能量更多,C错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组二 吸热反应和放热反应
3.(2022·黑龙江鸡西市第四中学高一期中)下列过程属于吸热反应的是
A.水的分解
B.盐酸与氢氧化钠溶液反应
C.金属镁与盐酸反应
D.铁丝在氧气中燃烧
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
常见的放热反应有:所有的物质燃烧的反应、所有金属与酸或与水的反应、所有中和反应、绝大多数化合反应、铝热反应;常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解反应(如某些铵盐和强碱的反应)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
4.(2022·河南商丘市第一高级中学高一阶段检测)下列各组变化中,前者属于吸热反应,后者属于放热反应的是
A.生石灰与水反应;醋酸与氢氧化钠反应
B.煅烧石灰石;碳酸氢钠与盐酸反应
C.Ba(OH)2·8H2O与NH4Cl反应;钠与水反应
D.甲烷的燃烧;过氧化氢的分解
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
生石灰与水反应为放热反应,醋酸与氢氧化钠反应即酸碱中和反应为放热反应,故A错误;
煅烧石灰石属于吸热反应,碳酸氢钠与盐酸的反应属于吸热反应,故B错误;
Ba(OH)2·8H2O与NH4Cl的反应属于吸热反应,钠与水反应是放热反应,故C正确;
甲烷的燃烧属于放热反应,过氧化氢的分解反应属于放热反应,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组三 化学反应中能量变化的实质
5.(2022·合肥高一期中)已知反应A+B===C+D的能量变化如图所示,下列说法不正确的是
A.该反应为吸热反应
B.该反应吸收的能量为E1-E2
C.该图可表示为酸和碱的反应图像
D.该反应中反应物的总能量低于生成物的总能量
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由图可知,该反应中反应物的总能量低于生成物的总能量,为吸热反应,A、D正确;
酸碱中和反应为放热反应,图为吸热反应,C错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
6.100 kPa时,1 mol石墨转化为金刚石的能量变化如图所示,下列说法正确的是
A.石墨比金刚石更稳定
B.金刚石比石墨更稳定
C.石墨转化为金刚石的反应为放热反应
D.破坏1 mol石墨中的化学键所吸收的能量小于形成1 mol金刚石中的化
学键所放出的能量
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由图可知,石墨转化为金刚石要吸收能量,说
明石墨的能量低,更稳定,选项A正确,选项B
错误;
由图可知,石墨转化为金刚石要吸收能量,反应为吸热反应,选项C错误;
由图可知,反应为吸热反应,故破坏1 mol石墨中的化学键所吸收的能量大于形成1 mol金刚石中的化学键所放出的能量,选项D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
7.化学家证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
下列关于合成氨反应的叙述不正确的是
A.该过程表明,在化学反应中存在化学键的断裂与形成
B.在催化剂的作用下,反应物的化学键变得容易断裂
C.过程②需吸收能量,过程③则放出能量
D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
由图可知,每3个氢气分子和
1个氮气分子断键得到原子,
然后氢原子和氮原子生成2个
氨分子,A项正确;
催化剂能改变化学反应的速率,合成氨的反应在催化剂作用下,反应速率加快,意味着反应物中化学键的断裂和生成物中化学键的形成变得更容易,B项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
化学键的断裂需要吸收能
量,而化学键的形成则放
出能量,从图中可看出②
为化学键断裂过程,③为新化学键形成过程,C项正确;
化学键的断裂需要吸收能量,所以该反应在常温下难以进行,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组四 人类对能源的利用及能源现状
8.人类将在未来几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能的转换形态),人们将适应“低碳经济”和“低碳生活”。下列说法不正确的是
A.研究菠菜蛋白质“发电”不属于“太阳能文明”
B.发展太阳能经济有助于减缓温室效应
C.太阳能电池可将太阳能直接转化为电能
D.石油和天然气都属于碳素燃料
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
菠菜蛋白质“发电”属于“太阳能文明”,A错误;
发展太阳能经济有助于减缓温室效应,B正确;
太阳能电池可将太阳能直接转化为电能,C正确;
石油和天然气都属于碳素燃料,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
9.下列关于能源和作为能源使用的物质的叙述错误的是
A.化石能源物质内部蕴含着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在一定条件下转化为热能、电能,为人类所利用
D.吸热反应没有利用价值
光合作用、水煤气的制取都是吸热反应,都具有很高的利用价值。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
10.下列叙述正确的是
A.生成物总能量一定低于反应物总能量
B.酒精可用作燃料,说明酒精燃烧是放热反应
C.硝酸铵溶于水温度降低,这个变化是吸热反应
D.在H2与Cl2的反应过程中,释放的能量小于吸收的能量
√
E生成物>E反应物为吸热反应,E生成物
硝酸铵溶于水是物理变化,故C错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.(2022·昆明市第三中学高一期中)下列变化过程符合如图能量变化规律的是
①金属铝与氢氧化钠溶液反应
②NH4Cl固体与Ca(OH)2固体制备NH3
③Na在Cl2中燃烧
④水蒸气变成液态水
⑤硫酸和氢氧化钡溶液反应
⑥碳酸氢钠热分解
A.①②⑤ B.①③⑤ C.③④⑤ D.②④⑥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
根据图示可知,反应物的总能量比生成物的总能量
高,发生的反应为放热反应。金属铝与氢氧化钠溶
液反应是放热反应,①符合题意;
NH4Cl固体与Ca(OH)2固体制备NH3的反应是吸热反
应,②不符合题意;
Na在Cl2中燃烧放出热量,反应为放热反应,③符合题意;
水蒸气变成液态水放出热量,但为物质的状态变化,不是化学反应,④不符合题意;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
硫酸和氢氧化钡溶液发生中和反应放出热量,该反应为放热反应,⑤符合题意;
碳酸氢钠热分解反应是吸热反应,⑥不符合题意;综上所述,属于放热反应的是①③⑤。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
12.(2022·江西临川一中高一阶段检测)某反应由两步反应A B C构成,反应过程中的能量变化曲线如图,下列叙述正确的是
A.A与C的能量差为E1
B.两步反应均为吸热反应
C.三种化合物中C最稳定
D.反应A B,反应条件一定要加热
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由图像可知,A和C的能量差为E4+E2-E1
-E3,A项错误;
A到B为吸热反应,B到C为放热反应,B项
错误;
物质的能量越低越稳定,从图中可知C能量最低,故C最稳定,C项正确;
反应吸、放热由反应物和生成物的总能量决定,与反应条件无关,故吸热反应不一定需要加热,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.NF3是一种温室气体,其储存能量的能力是CO2的12 000~20 000倍。已知:断开1 mol N≡N吸收的能量为946 kJ,断开1 mol F—F吸收的能量为154.8 kJ,断开1 mol N—F吸收的能量为283 kJ。下列说法正确的是
A.N2(g)―→ 2N(g)的过程会放出能量
B.N(g)+3F(g)―→ NF3(g)的过程会放出能量
C.N2(g)+3F2(g)===2NF3(g)的反应为吸热反应
D.如果NF3吸收能量后没有化学键的断裂与形成,仍可能会发生化学反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
N2(g)―→ 2N(g)的过程是化学键断裂的过程,需要吸收能量,A项错误;
N(g)+3F(g)―→ NF3(g)的过程为形成化学键的过程,会放出能量,B项正确;
在反应N2(g)+3F2(g)===2NF3(g)中,形成2 mol NF3中的化学键释放的能量为6×283 kJ=1 698 kJ,断裂1 mol N2和3 mol F2中的化学键需吸收的能量为1×946 kJ+3×154.8 kJ=1 410.4 kJ,放出的能量>吸收的能量,该反应为放热反应,C项错误;
化学反应的实质是旧化学键的断裂和新化学键的形成,如果NF3吸收能量后没有化学键的断裂与生成,则不可能发生化学反应,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
14.在一定条件下A与B反应可生成C和D,其能量变化如下:
(1)若E1>E2,反应体系的总能量_____(填“升高”或“降低”),为____
(填“吸热”或“放热”)反应,其原
因是___________________________
_________________________。
若E1>E2,反应体系的总能量降低,故反应物的部分化学能通过化学反应转化为热能释放给环境,则生成物的总能量小于反应物的总能量,依据反应前后能量守恒可知反应是放热反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
降低
放热
反应物的部分化学能通过化学
反应转化为热能释放给环境
(2)若E1<E2,反应体系的总能量______(填“升高”或“降低”),为_____(填“吸热”或“放热”)反应,其原因是______________________。
若E1<E2,反应体系的总能量升高,故反应物从环境中吸收能量,则生成物的总能量大于反应物的总能量,依据反应前后能量守恒可知反应是吸热反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
升高
吸热
反应物从环境中吸收能量
15.为探究Na2CO3、NaHCO3与盐酸的反应是吸热反应还是放热反应,某同学进行了下列实验(盐酸浓度相同,每项实验各做3次,取平均值)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
实验序号 试剂 固体 混合前温度/℃ 混合后温度/℃
a 35 mL水 2.5 g NaHCO3 20.0 18.5
b 35 mL水 3.2 g Na2CO3 20.0 24.3
c 35 mL盐酸 2.5 g NaHCO3 20.0 16.2
d 35 mL盐酸 3.2 g Na2CO3 20.0 25.1
(1)设计a、b组实验的目的是______________________________________
________。
作为对照实验,排除物质溶解而造成的热
量变化
(2)通过上述实验可得出结论:Na2CO3溶液和盐酸的反应是______(填“吸热”或“放热”,下同)反应;NaHCO3溶液和盐酸的反应是_____反应,NaHCO3溶液和盐酸反应的能量变化对应的图像是___(填字母)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
吸热
放热
A
由实验b、d可知,当Na2CO3与盐酸反应后,混合溶液的温度比Na2CO3在相同量水中溶解后的温度高,说明Na2CO3与盐酸的反应为放热反应;由实验a、c可知,当NaHCO3与盐酸反应后,混合溶液的温度比NaHCO3在相同量水中溶解后的温度低,说明碳酸氢钠与盐酸的反应为吸热反应,反应物的总能量小于生成物的总能量,A项图示能量变化符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.Ⅰ.下表中的数据是破坏1 mol物质中的化学键所吸收的能量:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
物质 Cl2 Br2 I2 HCl HBr HI H2
能量/kJ 243 193 151 432 366 298 436
根据上述数据,回答下列问题:
(1)下列物质本身具有的能量最低的是___(填字母,下同)。
A.H2 B.Cl2 C.Br2 D.I2
A
(2)下列氢化物中最稳定的是___。
A.HCl B.HBr C.HI
破坏1 mol 物质中的化学键所吸收的能量越大,则物质越稳定,所具有的能量越低。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Cl2
(3)X2(g)+H2(g)===2HX(g)(X代表Cl、Br、I)的反应是_________(填“吸热反应”或“放热反应”)。
放热反应
以氯元素为例计算断开1 mol Cl—Cl和H—H需吸收能量:243 kJ+436 kJ=679 kJ,而形成2 mol HCl放出的能量为2×432 kJ=864 kJ,所以在Cl2(g)+H2(g)===2HCl(g)反应中放出864 kJ-679 kJ=185 kJ的热量,同理可计算在Br2(g)+H2(g)===2HBr(g)、I2(g)+H2(g) 2HI(g)反应中,分别放出103 kJ、9 kJ的热量。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Ⅱ.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能[通常把拆开(或形成)1 mol化学键吸收(或放出)的能量称为键能]:P—P为198 kJ·mol-1、P—O为360 kJ·mol-1、O==O为498 kJ·mol-1。则P4(白磷,s)+3O2(g)===P4O6(s)的反应是_____(填“吸热”或“放热”)反应,生成1 mol P4O6放出的热量为________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
放热
1 638 kJ
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
返回
断开旧键吸收的能量为6×198 kJ+3×498 kJ=2 682 kJ,形成新键放出的能量为12×360 kJ=4 320 kJ,故该反应为放热反应,生成1 mol P4O6放出的热量为4 320 kJ-2 682 kJ=1 638 kJ。
本课结束
第六章
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
