第六章 第一节 第3课时 化学电池 课件(共71张PPT)
文档属性
| 名称 | 第六章 第一节 第3课时 化学电池 课件(共71张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 00:00:00 | ||
图片预览











文档简介
(共71张PPT)
DISANKESHI
一次电池 二次电池 / 燃料电池 / 随堂演练 知识落实 / 课时对点练
化学电池
第六章
第3课时
核心素养
发展目标
1.知道干电池、充电电池、燃料电池等化学电池的特点。
2.掌握构成化学电池的基本要素,了解常见化学电池的工作原理。
内容索引
随堂演练 知识落实
课时对点练
一、一次电池 二次电池
二、燃料电池
一次电池 二次电池
一
1.一次电池
(1)特点:电池放电后_____充电(内部的氧化还原反应_____逆向进行),如锌锰干电池属于一次电池。
(2)锌锰干电池的构造如图所示。
①锌筒为_____,电极反应是_________________。
②石墨棒为_____,最终被还原的物质是_________。
③NH4Cl糊的作用是_____________。
④特点:放电后不能充电,便于携带,价格低。
不能
无法
负极
Zn-2e-===Zn2+
正极
二氧化锰
作电解质溶液
2.二次电池(充电电池)
(1)特点:二次电池在放电时所进行的_____________,在充电时可以_________,使电池恢复到放电前的状态,从而实现放电与充电的循环。
(2)能量转化:化学能 电能。
(3)常见的充电电池:_______电池、_____电池、_______电池等。
氧化还原反应
逆向进行
铅酸蓄
镍氢
锂离子
(1)锌锰干电池工作一段时间后碳棒变细( )
(2)充电电池可以无限制地反复充电、放电( )
(3)二次电池充电时化学能转化为电能( )
×
正误判断
×
×
深度思考
铅酸蓄电池常用作汽车电瓶,其构造如图所示,工作时该电池总的方程
式为Pb+PbO2+2H2SO4 2PbSO4+2H2O。
按要求回答下列问题:
(1)负极材料是___,正极材料是______,电解质溶
液是_______。
(2)工作时,电解质溶液中的H+移向__________极。
(3)工作时,电解质溶液中硫酸的浓度______(填“增大”“减小”或“不变”)。
Pb
PbO2
稀硫酸
PbO2(或正)
减小
深度思考
(4)当铅酸蓄电池向外电路提供2 mol e-时,理论上负极板的质量增加___g。
96
归纳总结
应用体验
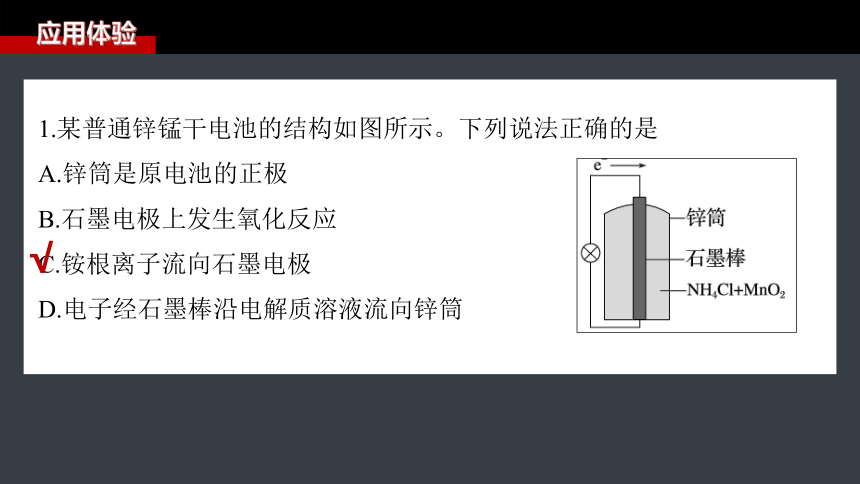
1.某普通锌锰干电池的结构如图所示。下列说法正确的是
A.锌筒是原电池的正极
B.石墨电极上发生氧化反应
C.铵根离子流向石墨电极
D.电子经石墨棒沿电解质溶液流向锌筒
√
锌锰干电池中,锌筒作负极,石墨棒作正极,正
极上二氧化锰得电子发生还原反应,A、B错误;
原电池中阳离子向正极移动,故铵根离子流向石
墨电极,C正确;
电子经导线由负极锌筒流向石墨棒,D错误。
2.(2022·浙江舟山调研)氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上。其中一种氟离子电池的工作原理为3Mg
+2BiF3 3MgF2+2Bi(MgF2为难溶盐),电解质为熔融氟化物。下列
说法正确的是
A.放电时,负极的电极反应式为Mg-2e-+2F-===MgF2
B.放电时,电子从镁电极流出,经电解质流向正极
C.放电时,化学能完全转化为电能
D.放电时,F-向正极移动
√
放电时,Mg作负极,失去电子,发生氧化反应,电极反应式为Mg+2F--2e-===MgF2,A项正确;
放电时,电子从镁电极流出,经导线流向正极,B项错误;
原电池是把化学能转化为电能的装置,但化学能不可能100%转化为电能,还有部分转化为热能等,C项错误;
放电时,阳离子向正极移动,阴离子向负极移动,故F-向负极移动,D项错误。
返回
燃料电池
二
1.概念
一种将燃料(如_____、_____、_____)和氧化剂(如_____)的化学能直接转化为电能的电化学反应装置。
2.特点
(1)清洁、安全、高效等;
(2)能量转化率可以达到_____以上;
(3)反应物不是储存在电池内部,而是从外部提供,供电量易于调节。
3.应用
在航天、军事、交通等领域有广阔的应用前景。
氢气
甲烷
乙醇
氧气
80%
4.氢氧燃料电池
氢氧燃料电池在不同介质中的总反应相同,均为2H2+O2===2H2O。但正、负极反应与电解质溶液有关,正、负极反应如下:
电解质溶液 负极 正极
酸性(H+) 2H2-4e-===4H+ O2+4H++4e-===2H2O
碱性(OH-) 2H2-4e-+4OH-===4H2O O2+2H2O+4e-===4OH-
特别提醒 在书写电极反应式时应看清溶液的酸碱性,酸性条件下不出现OH-,碱性条件下不出现H+。
(1)燃料电池是利用燃料的燃烧发电( )
(2)燃料电池中,燃料在正极上发生氧化反应( )
(3)氢氧燃料电池将热能直接转变为电能( )
(4)原电池中正极材料一定发生还原反应( )
(5)原电池中的负极反应一定是电极材料失电子( )
×
正误判断
×
×
×
×
深度思考
将CH4设计成燃料电池,其利用率更高,装置如图
所示(A、B为多孔碳棒)。
(1)实验测得OH-定向移向A电极,则____(填“A”
或“B”)电极入口通CH4,其电极反应式为
_________________________________,另一电极
的电极反应式为_______________________。
A
O2+4e-+2H2O===4OH-
深度思考
(2)若将电解质溶液更换为稀H2SO4,实验测得B电
极附近的pH减小,则A处电极入口通入的气体是
____,其电极反应式为______________________,
B电极的电极反应式为______________________
______。
O2
O2+4e-+4H+===2H2O
CH4-8e-+2H2O===CO2
+8H+
B电极附近的pH减小,说明酸性增强,有H+生成,B电极为负极,通入CH4,则A电极入口通入O2,其电极反应式为O2+4e-+4H+===2H2O;在稀H2SO4溶液中,B电极CH4失电子被氧化为CO2,则电极反应式为CH4-8e-+2H2O===CO2+8H+。
应用体验
1.(2022·江西新余市第一中学高一期末)国家电投氢能公司全自主研发的“氢腾”燃料电池系统广泛应用于氢能大巴。某种氢燃料电池的内部结构如图,下列说法正确的是
A.电池工作时,电解质溶液中的H+向b极
移动
B.a极发生的电极反应为H2+2e-+2OH-
===2H2O
C.b极为正极,发生氧化反应
D.当外电路有1 mol电子转移时,b极消耗5.6 L O2
√
电池工作时,H+移向正极,故A正确;
a极发生的电极反应为H2-2e-===2H+,
故B错误;
b极为正极,发生还原反应,故C错误;
题目中未说明标准状况,无法计算氧气的物质的量,故D错误。
2.燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是
A.负极反应式:O2+2H2O+4e-===4OH-
B.负极反应式:CH4+8OH--8e-===CO2+6H2O
C.随着放电的进行,溶液的OH-浓度不变
D.放电时溶液中的阴离子向负极移动
√
返回
随堂演练 知识落实
1.如图为发光二极管连接柠檬电池装置,下列说法正确的是
A.铁环作为柠檬电池的正极
B.电流由铁环经导线流向发光二极管
C.负极的电极反应为Fe-2e-===Fe2+
D.可将柠檬替换成盛装乙醇溶液的装置
1
2
3
4
√
铜线、铁环插入柠檬,制成柠檬电池,由于活泼
性:Fe>Cu,所以铜线是柠檬电池的正极,铁环
是柠檬电池的负极,故A项错误;
电子由负极铁环经导线流向发光二极管,再由发光二极管流向铜线,故B项错误;
负极发生氧化反应,电极反应为Fe-2e-===Fe2+,故C项正确;
乙醇溶液为非电解质溶液,不能将柠檬替换成盛装乙醇溶液的装置,故D项错误。
1
2
3
4
2.下列电池工作时,O2在正极得电子的是
1
2
3
4
A B C D
锌锰电池 铅酸蓄电池 氢氧燃料电池 镍镉电池
√
氢氧燃料电池的总反应是2H2+O2===2H2O,因而正极是O2得电子发生还原反应。
09
3.(2022·黑龙江大庆中学高一期中)纽扣电池可作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和Ag2O,用KOH溶液作电解质溶液,电池的总反应为Zn+Ag2O===2Ag+ZnO。关于该电池下列叙述不正确的是
A.电池的正极发生还原反应
B.Zn为负极,发生氧化反应,反应过程中失去电子
C.电池工作时,电解质溶液中的阳离子移向正极
D.电池使用时,电子由Zn极经电解质溶液流向Ag2O极
1
2
3
4
√
电池正极发生的是还原反应,故A正确;
根据电池的总反应可知,Zn的化合价升高,失去电子,作负极,发生氧化反应,故B正确;
电池工作时,电解质溶液中的阳离子移向正极,故C正确;
电子由负极经导线流向正极,电子不能进入电解质溶液中,故D错误。
1
2
3
4
4.一种直接铁燃料电池(电池反应为3Fe+2O2===Fe3O4)的装置如图所示,下列说法正确的是
A.Fe极为电池正极
B.KOH溶液为电池的电解质溶液
C.电子由多孔碳极沿导线移向Fe极
D.5.6 g Fe参与反应,导线中转移
1.204×1023个电子
1
2
3
4
√
该电池中铁失去电子为电池负极,A项错误;
KOH溶液为电池的电解质溶液,B项正确;
电子由Fe极沿导线移向多孔碳极,C项错误;
根据电池反应3Fe+2O2===Fe3O4可知,3 mol
铁参与反应时转移8 mol电子,故5.6 g Fe参与反应,导线中转移约1.605×1023个电子,D项错误。
1
2
3
4
返回
课时对点练
题组一 一次电池、二次电池
1.下列电池不属于二次电池(可充电电池)的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
铅酸蓄电池、镍镉电池、锂离子电池等可以反复充电,属于可充电电池,是二次电池;
锌锰干电池不能充电,完全放电后不能再使用,是一次电池。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2.普通锌锰干电池的构造如图所示,其电池反应的方程式为Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnO(OH),下列说法不正确的是
A.石墨作正极
B.锌发生氧化反应
C.电池工作时,电子从石墨经导线流向锌
D.电池工作时,每消耗6.5 g锌,线路中会
转移0.2NA个电子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
锌筒作负极,石墨作正极,故A正确;
电池中锌失去电子,发生氧化反应,故B正确;
电池中电子从负极流向正极,即从锌经导线流
向石墨,故C错误;
锌为负极,失电子发生氧化反应,每消耗6.5 g Zn,即0.1 mol锌,则失去0.2 mol电子,故线路中转移0.2NA个电子,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
3.(2022·南京期中)汽车的启动电源常用铅酸蓄电池。其结构如图所示,放电时的电池反应为PbO2+Pb+2H2SO4===2PbSO4+2H2O,根据此反应判断下列说法正确的是
A.负极反应式:Pb-2e-+ ===PbSO4
B.电池放电时,溶液的酸性增强
C.PbO2得电子,被氧化
D.PbO2是电池的负极
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Pb失电子作负极,电极反应式为Pb+
-2e-===PbSO4,故A正确;
放电时,硫酸参加反应,导致溶液中氢离
子浓度减小,则溶液的酸性减弱,故B错误;
PbO2得电子,被还原,故C错误;
根据电池反应式知,PbO2在反应中得电子,Pb元素的化合价由+4变为+2,所以二氧化铅作正极,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
4.一种锂水电池以锂和钢板为电极,LiOH为电解质,使用时加入水即可放电,总反应为2Li+2H2O===2LiOH+H2↑。下列有关该电池的说法错误的是
A.锂极为负极
B.OH-移向正极
C.H2为正极产物
D.电子由锂经导线流向钢板
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
由方程式可知,Li失去电子,发生氧化反应,作负极,则钢板作正极,A项正确;
正极上的电极反应式为:2H2O+2e-===2OH-+H2↑,可知氢气为正极产物,C项正确;
电子会从负极流向正极,即电子由锂经导线流向钢板,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
5.银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O===2Ag+Zn(OH)2,下列说法不正确的是
A.原电池放电时,负极上发生反应的物质是Zn
B.负极发生的反应是Zn+2OH--2e-===Zn(OH)2
C.工作时,负极区溶液中c(OH-)减小
D.溶液中OH-向正极移动,K+、H+向负极移动
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
根据电池总反应式知,Zn失电子发生氧化反应,故Zn作负极,Ag2O作正极,故A正确;
负极发生反应:Zn+2OH--2e-===Zn(OH)2,消耗OH-,负极区溶液中c(OH-)减小,正极上发生反应:Ag2O+H2O+2e-===2Ag+2OH-,正极区溶液中c(OH-)增大,故B、C正确;
放电时,电解质溶液中OH-向负极移动,K+、H+向正极移动,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 燃料电池
6.(2022·济南高一检测)目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系,下列说法中错误的是
A.燃料电池能够使化学反应产生的能量转化为电能
B.燃料电池中通入H2的一极作负极,发生氧化反应
C.在此循环中发生了反应:2H2O 2H2↑
+O2↑
D.目前化学家急需解决的问题是寻找合适的
光照条件下分解水的催化剂
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
此循环过程中利用太阳能将H2O分解为H2和O2,然后利用氢氧燃料电池将化学能转化为电能,循环过程中并没有发生电解水的反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
7.某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。下列叙述错误的是
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是2H2O+2e-===H2↑+2OH-
C.电池总反应为2H2+O2===2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
A项,a极通入H2,为负极,电极反应为H2+2OH-
-2e-===2H2O,发生的是氧化反应;
B项,b极通入O2,为正极,电极反应为O2+2H2O
+4e-===4OH-;
C项,正、负极电极反应式相加可得电池总反应为2H2+O2===2H2O;
D项,氢氧燃料电池的能量高,且产物为水,对环境无污染,故是具有应用前景的绿色电源。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
8.(2022·武汉高一检测)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示,下列说法正确的是
A.Pt电极上发生的是氧化反应
B.外电路中,电子从Pt电极流向NiO电极
C.NiO电极上的电极反应式为NO+O2--
2e-===NO2
D.O2的电极反应产物是H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
由离子的定向移动可知NiO电极为原电池
的负极, Pt电极为原电池的正极,发生还
原反应,A错误;
NiO电极为原电池的负极,外电路中,电
子从NiO电极流向Pt电极,B错误;
NiO电极上NO失电子和氧离子反应生成二氧化氮,所以电极反应式为NO+O2--2e-===NO2,C正确;
Pt电极为原电池的正极,O2的电极反应产物是O2-,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
9.(2022·昆明市第三中学高一期中)化学电源在日常生活和高科技领域中有广泛应用,下列说法错误的是
A.甲:正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-
B.乙:锌筒作负极,发生氧化反应,锌筒会变薄
C.丙:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
D.丁:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
甲为纽扣电池,正极为Ag2O得电子发生还原反应,电极反应式为Ag2O+2e-+H2O===2Ag+2OH-,故A正确;
乙为锌锰干电池,锌筒作负极,发生氧化反应被溶解,导致锌筒变薄,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
丙为氢氧燃料电池,放电过程中不断生成水,故电解质溶液的酸性减弱,导电能力下降,故C正确;
丁中Zn为负极,Cu为正极,原电池工作时Zn2+向Cu电极方向移动,硫酸中氢离子得电子生成氢气,故溶液中H+浓度减小,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过。该电
池的工作原理如图所示,其中多孔电极a、
b均不参与电极反应。下列判断正确的是
①多孔电极a为负极
②a极对应的电极反应式为O2+2H2O+4e-===4OH-
③b极的电极反应式为H2-2e-+O2-===H2O
④该电池的总反应式为2H2+O2 2H2O
A.①② B.②④ C.②③ D.③④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
图中电子由多孔电极b通过导线流向多孔
电极a,多孔电极b为负极,多孔电极a为
正极,①错误;
a极对应的电极反应式为O2+4e-===2O2-,
②错误;
b极的电极反应式为H2-2e-+O2-===H2O,③正确;
根据正、负极得失电子数相等,将正、负极电极反应式相加,该电
池的总反应式为2H2+O2 2H2O,④正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.(2022·贵州黔东南高一期中)Li-FeS2电池是目前电池中综合性能最好的一种电池,其原理示意图如图所示。已知电池放电时的反应为4Li+FeS2===Fe+2Li2S。下列说法正确的是
A.Li为电池的正极,发生氧化反应
B.电流由Li经负载,流向FeS2极
C.正极的电极反应式为FeS2+4e-===Fe+2S2-
D.将熔融的LiCF3SO3改为LiCl的水溶液,电池性能更好
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
根据分析,Li为电池负极,发生氧化反应,A错误;
Li为负极,电流应从正极流出,B错误;
FeS2为正极,正极反应式为FeS2+4e-===Fe+2S2-,
C正确;
将熔融的LiCF3SO3改为LiCl的水溶液,Li和水发生氧
化还原反应生成氢气,所以不能将熔融的LiCF3SO3改为LiCl的水溶液,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.最近,科学家研发了“全氢电池”,其工作原理如图所示。 下列说法正确的是
A.右边吸附层中发生氧化反应
B.负极的电极反应是H2-2e-+2OH-===
2H2O
C.当右边吸附层中产生标准状况下2.24 L氢
气时,电子在溶液中通过了0.2 mol
D.电解质溶液中Na+向左移动, 向右移动
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由电子流向可知,右边吸附层为正极,发
生还原反应,故A错误;
由电子流向可知,左边吸附层为负极,发
生氧化反应,电极反应式是H2-2e-+
2OH-===2H2O,故B正确;
电子不能通过溶液,故C错误;
原电池中阳离子向正极移动,阴离子向负极移动,所以电解质溶液中Na+向右移动, 向左移动,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.(2022·西安调研)利用反应6NO2+8NH3===7N2+12H2O设计的电池装置如图所示,该装置能有效消除氮氧化物的排放,减轻环境污染。下列说法错误的是
A.电极B为正极,发生还原反应
B.当有0.5 mol NO2参与反应时,外电路中转
移3 mol电子
C.电池工作时,OH-从右向左移动
D.电极B的电极反应式为2NO2+8e-+4H2O===N2+8OH-
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
根据电池总反应6NO2+8NH3===7N2+12H2O可
知,NO2得电子发生还原反应,NH3失电子发
生氧化反应,则通入NH3的电极A为负极,通
入NO2的电极B为正极,A项正确;
根据电池总反应可知,当有6 mol NO2参与反应时,外电路中转移24 mol e-,则当有0.5 mol NO2参与反应时,外电路中转移电子的物质的量为0.5 mol×
=2 mol,B项错误;
原电池工作时,阴离子移向负极,故OH-从右向左移动,C项正确;
电极B为正极,发生还原反应,电极反应式为2NO2+8e-+4H2O===N2+8OH-,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.(1)银锌电池是一种常见的化学电源,其反应原理:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其工作原理如图所示。
①在装置中Ag2O作____(填“正”或“负”)极发
生_________(填“还原反应”或“氧化反应”),
电极反应式为______________________________。
②在装置中Zn作___(填“正”或“负”)极,发生_________(填“还原反应”或“氧化反应”),电极反应式为__________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
正
还原反应
Ag2O+2e-+H2O===2Ag+2OH-
负
氧化反应
Zn-2e-+2OH-===Zn(OH)2
(2)将用导线相连的两个铂电极插入KOH溶液中,
然后向两极分别通入CO和O2,则发生了原电池
反应,该原电池中的负极反应式为___________
_____________________;正极反应式为______
___________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2CO-4e-+
O2+
4e-+2H2O===4OH-
15.(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为3Zn+2K2FeO4+
8H2O 3Zn(OH)2 +2Fe(OH)3+4KOH。请回答下列问题:
①高铁电池的负极材料是___。
②放电时,正极发生_____(填“氧化”或“还原”)反应。已知正极反应式为 +3e-+4H2O===Fe(OH)3+5OH-,则负极反应式为________
_________________。
③放电时,___(填“正”或“负”)极附近溶液的碱性增强。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Zn
还原
Zn+2OH-
-2e-===Zn(OH)2
正
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
高铁电池放电时为原电池,负极发生氧化反应,正极发生还原反应。总反应式减去正极反应式得负极反应式,正极生成OH-,故正极附近溶液碱性增强。
(2)锂锰电池的结构示意图如右,其中电解质LiClO4溶
于混合有机溶剂中,Li+通过电解质转移到MnO2晶格
中生成LiMnO2。
①外电路的电流方向是由___极流向___极(填字母)。
该电池中Li失去电子生成Li+,所以Li作电池的负极,则a是负极,b是正极,所以外电路中的电流方向由正极流向负极,所以从b流向a。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
b a
②正极材料是______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
MnO2
③是否可用水代替电池中的混合有机溶剂?___(填“是”或“否”);原因是_______________________
_______。
不能用水代替电池中的混合有机溶剂,因为Li是活泼金属,与水反应,无法参与原电池反应,不能产生电流。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
否
电极Li是活泼金属,能与
水反应
返回
本课结束
第六章
DISANKESHI
一次电池 二次电池 / 燃料电池 / 随堂演练 知识落实 / 课时对点练
化学电池
第六章
第3课时
核心素养
发展目标
1.知道干电池、充电电池、燃料电池等化学电池的特点。
2.掌握构成化学电池的基本要素,了解常见化学电池的工作原理。
内容索引
随堂演练 知识落实
课时对点练
一、一次电池 二次电池
二、燃料电池
一次电池 二次电池
一
1.一次电池
(1)特点:电池放电后_____充电(内部的氧化还原反应_____逆向进行),如锌锰干电池属于一次电池。
(2)锌锰干电池的构造如图所示。
①锌筒为_____,电极反应是_________________。
②石墨棒为_____,最终被还原的物质是_________。
③NH4Cl糊的作用是_____________。
④特点:放电后不能充电,便于携带,价格低。
不能
无法
负极
Zn-2e-===Zn2+
正极
二氧化锰
作电解质溶液
2.二次电池(充电电池)
(1)特点:二次电池在放电时所进行的_____________,在充电时可以_________,使电池恢复到放电前的状态,从而实现放电与充电的循环。
(2)能量转化:化学能 电能。
(3)常见的充电电池:_______电池、_____电池、_______电池等。
氧化还原反应
逆向进行
铅酸蓄
镍氢
锂离子
(1)锌锰干电池工作一段时间后碳棒变细( )
(2)充电电池可以无限制地反复充电、放电( )
(3)二次电池充电时化学能转化为电能( )
×
正误判断
×
×
深度思考
铅酸蓄电池常用作汽车电瓶,其构造如图所示,工作时该电池总的方程
式为Pb+PbO2+2H2SO4 2PbSO4+2H2O。
按要求回答下列问题:
(1)负极材料是___,正极材料是______,电解质溶
液是_______。
(2)工作时,电解质溶液中的H+移向__________极。
(3)工作时,电解质溶液中硫酸的浓度______(填“增大”“减小”或“不变”)。
Pb
PbO2
稀硫酸
PbO2(或正)
减小
深度思考
(4)当铅酸蓄电池向外电路提供2 mol e-时,理论上负极板的质量增加___g。
96
归纳总结
应用体验
1.某普通锌锰干电池的结构如图所示。下列说法正确的是
A.锌筒是原电池的正极
B.石墨电极上发生氧化反应
C.铵根离子流向石墨电极
D.电子经石墨棒沿电解质溶液流向锌筒
√
锌锰干电池中,锌筒作负极,石墨棒作正极,正
极上二氧化锰得电子发生还原反应,A、B错误;
原电池中阳离子向正极移动,故铵根离子流向石
墨电极,C正确;
电子经导线由负极锌筒流向石墨棒,D错误。
2.(2022·浙江舟山调研)氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上。其中一种氟离子电池的工作原理为3Mg
+2BiF3 3MgF2+2Bi(MgF2为难溶盐),电解质为熔融氟化物。下列
说法正确的是
A.放电时,负极的电极反应式为Mg-2e-+2F-===MgF2
B.放电时,电子从镁电极流出,经电解质流向正极
C.放电时,化学能完全转化为电能
D.放电时,F-向正极移动
√
放电时,Mg作负极,失去电子,发生氧化反应,电极反应式为Mg+2F--2e-===MgF2,A项正确;
放电时,电子从镁电极流出,经导线流向正极,B项错误;
原电池是把化学能转化为电能的装置,但化学能不可能100%转化为电能,还有部分转化为热能等,C项错误;
放电时,阳离子向正极移动,阴离子向负极移动,故F-向负极移动,D项错误。
返回
燃料电池
二
1.概念
一种将燃料(如_____、_____、_____)和氧化剂(如_____)的化学能直接转化为电能的电化学反应装置。
2.特点
(1)清洁、安全、高效等;
(2)能量转化率可以达到_____以上;
(3)反应物不是储存在电池内部,而是从外部提供,供电量易于调节。
3.应用
在航天、军事、交通等领域有广阔的应用前景。
氢气
甲烷
乙醇
氧气
80%
4.氢氧燃料电池
氢氧燃料电池在不同介质中的总反应相同,均为2H2+O2===2H2O。但正、负极反应与电解质溶液有关,正、负极反应如下:
电解质溶液 负极 正极
酸性(H+) 2H2-4e-===4H+ O2+4H++4e-===2H2O
碱性(OH-) 2H2-4e-+4OH-===4H2O O2+2H2O+4e-===4OH-
特别提醒 在书写电极反应式时应看清溶液的酸碱性,酸性条件下不出现OH-,碱性条件下不出现H+。
(1)燃料电池是利用燃料的燃烧发电( )
(2)燃料电池中,燃料在正极上发生氧化反应( )
(3)氢氧燃料电池将热能直接转变为电能( )
(4)原电池中正极材料一定发生还原反应( )
(5)原电池中的负极反应一定是电极材料失电子( )
×
正误判断
×
×
×
×
深度思考
将CH4设计成燃料电池,其利用率更高,装置如图
所示(A、B为多孔碳棒)。
(1)实验测得OH-定向移向A电极,则____(填“A”
或“B”)电极入口通CH4,其电极反应式为
_________________________________,另一电极
的电极反应式为_______________________。
A
O2+4e-+2H2O===4OH-
深度思考
(2)若将电解质溶液更换为稀H2SO4,实验测得B电
极附近的pH减小,则A处电极入口通入的气体是
____,其电极反应式为______________________,
B电极的电极反应式为______________________
______。
O2
O2+4e-+4H+===2H2O
CH4-8e-+2H2O===CO2
+8H+
B电极附近的pH减小,说明酸性增强,有H+生成,B电极为负极,通入CH4,则A电极入口通入O2,其电极反应式为O2+4e-+4H+===2H2O;在稀H2SO4溶液中,B电极CH4失电子被氧化为CO2,则电极反应式为CH4-8e-+2H2O===CO2+8H+。
应用体验
1.(2022·江西新余市第一中学高一期末)国家电投氢能公司全自主研发的“氢腾”燃料电池系统广泛应用于氢能大巴。某种氢燃料电池的内部结构如图,下列说法正确的是
A.电池工作时,电解质溶液中的H+向b极
移动
B.a极发生的电极反应为H2+2e-+2OH-
===2H2O
C.b极为正极,发生氧化反应
D.当外电路有1 mol电子转移时,b极消耗5.6 L O2
√
电池工作时,H+移向正极,故A正确;
a极发生的电极反应为H2-2e-===2H+,
故B错误;
b极为正极,发生还原反应,故C错误;
题目中未说明标准状况,无法计算氧气的物质的量,故D错误。
2.燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是
A.负极反应式:O2+2H2O+4e-===4OH-
B.负极反应式:CH4+8OH--8e-===CO2+6H2O
C.随着放电的进行,溶液的OH-浓度不变
D.放电时溶液中的阴离子向负极移动
√
返回
随堂演练 知识落实
1.如图为发光二极管连接柠檬电池装置,下列说法正确的是
A.铁环作为柠檬电池的正极
B.电流由铁环经导线流向发光二极管
C.负极的电极反应为Fe-2e-===Fe2+
D.可将柠檬替换成盛装乙醇溶液的装置
1
2
3
4
√
铜线、铁环插入柠檬,制成柠檬电池,由于活泼
性:Fe>Cu,所以铜线是柠檬电池的正极,铁环
是柠檬电池的负极,故A项错误;
电子由负极铁环经导线流向发光二极管,再由发光二极管流向铜线,故B项错误;
负极发生氧化反应,电极反应为Fe-2e-===Fe2+,故C项正确;
乙醇溶液为非电解质溶液,不能将柠檬替换成盛装乙醇溶液的装置,故D项错误。
1
2
3
4
2.下列电池工作时,O2在正极得电子的是
1
2
3
4
A B C D
锌锰电池 铅酸蓄电池 氢氧燃料电池 镍镉电池
√
氢氧燃料电池的总反应是2H2+O2===2H2O,因而正极是O2得电子发生还原反应。
09
3.(2022·黑龙江大庆中学高一期中)纽扣电池可作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和Ag2O,用KOH溶液作电解质溶液,电池的总反应为Zn+Ag2O===2Ag+ZnO。关于该电池下列叙述不正确的是
A.电池的正极发生还原反应
B.Zn为负极,发生氧化反应,反应过程中失去电子
C.电池工作时,电解质溶液中的阳离子移向正极
D.电池使用时,电子由Zn极经电解质溶液流向Ag2O极
1
2
3
4
√
电池正极发生的是还原反应,故A正确;
根据电池的总反应可知,Zn的化合价升高,失去电子,作负极,发生氧化反应,故B正确;
电池工作时,电解质溶液中的阳离子移向正极,故C正确;
电子由负极经导线流向正极,电子不能进入电解质溶液中,故D错误。
1
2
3
4
4.一种直接铁燃料电池(电池反应为3Fe+2O2===Fe3O4)的装置如图所示,下列说法正确的是
A.Fe极为电池正极
B.KOH溶液为电池的电解质溶液
C.电子由多孔碳极沿导线移向Fe极
D.5.6 g Fe参与反应,导线中转移
1.204×1023个电子
1
2
3
4
√
该电池中铁失去电子为电池负极,A项错误;
KOH溶液为电池的电解质溶液,B项正确;
电子由Fe极沿导线移向多孔碳极,C项错误;
根据电池反应3Fe+2O2===Fe3O4可知,3 mol
铁参与反应时转移8 mol电子,故5.6 g Fe参与反应,导线中转移约1.605×1023个电子,D项错误。
1
2
3
4
返回
课时对点练
题组一 一次电池、二次电池
1.下列电池不属于二次电池(可充电电池)的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
铅酸蓄电池、镍镉电池、锂离子电池等可以反复充电,属于可充电电池,是二次电池;
锌锰干电池不能充电,完全放电后不能再使用,是一次电池。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2.普通锌锰干电池的构造如图所示,其电池反应的方程式为Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnO(OH),下列说法不正确的是
A.石墨作正极
B.锌发生氧化反应
C.电池工作时,电子从石墨经导线流向锌
D.电池工作时,每消耗6.5 g锌,线路中会
转移0.2NA个电子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
锌筒作负极,石墨作正极,故A正确;
电池中锌失去电子,发生氧化反应,故B正确;
电池中电子从负极流向正极,即从锌经导线流
向石墨,故C错误;
锌为负极,失电子发生氧化反应,每消耗6.5 g Zn,即0.1 mol锌,则失去0.2 mol电子,故线路中转移0.2NA个电子,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
3.(2022·南京期中)汽车的启动电源常用铅酸蓄电池。其结构如图所示,放电时的电池反应为PbO2+Pb+2H2SO4===2PbSO4+2H2O,根据此反应判断下列说法正确的是
A.负极反应式:Pb-2e-+ ===PbSO4
B.电池放电时,溶液的酸性增强
C.PbO2得电子,被氧化
D.PbO2是电池的负极
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Pb失电子作负极,电极反应式为Pb+
-2e-===PbSO4,故A正确;
放电时,硫酸参加反应,导致溶液中氢离
子浓度减小,则溶液的酸性减弱,故B错误;
PbO2得电子,被还原,故C错误;
根据电池反应式知,PbO2在反应中得电子,Pb元素的化合价由+4变为+2,所以二氧化铅作正极,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
4.一种锂水电池以锂和钢板为电极,LiOH为电解质,使用时加入水即可放电,总反应为2Li+2H2O===2LiOH+H2↑。下列有关该电池的说法错误的是
A.锂极为负极
B.OH-移向正极
C.H2为正极产物
D.电子由锂经导线流向钢板
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
由方程式可知,Li失去电子,发生氧化反应,作负极,则钢板作正极,A项正确;
正极上的电极反应式为:2H2O+2e-===2OH-+H2↑,可知氢气为正极产物,C项正确;
电子会从负极流向正极,即电子由锂经导线流向钢板,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
5.银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O===2Ag+Zn(OH)2,下列说法不正确的是
A.原电池放电时,负极上发生反应的物质是Zn
B.负极发生的反应是Zn+2OH--2e-===Zn(OH)2
C.工作时,负极区溶液中c(OH-)减小
D.溶液中OH-向正极移动,K+、H+向负极移动
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
根据电池总反应式知,Zn失电子发生氧化反应,故Zn作负极,Ag2O作正极,故A正确;
负极发生反应:Zn+2OH--2e-===Zn(OH)2,消耗OH-,负极区溶液中c(OH-)减小,正极上发生反应:Ag2O+H2O+2e-===2Ag+2OH-,正极区溶液中c(OH-)增大,故B、C正确;
放电时,电解质溶液中OH-向负极移动,K+、H+向正极移动,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 燃料电池
6.(2022·济南高一检测)目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系,下列说法中错误的是
A.燃料电池能够使化学反应产生的能量转化为电能
B.燃料电池中通入H2的一极作负极,发生氧化反应
C.在此循环中发生了反应:2H2O 2H2↑
+O2↑
D.目前化学家急需解决的问题是寻找合适的
光照条件下分解水的催化剂
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
此循环过程中利用太阳能将H2O分解为H2和O2,然后利用氢氧燃料电池将化学能转化为电能,循环过程中并没有发生电解水的反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
7.某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。下列叙述错误的是
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是2H2O+2e-===H2↑+2OH-
C.电池总反应为2H2+O2===2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
A项,a极通入H2,为负极,电极反应为H2+2OH-
-2e-===2H2O,发生的是氧化反应;
B项,b极通入O2,为正极,电极反应为O2+2H2O
+4e-===4OH-;
C项,正、负极电极反应式相加可得电池总反应为2H2+O2===2H2O;
D项,氢氧燃料电池的能量高,且产物为水,对环境无污染,故是具有应用前景的绿色电源。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
8.(2022·武汉高一检测)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示,下列说法正确的是
A.Pt电极上发生的是氧化反应
B.外电路中,电子从Pt电极流向NiO电极
C.NiO电极上的电极反应式为NO+O2--
2e-===NO2
D.O2的电极反应产物是H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
由离子的定向移动可知NiO电极为原电池
的负极, Pt电极为原电池的正极,发生还
原反应,A错误;
NiO电极为原电池的负极,外电路中,电
子从NiO电极流向Pt电极,B错误;
NiO电极上NO失电子和氧离子反应生成二氧化氮,所以电极反应式为NO+O2--2e-===NO2,C正确;
Pt电极为原电池的正极,O2的电极反应产物是O2-,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
9.(2022·昆明市第三中学高一期中)化学电源在日常生活和高科技领域中有广泛应用,下列说法错误的是
A.甲:正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-
B.乙:锌筒作负极,发生氧化反应,锌筒会变薄
C.丙:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
D.丁:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
甲为纽扣电池,正极为Ag2O得电子发生还原反应,电极反应式为Ag2O+2e-+H2O===2Ag+2OH-,故A正确;
乙为锌锰干电池,锌筒作负极,发生氧化反应被溶解,导致锌筒变薄,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
丙为氢氧燃料电池,放电过程中不断生成水,故电解质溶液的酸性减弱,导电能力下降,故C正确;
丁中Zn为负极,Cu为正极,原电池工作时Zn2+向Cu电极方向移动,硫酸中氢离子得电子生成氢气,故溶液中H+浓度减小,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过。该电
池的工作原理如图所示,其中多孔电极a、
b均不参与电极反应。下列判断正确的是
①多孔电极a为负极
②a极对应的电极反应式为O2+2H2O+4e-===4OH-
③b极的电极反应式为H2-2e-+O2-===H2O
④该电池的总反应式为2H2+O2 2H2O
A.①② B.②④ C.②③ D.③④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
图中电子由多孔电极b通过导线流向多孔
电极a,多孔电极b为负极,多孔电极a为
正极,①错误;
a极对应的电极反应式为O2+4e-===2O2-,
②错误;
b极的电极反应式为H2-2e-+O2-===H2O,③正确;
根据正、负极得失电子数相等,将正、负极电极反应式相加,该电
池的总反应式为2H2+O2 2H2O,④正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.(2022·贵州黔东南高一期中)Li-FeS2电池是目前电池中综合性能最好的一种电池,其原理示意图如图所示。已知电池放电时的反应为4Li+FeS2===Fe+2Li2S。下列说法正确的是
A.Li为电池的正极,发生氧化反应
B.电流由Li经负载,流向FeS2极
C.正极的电极反应式为FeS2+4e-===Fe+2S2-
D.将熔融的LiCF3SO3改为LiCl的水溶液,电池性能更好
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
根据分析,Li为电池负极,发生氧化反应,A错误;
Li为负极,电流应从正极流出,B错误;
FeS2为正极,正极反应式为FeS2+4e-===Fe+2S2-,
C正确;
将熔融的LiCF3SO3改为LiCl的水溶液,Li和水发生氧
化还原反应生成氢气,所以不能将熔融的LiCF3SO3改为LiCl的水溶液,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.最近,科学家研发了“全氢电池”,其工作原理如图所示。 下列说法正确的是
A.右边吸附层中发生氧化反应
B.负极的电极反应是H2-2e-+2OH-===
2H2O
C.当右边吸附层中产生标准状况下2.24 L氢
气时,电子在溶液中通过了0.2 mol
D.电解质溶液中Na+向左移动, 向右移动
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由电子流向可知,右边吸附层为正极,发
生还原反应,故A错误;
由电子流向可知,左边吸附层为负极,发
生氧化反应,电极反应式是H2-2e-+
2OH-===2H2O,故B正确;
电子不能通过溶液,故C错误;
原电池中阳离子向正极移动,阴离子向负极移动,所以电解质溶液中Na+向右移动, 向左移动,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.(2022·西安调研)利用反应6NO2+8NH3===7N2+12H2O设计的电池装置如图所示,该装置能有效消除氮氧化物的排放,减轻环境污染。下列说法错误的是
A.电极B为正极,发生还原反应
B.当有0.5 mol NO2参与反应时,外电路中转
移3 mol电子
C.电池工作时,OH-从右向左移动
D.电极B的电极反应式为2NO2+8e-+4H2O===N2+8OH-
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
根据电池总反应6NO2+8NH3===7N2+12H2O可
知,NO2得电子发生还原反应,NH3失电子发
生氧化反应,则通入NH3的电极A为负极,通
入NO2的电极B为正极,A项正确;
根据电池总反应可知,当有6 mol NO2参与反应时,外电路中转移24 mol e-,则当有0.5 mol NO2参与反应时,外电路中转移电子的物质的量为0.5 mol×
=2 mol,B项错误;
原电池工作时,阴离子移向负极,故OH-从右向左移动,C项正确;
电极B为正极,发生还原反应,电极反应式为2NO2+8e-+4H2O===N2+8OH-,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.(1)银锌电池是一种常见的化学电源,其反应原理:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其工作原理如图所示。
①在装置中Ag2O作____(填“正”或“负”)极发
生_________(填“还原反应”或“氧化反应”),
电极反应式为______________________________。
②在装置中Zn作___(填“正”或“负”)极,发生_________(填“还原反应”或“氧化反应”),电极反应式为__________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
正
还原反应
Ag2O+2e-+H2O===2Ag+2OH-
负
氧化反应
Zn-2e-+2OH-===Zn(OH)2
(2)将用导线相连的两个铂电极插入KOH溶液中,
然后向两极分别通入CO和O2,则发生了原电池
反应,该原电池中的负极反应式为___________
_____________________;正极反应式为______
___________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2CO-4e-+
O2+
4e-+2H2O===4OH-
15.(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为3Zn+2K2FeO4+
8H2O 3Zn(OH)2 +2Fe(OH)3+4KOH。请回答下列问题:
①高铁电池的负极材料是___。
②放电时,正极发生_____(填“氧化”或“还原”)反应。已知正极反应式为 +3e-+4H2O===Fe(OH)3+5OH-,则负极反应式为________
_________________。
③放电时,___(填“正”或“负”)极附近溶液的碱性增强。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Zn
还原
Zn+2OH-
-2e-===Zn(OH)2
正
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
高铁电池放电时为原电池,负极发生氧化反应,正极发生还原反应。总反应式减去正极反应式得负极反应式,正极生成OH-,故正极附近溶液碱性增强。
(2)锂锰电池的结构示意图如右,其中电解质LiClO4溶
于混合有机溶剂中,Li+通过电解质转移到MnO2晶格
中生成LiMnO2。
①外电路的电流方向是由___极流向___极(填字母)。
该电池中Li失去电子生成Li+,所以Li作电池的负极,则a是负极,b是正极,所以外电路中的电流方向由正极流向负极,所以从b流向a。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
b a
②正极材料是______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
MnO2
③是否可用水代替电池中的混合有机溶剂?___(填“是”或“否”);原因是_______________________
_______。
不能用水代替电池中的混合有机溶剂,因为Li是活泼金属,与水反应,无法参与原电池反应,不能产生电流。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
否
电极Li是活泼金属,能与
水反应
返回
本课结束
第六章
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
