第六章 化学反应与能量 实验活动6 化学能转化成电能 课件(共17张PPT)
文档属性
| 名称 | 第六章 化学反应与能量 实验活动6 化学能转化成电能 课件(共17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 282.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 00:00:00 | ||
图片预览






文档简介
(共17张PPT)
实验活动6 化学能转化成电能
第六章
[实验目的]
1.理解氧化还原反应在化学能转化成电能过程中的作用,体会化学的价值。
2.认识原电池的构成要素及其作用。
[实验用品]
烧杯、导线、电流表。
锌片、铜片、石墨棒、稀硫酸。
[实验步骤]
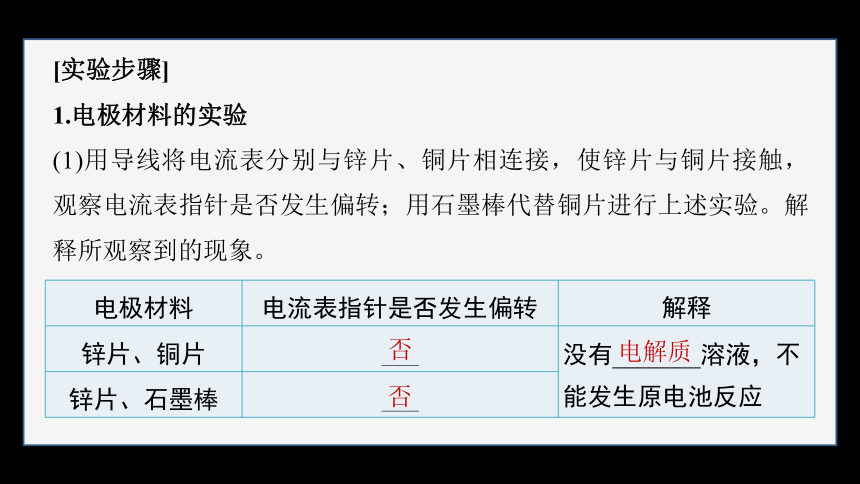
1.电极材料的实验
(1)用导线将电流表分别与锌片、铜片相连接,使锌片与铜片接触,观察电流表指针是否发生偏转;用石墨棒代替铜片进行上述实验。解释所观察到的现象。
电极材料 电流表指针是否发生偏转 解释
锌片、铜片 ___ 没有_______溶液,不能发生原电池反应
锌片、石墨棒 ___ 否
否
电解质
(2)按如图所示的装置实验,记录实验现象并解释原因。
实验装置 实验现象 解释
锌片____,表面产生________ 锌的还原性比H2_____,溶液中的___直接得到Zn失去的电子生成___
①锌片_____,表面产生_____ ____; ②铜片_______________ 铜的还原性比H2____,_____置换出H2,H+在锌片表面被_____成___
①锌片_____,表面产生_____ ____; ②石墨棒______________ 石墨为惰性材料,不能置换出H2,H+在锌片表面被_____成___
溶解
无色气泡
强
H+
H2
溶解
无色
气泡
表面无明显现象
弱
不能
还原
H2
溶解
无色
气泡
表面无明显现象
还原
H2
2.原电池实验
按如图所示的装置实验,记录实验现象并解释原因。
实验材料 实验现象 解释
Zn、Cu、H2SO4 ①锌片_____; ②铜片___溶解,表面产生_________; ③电流表指针_____ 锌_____的电子通过导线转移至_________产生电流,溶液中的____在铜片表面获得____生成___
溶解
不
无色气泡
偏转
失去
铜片表面
H+
电子
H2
Zn、石墨、H2SO4 ①锌片_____; ②石墨棒表面产生______ _____; ③电流表指针_____ 锌_____的电子通过导线转移至___________产生电流,溶液中的___在石墨棒表面获得_____生成____
Cu、石墨、H2SO4 铜片_______,电流表指针_______ 铜的还原性比___弱,_____发生氧化还原反应,_____电子转移,因而不能产生电流
溶解
无色
气泡
偏转
失去
石墨棒表面
H+
电子
H2
不溶解
不偏转
H2
不能
没有
[问题讨论]
1.根据以上实验,说明原电池的工作原理和构成要素。
提示 (1)工作原理:负极失去电子发生氧化反应,电子通过导线流入正极,溶液中的离子在正极上得到电子发生还原反应。
(2)构成要素:①化学反应:自发进行的氧化还原反应。②装置条件:a.活泼性不同的电极,b.电解质溶液,c.形成闭合回路。
2.指出原电池实验中铜锌原电池的电极名称,并写出电极反应和电池总反应。
提示 Zn:负极,Zn-2e-===Zn2+;
Cu:正极,2H++2e-===H2↑;
电池总反应:Zn+2H+===Zn2++H2↑。
3.在原电池实验中,若锌片、铜片接触,插入硫酸溶液,能否观察到电流?
提示 不能。
4.将原电池实验中锌-石墨原电池中的锌片换成铁片,能否形成电流?若能产生电流,写出电极反应和电池总反应。
提示 能产生电流。
负极:Fe-2e-===Fe2+;
正极:2H++2e-===H2↑;
电池总反应:Fe+2H+===Fe2++H2↑。
1
2
1.如图所示,在盛有稀硫酸的烧杯中放入用导线连接的X、Y两电极。下列说法错误的是
A.溶液中 移向Y电极
B.若两电极分别为铁棒和碳棒,则X电极为铁棒
C.X电极上发生的是氧化反应,Y电极上发生的是还原反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
√
1
2
由图可知,电子由X电极流向Y电极,故X电极为负极,Y电极为正极,溶液中 移向负极,即X电极,A项错误;
若两电极分别为铁棒和碳棒,则铁棒作负极,即X电极为铁
棒,B项正确;
X电极为负极,发生氧化反应,Y电极为正极,发生还原反
应,C项正确;
若两电极都是金属,则活泼性较强的金属作负极,故活动性顺序为X>Y,D项正确。
1
2
2.Ⅰ.现有两个反应:
a.NaOH+HCl===NaCl+H2O
b.Cu+2Ag+===2Ag+Cu2+
(1)根据两反应本质,判断它们能否设计成原电池:______________。
如果不能,说明其原因:_________________________________。
能设计成原电池的化学反应必须是自发进行的氧化还原反应,否则不能设计成原电池。
a不能,b可以
a是非氧化还原反应,没有电子转移
1
2
(2)如果可以,则写出正、负极材料,电极反应式及反应类型(“氧化反应”或“还原反应”),电解质溶液名称。
负极:____,________________,_________。
正极:_________________________________,___________________,
_________。
电解质溶液:___________。
Cu
Cu-2e-===Cu2+ 氧化反应
石墨棒(或Ag、铂、金等,任选一种)
2Ag++2e-===2Ag
还原反应
硝酸银溶液
1
2
根据Cu+2Ag+===2Ag+Cu2+可知,Cu应为负极,失电子被氧化,正极可为石墨棒、Ag等,正极上Ag+得电子生成Ag,电解质溶液为AgNO3溶液。
1
2
Ⅱ.常温下,将除去表面氧化膜的Al、Cu
片插入浓HNO3中组成原电池(图1),测得
原电池的电流强度(I)随时间(t)的变化如图
2所示。反应过程中有红棕色气体产生。
O~t1时,原电池的负极是Al片,此时,正极的电极反应式是________
_______________________,溶液中的H+向_____移动;t1时,原电池中电子流动方向发生改变,其原因是_____________________________
_________________________。
2H++
正极
Al在浓硝酸中发生钝化,形成的氧化膜阻止了Al进一步反应
1
2
本课结束
第六章
实验活动6 化学能转化成电能
第六章
[实验目的]
1.理解氧化还原反应在化学能转化成电能过程中的作用,体会化学的价值。
2.认识原电池的构成要素及其作用。
[实验用品]
烧杯、导线、电流表。
锌片、铜片、石墨棒、稀硫酸。
[实验步骤]
1.电极材料的实验
(1)用导线将电流表分别与锌片、铜片相连接,使锌片与铜片接触,观察电流表指针是否发生偏转;用石墨棒代替铜片进行上述实验。解释所观察到的现象。
电极材料 电流表指针是否发生偏转 解释
锌片、铜片 ___ 没有_______溶液,不能发生原电池反应
锌片、石墨棒 ___ 否
否
电解质
(2)按如图所示的装置实验,记录实验现象并解释原因。
实验装置 实验现象 解释
锌片____,表面产生________ 锌的还原性比H2_____,溶液中的___直接得到Zn失去的电子生成___
①锌片_____,表面产生_____ ____; ②铜片_______________ 铜的还原性比H2____,_____置换出H2,H+在锌片表面被_____成___
①锌片_____,表面产生_____ ____; ②石墨棒______________ 石墨为惰性材料,不能置换出H2,H+在锌片表面被_____成___
溶解
无色气泡
强
H+
H2
溶解
无色
气泡
表面无明显现象
弱
不能
还原
H2
溶解
无色
气泡
表面无明显现象
还原
H2
2.原电池实验
按如图所示的装置实验,记录实验现象并解释原因。
实验材料 实验现象 解释
Zn、Cu、H2SO4 ①锌片_____; ②铜片___溶解,表面产生_________; ③电流表指针_____ 锌_____的电子通过导线转移至_________产生电流,溶液中的____在铜片表面获得____生成___
溶解
不
无色气泡
偏转
失去
铜片表面
H+
电子
H2
Zn、石墨、H2SO4 ①锌片_____; ②石墨棒表面产生______ _____; ③电流表指针_____ 锌_____的电子通过导线转移至___________产生电流,溶液中的___在石墨棒表面获得_____生成____
Cu、石墨、H2SO4 铜片_______,电流表指针_______ 铜的还原性比___弱,_____发生氧化还原反应,_____电子转移,因而不能产生电流
溶解
无色
气泡
偏转
失去
石墨棒表面
H+
电子
H2
不溶解
不偏转
H2
不能
没有
[问题讨论]
1.根据以上实验,说明原电池的工作原理和构成要素。
提示 (1)工作原理:负极失去电子发生氧化反应,电子通过导线流入正极,溶液中的离子在正极上得到电子发生还原反应。
(2)构成要素:①化学反应:自发进行的氧化还原反应。②装置条件:a.活泼性不同的电极,b.电解质溶液,c.形成闭合回路。
2.指出原电池实验中铜锌原电池的电极名称,并写出电极反应和电池总反应。
提示 Zn:负极,Zn-2e-===Zn2+;
Cu:正极,2H++2e-===H2↑;
电池总反应:Zn+2H+===Zn2++H2↑。
3.在原电池实验中,若锌片、铜片接触,插入硫酸溶液,能否观察到电流?
提示 不能。
4.将原电池实验中锌-石墨原电池中的锌片换成铁片,能否形成电流?若能产生电流,写出电极反应和电池总反应。
提示 能产生电流。
负极:Fe-2e-===Fe2+;
正极:2H++2e-===H2↑;
电池总反应:Fe+2H+===Fe2++H2↑。
1
2
1.如图所示,在盛有稀硫酸的烧杯中放入用导线连接的X、Y两电极。下列说法错误的是
A.溶液中 移向Y电极
B.若两电极分别为铁棒和碳棒,则X电极为铁棒
C.X电极上发生的是氧化反应,Y电极上发生的是还原反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
√
1
2
由图可知,电子由X电极流向Y电极,故X电极为负极,Y电极为正极,溶液中 移向负极,即X电极,A项错误;
若两电极分别为铁棒和碳棒,则铁棒作负极,即X电极为铁
棒,B项正确;
X电极为负极,发生氧化反应,Y电极为正极,发生还原反
应,C项正确;
若两电极都是金属,则活泼性较强的金属作负极,故活动性顺序为X>Y,D项正确。
1
2
2.Ⅰ.现有两个反应:
a.NaOH+HCl===NaCl+H2O
b.Cu+2Ag+===2Ag+Cu2+
(1)根据两反应本质,判断它们能否设计成原电池:______________。
如果不能,说明其原因:_________________________________。
能设计成原电池的化学反应必须是自发进行的氧化还原反应,否则不能设计成原电池。
a不能,b可以
a是非氧化还原反应,没有电子转移
1
2
(2)如果可以,则写出正、负极材料,电极反应式及反应类型(“氧化反应”或“还原反应”),电解质溶液名称。
负极:____,________________,_________。
正极:_________________________________,___________________,
_________。
电解质溶液:___________。
Cu
Cu-2e-===Cu2+ 氧化反应
石墨棒(或Ag、铂、金等,任选一种)
2Ag++2e-===2Ag
还原反应
硝酸银溶液
1
2
根据Cu+2Ag+===2Ag+Cu2+可知,Cu应为负极,失电子被氧化,正极可为石墨棒、Ag等,正极上Ag+得电子生成Ag,电解质溶液为AgNO3溶液。
1
2
Ⅱ.常温下,将除去表面氧化膜的Al、Cu
片插入浓HNO3中组成原电池(图1),测得
原电池的电流强度(I)随时间(t)的变化如图
2所示。反应过程中有红棕色气体产生。
O~t1时,原电池的负极是Al片,此时,正极的电极反应式是________
_______________________,溶液中的H+向_____移动;t1时,原电池中电子流动方向发生改变,其原因是_____________________________
_________________________。
2H++
正极
Al在浓硝酸中发生钝化,形成的氧化膜阻止了Al进一步反应
1
2
本课结束
第六章
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
