第七章 第三节 第2课时 乙酸 课件(共70张PPT)
文档属性
| 名称 | 第七章 第三节 第2课时 乙酸 课件(共70张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 19:36:52 | ||
图片预览










文档简介
(共70张PPT)
DIERKESHI
乙酸的物理性质、结构及弱酸性 / 乙酸的典型性质——酯化反应 / 随堂演练 知识落实 / 课时对点练
乙酸
第七章
第2课时
核心素养
发展目标
1.了解乙酸的物理性质和用途,培养科学态度与社会责任。
2.掌握乙酸的组成、结构和化学性质,培养变化观念与平衡思想。
3.掌握酯化反应的原理、实质和实验操作,能依据给出的问题,设计简单的实验方案,培养科学探究与创新意识。
内容索引
随堂演练 知识落实
课时对点练
一、乙酸的物理性质、结构及弱酸性
二、乙酸的典型性质——酯化反应
乙酸的物理性质、结构及弱酸性
一
1.乙酸的物理性质
乙酸俗称_____,是有强烈刺激性气味的无色液体,易溶于_________,当温度低于熔点(16.6 ℃)时,凝结成类似冰的晶体,所以纯净的乙酸又叫_______。
醋酸
水和乙醇
冰醋酸
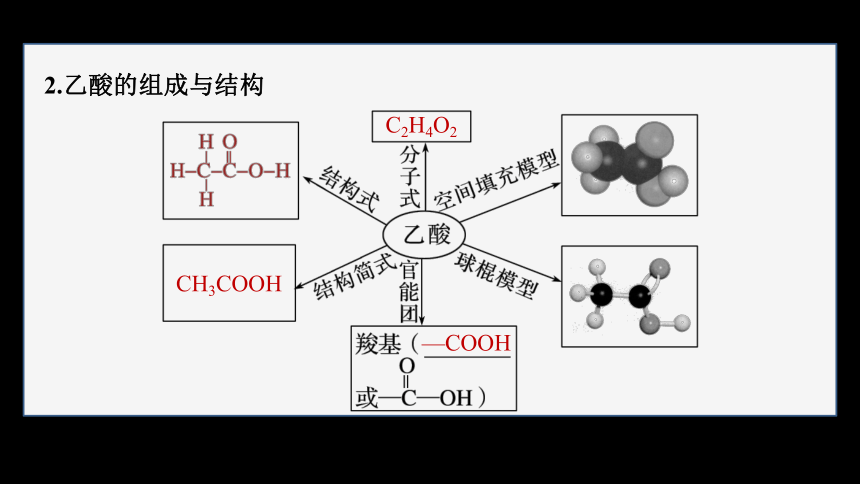
2.乙酸的组成与结构
CH3COOH
C2H4O2
—COOH
3.乙酸的酸性
乙酸是一元弱酸,其酸性比H2CO3____,具有酸的通性,滴入紫色石蕊溶液,溶液变______,写出下列反应的化学方程式。
(1)与Na反应:_____________________________________;
(2)与NaOH反应:_____________________________________;
(3)与Na2O反应:______________________________________;
(4)与Na2CO3反应:_________________________________________________;
(5)与NaHCO3反应:________________________________________________。
强
红色
2CH3COOH+2Na―→ 2CH3COONa+H2↑
CH3COOH+NaOH―→ CH3COONa+H2O
2CH3COOH+Na2O―→ 2CH3COONa+H2O
2CH3COOH+Na2CO3―→ 2CH3COONa+H2O+CO2↑
CH3COOH+NaHCO3―→ CH3COONa+CO2↑+H2O
(1)在标准状况下醋酸是一种无色有强烈刺激性气味的液体( )
(2)乙酸中含有双键,因此属于不饱和烃( )
(3)乙酸分子中含有 和—OH两种官能团( )
(4)乙酸分子中含有4个H原子,故为四元酸( )
(5)酸性高锰酸钾溶液、碳酸钠、紫色石蕊溶液均可鉴别乙醇和乙酸( )
×
正误判断
√
×
×
×
深度思考
1.某化学小组要证实乙酸的酸性强于碳酸的酸性,
设计如图装置。
选择试剂:0.1 mol· L-1稀醋酸、碳酸钠粉末、醋
酸钠、水。
试回答下列问题:
(1)A试剂为_________________,B试剂为__________。
(2)证明乙酸强于碳酸的实验现象:________________________________
____________________________________。
0.1 mol·L-1稀醋酸
碳酸钠粉末
当0.1 mol·L-1稀醋酸滴入圆底烧瓶时,产生无色气泡,澄清石灰水变浑浊
深度思考
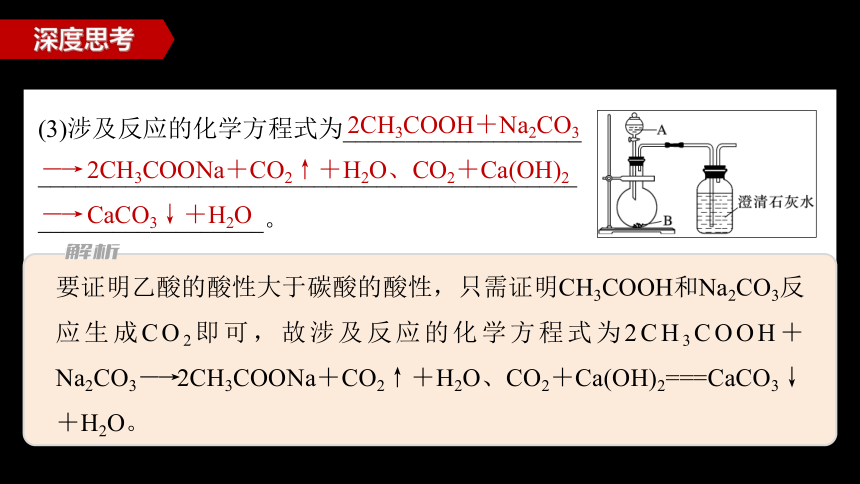
(3)涉及反应的化学方程式为___________________
___________________________________________
__________________。
2CH3COOH+Na2CO3
―→ 2CH3COONa+CO2↑+H2O、CO2+Ca(OH)2
―→ CaCO3↓+H2O
要证明乙酸的酸性大于碳酸的酸性,只需证明CH3COOH和Na2CO3反应生成CO2即可,故涉及反应的化学方程式为2CH3COOH+Na2CO3―→2CH3COONa+CO2↑+H2O、CO2+Ca(OH)2===CaCO3↓+H2O。
深度思考
(4)下列物质:①C2H5OH ②CH3COOH ③H2O都能与Na反应放出H2,其产生H2速率由快到慢的顺序为__________(填序号)。
②>③>①
C2H5OH、CH3COOH和H2O中都存在—OH,其活泼性为乙酸>水>乙醇,故和Na反应生成H2的速率为CH3COOH>H2O>C2H5OH。
深度思考
2.在家庭生活中,常用食醋(3%~5%的乙酸)清除水壶中少量的水垢(主要成分为碳酸钙),写出清除过程发生反应的化学方程式:___________
______________________________________。乙酸能与活泼金属反应,写出乙酸和镁反应的离子方程式:________________________________
_________________。
2CH3COOH
+CaCO3―→ (CH3COO)2Ca+CO2↑+H2O
Mg+2CH3COOH―→ Mg2++
2CH3COO-+H2↑
归纳总结
乙酸、水、乙醇、碳酸的性质比较
名称 乙酸 水 乙醇 碳酸
分子结构 CH3COOH H—OH C2H5OH
与羟基直接相连的原子或原子团 —H C2H5—
归纳总结
遇石蕊溶液 变红 不变红 不变红 变红
与Na 反应 反应 反应 反应
与Na2CO3 反应 — 不反应 反应
羟基氢的活 泼性强弱 CH3COOH>H2CO3>H2O>C2H5OH 返回
乙酸的典型性质——酯化反应
二
1.酯化反应的实验探究
实验装置
注意事项 (1)试剂的加入顺序
先加入乙醇,然后边振荡试管边慢慢加入浓硫酸和乙酸。
(2)导管末端不能插入饱和Na2CO3溶液中,防止挥发出来的CH3COOH、CH3CH2OH溶于水,造成溶液倒吸。
(3)加热前应加入几片碎瓷片防止液体暴沸,加热时小火加热减少乙酸、乙醇的挥发
实验 现象 a.饱和Na2CO3溶液的液面上层有___________________生成
b.能闻到_____
化学方 程式 CH3COOH+CH3CH2OH _____________+H2O
乙酸乙酯
无色透明的油状液体
香味
CH3COOC2H5
2.酯化反应
(1)概念:酸与醇反应生成___和___的反应。
(2)反应特点:酯化反应是_________,乙酸乙酯会与水发生水解反应生成_____和_____。
(3)反应机理(乙醇中含有示踪原子)
即酸脱_____醇脱___,所以酯化反应也属于取代反应。
酯
水
可逆反应
乙酸
乙醇
羟基
氢
3.酯
(1)酯:羧酸分子羧基中的____被—OR取代后的一类有机物,乙酸乙酯
是酯类物质的一种,其官能团为_____( 或—COOR)。
(2)物理性质
低级酯密度比水___,易溶于有机溶剂,具有一定的挥发性,具有_____气味。
(3)用途
①作香料:如作饮料、糖果、化妆品中的香料。
②作有机溶剂。
羟基
酯基
小
芳香
(1)在酯化反应实验时,可以先加入浓硫酸,然后边振荡试管,边加入乙醇和乙酸( )
(2)在酯化反应中,只要乙醇过量,可以把乙酸完全反应生成乙酸乙酯( )
(3)酯化反应一定为取代反应( )
(4)乙酸乙酯是有特殊香味的、易溶于水的无色液体( )
(5)在酯化反应实验中,可用稀硫酸代替浓硫酸( )
×
正误判断
√
×
×
×
深度思考
某研究小组用如图所示装置制取乙酸乙酯,请回答下列
问题:
(1)为防止试管a中液体实验时发生暴沸,加热前应采取的
措施为__________________。
为防止溶液暴沸,液体加热前要加碎瓷片或沸石。
加入碎瓷片(或沸石)
深度思考
(2)装置中的球形干燥管除起冷凝作用外,它的另一重要作用是_________。
乙酸乙酯中混有乙醇和乙酸,二者易溶于水,乙酸能和碳酸钠反应,易发生倒吸,该实验中使用球形干燥管,球形部位空间大,液面上升时可缓冲,防止倒吸。
防止倒吸
深度思考
(3)试管b中饱和碳酸钠溶液的作用除了溶解乙醇,还有
_________,_____________________。
由(2)中分析可知,饱和碳酸钠溶液还有中和乙酸,降低乙酸乙酯的溶解度的作用。
中和乙酸
降低乙酸乙酯的溶解度
深度思考
(4)待试管b收集到一定量产物后停止加热,撤去试管b并
用力振荡试管b,静置后试管b中所观察到的实验现象:
_____________________________________。
乙酸乙酯不溶于饱和碳酸钠溶液,且密度比水小,有香味,所以静置后,试管b中所观察到的实验现象为液体分层,上层是无色有香味的油状液体。
液体分层,上层为无色有香味的油状液体
深度思考
(5)如果用含示踪原子18O的乙醇参与反应,生成的产物中,
只有乙酸乙酯中含有18O,则酯化反应中,乙酸和乙醇分
子中断裂的各是什么键,在化学方程式中表示出其断键部
位:_______________________________________。
据题给信息,乙酸和乙醇在酯化反应中乙酸断裂的是C—O,乙醇断裂的是O—H,即酸脱羟基醇脱氢。
归纳总结
酯化反应中的“一原理”“两作用”
1.一原理
在酯化反应中,有机羧酸断C—O,醇分子断O—H,即“酸脱羟基醇脱氢”,表示如下:
归纳总结
2.两作用
(1)浓硫酸的作用
①催化剂——加快反应速率。
②吸水剂——除去反应的副产物水,提高酯的产率。
(2)饱和Na2CO3溶液的作用
①降低乙酸乙酯的溶解度,便于分层,得到酯。
②与挥发出来的乙酸反应。
③溶解挥发出来的乙醇。
返回
随堂演练 知识落实
1.下列关于乙酸性质的叙述中,错误的是
A.乙酸的酸性比碳酸的强,所以它可以与碳酸盐溶液反应,产生CO2气体
B.乙酸具有酸性,所以能与钠反应放出H2
C.乙酸分子中含有碳氧双键,所以它能使溴水褪色
D.乙酸在温度低于16.6 ℃时,就凝结成冰状晶体
√
1
2
3
4
乙酸的结构式为 ,分子中的碳氧双键和Br2不能发生反
应,故C错误。
1
2
3
4
2.将CH3COOH和H18O—C2H5混合发生酯化反应,已知酯化反应是可逆反应,反应达到平衡后,下列说法正确的是
A.18O存在于所有物质里
B.18O仅存在于乙醇和乙酸乙酯里
C.18O仅存在于乙醇和水里
D.有的乙醇分子可能不含18O
1
2
3
4
√
由CH3COOH+H18O—C2H5 +H2O可知,18O存
在于乙醇和乙酸乙酯中,B项正确。
1
2
3
4
3.(2022·豫西名校高一检测)乙酸分子的结构式为 ,已知:
CH3COOH+Br2 BrCH2COOH+HBr,下列反应及断键部位正确的是
(1)乙酸的电离,是①键断裂
(2)乙酸与乙醇发生酯化反应,是②键断裂
(3)在红磷存在时,Br2与CH3COOH的反应是③键断裂
(4)乙酸在空气中燃烧是①②键断裂
A.(1)(2)(3) B.(1)(2)(3)(4)
C.(2)(3)(4) D.(1)(3)(4)
√
1
2
3
4
乙酸电离出H+时,断裂①键;
发生酯化反应时酸脱羟基,断裂②键;
在红磷存在时,乙酸与Br2反应,溴原子取代了甲基上的氢原子,断裂③键;
乙酸在空气中燃烧生成CO2和H2O,分子结构中的所有键均断裂。
1
2
3
4
4.(2022·天津高一检测)某课外小组设计的实验室制取乙
酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙
醇、无水乙酸,D中盛有饱和碳酸钠溶液。
已知:无水氯化钙可与乙醇形成难溶于水的
CaCl2·6C2H5OH。
请回答下列问题:
(1)若实验中用乙酸和含18O的乙醇反应,写出该反应的化学方程式:
_________________________________________________。
1
2
3
4
CH3COOH+C2H518OH +H2O
在酯化反应中,羧酸提供羟基,醇提供氢原子,所以反应后乙醇中的18O在乙酸乙酯中。
1
2
3
4
(2)球形干燥管C的作用是___________________。若反应
前向D中加入几滴酚酞溶液,溶液呈红色,说明碳酸钠
溶液显____性;反应结束后,D中的现象是___________
_____________________________________。
球形干燥管容积大,可以防止倒吸,同时可冷凝乙酸乙酯蒸气。酚酞遇碱变红,故碳酸钠溶液呈碱性,乙酸乙酯不溶于饱和碳酸钠溶液,且其密度比水的小,故D中溶液分层,上层为无色油状液体,反应中挥发出来的乙酸和碳酸钠反应而使下层溶液红色变浅。
1
2
3
4
上层为无色油状液体,下层溶液红色变浅
冷凝蒸气,防止倒吸
碱
溶液分层,
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出_____。
无水氯化钙能与乙醇形成难溶于水的物质,所以先加入无水氯化钙,分离出乙醇。
1
2
3
4
乙醇
返回
课时对点练
题组一 乙酸的结构与酸性
1.如图所示是某常见有机物分子的空间填充模型,该物质不具有的性质是
A.与大理石反应 B.与稀盐酸反应
C.发生酯化反应 D.使紫色石蕊溶液变红
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由有机物分子的空间填充模型可知,该物质为乙酸,乙
酸为一元弱酸,但比H2CO3的酸性强,故可与大理石反应,
也可使紫色石蕊溶液变红,故A、D正确;
乙酸和乙醇在浓H2SO4加热条件下发生酯化反应,故C正确;
乙酸与稀盐酸不反应,故B错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2.食醋的主要成分是乙酸,下列物质在一定条件下能与乙酸发生反应的是
①石蕊 ②乙醇 ③金属镁 ④氢氧化铁 ⑤氧化钙 ⑥碳酸钠 ⑦稀硫酸
A.①③④⑤⑦ B.②③④⑥⑦
C.①②③④⑤⑥⑦ D.①②③④⑤⑥
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
CH3COOH为有机酸,具有酸的通性,能使石蕊溶液变红,能和活泼金属镁反应生成H2,能与碱性氧化物及碱生成盐和水,能与Na2CO3反应生成CO2,能与乙醇发生酯化反应,但乙酸和H2SO4不反应,故①②③④⑤⑥正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 酯化反应及实验探究
3.若乙酸分子中的O都是18O,乙醇分子中的O都是16O,二者发生酯化反应所得生成物中水的相对分子质量是
A.16 B.18 C.20 D.22
√
该反应的化学方程式为 +C2H516OH
+H218O,故C项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
4.(2022·广东兴宁市高一检测)某羧酸酯的分子式为C10H18O3,1 mol该酯完全水解可得到1 mol羧酸和1 mol乙醇,则该羧酸的分子式为
A.C8H16O2 B.C8H16O3
C.C8H14O2 D.C8H14O3
√
乙醇的分子式为C2H6O,该酯水解反应表示为C10H18O3+H2O―→ 羧酸+C2H6O,根据原子守恒可得羧酸的分子式为C8H14O3。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
5.下列有关乙酸乙酯的说法错误的是
A.乙酸乙酯的结构式为
B.乙酸乙酯和乙酸互为同系物
C.由乙酸乙酯的名称可知,CH3CH2COOCH3的名称为丙酸甲酯
D.乙酸乙酯为无色油状物质,与碳酸钠溶液不反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
6.(2022·济南高一月考)1-丁醇(CH3CH2CH2CH2OH)和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125 ℃,反应装置如图,下列对该实验的描述正确的是
A.该实验可以选择水浴加热
B.该反应中,如果乙酸足量,1-丁醇可以完全被消耗
C.长玻璃管除平衡气压外,还起到冷凝回流的作用
D.在反应中1-丁醇分子脱去羟基,乙酸脱去氢原子
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
据信息,该反应温度为115~125 ℃,不能用水浴加热,故A
错误;
1-丁醇和乙酸的酯化反应为可逆反应,即使乙酸过量,1-丁
醇也不能完全被消耗,故B错误;
长玻璃管可以平衡试管内外气压,同时可冷凝回流乙酸及1-丁醇,故C正确;
据酯化反应原理,1-丁醇分子脱去羟基中氢原子,乙酸分子脱去羟基,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
7.已知反应:甲( )+乙―→ 丙( )+H2O,则
下列判断不正确的是
A.乙物质为甲醇
B.该反应为取代反应
C.甲和乙都能与金属钠反应产生氢气
D.甲、乙、丙都能使溴的四氯化碳溶液发生加成反应而褪色
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
根据反应方程式,可知乙为甲醇(CH3OH),发生的反应为酯化反应,也为取代反应,故A、B项正确;
甲和乙(CH3OH),都能和金属钠反应生成H2,C项正确;
甲和丙分子中含有 ,可以和溴发生加成反应,但乙为CH3OH,
不能和溴发生加成反应,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
8.乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计了如图所示的两套装置,用乙醇、乙酸和浓硫酸作原料分别制备乙酸乙酯(沸点77.2 ℃)。下列有关说法不正确的是
A.浓硫酸能提高酯化反应的速率
B.温度越高反应速率越大,装置a更佳
C.装置b比装置a原料损失得少
D.用饱和Na2CO3溶液收集乙酸乙酯有利于酯的纯化
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A 乙酸与乙醇生成乙酸乙酯的反应是可逆反应,浓硫酸是该反应的催化剂,能起到增大反应速率的作用 √
B 乙酸、乙醇都易挥发,温度高会加速反应物的挥发,降低酯的产率,因此装置b更佳 ×
C 装置b是通过水浴加热,相对于装置a,温度较低,减少了反应物的挥发 √
D 乙酸乙酯在饱和Na2CO3溶液中的溶解度很小,且能将混在乙酸乙酯中的乙酸和部分乙醇除去,得到较纯净的乙酸乙酯 √
9.在同温、同压下,某有机物与过量Na反应得到V1 L氢气,另取一份等量的该有机物与足量NaHCO3反应得到V2 L二氧化碳,若V1=V2≠0,则有机物可能是
A. B.HOOC—COOH
C.HOCH2CH2OH D.CH3COOH
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
钠既能与羟基反应,又能与羧基反应,且2—OH~H2或2—COOH~H2、—COOH~CO2;由题意知该有机物中既有羧基又有羟基,且羧基和羟基个数相等,故A项中的物质符合要求。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.下列试剂能将 转化为 的是
①金属钠 ②氢氧化钠 ③碳酸钠 ④碳酸氢钠 ⑤硫酸钠
A.①②④ B.②③④
C.③④⑤ D.①②⑤
—COOH和—OH都可以和Na发生反应,—COOH呈酸性,能与碱性物质反应,因此实现—COOH转化为—COONa而—OH不变,只能选择NaOH、Na2CO3和NaHCO3。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
11.分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构)
A.3种 B.4种
C.5种 D.6种
√
据题给信息,能和饱和NaHCO3反应放出气体的有机物,分子结构中应含有羧基,故有机物为C4H9—COOH,丁基(—C4H9)有4种异构体,C4H9—COOH也有4种异构体,故C5H10O2属于羧酸的有机物共有4种。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.(2022·成都高一检测)苹果酸有特殊的酸味,主要用于食品和医药行业。
苹果酸的结构简式为 ,下列说法正确的是
A.苹果酸中能发生酯化反应的官能团有2种
B.1 mol苹果酸可与3 mol NaOH发生中和反应
C.1 mol苹果酸与足量Na反应生成1 mol H2
D.HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A项,苹果酸中含—OH和—COOH 2种能发生酯化反应的官能团;
B项,1 mol苹果酸可与2 mol NaOH发生中和反应;
C项,1 mol苹果酸与足量Na反应生成1.5 mol H2;
D项,二者为同一物质。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.分子式为C2H4O2的有机化合物A具有如下性质:
①A+Na→迅速产生气泡;②A+CH3CH2OH 有香味的物质。
(1)根据上述信息,对该化合物可作出的判断是____(填字母)。
A.一定含有—OH
B.一定含有—COOH
C.有机化合物A为乙醇
D.有机化合物A为乙酸
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
BD
根据A的分子式及A的化学性质推知A为乙酸。
(2)A与钠反应的化学方程式为____________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2CH3COOH+2Na―→ 2CH3COONa+H2↑
(3)化合物A和CH3CH2OH反应生成的有香味的物质的结构简式为________________。
乙醇和CH3COOH发生酯化反应生成乙酸乙酯。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
CH3COOCH2CH3
(4)有机化合物B分子式为C2H4O3,与Na反应迅速产生H2,且1 mol B与足量Na反应放出1 mol H2,则B的结构简式为______________。
与Na反应迅速,则含有—COOH,且产生H2与消耗B的物质的量之比为1∶1,根据分子式,则必含—OH,B的结构简式为HOCH2COOH。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
HOCH2COOH
14.(2022·长春高一期末)查阅资料可知以下数据:
某学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL大试管A中按体积比1∶4∶4配制浓硫酸、乙醇和乙酸的混合溶液。
②按如图所示连接好装置(装置气密性良好),用小火均
匀地加热装有混合溶液的大试管A 5~10 min。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
物质 乙醇 乙酸 乙酸乙酯 浓硫酸
沸点/℃ 78.5 118 77.2 338.0
③待试管B收集到一定量的产物后停止加热,撤下试管B并用力振荡B,然后静置分层。
④分离出乙酸乙酯层,洗涤、干燥。
请根据题目要求回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(1)配制①中混合溶液的主要操作步骤为____________________________
________________________________________________________________________________________。
在30 mL的大试管A中先注入
4 mL乙醇,然后边振荡试管边缓慢加入1 mL的浓硫酸,待冷却至室温时,再加入4 mL乙酸并摇匀
配制乙醇、浓硫酸、乙酸混合溶液时,各试剂加入
试管的顺序为乙醇→浓硫酸→乙酸。将浓硫酸加入
乙醇中,边加边振荡是为了防止混合时产生的热量
不能散出导致液体飞溅造成事故;将乙醇与浓硫酸
的混合液冷却后再与乙酸混合,是为了防止乙酸的挥发造成原料损失。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)步骤②中需要小火均匀加热,其主要理由是_______
_______________________________________________
_______________________________________________
___________________。
根据各物质的沸点数据可知,乙酸(118 ℃)、乙醇(78.5 ℃)的沸点都比较低,且与乙酸乙酯的沸点(77.2 ℃)比较接近,若用大火加热,反应物容易随生成物(乙酸乙酯)一起蒸发出来,导致原料大量损失;同时温度太高,可能发生其他副反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
一方面,用大火加热,反应物容易随生成物(乙酸乙酯)一起蒸发出来,导致原料大量损失;另一方面,温度太高,可能发生其他副反应
(3)指出步骤③所观察到的现象:___________________
_______________________________________________
______________________________________________。
分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为___(填字母)。
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
试管B中的液体分成上下两层,上层为无色油状液体(可以闻到芳香气味),下层液体呈(浅)红色,振荡后下层液体的红色变浅
B
15.石油经裂解可获得大量化工产品A,以A为原料合成香料D的流程如下:
(1)在标准状况下,烃A的结构简式为___________。
(2)写出物质C与金属钠反应的化学方程式:________________________
______________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
CH2==CH2
HOCH2CH2OH+2Na―→
NaOCH2CH2ONa+H2↑
(3)CH3COOH与物质C按物质的量2∶1反应生成D,则D的化学式为_________。
(4)写出②的化学方程式:______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
C6H10O4
+H2O
返回
本课结束
第七章
DIERKESHI
乙酸的物理性质、结构及弱酸性 / 乙酸的典型性质——酯化反应 / 随堂演练 知识落实 / 课时对点练
乙酸
第七章
第2课时
核心素养
发展目标
1.了解乙酸的物理性质和用途,培养科学态度与社会责任。
2.掌握乙酸的组成、结构和化学性质,培养变化观念与平衡思想。
3.掌握酯化反应的原理、实质和实验操作,能依据给出的问题,设计简单的实验方案,培养科学探究与创新意识。
内容索引
随堂演练 知识落实
课时对点练
一、乙酸的物理性质、结构及弱酸性
二、乙酸的典型性质——酯化反应
乙酸的物理性质、结构及弱酸性
一
1.乙酸的物理性质
乙酸俗称_____,是有强烈刺激性气味的无色液体,易溶于_________,当温度低于熔点(16.6 ℃)时,凝结成类似冰的晶体,所以纯净的乙酸又叫_______。
醋酸
水和乙醇
冰醋酸
2.乙酸的组成与结构
CH3COOH
C2H4O2
—COOH
3.乙酸的酸性
乙酸是一元弱酸,其酸性比H2CO3____,具有酸的通性,滴入紫色石蕊溶液,溶液变______,写出下列反应的化学方程式。
(1)与Na反应:_____________________________________;
(2)与NaOH反应:_____________________________________;
(3)与Na2O反应:______________________________________;
(4)与Na2CO3反应:_________________________________________________;
(5)与NaHCO3反应:________________________________________________。
强
红色
2CH3COOH+2Na―→ 2CH3COONa+H2↑
CH3COOH+NaOH―→ CH3COONa+H2O
2CH3COOH+Na2O―→ 2CH3COONa+H2O
2CH3COOH+Na2CO3―→ 2CH3COONa+H2O+CO2↑
CH3COOH+NaHCO3―→ CH3COONa+CO2↑+H2O
(1)在标准状况下醋酸是一种无色有强烈刺激性气味的液体( )
(2)乙酸中含有双键,因此属于不饱和烃( )
(3)乙酸分子中含有 和—OH两种官能团( )
(4)乙酸分子中含有4个H原子,故为四元酸( )
(5)酸性高锰酸钾溶液、碳酸钠、紫色石蕊溶液均可鉴别乙醇和乙酸( )
×
正误判断
√
×
×
×
深度思考
1.某化学小组要证实乙酸的酸性强于碳酸的酸性,
设计如图装置。
选择试剂:0.1 mol· L-1稀醋酸、碳酸钠粉末、醋
酸钠、水。
试回答下列问题:
(1)A试剂为_________________,B试剂为__________。
(2)证明乙酸强于碳酸的实验现象:________________________________
____________________________________。
0.1 mol·L-1稀醋酸
碳酸钠粉末
当0.1 mol·L-1稀醋酸滴入圆底烧瓶时,产生无色气泡,澄清石灰水变浑浊
深度思考
(3)涉及反应的化学方程式为___________________
___________________________________________
__________________。
2CH3COOH+Na2CO3
―→ 2CH3COONa+CO2↑+H2O、CO2+Ca(OH)2
―→ CaCO3↓+H2O
要证明乙酸的酸性大于碳酸的酸性,只需证明CH3COOH和Na2CO3反应生成CO2即可,故涉及反应的化学方程式为2CH3COOH+Na2CO3―→2CH3COONa+CO2↑+H2O、CO2+Ca(OH)2===CaCO3↓+H2O。
深度思考
(4)下列物质:①C2H5OH ②CH3COOH ③H2O都能与Na反应放出H2,其产生H2速率由快到慢的顺序为__________(填序号)。
②>③>①
C2H5OH、CH3COOH和H2O中都存在—OH,其活泼性为乙酸>水>乙醇,故和Na反应生成H2的速率为CH3COOH>H2O>C2H5OH。
深度思考
2.在家庭生活中,常用食醋(3%~5%的乙酸)清除水壶中少量的水垢(主要成分为碳酸钙),写出清除过程发生反应的化学方程式:___________
______________________________________。乙酸能与活泼金属反应,写出乙酸和镁反应的离子方程式:________________________________
_________________。
2CH3COOH
+CaCO3―→ (CH3COO)2Ca+CO2↑+H2O
Mg+2CH3COOH―→ Mg2++
2CH3COO-+H2↑
归纳总结
乙酸、水、乙醇、碳酸的性质比较
名称 乙酸 水 乙醇 碳酸
分子结构 CH3COOH H—OH C2H5OH
与羟基直接相连的原子或原子团 —H C2H5—
归纳总结
遇石蕊溶液 变红 不变红 不变红 变红
与Na 反应 反应 反应 反应
与Na2CO3 反应 — 不反应 反应
羟基氢的活 泼性强弱 CH3COOH>H2CO3>H2O>C2H5OH 返回
乙酸的典型性质——酯化反应
二
1.酯化反应的实验探究
实验装置
注意事项 (1)试剂的加入顺序
先加入乙醇,然后边振荡试管边慢慢加入浓硫酸和乙酸。
(2)导管末端不能插入饱和Na2CO3溶液中,防止挥发出来的CH3COOH、CH3CH2OH溶于水,造成溶液倒吸。
(3)加热前应加入几片碎瓷片防止液体暴沸,加热时小火加热减少乙酸、乙醇的挥发
实验 现象 a.饱和Na2CO3溶液的液面上层有___________________生成
b.能闻到_____
化学方 程式 CH3COOH+CH3CH2OH _____________+H2O
乙酸乙酯
无色透明的油状液体
香味
CH3COOC2H5
2.酯化反应
(1)概念:酸与醇反应生成___和___的反应。
(2)反应特点:酯化反应是_________,乙酸乙酯会与水发生水解反应生成_____和_____。
(3)反应机理(乙醇中含有示踪原子)
即酸脱_____醇脱___,所以酯化反应也属于取代反应。
酯
水
可逆反应
乙酸
乙醇
羟基
氢
3.酯
(1)酯:羧酸分子羧基中的____被—OR取代后的一类有机物,乙酸乙酯
是酯类物质的一种,其官能团为_____( 或—COOR)。
(2)物理性质
低级酯密度比水___,易溶于有机溶剂,具有一定的挥发性,具有_____气味。
(3)用途
①作香料:如作饮料、糖果、化妆品中的香料。
②作有机溶剂。
羟基
酯基
小
芳香
(1)在酯化反应实验时,可以先加入浓硫酸,然后边振荡试管,边加入乙醇和乙酸( )
(2)在酯化反应中,只要乙醇过量,可以把乙酸完全反应生成乙酸乙酯( )
(3)酯化反应一定为取代反应( )
(4)乙酸乙酯是有特殊香味的、易溶于水的无色液体( )
(5)在酯化反应实验中,可用稀硫酸代替浓硫酸( )
×
正误判断
√
×
×
×
深度思考
某研究小组用如图所示装置制取乙酸乙酯,请回答下列
问题:
(1)为防止试管a中液体实验时发生暴沸,加热前应采取的
措施为__________________。
为防止溶液暴沸,液体加热前要加碎瓷片或沸石。
加入碎瓷片(或沸石)
深度思考
(2)装置中的球形干燥管除起冷凝作用外,它的另一重要作用是_________。
乙酸乙酯中混有乙醇和乙酸,二者易溶于水,乙酸能和碳酸钠反应,易发生倒吸,该实验中使用球形干燥管,球形部位空间大,液面上升时可缓冲,防止倒吸。
防止倒吸
深度思考
(3)试管b中饱和碳酸钠溶液的作用除了溶解乙醇,还有
_________,_____________________。
由(2)中分析可知,饱和碳酸钠溶液还有中和乙酸,降低乙酸乙酯的溶解度的作用。
中和乙酸
降低乙酸乙酯的溶解度
深度思考
(4)待试管b收集到一定量产物后停止加热,撤去试管b并
用力振荡试管b,静置后试管b中所观察到的实验现象:
_____________________________________。
乙酸乙酯不溶于饱和碳酸钠溶液,且密度比水小,有香味,所以静置后,试管b中所观察到的实验现象为液体分层,上层是无色有香味的油状液体。
液体分层,上层为无色有香味的油状液体
深度思考
(5)如果用含示踪原子18O的乙醇参与反应,生成的产物中,
只有乙酸乙酯中含有18O,则酯化反应中,乙酸和乙醇分
子中断裂的各是什么键,在化学方程式中表示出其断键部
位:_______________________________________。
据题给信息,乙酸和乙醇在酯化反应中乙酸断裂的是C—O,乙醇断裂的是O—H,即酸脱羟基醇脱氢。
归纳总结
酯化反应中的“一原理”“两作用”
1.一原理
在酯化反应中,有机羧酸断C—O,醇分子断O—H,即“酸脱羟基醇脱氢”,表示如下:
归纳总结
2.两作用
(1)浓硫酸的作用
①催化剂——加快反应速率。
②吸水剂——除去反应的副产物水,提高酯的产率。
(2)饱和Na2CO3溶液的作用
①降低乙酸乙酯的溶解度,便于分层,得到酯。
②与挥发出来的乙酸反应。
③溶解挥发出来的乙醇。
返回
随堂演练 知识落实
1.下列关于乙酸性质的叙述中,错误的是
A.乙酸的酸性比碳酸的强,所以它可以与碳酸盐溶液反应,产生CO2气体
B.乙酸具有酸性,所以能与钠反应放出H2
C.乙酸分子中含有碳氧双键,所以它能使溴水褪色
D.乙酸在温度低于16.6 ℃时,就凝结成冰状晶体
√
1
2
3
4
乙酸的结构式为 ,分子中的碳氧双键和Br2不能发生反
应,故C错误。
1
2
3
4
2.将CH3COOH和H18O—C2H5混合发生酯化反应,已知酯化反应是可逆反应,反应达到平衡后,下列说法正确的是
A.18O存在于所有物质里
B.18O仅存在于乙醇和乙酸乙酯里
C.18O仅存在于乙醇和水里
D.有的乙醇分子可能不含18O
1
2
3
4
√
由CH3COOH+H18O—C2H5 +H2O可知,18O存
在于乙醇和乙酸乙酯中,B项正确。
1
2
3
4
3.(2022·豫西名校高一检测)乙酸分子的结构式为 ,已知:
CH3COOH+Br2 BrCH2COOH+HBr,下列反应及断键部位正确的是
(1)乙酸的电离,是①键断裂
(2)乙酸与乙醇发生酯化反应,是②键断裂
(3)在红磷存在时,Br2与CH3COOH的反应是③键断裂
(4)乙酸在空气中燃烧是①②键断裂
A.(1)(2)(3) B.(1)(2)(3)(4)
C.(2)(3)(4) D.(1)(3)(4)
√
1
2
3
4
乙酸电离出H+时,断裂①键;
发生酯化反应时酸脱羟基,断裂②键;
在红磷存在时,乙酸与Br2反应,溴原子取代了甲基上的氢原子,断裂③键;
乙酸在空气中燃烧生成CO2和H2O,分子结构中的所有键均断裂。
1
2
3
4
4.(2022·天津高一检测)某课外小组设计的实验室制取乙
酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙
醇、无水乙酸,D中盛有饱和碳酸钠溶液。
已知:无水氯化钙可与乙醇形成难溶于水的
CaCl2·6C2H5OH。
请回答下列问题:
(1)若实验中用乙酸和含18O的乙醇反应,写出该反应的化学方程式:
_________________________________________________。
1
2
3
4
CH3COOH+C2H518OH +H2O
在酯化反应中,羧酸提供羟基,醇提供氢原子,所以反应后乙醇中的18O在乙酸乙酯中。
1
2
3
4
(2)球形干燥管C的作用是___________________。若反应
前向D中加入几滴酚酞溶液,溶液呈红色,说明碳酸钠
溶液显____性;反应结束后,D中的现象是___________
_____________________________________。
球形干燥管容积大,可以防止倒吸,同时可冷凝乙酸乙酯蒸气。酚酞遇碱变红,故碳酸钠溶液呈碱性,乙酸乙酯不溶于饱和碳酸钠溶液,且其密度比水的小,故D中溶液分层,上层为无色油状液体,反应中挥发出来的乙酸和碳酸钠反应而使下层溶液红色变浅。
1
2
3
4
上层为无色油状液体,下层溶液红色变浅
冷凝蒸气,防止倒吸
碱
溶液分层,
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出_____。
无水氯化钙能与乙醇形成难溶于水的物质,所以先加入无水氯化钙,分离出乙醇。
1
2
3
4
乙醇
返回
课时对点练
题组一 乙酸的结构与酸性
1.如图所示是某常见有机物分子的空间填充模型,该物质不具有的性质是
A.与大理石反应 B.与稀盐酸反应
C.发生酯化反应 D.使紫色石蕊溶液变红
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由有机物分子的空间填充模型可知,该物质为乙酸,乙
酸为一元弱酸,但比H2CO3的酸性强,故可与大理石反应,
也可使紫色石蕊溶液变红,故A、D正确;
乙酸和乙醇在浓H2SO4加热条件下发生酯化反应,故C正确;
乙酸与稀盐酸不反应,故B错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2.食醋的主要成分是乙酸,下列物质在一定条件下能与乙酸发生反应的是
①石蕊 ②乙醇 ③金属镁 ④氢氧化铁 ⑤氧化钙 ⑥碳酸钠 ⑦稀硫酸
A.①③④⑤⑦ B.②③④⑥⑦
C.①②③④⑤⑥⑦ D.①②③④⑤⑥
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
CH3COOH为有机酸,具有酸的通性,能使石蕊溶液变红,能和活泼金属镁反应生成H2,能与碱性氧化物及碱生成盐和水,能与Na2CO3反应生成CO2,能与乙醇发生酯化反应,但乙酸和H2SO4不反应,故①②③④⑤⑥正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 酯化反应及实验探究
3.若乙酸分子中的O都是18O,乙醇分子中的O都是16O,二者发生酯化反应所得生成物中水的相对分子质量是
A.16 B.18 C.20 D.22
√
该反应的化学方程式为 +C2H516OH
+H218O,故C项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
4.(2022·广东兴宁市高一检测)某羧酸酯的分子式为C10H18O3,1 mol该酯完全水解可得到1 mol羧酸和1 mol乙醇,则该羧酸的分子式为
A.C8H16O2 B.C8H16O3
C.C8H14O2 D.C8H14O3
√
乙醇的分子式为C2H6O,该酯水解反应表示为C10H18O3+H2O―→ 羧酸+C2H6O,根据原子守恒可得羧酸的分子式为C8H14O3。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
5.下列有关乙酸乙酯的说法错误的是
A.乙酸乙酯的结构式为
B.乙酸乙酯和乙酸互为同系物
C.由乙酸乙酯的名称可知,CH3CH2COOCH3的名称为丙酸甲酯
D.乙酸乙酯为无色油状物质,与碳酸钠溶液不反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
6.(2022·济南高一月考)1-丁醇(CH3CH2CH2CH2OH)和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125 ℃,反应装置如图,下列对该实验的描述正确的是
A.该实验可以选择水浴加热
B.该反应中,如果乙酸足量,1-丁醇可以完全被消耗
C.长玻璃管除平衡气压外,还起到冷凝回流的作用
D.在反应中1-丁醇分子脱去羟基,乙酸脱去氢原子
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
据信息,该反应温度为115~125 ℃,不能用水浴加热,故A
错误;
1-丁醇和乙酸的酯化反应为可逆反应,即使乙酸过量,1-丁
醇也不能完全被消耗,故B错误;
长玻璃管可以平衡试管内外气压,同时可冷凝回流乙酸及1-丁醇,故C正确;
据酯化反应原理,1-丁醇分子脱去羟基中氢原子,乙酸分子脱去羟基,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
7.已知反应:甲( )+乙―→ 丙( )+H2O,则
下列判断不正确的是
A.乙物质为甲醇
B.该反应为取代反应
C.甲和乙都能与金属钠反应产生氢气
D.甲、乙、丙都能使溴的四氯化碳溶液发生加成反应而褪色
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
根据反应方程式,可知乙为甲醇(CH3OH),发生的反应为酯化反应,也为取代反应,故A、B项正确;
甲和乙(CH3OH),都能和金属钠反应生成H2,C项正确;
甲和丙分子中含有 ,可以和溴发生加成反应,但乙为CH3OH,
不能和溴发生加成反应,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
8.乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计了如图所示的两套装置,用乙醇、乙酸和浓硫酸作原料分别制备乙酸乙酯(沸点77.2 ℃)。下列有关说法不正确的是
A.浓硫酸能提高酯化反应的速率
B.温度越高反应速率越大,装置a更佳
C.装置b比装置a原料损失得少
D.用饱和Na2CO3溶液收集乙酸乙酯有利于酯的纯化
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A 乙酸与乙醇生成乙酸乙酯的反应是可逆反应,浓硫酸是该反应的催化剂,能起到增大反应速率的作用 √
B 乙酸、乙醇都易挥发,温度高会加速反应物的挥发,降低酯的产率,因此装置b更佳 ×
C 装置b是通过水浴加热,相对于装置a,温度较低,减少了反应物的挥发 √
D 乙酸乙酯在饱和Na2CO3溶液中的溶解度很小,且能将混在乙酸乙酯中的乙酸和部分乙醇除去,得到较纯净的乙酸乙酯 √
9.在同温、同压下,某有机物与过量Na反应得到V1 L氢气,另取一份等量的该有机物与足量NaHCO3反应得到V2 L二氧化碳,若V1=V2≠0,则有机物可能是
A. B.HOOC—COOH
C.HOCH2CH2OH D.CH3COOH
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
钠既能与羟基反应,又能与羧基反应,且2—OH~H2或2—COOH~H2、—COOH~CO2;由题意知该有机物中既有羧基又有羟基,且羧基和羟基个数相等,故A项中的物质符合要求。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.下列试剂能将 转化为 的是
①金属钠 ②氢氧化钠 ③碳酸钠 ④碳酸氢钠 ⑤硫酸钠
A.①②④ B.②③④
C.③④⑤ D.①②⑤
—COOH和—OH都可以和Na发生反应,—COOH呈酸性,能与碱性物质反应,因此实现—COOH转化为—COONa而—OH不变,只能选择NaOH、Na2CO3和NaHCO3。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
11.分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构)
A.3种 B.4种
C.5种 D.6种
√
据题给信息,能和饱和NaHCO3反应放出气体的有机物,分子结构中应含有羧基,故有机物为C4H9—COOH,丁基(—C4H9)有4种异构体,C4H9—COOH也有4种异构体,故C5H10O2属于羧酸的有机物共有4种。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.(2022·成都高一检测)苹果酸有特殊的酸味,主要用于食品和医药行业。
苹果酸的结构简式为 ,下列说法正确的是
A.苹果酸中能发生酯化反应的官能团有2种
B.1 mol苹果酸可与3 mol NaOH发生中和反应
C.1 mol苹果酸与足量Na反应生成1 mol H2
D.HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A项,苹果酸中含—OH和—COOH 2种能发生酯化反应的官能团;
B项,1 mol苹果酸可与2 mol NaOH发生中和反应;
C项,1 mol苹果酸与足量Na反应生成1.5 mol H2;
D项,二者为同一物质。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.分子式为C2H4O2的有机化合物A具有如下性质:
①A+Na→迅速产生气泡;②A+CH3CH2OH 有香味的物质。
(1)根据上述信息,对该化合物可作出的判断是____(填字母)。
A.一定含有—OH
B.一定含有—COOH
C.有机化合物A为乙醇
D.有机化合物A为乙酸
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
BD
根据A的分子式及A的化学性质推知A为乙酸。
(2)A与钠反应的化学方程式为____________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2CH3COOH+2Na―→ 2CH3COONa+H2↑
(3)化合物A和CH3CH2OH反应生成的有香味的物质的结构简式为________________。
乙醇和CH3COOH发生酯化反应生成乙酸乙酯。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
CH3COOCH2CH3
(4)有机化合物B分子式为C2H4O3,与Na反应迅速产生H2,且1 mol B与足量Na反应放出1 mol H2,则B的结构简式为______________。
与Na反应迅速,则含有—COOH,且产生H2与消耗B的物质的量之比为1∶1,根据分子式,则必含—OH,B的结构简式为HOCH2COOH。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
HOCH2COOH
14.(2022·长春高一期末)查阅资料可知以下数据:
某学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL大试管A中按体积比1∶4∶4配制浓硫酸、乙醇和乙酸的混合溶液。
②按如图所示连接好装置(装置气密性良好),用小火均
匀地加热装有混合溶液的大试管A 5~10 min。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
物质 乙醇 乙酸 乙酸乙酯 浓硫酸
沸点/℃ 78.5 118 77.2 338.0
③待试管B收集到一定量的产物后停止加热,撤下试管B并用力振荡B,然后静置分层。
④分离出乙酸乙酯层,洗涤、干燥。
请根据题目要求回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(1)配制①中混合溶液的主要操作步骤为____________________________
________________________________________________________________________________________。
在30 mL的大试管A中先注入
4 mL乙醇,然后边振荡试管边缓慢加入1 mL的浓硫酸,待冷却至室温时,再加入4 mL乙酸并摇匀
配制乙醇、浓硫酸、乙酸混合溶液时,各试剂加入
试管的顺序为乙醇→浓硫酸→乙酸。将浓硫酸加入
乙醇中,边加边振荡是为了防止混合时产生的热量
不能散出导致液体飞溅造成事故;将乙醇与浓硫酸
的混合液冷却后再与乙酸混合,是为了防止乙酸的挥发造成原料损失。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)步骤②中需要小火均匀加热,其主要理由是_______
_______________________________________________
_______________________________________________
___________________。
根据各物质的沸点数据可知,乙酸(118 ℃)、乙醇(78.5 ℃)的沸点都比较低,且与乙酸乙酯的沸点(77.2 ℃)比较接近,若用大火加热,反应物容易随生成物(乙酸乙酯)一起蒸发出来,导致原料大量损失;同时温度太高,可能发生其他副反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
一方面,用大火加热,反应物容易随生成物(乙酸乙酯)一起蒸发出来,导致原料大量损失;另一方面,温度太高,可能发生其他副反应
(3)指出步骤③所观察到的现象:___________________
_______________________________________________
______________________________________________。
分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为___(填字母)。
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
试管B中的液体分成上下两层,上层为无色油状液体(可以闻到芳香气味),下层液体呈(浅)红色,振荡后下层液体的红色变浅
B
15.石油经裂解可获得大量化工产品A,以A为原料合成香料D的流程如下:
(1)在标准状况下,烃A的结构简式为___________。
(2)写出物质C与金属钠反应的化学方程式:________________________
______________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
CH2==CH2
HOCH2CH2OH+2Na―→
NaOCH2CH2ONa+H2↑
(3)CH3COOH与物质C按物质的量2∶1反应生成D,则D的化学式为_________。
(4)写出②的化学方程式:______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
C6H10O4
+H2O
返回
本课结束
第七章
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
