第八章 第三节 环境保护与绿色化学 课件(共76张PPT)
文档属性
| 名称 | 第八章 第三节 环境保护与绿色化学 课件(共76张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 20:10:28 | ||
图片预览











文档简介
(共76张PPT)
DISANJIE
化学与环境保护 / 绿色化学 / 随堂演练 知识落实 / 课时对点练
环境保护与绿色化学
第八章
第三节
核心素养
发展目标
1.了解环境污染的主要因素、危害及防治的方法,认识化学对环境保护的重要意义,培养保护环境的科学态度和社会责任。
2.了解“绿色化学”“原子经济性反应”的内涵,知道它们在对利用资源、保护环境中的重要意义,加强环境保护意识并培养绿色化学的理念。
内容索引
随堂演练 知识落实
课时对点练
一、化学与环境保护
二、绿色化学
化学与环境保护
一
1.环境保护
(1)环境问题:主要是指由于人类不合理地开发和利用自然资源而造成的_________破坏,以及工农业生产和人类生活所造成的_________。
(2)环境保护的任务
①环境监测:对污染物的_________、_____等进行_____和_____,为控制和消除污染提供可靠的数据。
②治理工业“三废”(_____、_____、_____)。
③寻找源头治理环境污染的生产工艺,杜绝污染物的排放,能从根本上解决环境问题。
生态环境
环境污染
存在形态
含量
分析
测定
废气
废水
废渣
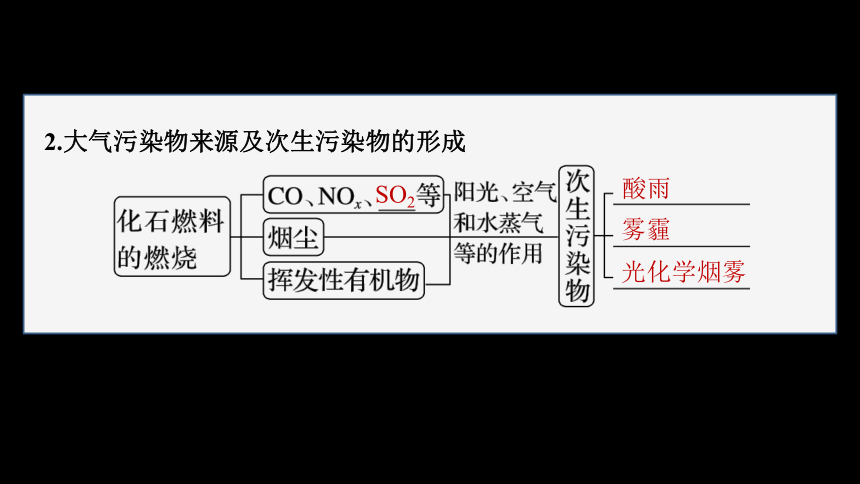
2.大气污染物来源及次生污染物的形成
SO2
酸雨
雾霾
光化学烟雾
3.污水的处理
(1)常用的污水处理方法:_______、_______和_______等。
(2)污水处理的常用化学方法:_______、___________、_______等。
(3)污水处理的流程
①一级处理:通常采用_____方法,即用格栅间、沉淀池等除去污水中不溶解的污染物。经一级处理后的水一般达不到排放标准,通常将一级处理作为预处理。
物理法
化学法
生物法
中和法
氧化还原法
沉淀法
物理
②二级处理:采用_____方法(又称_______法)及某些化学方法,除去水中的可降解有机物等污染物。经二级处理后的水一般可以达到国家规定的排放标准。
③三级处理:主要采用_________法、_________法、_________法和_______法等,对污水进行深度处理和净化。经三级处理后的水可用于绿化和景观用水等。
生物
微生物
化学沉淀
氧化还原
离子交换
反渗透
4.固体废物的处理
(1)处理原则:_______、_______和_______。
(2)目的:_____________和_____________。
无害化
减量化
资源化
减少环境污染
资源回收利用
(1)化学工作者进行的环境质量监测工作可有可无,有污染治理就行( )
(2)化石燃料燃烧产生的CO、NOx、SO2为次生污染物( )
(3)“燃煤固硫”“汽车尾气催化净化”都能提高空气质量( )
(4)工业废渣和生活垃圾等固体废弃物对环境影响不大,可不必处理( )
(5)污水的一级处理通常采用化学法和生物法将难溶解的污染物除去( )
×
正误判断
√
×
×
×
应用体验
1.“打赢蓝天保卫战,建设美丽中国”。下列做法与这一理念不相符的是
A.将废旧电池进行直接填埋,减少对环境的污染
B.开发核能、太阳能、风能等新能源,减少对矿物能源的依赖
C.将煤进行气化处理,既提高煤的综合利用效率,又可减少酸雨的危害
D.利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气
√
A项,废旧电池做填埋处理,电池中的重金属离子会对土壤造成污染,符合题意;
B项,开发新能源,减少对矿物能源的依赖,有利于保护环境,不符合题意;
C项,将煤进行气化处理,可以提高煤的综合利用效率,减少污染性气体的排放,减少酸雨的危害,不符合题意;
D项,利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气以替代液化石油气,减少污染性气体的排放,不符合题意。
2.活性炭联合脱硫脱硝技术(AC)是一种比较成熟
的脱硫脱硝技术,可以在较低的温度下,将废气
中的SO2、NOx通过一系列反应生成铵盐,从而
变废为宝,其工作示意图如图所示:
(1)SO2在活性炭表面被氧化最终生成硫酸,反应
的化学方程式为________________________________________________
____________________。
在反应中,SO2可以在活性炭表面被O2氧化为SO3,进而和H2O反应生成H2SO4。
2SO3、SO3+H2O===H2SO4(或2SO2+
O2+2H2O===2H2SO4)
(2)吸收塔加入NH3后,可脱除废气中的NO、
NO2,写出NO和NO2分别和NH3反应的化学
方程式:_____________________________、
__________________________。
NH3和NO、NO2反应时,NH3为还原剂,NO、NO2为氧化剂最终生成N2和H2O。
4NH3+6NO===5N2+6H2O
8NH3+6NO2===7N2+12H2O
(3)NH3和吸收塔中生成的H2SO4反应,会生成铵
盐,写出反应的化学方程式:_______________
_______________________________________。
NH3和生成的H2SO4反应可生成(NH4)2SO4或NH4HSO4。
2NH3+H2SO4
===(NH4)2SO4(或NH3+H2SO4===NH4HSO4)
(4)活性炭的造价较高,工业上一般选用活性焦作
为吸附剂来脱硫脱硝,活性炭来自煤干馏产品,
煤的干馏为______(填“物理”或“化学”)变化,
从煤干馏产品中获取苯、二甲苯的操作方法为
____________。
煤的干馏为化学变化,从煤焦油中获取苯及二甲苯等原料应采取蒸馏或分馏的方法。
化学
蒸馏(或分馏)
返回
绿色化学
二
1.核心思想
绿色化学也称_________化学,其核心思想就是改变“先污染后治理”的观念和做法,利用化学原理和技术手段,减少或消除产品在生产和应用中涉及的有害化学物质,实现从源头_____或_____环境污染。
2.原子经济性反应:反应物的原子全部转化为期望的最终产物,原子利用率达到______。
原子利用率= ×100%
环境友好
减少
消除
100%
3.绿色化学对化学反应的要求
4.开发和利用自然资源遵循的三原则(3R原则)
_______、_______和_______。
减量化
再利用
再循环
(1)“绿色化学”就是污染后有效治理的化学思想( )
(2)“绿色化学”就是指在化工生产中不排放任何有害物质( )
(3)“3R”原则(减量化、再利用和再循环)是开发和利用自然资源的基本原则( )
(4)植物秸秆含大量钾元素,焚烧后作钾肥符合“绿色化学”的思想( )
(5)利用阳光发电,光解水制氢气是解决能源危机,实现可持续发展的有效途径( )
×
正误判断
√
√
×
√
应用体验
1.绿色化学的核心就是利用化学原理从源头上减少或消除工业生产对环境的污染。下列不符合绿色化学理念的是
A.尽可能使用无毒无害的原材料
B.尽可能减少生产过程中的能量消耗
C.治理产生的污染优于防治污染的产生
D.尽可能采用对人类和环境低毒或无毒的合成路线
√
生产中使用无毒无害的原材料,可有效减少生产过程中对环境的污染,故A正确;
减少生产过程中能量损耗,可以减少化石燃料的利用,可有效防止环境污染,故B正确;
绿色化学理念应是从源头上防止或减少污染而不是先污染后治理,故C项不符合绿色化学理念;
制造产品时,采用对人类和环境低毒或无毒的合成路线,可有效减少生产过程对环境的污染,符合绿色化学理念,故D正确。
2.乙烯大量用来生产环氧乙烷,生产工艺主要有两种。
工艺一:CH2==CH2+Cl2+Ca(OH)2―→ +CaCl2+H2O;
工艺二:2CH2==CH2+O2 2 。
试回答下列问题:
(1)根据绿色化学原则,理想的生产工艺是原子经济性好的反应,上述工艺一的原子利用率____(填“高”或“低”,下同);工艺二的原子利用率____,因此,在实际生产中,应采用工艺____更环保、更经济。
低
高
二
(2)下列有机反应中最符合“绿色化学”思想的为_____(填序号)。
①CH2==CH2+ ―→ +CH3COOH
②3 + +2H2O
③nCH2==CH2 ?CH2—CH2?
④CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O
⑤CH3—C≡CH+CO+CH3OH―→
③⑤
最符合“绿色化学”思想的反应为满足原子经济性反应,原子利用率为100%的反应,因此选择③⑤。
返回
随堂演练 知识落实
1.(2022·陕西绥德中学高一检测)下列实验或叙述符合绿色化学理念的是
A.加热Cu和浓硫酸的混合物制备CuSO4
B.催化剂作用下乙烯和水反应制备乙醇
C.使用含铅汽油,降低汽车噪音
D.用稀硝酸和铜反应制取Cu(NO3)2
√
1
2
3
4
Cu和浓硫酸反应生成CuSO4、SO2和H2O,SO2污染空气,故不选A;
催化剂作用下乙烯和水发生加成反应生成乙醇,原子利用率为100%,符合绿色化学理念,故选B;
铅是重金属,能污染土壤,使用含铅汽油,降低汽车噪音,容易引起重金属污染,故不选C;
稀硝酸和铜反应生成Cu(NO3)2、NO和H2O,NO污染空气,故不选D。
1
2
3
4
2.下列有关环境保护与绿色化学的叙述不正确的是
A.形成酸雨的主要物质是硫的氧化物和氮的氧化物
B.大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气
C.绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D.燃煤烟气脱硫的石灰石-石膏法,可将烟气中的二氧化硫转化为硫酸钙
√
1
2
3
4
酸雨一般是硫酸型和硝酸型两种,硫的氧化物二氧化硫排放到空气中最终被氧气氧化成三氧化硫,再与水结合形成硫酸,而氮的氧化物二氧化氮与水结合产生硝酸,故A正确;
大气污染物主要是粉尘颗粒和有害气体的排放导致,而化石燃料燃烧时会有粉尘和二氧化硫,再比如硫酸工业尾气中含有二氧化硫,硝酸工业尾气中含有氮的氧化物均是大气污染物,故B正确;
绿色化学的核心是从源头上杜绝污染产生,而不是先污染后治理,故C错误;
石灰石高温时分解成的生石灰与煤燃烧时产生的二氧化硫反应生成亚硫酸钙,最终被氧化成硫酸钙而起到处理硫的目的,故D正确。
1
2
3
4
3.下列活动不符合“如何应对气候变化、提升经济绿色水平,实现人类可持续发展”这一主题的是
A.机动车实行限行措施是减少雾霾的途径之一
B.推广使用可降解塑料及布袋购物,以减少“白色污染”
C.通过吸收空气中的CO2并利用廉价能源合成汽油,可推广“绿色自由”
计划
D.将秸秆焚烧可得富含钾肥的草木灰,焚烧是一种较为理想的秸秆处理
办法
1
2
3
4
√
机动车实行限行措施可以减少雾霾,A项不符合题意;
通过吸收空气中的CO2并利用廉价能源合成汽油,可推广“绿色自由”计划,C项不符合题意;
焚烧秸秆会污染大气,增加雾霾的产生,D项符合题意。
1
2
3
4
4.中国“十九大”规划纲要提出节能减排(指的是减少能源浪费和降低废气排放),这是贯彻落实科学发展观、构建社会主义和谐社会的重大举措;是建设资源节约型、环境友好型社会的必然选择;是推进经济结构调整,转变增长方式的必由之路;是维护中华民族长远利益的必然要求。请你分析并回答下列问题:
1
2
3
4
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”,下列化学反应不符合“绿色化学”思想的是____(填字母)。
1
2
3
4
BD
反应属于加成反应,原子利用率高达100%,且产物无污染,故A符合;
制备硫酸铜的过程中硫酸的利用率低,且生成的二氧化硫是有毒气体,故B不符合;
反应属于化合反应,原子利用率高达100%,且产物无污染,故C符合;
铜与稀硝酸反应制备硝酸铜的过程中硝酸的利用率低,且生成的一氧化氮是有毒气体,故D不符合。
1
2
3
4
(2)工业上目前使用两种方法制取乙醛——“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
1
2
3
4
乙炔水化法 乙烯氧化法
原料 乙炔、水 乙烯、空气
反应条件 HgSO4、100~125 ℃ PdCl2-CuCl2、100~125 ℃
平衡转化率 乙炔平衡转化率90%左右 乙烯平衡转化率80%左右
日产量 2.5吨(某设备条件下) 3.6吨(相同设备条件下)
表二:原料来源生产工艺
1
2
3
4
原料生产工艺过程
乙炔
乙烯 来源于石油裂解气
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因。
①从产率和产量角度分析:______________________________________
_______________________________。
②从环境保护和能耗角度分析:__________________________________
_______________________________________________________________________________________________________________________________________________________。
1
2
3
4
虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多
两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得
返回
课时对点练
题组一 化学与环境保护
1.十九大报告提出:必须树立和践行“绿水青山就是金山银山”的理念,你认为下列做法与这一理念不相符的是
A.工业废水经处理达标后排放
B.植树造林,增大绿化面积
C.将废弃塑料焚烧处理
D.对含硫燃料预先进行脱硫处理,使能源更清洁
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
工业废水经处理达标后排放可减少水体污染;植树造林,增大绿化面积,改善空气质量,也可以减少水土流失;将塑料焚烧会污染空气,方法不合理;对含硫燃料预先进行脱硫处理,可以减少SO2等污染气体的排放,使能源更清洁。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
2.(2021·湖南,1)下列有关湘江流域的治理和生态修复的措施中,没有涉及到化学变化的是
A.定期清淤,疏通河道
B.化工企业“三废”处理后,达标排放
C.利用微生物降解水域中的有毒有害物质
D.河道中的垃圾回收分类后,进行无害化处理
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
定期清淤,疏通河道,保证河流畅通,没有涉及化学变化,A符合题意;
工业生产中得到产品的同时常产生废气、废水和废渣(简称“三废”),常用化学方法进行处理,如石膏法脱硫、氧化还原法和沉淀法等处理废水,废渣资源回收利用等过程均有新物质生成,涉及化学变化,B不符合题意;
可通过微生物的代谢作用,将废水中有毒有害物质尤其是复杂的有机污染物降解为简单的、无害物质,所以微生物法处理废水有新物质的生成,涉及化学变化,C不符合题意;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
河道中的垃圾回收分类后,适合焚化处理的垃圾,利用现代焚化炉进行燃烧,消灭各种病原体,把一些有毒、有害物质转化为无害物质,同时可回收热能,用于供热和发电等,此过程涉及化学变化,D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
3.(2022·河南洛阳高一阶段检测)以下氧化物的主要来源与其引起的环境问题对应正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
选项 氧化物 环境问题 主要来源
A CO2 酸雨 化石燃料的燃烧
B SO2 光化学烟雾 汽车尾气的排放
C NO2 温室效应 工厂废气的排放
D CO 煤气中毒 煤炭的不完全燃烧
√
化石燃料的燃烧产生的CO2过度排放不会产生酸雨污染,只会形成温室效应,A不符合题意;
汽车尾气主要成分不是SO2,且SO2污染不会产生光化学烟雾污染,应该是汽车尾气中产生的氮氧化物,引起光化学烟雾,B不符合题意;
工业废气中的氮氧化物NOx不会造成温室效应,C不符合题意;
煤炭的不完全燃烧产生CO,会引起煤气中毒即CO中毒,D符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4.下列有关有机化合物的说法正确的是
A.利用煤燃烧放出热量使水分解产生氢气,是氢能开发的研究方向
B.“白色垃圾”“地沟油”均属于高分子材料,都对环境有害
C.聚氯乙烯制品可倾倒在海洋中处理
D.光化学烟雾、硝酸型酸雨的形成都与氮氧化合物有关
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
煤燃烧会产生大量的SO2等污染物,用其放出的热分解水产生氢气,效益低,故A错误;
“白色垃圾”主要成分为塑料,属于高分子材料,“地沟油”主要成分为油脂,不属于高分子材料,故B错误;
聚氯乙烯制品不易降解,不能倾倒在海洋中处理,故C错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
题组二 绿色化学
5.在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应
A.①② B.②⑤ C.②④ D.①③
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
上述反应中,②化合反应、⑤加成反应中反应产物只有一种,原子利用率达到100%,而置换反应、分解反应、取代反应生成物不止一种,不能满足原子利用率为100%。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
6.(2022·天津市第二南开中学高一检测)下列不符合“绿色发展,保护生态环境”理念的是
A.含酶洗衣粉代替含磷洗衣粉
B.含汞废旧电池有毒,应直接掩埋
C.用秸秆、粪便生产沼气,实现垃圾资源化
D.将废旧塑料制品制成再生制品
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
含酶洗衣粉代替含磷洗衣粉可减少水体富营养化、水华、赤潮等水污染,A不符合题意;
废旧电池中含有重金属等金属离子,直接掩埋会造成土壤污染、水体污染等,B符合题意;
植物秸秆、枝叶、杂草含有生物质能,可通过发酵制取甲烷,从而有效利用生物质能,实现垃圾资源化,C不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
7.(2021·山东,1)有利于实现“碳达峰、碳中和”的是
A.风能发电 B.粮食酿酒
C.燃煤脱硫 D.石油裂化
√
“碳达峰”是指我国承诺2030年前,二氧化碳的排放不再增长,达到峰值之后逐步降低;“碳中和”是指通过植树造林、节能减排等形式,抵消自身产生的二氧化碳排放量,实现二氧化碳“零排放”。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
题组三 环境保护与可持续发展
8.化学与人类生产、生活、社会可持续发展密切相关,下列说法不正确的是
A.“天宫一号”中使用的碳纤维,是一种新型无机非金属材料
B.为防止富脂食品氧化变质,常在包装袋中放入生石灰
C.开发新能源,减少对化石燃料的依赖,可以促进低碳经济
D.“静电除尘”“燃煤固硫”“汽车尾气催化净化”都能提高空气质量
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
碳纤维的成分为碳单质,为无机物,是一种新型无机非金属材料,A正确;
生石灰只能吸收水分,不能吸收氧气,所以加入生石灰不能防止富脂食品被氧化变质,B错误;
开发新能源,减少对化石燃料的依赖,可以促进低碳经济,C正确;
“静电除尘”“燃煤固硫”“汽车尾气催化净化”都可减少污染气体的排放,能提高空气质量,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
9.下列关于垃圾分类的说法正确的是
A.废电池、过期药品属于有害垃圾,无需回收,为防止污染环境应当深
埋处理
B.其他垃圾包括防新型冠状病毒用的口罩、烟头等物品无法利用,应当
弃去不要
C.废纸类、废塑料、废玻璃、废金属、废油漆桶等属于可回收物
D.厨余垃圾经生化处理转化为沼气和有机肥料,从而生产绿色有机食品
和清洁燃料
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
废电池、过期药品属于有害垃圾,需要回收经过特殊处理,故A错误;
防新型冠状病毒用的口罩为医疗垃圾,属于有害垃圾,应回收经过特殊处理,故B错误;
废油漆桶为有害垃圾,不属于可回收物,故C错误;
厨余垃圾富有营养,可以生化处理或者堆肥,减少环境污染,同时变废为宝,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
10.(2022·成都高一阶段检测)“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制得的产物,即原子利用率为100%。下列反应中最符合“绿色化学”概念的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A.溴乙烷在碱性条件下制备乙醇:CH3CH2Br+NaOH CH3CH2OH+NaBr
B.合成甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH
CH2==C(CH3)COOCH3
C.以铜和浓硝酸为原料生产硝酸铜:Cu+4HNO3(浓)===Cu(NO3)2+
2NO2↑+2H2O
D.FeCl3溶液制Fe(OH)3胶体:FeCl3+3H2O Fe(OH)3(胶体)+3HCl
√
溴乙烷在碱性条件下制备乙醇,除了乙醇外还有副产物NaBr,不符合原子利用率为100%,A项错误;
合成甲基丙烯酸甲酯,所有反应物均变成产物,原子利用率为100%,B项正确;
以铜和浓硝酸为原料生产硝酸铜,会有副产物NO2和H2O,C项错误;
FeCl3溶液制Fe(OH)3胶体,有副产物HCl,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
11.如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程。该方法对H2S的吸收率达99%以上,并可制取H2和S。下列说法正确的是
A.吸收H2S的反应的离子方程式为
Fe3++H2S===Fe2++S↓+2H+
B.吸收H2S的反应的离子方程式为2Fe3++3H2S===2Fe2++3S↓+6H+
C.实验室可用点燃的方法消除H2S对环境的污染
D.该工艺流程体现了绿色化学思想
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
FeCl3有氧化性,H2S有还原性,二
者在溶液中发生反应的离子方程式
为2Fe3++H2S===2Fe2++S↓+2H+,
A、B项错误;
若点燃H2S,则发生反应:2H2S+3O2 2SO2+2H2O,燃烧产物SO2也是大气污染物,C项错误;
电解的产物又重新用来吸收石油炼制过程中产生的大量H2S废气,物质得到充分利用,该工艺流程体现了绿色化学思想,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
12.“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出)。
下列有关该方法的叙述正确的是
①能耗小是该方法的一大优点
②整个过程中,有两种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是过滤、蒸发、结晶
④该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
A.①③ B.②④ C.③④ D.①④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
根据题中信息可知,基本过程中
有两个反应:①二氧化碳与氢氧
化钠溶液反应;②碳酸钙的高温
分解,循环利用的物质有CaO和NaOH两种物质,捕捉室中的反应为二氧化碳与氢氧化钠反应,得到Na2CO3,Na2CO3和CaO在溶液中反应得到NaOH和CaCO3,由此可分析判断。①碳酸钙高温分解需要消耗大量的能量,不正确;②氧化钙与氢氧化钠可以循环使用,正确;③碳酸钙不溶于水,所以“反应分离”环节中,分离物质的基本操作是过滤,不正确;④工业上可以用CO2合成甲醇,正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13.绿色化学是预防污染的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
(1)下列各项符合“绿色化学”要求的是___(填字母)。
A.处理废弃物 B.治理污染点
C.减少有毒物 D.杜绝污染源
根据题干描述“绿色化学是预防污染的根本手段”可知,“绿色化学”要求从“源头”上杜绝污染源。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
D
(2)某化工厂排放的污水中含有Mg2+、
Fe3+、Cu2+、Hg2+四种离子。某同
学设计了从该污水中回收纯净的金属铜的方案。
在回收金属铜的方案中,操作____会导致环境污染,为防止污染,应采取的措施是_________________。
因为汞的沸点低,易挥发,且汞有毒,所以操作③会造成环境污染。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
③
增加冷凝回收装置
14.SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02 mg·L-1。
(1)酸雨是降水呈酸性(pH小于5.6)的统称,个别地方甚至低于2.1(食醋的pH=3)。引起酸雨的罪魁祸首是大气中的SO2和氮的氧化物。它们的主要来源是煤和石油的燃烧,全世界每年排放1.5亿吨的SO2。
①SO2可在空气中受光照等因素作用而被氧化,最终与雨水形成硫酸型
酸雨。试写出这两个反应的化学方程式:___________________,_____
_______________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
+H2O===H2SO4
SO3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
②汽车排放的尾气、硝酸厂和化肥厂的废气中都含有氮的氧化物,全世界每年排放量约为5×107 kg。NO2溶于水生成_______和NO。
NO2与水反应生成HNO3与NO,化学方程式为3NO2+H2O===2HNO3+NO。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
HNO3
③酸雨可导致的危害有_____(填字母)。
A.腐蚀建筑物 B.导致树木枯萎
C.造成洪涝灾害 D.恶化人类环境
酸雨的酸性较强,能腐蚀建筑物,导致树木枯萎等,从而恶化人类环境,但不会造成洪涝灾害。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
ABD
④为了减少酸雨的形成,必须减少SO2的排放量,对燃料中的硫化物进行_________,对废气中的氮的氧化物用_____吸收。
为了减少酸雨的形成,必须减少SO2的排放量,对燃料进行脱硫处理,对废气中的氮的氧化物用碱液吸收。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
脱硫处理
碱液
(2)某化学兴趣小组选用如图所示的实验装置,
测定工业原料气(含SO2、N2、O2)中SO2的含量
(已知碘能氧化H2SO3生成 H2SO4)。
①若原料气从左向右流时,上述装置连接的顺序是:原料气________________(用字母和箭头表示)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
→c→d→b→a→e
②写出装置B中发生反应的离子方程式:________________________________;
当装置B中出现__________________现象时,立即停止通气。
蓝色恰好变成无色
③你认为下列试剂中,可以用来代替试管中碘
的淀粉溶液的是___(填字母)。
A.酸性KMnO4溶液 B.NaOH溶液
C.溴水 D.氨水
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A
④若碘溶液的浓度为0.05 mol·L-1,体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积)。那么SO2的含量是否超标?___(填“是”或“否”)。
是
因废气中的SO2能与I2发生化学反应:SO2+I2+2H2O===H2SO4+2HI,当装置B中蓝色恰好变成无色时,说明SO2恰好完全反应,根据消耗I2的物质的量即可求出SO2的体积,剩余气体N2和O2的体积可用排水法(短管进,长管出)测出,故装置的连接顺序为原料气→c→d→b→a→e。SO2也能被酸性KMnO4溶液氧化且有明显的实验现象,溴水也能与SO2反应,但Br2易挥发,会产生实验误差,NaOH溶液、氨水也能消耗SO2,但无明显实验现象。由条件知n(SO2)=n(I2)=0.05 mol·L-1×0.02 L=0.001 mol,即其体积为22.4 mL,
1
2
3
4
5
6
7
8
9
10
11
12
13
14
所以工业原料气总体积为297.6 mL+22.4 mL=320 mL,其中SO2的
质量为0.001 mol×64 g·mol-1=0.064 g,故SO2的含量为 =200 mg·
L-1>0.02 mg·L-1,所以SO2含量超标。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
返回
本课结束
第八章
DISANJIE
化学与环境保护 / 绿色化学 / 随堂演练 知识落实 / 课时对点练
环境保护与绿色化学
第八章
第三节
核心素养
发展目标
1.了解环境污染的主要因素、危害及防治的方法,认识化学对环境保护的重要意义,培养保护环境的科学态度和社会责任。
2.了解“绿色化学”“原子经济性反应”的内涵,知道它们在对利用资源、保护环境中的重要意义,加强环境保护意识并培养绿色化学的理念。
内容索引
随堂演练 知识落实
课时对点练
一、化学与环境保护
二、绿色化学
化学与环境保护
一
1.环境保护
(1)环境问题:主要是指由于人类不合理地开发和利用自然资源而造成的_________破坏,以及工农业生产和人类生活所造成的_________。
(2)环境保护的任务
①环境监测:对污染物的_________、_____等进行_____和_____,为控制和消除污染提供可靠的数据。
②治理工业“三废”(_____、_____、_____)。
③寻找源头治理环境污染的生产工艺,杜绝污染物的排放,能从根本上解决环境问题。
生态环境
环境污染
存在形态
含量
分析
测定
废气
废水
废渣
2.大气污染物来源及次生污染物的形成
SO2
酸雨
雾霾
光化学烟雾
3.污水的处理
(1)常用的污水处理方法:_______、_______和_______等。
(2)污水处理的常用化学方法:_______、___________、_______等。
(3)污水处理的流程
①一级处理:通常采用_____方法,即用格栅间、沉淀池等除去污水中不溶解的污染物。经一级处理后的水一般达不到排放标准,通常将一级处理作为预处理。
物理法
化学法
生物法
中和法
氧化还原法
沉淀法
物理
②二级处理:采用_____方法(又称_______法)及某些化学方法,除去水中的可降解有机物等污染物。经二级处理后的水一般可以达到国家规定的排放标准。
③三级处理:主要采用_________法、_________法、_________法和_______法等,对污水进行深度处理和净化。经三级处理后的水可用于绿化和景观用水等。
生物
微生物
化学沉淀
氧化还原
离子交换
反渗透
4.固体废物的处理
(1)处理原则:_______、_______和_______。
(2)目的:_____________和_____________。
无害化
减量化
资源化
减少环境污染
资源回收利用
(1)化学工作者进行的环境质量监测工作可有可无,有污染治理就行( )
(2)化石燃料燃烧产生的CO、NOx、SO2为次生污染物( )
(3)“燃煤固硫”“汽车尾气催化净化”都能提高空气质量( )
(4)工业废渣和生活垃圾等固体废弃物对环境影响不大,可不必处理( )
(5)污水的一级处理通常采用化学法和生物法将难溶解的污染物除去( )
×
正误判断
√
×
×
×
应用体验
1.“打赢蓝天保卫战,建设美丽中国”。下列做法与这一理念不相符的是
A.将废旧电池进行直接填埋,减少对环境的污染
B.开发核能、太阳能、风能等新能源,减少对矿物能源的依赖
C.将煤进行气化处理,既提高煤的综合利用效率,又可减少酸雨的危害
D.利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气
√
A项,废旧电池做填埋处理,电池中的重金属离子会对土壤造成污染,符合题意;
B项,开发新能源,减少对矿物能源的依赖,有利于保护环境,不符合题意;
C项,将煤进行气化处理,可以提高煤的综合利用效率,减少污染性气体的排放,减少酸雨的危害,不符合题意;
D项,利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气以替代液化石油气,减少污染性气体的排放,不符合题意。
2.活性炭联合脱硫脱硝技术(AC)是一种比较成熟
的脱硫脱硝技术,可以在较低的温度下,将废气
中的SO2、NOx通过一系列反应生成铵盐,从而
变废为宝,其工作示意图如图所示:
(1)SO2在活性炭表面被氧化最终生成硫酸,反应
的化学方程式为________________________________________________
____________________。
在反应中,SO2可以在活性炭表面被O2氧化为SO3,进而和H2O反应生成H2SO4。
2SO3、SO3+H2O===H2SO4(或2SO2+
O2+2H2O===2H2SO4)
(2)吸收塔加入NH3后,可脱除废气中的NO、
NO2,写出NO和NO2分别和NH3反应的化学
方程式:_____________________________、
__________________________。
NH3和NO、NO2反应时,NH3为还原剂,NO、NO2为氧化剂最终生成N2和H2O。
4NH3+6NO===5N2+6H2O
8NH3+6NO2===7N2+12H2O
(3)NH3和吸收塔中生成的H2SO4反应,会生成铵
盐,写出反应的化学方程式:_______________
_______________________________________。
NH3和生成的H2SO4反应可生成(NH4)2SO4或NH4HSO4。
2NH3+H2SO4
===(NH4)2SO4(或NH3+H2SO4===NH4HSO4)
(4)活性炭的造价较高,工业上一般选用活性焦作
为吸附剂来脱硫脱硝,活性炭来自煤干馏产品,
煤的干馏为______(填“物理”或“化学”)变化,
从煤干馏产品中获取苯、二甲苯的操作方法为
____________。
煤的干馏为化学变化,从煤焦油中获取苯及二甲苯等原料应采取蒸馏或分馏的方法。
化学
蒸馏(或分馏)
返回
绿色化学
二
1.核心思想
绿色化学也称_________化学,其核心思想就是改变“先污染后治理”的观念和做法,利用化学原理和技术手段,减少或消除产品在生产和应用中涉及的有害化学物质,实现从源头_____或_____环境污染。
2.原子经济性反应:反应物的原子全部转化为期望的最终产物,原子利用率达到______。
原子利用率= ×100%
环境友好
减少
消除
100%
3.绿色化学对化学反应的要求
4.开发和利用自然资源遵循的三原则(3R原则)
_______、_______和_______。
减量化
再利用
再循环
(1)“绿色化学”就是污染后有效治理的化学思想( )
(2)“绿色化学”就是指在化工生产中不排放任何有害物质( )
(3)“3R”原则(减量化、再利用和再循环)是开发和利用自然资源的基本原则( )
(4)植物秸秆含大量钾元素,焚烧后作钾肥符合“绿色化学”的思想( )
(5)利用阳光发电,光解水制氢气是解决能源危机,实现可持续发展的有效途径( )
×
正误判断
√
√
×
√
应用体验
1.绿色化学的核心就是利用化学原理从源头上减少或消除工业生产对环境的污染。下列不符合绿色化学理念的是
A.尽可能使用无毒无害的原材料
B.尽可能减少生产过程中的能量消耗
C.治理产生的污染优于防治污染的产生
D.尽可能采用对人类和环境低毒或无毒的合成路线
√
生产中使用无毒无害的原材料,可有效减少生产过程中对环境的污染,故A正确;
减少生产过程中能量损耗,可以减少化石燃料的利用,可有效防止环境污染,故B正确;
绿色化学理念应是从源头上防止或减少污染而不是先污染后治理,故C项不符合绿色化学理念;
制造产品时,采用对人类和环境低毒或无毒的合成路线,可有效减少生产过程对环境的污染,符合绿色化学理念,故D正确。
2.乙烯大量用来生产环氧乙烷,生产工艺主要有两种。
工艺一:CH2==CH2+Cl2+Ca(OH)2―→ +CaCl2+H2O;
工艺二:2CH2==CH2+O2 2 。
试回答下列问题:
(1)根据绿色化学原则,理想的生产工艺是原子经济性好的反应,上述工艺一的原子利用率____(填“高”或“低”,下同);工艺二的原子利用率____,因此,在实际生产中,应采用工艺____更环保、更经济。
低
高
二
(2)下列有机反应中最符合“绿色化学”思想的为_____(填序号)。
①CH2==CH2+ ―→ +CH3COOH
②3 + +2H2O
③nCH2==CH2 ?CH2—CH2?
④CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O
⑤CH3—C≡CH+CO+CH3OH―→
③⑤
最符合“绿色化学”思想的反应为满足原子经济性反应,原子利用率为100%的反应,因此选择③⑤。
返回
随堂演练 知识落实
1.(2022·陕西绥德中学高一检测)下列实验或叙述符合绿色化学理念的是
A.加热Cu和浓硫酸的混合物制备CuSO4
B.催化剂作用下乙烯和水反应制备乙醇
C.使用含铅汽油,降低汽车噪音
D.用稀硝酸和铜反应制取Cu(NO3)2
√
1
2
3
4
Cu和浓硫酸反应生成CuSO4、SO2和H2O,SO2污染空气,故不选A;
催化剂作用下乙烯和水发生加成反应生成乙醇,原子利用率为100%,符合绿色化学理念,故选B;
铅是重金属,能污染土壤,使用含铅汽油,降低汽车噪音,容易引起重金属污染,故不选C;
稀硝酸和铜反应生成Cu(NO3)2、NO和H2O,NO污染空气,故不选D。
1
2
3
4
2.下列有关环境保护与绿色化学的叙述不正确的是
A.形成酸雨的主要物质是硫的氧化物和氮的氧化物
B.大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气
C.绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D.燃煤烟气脱硫的石灰石-石膏法,可将烟气中的二氧化硫转化为硫酸钙
√
1
2
3
4
酸雨一般是硫酸型和硝酸型两种,硫的氧化物二氧化硫排放到空气中最终被氧气氧化成三氧化硫,再与水结合形成硫酸,而氮的氧化物二氧化氮与水结合产生硝酸,故A正确;
大气污染物主要是粉尘颗粒和有害气体的排放导致,而化石燃料燃烧时会有粉尘和二氧化硫,再比如硫酸工业尾气中含有二氧化硫,硝酸工业尾气中含有氮的氧化物均是大气污染物,故B正确;
绿色化学的核心是从源头上杜绝污染产生,而不是先污染后治理,故C错误;
石灰石高温时分解成的生石灰与煤燃烧时产生的二氧化硫反应生成亚硫酸钙,最终被氧化成硫酸钙而起到处理硫的目的,故D正确。
1
2
3
4
3.下列活动不符合“如何应对气候变化、提升经济绿色水平,实现人类可持续发展”这一主题的是
A.机动车实行限行措施是减少雾霾的途径之一
B.推广使用可降解塑料及布袋购物,以减少“白色污染”
C.通过吸收空气中的CO2并利用廉价能源合成汽油,可推广“绿色自由”
计划
D.将秸秆焚烧可得富含钾肥的草木灰,焚烧是一种较为理想的秸秆处理
办法
1
2
3
4
√
机动车实行限行措施可以减少雾霾,A项不符合题意;
通过吸收空气中的CO2并利用廉价能源合成汽油,可推广“绿色自由”计划,C项不符合题意;
焚烧秸秆会污染大气,增加雾霾的产生,D项符合题意。
1
2
3
4
4.中国“十九大”规划纲要提出节能减排(指的是减少能源浪费和降低废气排放),这是贯彻落实科学发展观、构建社会主义和谐社会的重大举措;是建设资源节约型、环境友好型社会的必然选择;是推进经济结构调整,转变增长方式的必由之路;是维护中华民族长远利益的必然要求。请你分析并回答下列问题:
1
2
3
4
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”,下列化学反应不符合“绿色化学”思想的是____(填字母)。
1
2
3
4
BD
反应属于加成反应,原子利用率高达100%,且产物无污染,故A符合;
制备硫酸铜的过程中硫酸的利用率低,且生成的二氧化硫是有毒气体,故B不符合;
反应属于化合反应,原子利用率高达100%,且产物无污染,故C符合;
铜与稀硝酸反应制备硝酸铜的过程中硝酸的利用率低,且生成的一氧化氮是有毒气体,故D不符合。
1
2
3
4
(2)工业上目前使用两种方法制取乙醛——“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
1
2
3
4
乙炔水化法 乙烯氧化法
原料 乙炔、水 乙烯、空气
反应条件 HgSO4、100~125 ℃ PdCl2-CuCl2、100~125 ℃
平衡转化率 乙炔平衡转化率90%左右 乙烯平衡转化率80%左右
日产量 2.5吨(某设备条件下) 3.6吨(相同设备条件下)
表二:原料来源生产工艺
1
2
3
4
原料生产工艺过程
乙炔
乙烯 来源于石油裂解气
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因。
①从产率和产量角度分析:______________________________________
_______________________________。
②从环境保护和能耗角度分析:__________________________________
_______________________________________________________________________________________________________________________________________________________。
1
2
3
4
虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多
两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得
返回
课时对点练
题组一 化学与环境保护
1.十九大报告提出:必须树立和践行“绿水青山就是金山银山”的理念,你认为下列做法与这一理念不相符的是
A.工业废水经处理达标后排放
B.植树造林,增大绿化面积
C.将废弃塑料焚烧处理
D.对含硫燃料预先进行脱硫处理,使能源更清洁
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
工业废水经处理达标后排放可减少水体污染;植树造林,增大绿化面积,改善空气质量,也可以减少水土流失;将塑料焚烧会污染空气,方法不合理;对含硫燃料预先进行脱硫处理,可以减少SO2等污染气体的排放,使能源更清洁。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
2.(2021·湖南,1)下列有关湘江流域的治理和生态修复的措施中,没有涉及到化学变化的是
A.定期清淤,疏通河道
B.化工企业“三废”处理后,达标排放
C.利用微生物降解水域中的有毒有害物质
D.河道中的垃圾回收分类后,进行无害化处理
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
定期清淤,疏通河道,保证河流畅通,没有涉及化学变化,A符合题意;
工业生产中得到产品的同时常产生废气、废水和废渣(简称“三废”),常用化学方法进行处理,如石膏法脱硫、氧化还原法和沉淀法等处理废水,废渣资源回收利用等过程均有新物质生成,涉及化学变化,B不符合题意;
可通过微生物的代谢作用,将废水中有毒有害物质尤其是复杂的有机污染物降解为简单的、无害物质,所以微生物法处理废水有新物质的生成,涉及化学变化,C不符合题意;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
河道中的垃圾回收分类后,适合焚化处理的垃圾,利用现代焚化炉进行燃烧,消灭各种病原体,把一些有毒、有害物质转化为无害物质,同时可回收热能,用于供热和发电等,此过程涉及化学变化,D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
3.(2022·河南洛阳高一阶段检测)以下氧化物的主要来源与其引起的环境问题对应正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
选项 氧化物 环境问题 主要来源
A CO2 酸雨 化石燃料的燃烧
B SO2 光化学烟雾 汽车尾气的排放
C NO2 温室效应 工厂废气的排放
D CO 煤气中毒 煤炭的不完全燃烧
√
化石燃料的燃烧产生的CO2过度排放不会产生酸雨污染,只会形成温室效应,A不符合题意;
汽车尾气主要成分不是SO2,且SO2污染不会产生光化学烟雾污染,应该是汽车尾气中产生的氮氧化物,引起光化学烟雾,B不符合题意;
工业废气中的氮氧化物NOx不会造成温室效应,C不符合题意;
煤炭的不完全燃烧产生CO,会引起煤气中毒即CO中毒,D符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4.下列有关有机化合物的说法正确的是
A.利用煤燃烧放出热量使水分解产生氢气,是氢能开发的研究方向
B.“白色垃圾”“地沟油”均属于高分子材料,都对环境有害
C.聚氯乙烯制品可倾倒在海洋中处理
D.光化学烟雾、硝酸型酸雨的形成都与氮氧化合物有关
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
煤燃烧会产生大量的SO2等污染物,用其放出的热分解水产生氢气,效益低,故A错误;
“白色垃圾”主要成分为塑料,属于高分子材料,“地沟油”主要成分为油脂,不属于高分子材料,故B错误;
聚氯乙烯制品不易降解,不能倾倒在海洋中处理,故C错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
题组二 绿色化学
5.在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应
A.①② B.②⑤ C.②④ D.①③
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
上述反应中,②化合反应、⑤加成反应中反应产物只有一种,原子利用率达到100%,而置换反应、分解反应、取代反应生成物不止一种,不能满足原子利用率为100%。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
6.(2022·天津市第二南开中学高一检测)下列不符合“绿色发展,保护生态环境”理念的是
A.含酶洗衣粉代替含磷洗衣粉
B.含汞废旧电池有毒,应直接掩埋
C.用秸秆、粪便生产沼气,实现垃圾资源化
D.将废旧塑料制品制成再生制品
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
含酶洗衣粉代替含磷洗衣粉可减少水体富营养化、水华、赤潮等水污染,A不符合题意;
废旧电池中含有重金属等金属离子,直接掩埋会造成土壤污染、水体污染等,B符合题意;
植物秸秆、枝叶、杂草含有生物质能,可通过发酵制取甲烷,从而有效利用生物质能,实现垃圾资源化,C不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
7.(2021·山东,1)有利于实现“碳达峰、碳中和”的是
A.风能发电 B.粮食酿酒
C.燃煤脱硫 D.石油裂化
√
“碳达峰”是指我国承诺2030年前,二氧化碳的排放不再增长,达到峰值之后逐步降低;“碳中和”是指通过植树造林、节能减排等形式,抵消自身产生的二氧化碳排放量,实现二氧化碳“零排放”。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
题组三 环境保护与可持续发展
8.化学与人类生产、生活、社会可持续发展密切相关,下列说法不正确的是
A.“天宫一号”中使用的碳纤维,是一种新型无机非金属材料
B.为防止富脂食品氧化变质,常在包装袋中放入生石灰
C.开发新能源,减少对化石燃料的依赖,可以促进低碳经济
D.“静电除尘”“燃煤固硫”“汽车尾气催化净化”都能提高空气质量
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
碳纤维的成分为碳单质,为无机物,是一种新型无机非金属材料,A正确;
生石灰只能吸收水分,不能吸收氧气,所以加入生石灰不能防止富脂食品被氧化变质,B错误;
开发新能源,减少对化石燃料的依赖,可以促进低碳经济,C正确;
“静电除尘”“燃煤固硫”“汽车尾气催化净化”都可减少污染气体的排放,能提高空气质量,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
9.下列关于垃圾分类的说法正确的是
A.废电池、过期药品属于有害垃圾,无需回收,为防止污染环境应当深
埋处理
B.其他垃圾包括防新型冠状病毒用的口罩、烟头等物品无法利用,应当
弃去不要
C.废纸类、废塑料、废玻璃、废金属、废油漆桶等属于可回收物
D.厨余垃圾经生化处理转化为沼气和有机肥料,从而生产绿色有机食品
和清洁燃料
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
废电池、过期药品属于有害垃圾,需要回收经过特殊处理,故A错误;
防新型冠状病毒用的口罩为医疗垃圾,属于有害垃圾,应回收经过特殊处理,故B错误;
废油漆桶为有害垃圾,不属于可回收物,故C错误;
厨余垃圾富有营养,可以生化处理或者堆肥,减少环境污染,同时变废为宝,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
10.(2022·成都高一阶段检测)“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制得的产物,即原子利用率为100%。下列反应中最符合“绿色化学”概念的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A.溴乙烷在碱性条件下制备乙醇:CH3CH2Br+NaOH CH3CH2OH+NaBr
B.合成甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH
CH2==C(CH3)COOCH3
C.以铜和浓硝酸为原料生产硝酸铜:Cu+4HNO3(浓)===Cu(NO3)2+
2NO2↑+2H2O
D.FeCl3溶液制Fe(OH)3胶体:FeCl3+3H2O Fe(OH)3(胶体)+3HCl
√
溴乙烷在碱性条件下制备乙醇,除了乙醇外还有副产物NaBr,不符合原子利用率为100%,A项错误;
合成甲基丙烯酸甲酯,所有反应物均变成产物,原子利用率为100%,B项正确;
以铜和浓硝酸为原料生产硝酸铜,会有副产物NO2和H2O,C项错误;
FeCl3溶液制Fe(OH)3胶体,有副产物HCl,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
11.如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程。该方法对H2S的吸收率达99%以上,并可制取H2和S。下列说法正确的是
A.吸收H2S的反应的离子方程式为
Fe3++H2S===Fe2++S↓+2H+
B.吸收H2S的反应的离子方程式为2Fe3++3H2S===2Fe2++3S↓+6H+
C.实验室可用点燃的方法消除H2S对环境的污染
D.该工艺流程体现了绿色化学思想
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
FeCl3有氧化性,H2S有还原性,二
者在溶液中发生反应的离子方程式
为2Fe3++H2S===2Fe2++S↓+2H+,
A、B项错误;
若点燃H2S,则发生反应:2H2S+3O2 2SO2+2H2O,燃烧产物SO2也是大气污染物,C项错误;
电解的产物又重新用来吸收石油炼制过程中产生的大量H2S废气,物质得到充分利用,该工艺流程体现了绿色化学思想,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
12.“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出)。
下列有关该方法的叙述正确的是
①能耗小是该方法的一大优点
②整个过程中,有两种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是过滤、蒸发、结晶
④该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
A.①③ B.②④ C.③④ D.①④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
根据题中信息可知,基本过程中
有两个反应:①二氧化碳与氢氧
化钠溶液反应;②碳酸钙的高温
分解,循环利用的物质有CaO和NaOH两种物质,捕捉室中的反应为二氧化碳与氢氧化钠反应,得到Na2CO3,Na2CO3和CaO在溶液中反应得到NaOH和CaCO3,由此可分析判断。①碳酸钙高温分解需要消耗大量的能量,不正确;②氧化钙与氢氧化钠可以循环使用,正确;③碳酸钙不溶于水,所以“反应分离”环节中,分离物质的基本操作是过滤,不正确;④工业上可以用CO2合成甲醇,正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13.绿色化学是预防污染的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
(1)下列各项符合“绿色化学”要求的是___(填字母)。
A.处理废弃物 B.治理污染点
C.减少有毒物 D.杜绝污染源
根据题干描述“绿色化学是预防污染的根本手段”可知,“绿色化学”要求从“源头”上杜绝污染源。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
D
(2)某化工厂排放的污水中含有Mg2+、
Fe3+、Cu2+、Hg2+四种离子。某同
学设计了从该污水中回收纯净的金属铜的方案。
在回收金属铜的方案中,操作____会导致环境污染,为防止污染,应采取的措施是_________________。
因为汞的沸点低,易挥发,且汞有毒,所以操作③会造成环境污染。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
③
增加冷凝回收装置
14.SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02 mg·L-1。
(1)酸雨是降水呈酸性(pH小于5.6)的统称,个别地方甚至低于2.1(食醋的pH=3)。引起酸雨的罪魁祸首是大气中的SO2和氮的氧化物。它们的主要来源是煤和石油的燃烧,全世界每年排放1.5亿吨的SO2。
①SO2可在空气中受光照等因素作用而被氧化,最终与雨水形成硫酸型
酸雨。试写出这两个反应的化学方程式:___________________,_____
_______________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
+H2O===H2SO4
SO3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
②汽车排放的尾气、硝酸厂和化肥厂的废气中都含有氮的氧化物,全世界每年排放量约为5×107 kg。NO2溶于水生成_______和NO。
NO2与水反应生成HNO3与NO,化学方程式为3NO2+H2O===2HNO3+NO。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
HNO3
③酸雨可导致的危害有_____(填字母)。
A.腐蚀建筑物 B.导致树木枯萎
C.造成洪涝灾害 D.恶化人类环境
酸雨的酸性较强,能腐蚀建筑物,导致树木枯萎等,从而恶化人类环境,但不会造成洪涝灾害。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
ABD
④为了减少酸雨的形成,必须减少SO2的排放量,对燃料中的硫化物进行_________,对废气中的氮的氧化物用_____吸收。
为了减少酸雨的形成,必须减少SO2的排放量,对燃料进行脱硫处理,对废气中的氮的氧化物用碱液吸收。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
脱硫处理
碱液
(2)某化学兴趣小组选用如图所示的实验装置,
测定工业原料气(含SO2、N2、O2)中SO2的含量
(已知碘能氧化H2SO3生成 H2SO4)。
①若原料气从左向右流时,上述装置连接的顺序是:原料气________________(用字母和箭头表示)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
→c→d→b→a→e
②写出装置B中发生反应的离子方程式:________________________________;
当装置B中出现__________________现象时,立即停止通气。
蓝色恰好变成无色
③你认为下列试剂中,可以用来代替试管中碘
的淀粉溶液的是___(填字母)。
A.酸性KMnO4溶液 B.NaOH溶液
C.溴水 D.氨水
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A
④若碘溶液的浓度为0.05 mol·L-1,体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积)。那么SO2的含量是否超标?___(填“是”或“否”)。
是
因废气中的SO2能与I2发生化学反应:SO2+I2+2H2O===H2SO4+2HI,当装置B中蓝色恰好变成无色时,说明SO2恰好完全反应,根据消耗I2的物质的量即可求出SO2的体积,剩余气体N2和O2的体积可用排水法(短管进,长管出)测出,故装置的连接顺序为原料气→c→d→b→a→e。SO2也能被酸性KMnO4溶液氧化且有明显的实验现象,溴水也能与SO2反应,但Br2易挥发,会产生实验误差,NaOH溶液、氨水也能消耗SO2,但无明显实验现象。由条件知n(SO2)=n(I2)=0.05 mol·L-1×0.02 L=0.001 mol,即其体积为22.4 mL,
1
2
3
4
5
6
7
8
9
10
11
12
13
14
所以工业原料气总体积为297.6 mL+22.4 mL=320 mL,其中SO2的
质量为0.001 mol×64 g·mol-1=0.064 g,故SO2的含量为 =200 mg·
L-1>0.02 mg·L-1,所以SO2含量超标。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
返回
本课结束
第八章
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
