第五章 第三节 无机非金属材料 课件 (25张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章 第三节 无机非金属材料 课件 (25张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 22.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-31 07:29:04 | ||
图片预览








文档简介
(共25张PPT)
第五章 化工生产中的重要非金属元素
第三节 无机非金属材料
材料的分类
金属材料
材料
无机非金属材料
有机高分子材料
复合材料
传统无机非金属材料
新型无机非金属材料
(以硅酸盐材料为主)
1.三大传统硅酸盐材料:陶瓷、玻璃、水泥
玻璃
水泥
陶瓷
一、传统无机非金属材料-硅酸盐材料
陶瓷
陶瓷是以黏土(主要成分为含水的铝硅酸盐)为主要原料,经高温烧结而成的。
普通玻璃的主要成分为Na2SiO3、CaSiO3和SiO2。它是以纯碱、石灰石和石英砂(主要成分是SiO2)为原料。
玻璃
反应原理:
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
有色玻璃
钢化玻璃
加入不同的金属氧化物
普通玻璃加热近熔化再急速冷却
主要原料:黏土和石灰石(石膏)
生产设备:水泥回转窑
用途:水泥、沙子和碎石等与水混合可以得
到混凝土
三峡大坝
水泥
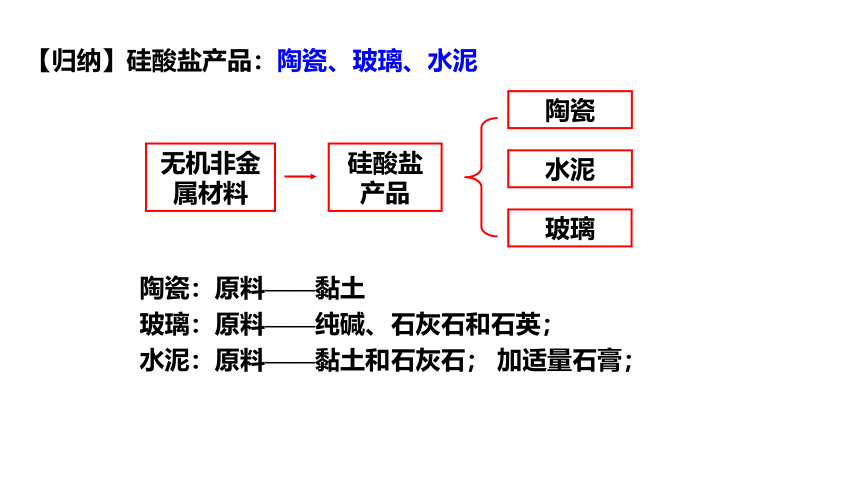
无机非金属材料
硅酸盐产品
陶瓷
水泥
玻璃
陶瓷:原料——黏土
玻璃:原料——纯碱、石灰石和石英;
水泥:原料——黏土和石灰石; 加适量石膏;
【归纳】硅酸盐产品:陶瓷、玻璃、水泥
①概念:由硅、氧和金属组成的化合物的总称;
2.硅酸盐的组成、结构和性质:
③性质:
大多数难溶于水,可溶性硅酸盐如Na2SiO3,K2SiO3等。
硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点。
②结构:
在硅酸盐中硅原子和氧原子构成了硅氧四面体
硅在自然界中只有化合态,主要以二氧化硅和硅酸盐的形式存在。
硅酸盐矿石
水晶、石英( SiO2 )
玛瑙( SiO2 )
二、新型无机非金属材料
岩石
沙子
土壤
1.硅
硅元素含量仅此于氧,位于元素周期表第三周期、第ⅣA族。
单质硅是灰黑色具有金属光泽的固体。
Si
+14
8
4
2
主要形成四价的化合物
(1)硅的用途
Si导电性介于导体和半导体之间,是良好的半导体材料,硅是信息技术的关键材料
硅太阳能电池
半导体材料
硅芯片
第三周期、第IV A族,处于金属和非金属的过渡位置
【思考】根据元素周期表中硅的位置,为什么硅能成为应
用最为广泛的半导体材料?
(2)硅的制备
SiO2+2C == Si+2CO ↑
高温
Si+3HCl == SiHCl3+H2
300℃
SiHCl3+H2 == Si+3HCl (高纯硅)
高温
第一步:制粗硅
第二步:粗硅提纯
(3)化学性质
a.常温下,化学性质稳定
Si+2NaOH+H2O == Na2SiO3+2H2↑
b.与强碱反应
c.加热时能与某些非金属单质反应
水晶
玛瑙
石英
沙子
生活中的二氧化硅
(1)物理性质:难溶于水,熔点高,硬度大 ,不导电
SiO2是原子晶体;硬度大、熔点高是原子晶体的特点
1mol 二氧化硅中含4mol Si-O键
2.二氧化硅SiO2
(2)结构:
a.酸性氧化物
①与碱溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O
②与碱性氧化物反应:SiO2 + CaO CaSiO3
③与某些盐反应:
(2)SiO2的化学性质
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
制玻璃
【注意】①Na2SiO3的水溶液俗称水玻璃,具有黏结力强、耐高温等特性,
可以用作黏合剂和防火剂。
②酸性:碳酸>硅酸
SiO2 + 4HF== SiF4 ↑+2H2O
——唯一能与SiO2反应的酸
用途:刻蚀玻璃
(2)SiO2的化学性质
b.特性:与HF反应
【思考】某同学根据SiO2既可与碱反应,也能与氢氟酸反应
推断SiO2为两性氧化物.是否正确
不正确,SiO2 + 4HF== SiF4 ↑+2H2O
光导纤维
(3)SiO2的用途
石英坩埚( SiO2 )
沙子作建材
装饰品
3.新型陶瓷
高温陶瓷
压电陶瓷
透明陶瓷
碳化硅(SiC)俗称金刚砂
硬度很大,可用作砂纸和砂轮的磨料
还具有优异的高温抗氧化性能,可以用作耐高温结构材料、耐高温半导体材料等。
超导陶瓷
富勒烯C60
石墨烯
碳纳米管
(单壁)
碳纳米管
(多壁)
4.碳纳米材料:碳单质的同素异形体
1. 下列有关无机非金属材料的说法错误的是( )
A. 氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
B. 碳化硅(SiC)的硬度大,熔点高,可制作耐高温轴承
C. 富勒烯C60是一种新型化合物
D. 超导陶瓷在某一临界温度下电阻为零,可用于磁悬浮技术
C
2.利用“强酸制弱酸”原理可用来设计酸性强弱比较的实验,如比较HCl、H2CO3、H2SiO3酸性强弱:
(1)分液漏斗所盛试剂是稀盐酸,锥形瓶所盛试剂是______________,装置A中反应的化学方程式是_____________________________________________。
(2)装置B所盛试剂是饱和NaHCO3溶液,其作用是:
_____________________________________。
(3)装置C所盛试剂是_____________,C中反应的离子方程式是
___________________________________。
(4)结论:HCl、H2CO3、H2SiO3酸性强弱:________>________>________。
能否说明非金属性:Cl > C > Si ?
Na2CO3溶液
Na2CO3 + 2HCl === 2NaCl + CO2↑+ H2O
除去盐酸中挥发出的HCl气体
Na2SiO3溶液
HCl H2CO3 H2SiO3
第五章 化工生产中的重要非金属元素
第三节 无机非金属材料
材料的分类
金属材料
材料
无机非金属材料
有机高分子材料
复合材料
传统无机非金属材料
新型无机非金属材料
(以硅酸盐材料为主)
1.三大传统硅酸盐材料:陶瓷、玻璃、水泥
玻璃
水泥
陶瓷
一、传统无机非金属材料-硅酸盐材料
陶瓷
陶瓷是以黏土(主要成分为含水的铝硅酸盐)为主要原料,经高温烧结而成的。
普通玻璃的主要成分为Na2SiO3、CaSiO3和SiO2。它是以纯碱、石灰石和石英砂(主要成分是SiO2)为原料。
玻璃
反应原理:
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
有色玻璃
钢化玻璃
加入不同的金属氧化物
普通玻璃加热近熔化再急速冷却
主要原料:黏土和石灰石(石膏)
生产设备:水泥回转窑
用途:水泥、沙子和碎石等与水混合可以得
到混凝土
三峡大坝
水泥
无机非金属材料
硅酸盐产品
陶瓷
水泥
玻璃
陶瓷:原料——黏土
玻璃:原料——纯碱、石灰石和石英;
水泥:原料——黏土和石灰石; 加适量石膏;
【归纳】硅酸盐产品:陶瓷、玻璃、水泥
①概念:由硅、氧和金属组成的化合物的总称;
2.硅酸盐的组成、结构和性质:
③性质:
大多数难溶于水,可溶性硅酸盐如Na2SiO3,K2SiO3等。
硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点。
②结构:
在硅酸盐中硅原子和氧原子构成了硅氧四面体
硅在自然界中只有化合态,主要以二氧化硅和硅酸盐的形式存在。
硅酸盐矿石
水晶、石英( SiO2 )
玛瑙( SiO2 )
二、新型无机非金属材料
岩石
沙子
土壤
1.硅
硅元素含量仅此于氧,位于元素周期表第三周期、第ⅣA族。
单质硅是灰黑色具有金属光泽的固体。
Si
+14
8
4
2
主要形成四价的化合物
(1)硅的用途
Si导电性介于导体和半导体之间,是良好的半导体材料,硅是信息技术的关键材料
硅太阳能电池
半导体材料
硅芯片
第三周期、第IV A族,处于金属和非金属的过渡位置
【思考】根据元素周期表中硅的位置,为什么硅能成为应
用最为广泛的半导体材料?
(2)硅的制备
SiO2+2C == Si+2CO ↑
高温
Si+3HCl == SiHCl3+H2
300℃
SiHCl3+H2 == Si+3HCl (高纯硅)
高温
第一步:制粗硅
第二步:粗硅提纯
(3)化学性质
a.常温下,化学性质稳定
Si+2NaOH+H2O == Na2SiO3+2H2↑
b.与强碱反应
c.加热时能与某些非金属单质反应
水晶
玛瑙
石英
沙子
生活中的二氧化硅
(1)物理性质:难溶于水,熔点高,硬度大 ,不导电
SiO2是原子晶体;硬度大、熔点高是原子晶体的特点
1mol 二氧化硅中含4mol Si-O键
2.二氧化硅SiO2
(2)结构:
a.酸性氧化物
①与碱溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O
②与碱性氧化物反应:SiO2 + CaO CaSiO3
③与某些盐反应:
(2)SiO2的化学性质
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
制玻璃
【注意】①Na2SiO3的水溶液俗称水玻璃,具有黏结力强、耐高温等特性,
可以用作黏合剂和防火剂。
②酸性:碳酸>硅酸
SiO2 + 4HF== SiF4 ↑+2H2O
——唯一能与SiO2反应的酸
用途:刻蚀玻璃
(2)SiO2的化学性质
b.特性:与HF反应
【思考】某同学根据SiO2既可与碱反应,也能与氢氟酸反应
推断SiO2为两性氧化物.是否正确
不正确,SiO2 + 4HF== SiF4 ↑+2H2O
光导纤维
(3)SiO2的用途
石英坩埚( SiO2 )
沙子作建材
装饰品
3.新型陶瓷
高温陶瓷
压电陶瓷
透明陶瓷
碳化硅(SiC)俗称金刚砂
硬度很大,可用作砂纸和砂轮的磨料
还具有优异的高温抗氧化性能,可以用作耐高温结构材料、耐高温半导体材料等。
超导陶瓷
富勒烯C60
石墨烯
碳纳米管
(单壁)
碳纳米管
(多壁)
4.碳纳米材料:碳单质的同素异形体
1. 下列有关无机非金属材料的说法错误的是( )
A. 氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
B. 碳化硅(SiC)的硬度大,熔点高,可制作耐高温轴承
C. 富勒烯C60是一种新型化合物
D. 超导陶瓷在某一临界温度下电阻为零,可用于磁悬浮技术
C
2.利用“强酸制弱酸”原理可用来设计酸性强弱比较的实验,如比较HCl、H2CO3、H2SiO3酸性强弱:
(1)分液漏斗所盛试剂是稀盐酸,锥形瓶所盛试剂是______________,装置A中反应的化学方程式是_____________________________________________。
(2)装置B所盛试剂是饱和NaHCO3溶液,其作用是:
_____________________________________。
(3)装置C所盛试剂是_____________,C中反应的离子方程式是
___________________________________。
(4)结论:HCl、H2CO3、H2SiO3酸性强弱:________>________>________。
能否说明非金属性:Cl > C > Si ?
Na2CO3溶液
Na2CO3 + 2HCl === 2NaCl + CO2↑+ H2O
除去盐酸中挥发出的HCl气体
Na2SiO3溶液
HCl H2CO3 H2SiO3
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
