5.1.3 不同价态含硫物质的转化 课件(17张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1.3 不同价态含硫物质的转化 课件(17张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-31 00:00:00 | ||
图片预览



文档简介
(共17张PPT)
第五章 化工生产中的
重要非金属元素
第1节 硫及其化合物
第3课时 不同价态含硫物质的转化
课程学习目标
学习化学实验的设计
2
掌握不同价态含硫物质之间的转化
1
新课展示
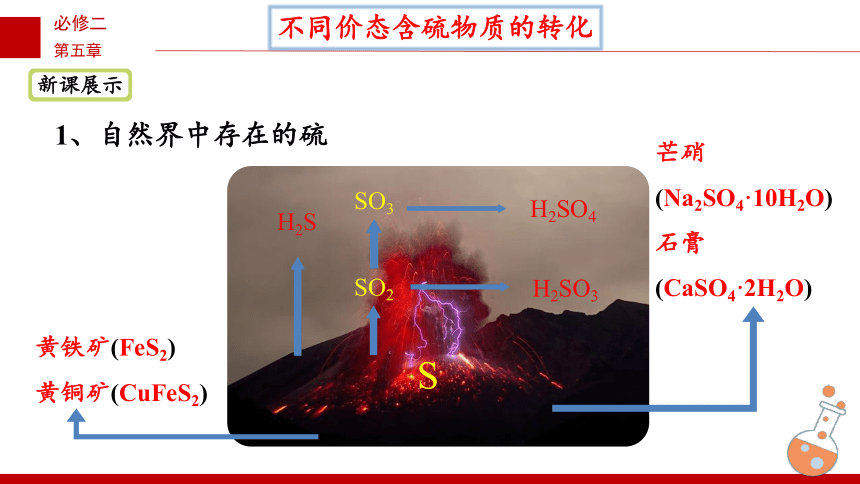
不同价态含硫物质的转化
黄铁矿(FeS2)
黄铜矿(CuFeS2)
H2S
SO2
H2SO3
H2SO4
S
芒硝
(Na2SO4·10H2O)
石膏
(CaSO4·2H2O)
SO3
1、自然界中存在的硫
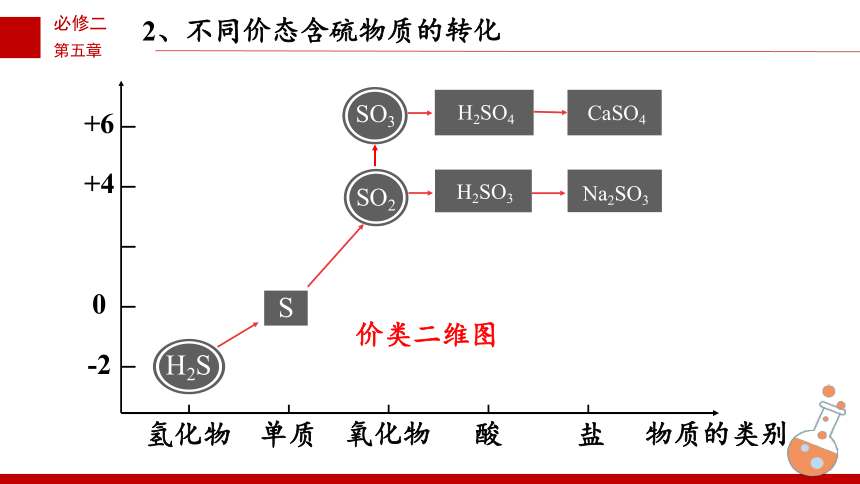
单质
氢化物
氧化物
酸
盐
物质的类别
-2
0
+4
+6
SO2
SO3
S
H2SO4
CaSO4
H2SO3
Na2SO3
价类二维图
H2S
2、不同价态含硫物质的转化
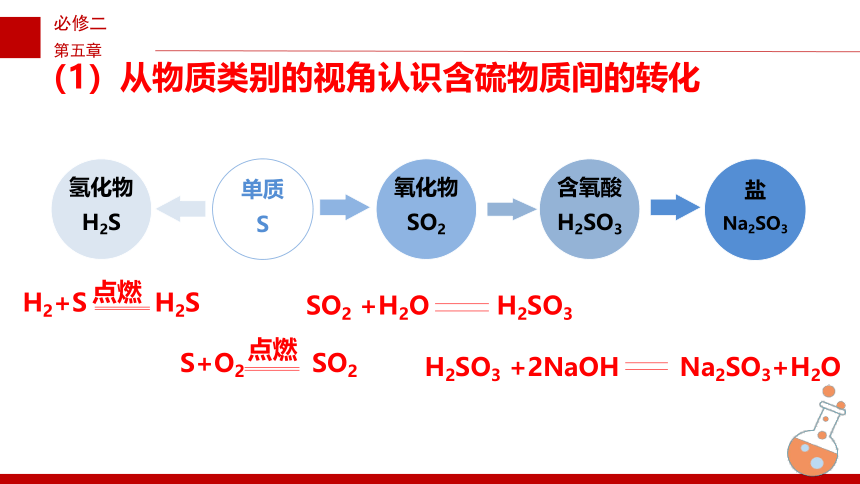
(1)从物质类别的视角认识含硫物质间的转化
单质
S
氢化物
H2S
H2+S H2S
点燃
氧化物
SO2
S+O2 SO2
点燃
含氧酸
H2SO3
SO2 +H2O H2SO3
盐
Na2SO3
H2SO3 +2NaOH Na2SO3+H2O
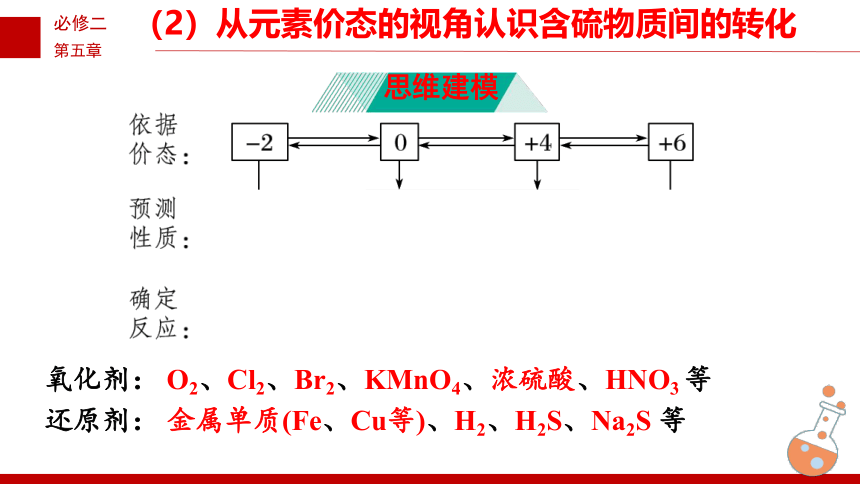
(2)从元素价态的视角认识含硫物质间的转化
思维建模
氧化剂: O2、Cl2、Br2、KMnO4、浓硫酸、HNO3 等
还原剂: 金属单质(Fe、Cu等)、H2、H2S、Na2S 等
①邻位价态原则:当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降,可用下图表示。
②相邻价态的微粒间互不发生氧化还原反应,如S和H2S、S和SO2、SO2和浓H2SO4之间不发生氧化还原反应。
③归中规律
当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态,如:
2H2S+SO2=3S+2H2O
④含硫物质的连续氧化规律
H2S
足量O2
SO2
S
O2
O2
催化剂
SO3
H2O
H2SO4
中学阶段常见的符合A B C D转化关系的有哪些?
O2
O2
H2O
硫元素:
H2S SO2 SO3 H2SO4
S SO2 SO3 H2SO4
碳元素:
C CO CO2 H2CO3
钠元素:
Na Na2O Na2O2 NaOH
⑤相同价态的不同含硫化合物间是通过酸碱反应规律联系在一起的。如:
SO2 H2SO3 NaHSO3 Na2SO3
H2O
△
NaOH溶液
稀硫酸
NaOH溶液
亚硫酸
NaOH溶液
浓硫酸
化学实验设计
化学实验设计是指实验者在实施化学实验之前,根据一定的实验目的,运用化学知识与技能,按照一定的实验方法,对实验的原理、试剂、仪器与装置、步骤和方法等所进行的规划。
运用化学实验设计时,应遵循科学性、可行性、安全性和绿色化原则。化学实验设计一般以实验设计方案的形式呈现。
方法导引
实验序号 价态 变化 转化前的物质 选择试剂 转化后的物质 预期现象
1 -2→0 H2S
2 0→+4 S
3 +4→+6 H2SO3
4 +6→+4 H2SO4
5 +4→0 SO2
6 0→-2 S
SO2
S
生成淡黄色固体
空气
SO2
硫燃烧,发出淡蓝色火焰,
产生有刺激气味的气体。
H2O2
H2SO4
滴入稀盐酸,再滴入 BaCl2,
产生白色沉淀。
Cu
SO2
产生有刺激气味的气体,通入品红溶液,品红褪色
H2S
S
生成淡黄色固体
Fe
FeS
生成黑色固体
H2O2+H2SO3=H2SO4+H2O
化工工程师
化工工程师是解决人类在生产、生活等领域面临的化工相关问题的专业技术人才,工作在石油炼制、化肥生产、医药开发和环境治理等了领域。主要工作是依据科学原理,统筹各方面的资源,设计化工生产的工艺流程,并监控生产过程,及时解决生产中遇到的技术问题。
化工工程师需要具有高度的社会责任感、团队精神、全局观念、风险管控意识和创新能力,并具备化学、化工、安全、经济、环境等方面的专业知识。
化学与职业
SO2
物质类别
化
合
价
单质
氧化物
盐
含氧酸
-2
+4
SO3
氢化物
硫元素的价类图
0
H2S
S
H2SO3
H2SO4
SO32-
SO42-
FeS
NaOH
Cl2、H2O2、O2
Cu、C、HI、H2S
Cl2、H2O2、O2
O2、浓硫酸
H2S
H2
KMnO4、HNO3、Fe3+
H2O
△
Cl2、O2、SO2、Fe3+、 HNO3 、 KMnO4
O2
NaOH
稀硫酸
+6
Fe
酸碱转化
氧化还原转化
H2O
△
硫酸根离子的检验 不同价态含硫物质的转化
一、硫酸根离子的检验
二、粗盐提纯
1、方法:
1、方法:
课堂总结
三、不同价态含硫物质的转化
1、方法:
第五章 化工生产中的
重要非金属元素
第1节 硫及其化合物
第3课时 不同价态含硫物质的转化
课程学习目标
学习化学实验的设计
2
掌握不同价态含硫物质之间的转化
1
新课展示
不同价态含硫物质的转化
黄铁矿(FeS2)
黄铜矿(CuFeS2)
H2S
SO2
H2SO3
H2SO4
S
芒硝
(Na2SO4·10H2O)
石膏
(CaSO4·2H2O)
SO3
1、自然界中存在的硫
单质
氢化物
氧化物
酸
盐
物质的类别
-2
0
+4
+6
SO2
SO3
S
H2SO4
CaSO4
H2SO3
Na2SO3
价类二维图
H2S
2、不同价态含硫物质的转化
(1)从物质类别的视角认识含硫物质间的转化
单质
S
氢化物
H2S
H2+S H2S
点燃
氧化物
SO2
S+O2 SO2
点燃
含氧酸
H2SO3
SO2 +H2O H2SO3
盐
Na2SO3
H2SO3 +2NaOH Na2SO3+H2O
(2)从元素价态的视角认识含硫物质间的转化
思维建模
氧化剂: O2、Cl2、Br2、KMnO4、浓硫酸、HNO3 等
还原剂: 金属单质(Fe、Cu等)、H2、H2S、Na2S 等
①邻位价态原则:当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降,可用下图表示。
②相邻价态的微粒间互不发生氧化还原反应,如S和H2S、S和SO2、SO2和浓H2SO4之间不发生氧化还原反应。
③归中规律
当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态,如:
2H2S+SO2=3S+2H2O
④含硫物质的连续氧化规律
H2S
足量O2
SO2
S
O2
O2
催化剂
SO3
H2O
H2SO4
中学阶段常见的符合A B C D转化关系的有哪些?
O2
O2
H2O
硫元素:
H2S SO2 SO3 H2SO4
S SO2 SO3 H2SO4
碳元素:
C CO CO2 H2CO3
钠元素:
Na Na2O Na2O2 NaOH
⑤相同价态的不同含硫化合物间是通过酸碱反应规律联系在一起的。如:
SO2 H2SO3 NaHSO3 Na2SO3
H2O
△
NaOH溶液
稀硫酸
NaOH溶液
亚硫酸
NaOH溶液
浓硫酸
化学实验设计
化学实验设计是指实验者在实施化学实验之前,根据一定的实验目的,运用化学知识与技能,按照一定的实验方法,对实验的原理、试剂、仪器与装置、步骤和方法等所进行的规划。
运用化学实验设计时,应遵循科学性、可行性、安全性和绿色化原则。化学实验设计一般以实验设计方案的形式呈现。
方法导引
实验序号 价态 变化 转化前的物质 选择试剂 转化后的物质 预期现象
1 -2→0 H2S
2 0→+4 S
3 +4→+6 H2SO3
4 +6→+4 H2SO4
5 +4→0 SO2
6 0→-2 S
SO2
S
生成淡黄色固体
空气
SO2
硫燃烧,发出淡蓝色火焰,
产生有刺激气味的气体。
H2O2
H2SO4
滴入稀盐酸,再滴入 BaCl2,
产生白色沉淀。
Cu
SO2
产生有刺激气味的气体,通入品红溶液,品红褪色
H2S
S
生成淡黄色固体
Fe
FeS
生成黑色固体
H2O2+H2SO3=H2SO4+H2O
化工工程师
化工工程师是解决人类在生产、生活等领域面临的化工相关问题的专业技术人才,工作在石油炼制、化肥生产、医药开发和环境治理等了领域。主要工作是依据科学原理,统筹各方面的资源,设计化工生产的工艺流程,并监控生产过程,及时解决生产中遇到的技术问题。
化工工程师需要具有高度的社会责任感、团队精神、全局观念、风险管控意识和创新能力,并具备化学、化工、安全、经济、环境等方面的专业知识。
化学与职业
SO2
物质类别
化
合
价
单质
氧化物
盐
含氧酸
-2
+4
SO3
氢化物
硫元素的价类图
0
H2S
S
H2SO3
H2SO4
SO32-
SO42-
FeS
NaOH
Cl2、H2O2、O2
Cu、C、HI、H2S
Cl2、H2O2、O2
O2、浓硫酸
H2S
H2
KMnO4、HNO3、Fe3+
H2O
△
Cl2、O2、SO2、Fe3+、 HNO3 、 KMnO4
O2
NaOH
稀硫酸
+6
Fe
酸碱转化
氧化还原转化
H2O
△
硫酸根离子的检验 不同价态含硫物质的转化
一、硫酸根离子的检验
二、粗盐提纯
1、方法:
1、方法:
课堂总结
三、不同价态含硫物质的转化
1、方法:
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
