第16讲+微粒间相互作用与物质性质(30张ppt)(精讲课件)-2023届高考二轮精准复习45讲(全国通用)
文档属性
| 名称 | 第16讲+微粒间相互作用与物质性质(30张ppt)(精讲课件)-2023届高考二轮精准复习45讲(全国通用) |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-31 16:37:02 | ||
图片预览








文档简介
(共30张PPT)
高中
化学
二轮精准复习45讲
微粒间相互作用与物质性质
第16讲
2023
考向1 化学键类型
真题示例1
(2020山东卷)B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的是( )
A.其熔点主要取决于所含化学键的键能 B.形成大π键的电子全部由N提供
C.分子中B和N的杂化方式相同 D.分子中所有原子共平面
A
解析 由题意知,无机苯与苯结构相似,应属于分子晶体,其熔点取决于范德华力,A项错误;分子中所有原子共平面,D项正确;根据价键原理和题干信息,无机苯的结构式为 ,该分子属于平面形分子,分子中N原子和B原子都属于sp2杂化,N形
成4个价键,故大π键的电子全部由N原子提供。
(2020山东卷节选)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 mol该配合物中通过螯合作用形成的配位键有 mol,该螯合物中N的杂化方式有 种。
真题示例2
6 1
解析 由题意可知,只有成环的配位键才能起到螯合作用,再结合题给结构可知 N中的2个O原子和C、N杂环上的4个N原子通过螯合作用与Cd2+形成配位键,故1 mol该配合物中通过螯合作用形成6 mol配位键; N中N原子的价层电子对数为3+0=3, N
中N原子的价层电子对数为2+1=3,C、N杂环上的4个N原子的价层电子对数为3+0=3,故该配合物中N原子均采取sp2杂化。
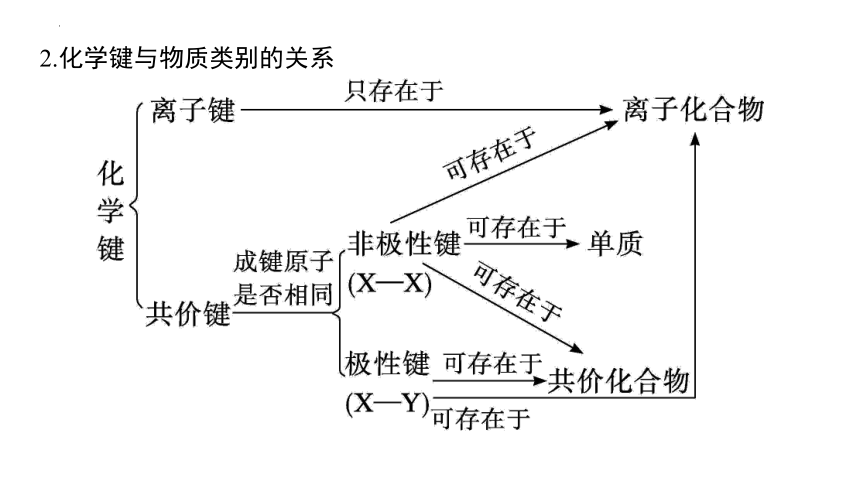
1.离子键、共价键及金属键的比较
化学键 类型 离子键 共价键(包括配位键) 金属键
非极性键 极性键
定义 阴、阳离子通过静电作用所形成的化学键 原子间通过共用电子对(电子云重叠)而形成的化学键 金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子共用,从而把所有金属原子维系在一起
成键粒子 阴、阳离子 原子 金属阳离子和自由电子
知识梳理———————夯实基础 强化要点
化学键类型 离子键 共价键(包括配位键) 金属键
非极性键 极性键
形成 条件 活泼金属元素与活泼非金属元素经电子得失,形成离子键 通常为同种元素原子之间成键 不同种元素原子之间成键 金属阳离子和自由电子间成键
形成的 物质 离子化合物 非金属单质;某些共价化合物或离子化合物 共价化合物或离子化合物 金属晶体
微点拨(1)离子键和金属键均含金属阳离子。
(2)离子化合物中的复杂阳离子和阴离子内含共价键。
2.化学键与物质类别的关系
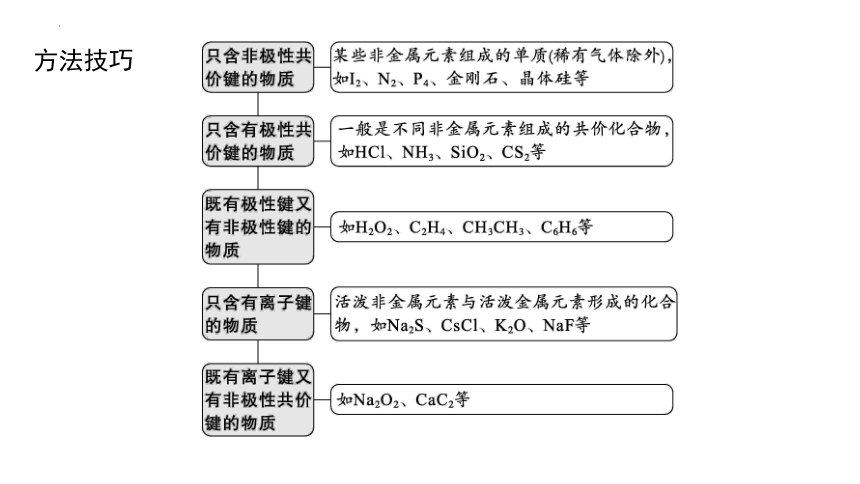
方法技巧
(1)σ键与π键的判断方法
3.判断共价键的方法
④共价键强度,σ键强度较大,较稳定;π键活泼,比较容易断裂。
注意:N≡N 中π键较稳定。
(2)极性键与非极性键的判断,看形成共价键的两原子,不同种元素的原子之间形成的是极性共价键,同种元素的原子之间形成的是非极性共价键。
(3) 配位键:形成配位键的条件是成键原子一方(A)能够提供孤电子对,另一方(B)具有能够接受孤电子对的空轨道,可表示为A→B。
配合物的组成特点
示,下列说法正确的是(
示,下列说法正确的是(
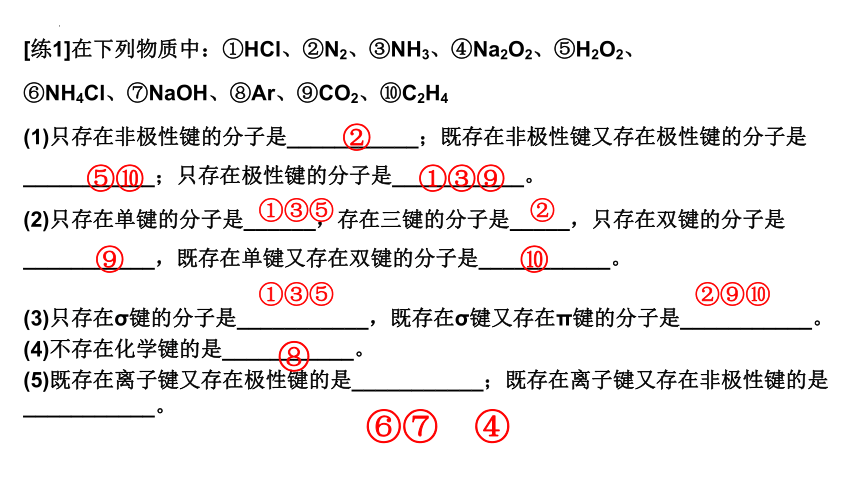
[练1]在下列物质中:①HCl、②N2、③NH3、④Na2O2、⑤H2O2、
⑥NH4Cl、⑦NaOH、⑧Ar、⑨CO2、⑩C2H4
(1)只存在非极性键的分子是___________;既存在非极性键又存在极性键的分子是___________;只存在极性键的分子是___________。
(2)只存在单键的分子是______,存在三键的分子是_____,只存在双键的分子是___________,既存在单键又存在双键的分子是___________。
(3)只存在σ键的分子是___________,既存在σ键又存在π键的分子是___________。
(4)不存在化学键的是___________。
(5)既存在离子键又存在极性键的是___________;既存在离子键又存在非极性键的是___________。
②
⑤⑩
①③⑨
①③⑤ ②
⑨ ⑩
①③⑤ ②⑨⑩
⑧
⑥⑦ ④
[练后归纳] 判断离子化合物和共价化合物的3种方法
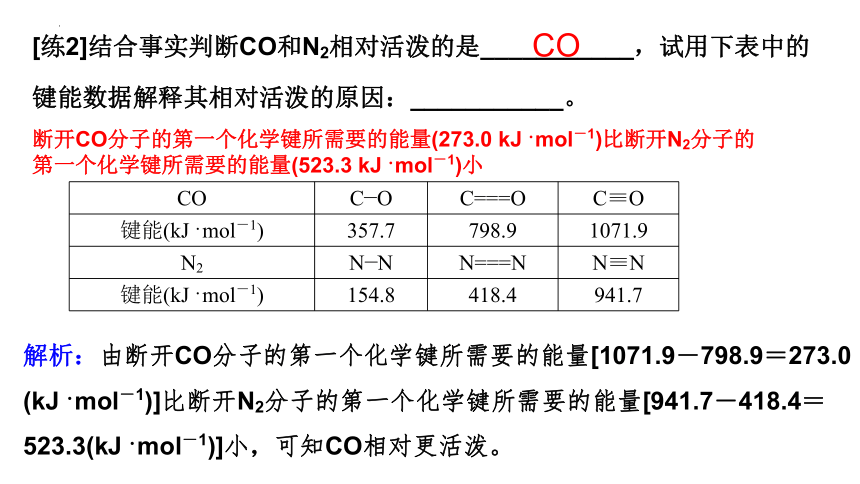
[练2]结合事实判断CO和N2相对活泼的是___________,试用下表中的
键能数据解释其相对活泼的原因:___________。
CO C—O C===O C≡O
键能(kJ·mol-1) 357.7 798.9 1071.9
N2 N—N N===N N≡N
键能(kJ·mol-1) 154.8 418.4 941.7
CO
断开CO分子的第一个化学键所需要的能量(273.0 kJ·mol-1)比断开N2分子的第一个化学键所需要的能量(523.3 kJ·mol-1)小
解析:由断开CO分子的第一个化学键所需要的能量[1071.9-798.9=273.0 (kJ·mol-1)]比断开N2分子的第一个化学键所需要的能量[941.7-418.4=523.3(kJ·mol-1)]小,可知CO相对更活泼。
共价键 H—H F—F H—F H—Cl H—I
键能E(kJ·mol-1) 436 157 568 432 299
【练3】已知各共价键的键能如表所示,下列说法正确的是( )
A.稳定性:H—I>H—Cl>H—F
B.表中看出F2能量最低
C.432 kJ·mol-1>E(H—Br)>299 kJ·mol-1
D.H2(g)+F2(g)===2HF(g) ΔH=+25 kJ·mol-1
解析:键能越大,共价键越稳定,根据题表中数据,H—F最稳定,A 错误;键能越大,形成的分子越稳定,能量越低。根据数据,H—F 最稳定,HF 能量最低,F—F 最不稳定,F2能量最高,B 错误;同主族从上往下半径逐渐增大,即 Br 的半径介于 Cl 和 I 之间,因此,H—Br 的键能介于 H—Cl 和 H—I之间,C 正确;根据ΔH=反应物的键能总和-生成物的键能总和=(436+157-2×568) kJ·mol-1=-543 kJ·mol-1,D错误。
C
[练4](1)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4中含有 mol配位键。
(2)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”(或大π键)。大π键可用 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为 。
①下列粒子中存在“离域Π键”的是 。
A.CH2=CH—CH=CH2 B.CCl4 C.H2O D.SO2
②NaN3中阴离子 与CO2均为直线形结构, 中的2个大π键可表示为 。
2
AD
(3)二氧化钛与COCl2(光气)、SOCl2(二氯亚砜)等氯化试剂反应可用于制取四氯化钛。
①COCl2(光气)的空间结构为 ,COCl2中σ键和π键的数目比为 。
②SOCl2(二氯亚砜)是 (填“极性”或“非极性”)分子。
平面三角形 3∶1
极性
解析:①[TiCl4(H2NCH2CH2NH2)]中,Ti与H2NCH2CH2NH2形成2个配位键,Ti与Cl形成4个配位键,从而得出配位键的数目为6。
②1个H2NCH2CH2NH2分子含有11个共价单键,从而得出1 mol H2NCH2CH2NH2中含 11 mol σ键。
(4)TiCl4可以与胺形成配合物,如[TiCl4(CH3NH2)2]、[TiCl4(H2NCH2CH2NH2)]等。
①[TiCl4(H2NCH2CH2NH2)]中Ti的配位数是 。
②1 mol H2NCH2CH2NH2中含有的σ键的物质的量为 。
6
11 mol
考向2 化学键、分子间作用力对物质性质的影响
真题示例1
(2020山东卷)下列关于C、Si及其化合物结构与性质的论述错误的是( )
A.键能C—C>Si—Si、C—H>Si—H,因此C2H6稳定性大于Si2H6
B.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度
C.SiH4中Si的化合价为+4价,CH4中C的化合价为-4价,因此SiH4还原性小于CH4
D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成p-p π键
C
解析 A项,键能C—C>Si—Si、C—H>Si—H,则C2H6的稳定性>Si2H6;B项,金刚石与SiC均属于共价晶体,具有很高的硬度;C项,C与Si在同一主族,非金属性C>Si,故CH4的还原性弱于SiH4,C项错误;D项,由于Si的原子半径较大,p轨道重叠程度小,所以Si原子间难以形成p-p π键。
(2020海南卷)下列有关事实的解释正确的是( )
选项 事实 解释
A 某些金属盐灼烧呈现不同焰色 电子从低能轨道跃迁至高能轨道时吸收光波长不同
B CH4与NH3分子的空间结构不同 两者中心原子杂化轨道类型不同
C HF的热稳定性比HCl强 H—F比H—Cl的键能大
D SiO2的熔点比干冰高 SiO2分子间的范德华力大
真题示例2
C
解析
A项,某些金属盐灼烧呈现不同焰色是因为电子从高能轨道跃迁到低能轨道时释放不同的光,错误;B项,CH4和NH3的中心原子都是sp3杂化,甲烷分子中C上无孤电子对,而NH3中N上有一个孤电子对,错误;C项,H—F的键长比H—Cl的短,H—F的键能大,HF的热稳定性强,正确;D项,SiO2是共价晶体,原子间形成共价键三维骨架结构,而干冰是分子晶体,通过分子间作用力结合,错误。
1.三种作用力及对物质性质的影响
作用力类型 范德华力 氢键 共价键
作用粒子 分子 H与N、O、F 原子
强度比较 共价键>氢键>范德华力
影响因素 组成和结构相似的物质,相对分子质量越大,范德华力越大 形成氢键的元素的电负性 原子半径
对性质的影响 影响物质的熔点、沸点、溶解度等物理性质 分子间氢键使物质的熔点、沸点升高,使溶解度增大 键能越大,物质的稳定性越强
知识梳理———————夯实基础 强化要点
归纳总结
[练1](1)(2020海南卷节选)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有 种键能数据。CH3OH可以与水以任意比例互溶的原因是 。
解析 (1)CH3OH中存在C—H、C—O、O—H,故CH3OH键参数中有3种键能数据;水与甲醇均具有羟基,彼此可以形成氢键,根据“相似相溶”规律,甲醇可与水以任意比例混溶。
答案 3 极性相近,形成分子间氢键
水之间形成氢键,而氯乙烷与水之间不能形成分子间氢键
[练1] (2)(2020山东卷节选)NH3、PH3、AsH3的沸点由高到低的顺序为 (填化学式,下同),还原性由强到弱的顺序为 ,键角由大到小的顺序为 。
解析 NH3、PH3、AsH3的分子组成相似,因NH3分子间存在氢键,AsH3分子间的范德华力大于PH3分子间的范德华力,所以沸点由高到低的顺序是NH3、AsH3、PH3。
非金属性N>P>As,故氢化物的还原性AsH3>PH3>NH3。
NH3、PH3、AsH3都是三角锥形分子,原子半径NPH3>AsH3。
答案 NH3、AsH3、PH3 AsH3、PH3、NH3 NH3、PH3、AsH3
[练1 ](3)(2020浙江卷节选)①CaCN2是离子化合物,各原子均满足8电子稳定结构,CaCN2的电子式是 。
②常温下,在水中的溶解度乙醇大于氯乙烷,原因是 。
答案
②乙醇与水之间形成氢键,而氯乙烷与水之间不能形成分子间氢键
解析 ①CaCN2是离子化合物,则阳离子为Ca2+、阴离子为 ;Ca原子最外层有2个电子,易失去最外层的2个电子达到8电子的稳定结构;N原子最外层有5个电子,易得到3个电子或形成3对共用电子对达到8电子的稳定结构;C原子最外层有4个电子,通常形成4对共用电子对达到8电子的稳定结构;则每个N原子分别得到Ca失去的1个电子、与C原子形成两对共用电子对,Ca、C、N都达到8电子的稳定结构,CaCN2的电子式为
②乙醇和氯乙烷都属于极性分子,但乙醇与水分子之间形成氢键,而氯乙烷与水分子间不能形成氢键,故常温下在水中的溶解度乙醇大于氯乙烷。
[练2]正氰酸(H—O—C≡N)与异氰酸(H—N=C=O)、雷酸(H—O—N≡C)互为同分异构体,均可以与氨水形成相应铵盐。下列说法错误的是( )
A.三种酸的分子均能形成分子间氢键
B.正氰酸和雷酸的分子中,氧原子的杂化方式不同
C.三种酸的组成元素中,碳的第一电离能最小
D.三种酸的铵盐中,只有雷酸铵的阴、阳离子均含有配位键
B
解析 三种酸中都含有H—N或H—O,则均可形成分子间氢键,A项正确。正氰酸、雷酸中的O都是只形成单键,均采取sp3杂化,B项错误。电离能大小:N>O>C,C与H相比,H原子半径较小且核外只有1个电子,原子核对该电子的吸引作用强,难以失去,则第一电离能H>C,则碳的第一电离能最小,C项正确。铵根离子中有一个配位键,雷酸中N—O之间还有配位键,而其他酸根中的所有原子刚好满足8电子结构,不存在配位键,D项正确。
[练3]M分子的部分结构如图所示(…表示氢键)。W、X、Y、Z是短周期主族元素,M中含有碳、氮、W、Z四种元素,化合物W2Z能与Y2反应产生Z2,X元素是地壳中含量最高的金属元素。下列说法正确的是( )
A.氢键是一种特殊的化学键
B.稳定性:W2Z>WY
C.X的氧化物的水化物是强碱
D.简单离子半径:Z>Y>X
M
D
解析 W、X、Y、Z是短周期主族元素,X元素是地壳中含量最高的金属元素,X为Al;M中含有碳、氮、W、Z四种元素,结合图中氢键结构可知W为H,Z为O;化合物W2Z能与Y2反应产生Z2,可知Y为F。氢键不属于化学键,A项错误。非金属性F大于O,则稳定性:W2ZY>X,D项正确。
[练4](1)化合物CH3NH2、CH3CH3常温下均为气体,沸点较高的是 。
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3 (填“>”或“<”)PH3,原因是 。
答案 (1)CH3NH2
(2)> 原子半径NP,NH3更易结合水电离的H+
解析 (1)CH3NH2分子中存在N—H,所以分子间存在氢键,沸点较高。
(2)原子半径NP,NH3更易结合水电离的H+,所以NH3水溶液的碱性更强。
[练5] 配位化学创始人维尔纳发现,取CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)四种化合物各1 mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3 mol、2 mol、1 mol和1 mol。
(1)请根据实验事实用配合物的形式写出它们的化学式。
CoCl3·6NH3___________,CoCl3·5NH3___________,
CoCl3·4NH3(绿色和紫色)___________。
(2)后两种物质组成相同而颜色不同的原因是 ___________。
(3)上述配合物中,中心离子的配位数都是___________。
解析:由题意知,四种配合物中的自由Cl-分别为3、2、1、1,则它们的化学式分别为[Co(NH3)6]Cl3、[Co(NH3)5Cl]Cl2、[Co(NH3)4Cl2]Cl。最后两种应互为同分异构体。
答案:
(1)[Co(NH3)6]Cl3 [Co(NH3)5Cl]Cl2 [Co(NH3)4Cl2]Cl
(2)它们互为同分异构体
(3)6
高中
化学
二轮精准复习45讲
微粒间相互作用与物质性质
第16讲
2023
考向1 化学键类型
真题示例1
(2020山东卷)B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的是( )
A.其熔点主要取决于所含化学键的键能 B.形成大π键的电子全部由N提供
C.分子中B和N的杂化方式相同 D.分子中所有原子共平面
A
解析 由题意知,无机苯与苯结构相似,应属于分子晶体,其熔点取决于范德华力,A项错误;分子中所有原子共平面,D项正确;根据价键原理和题干信息,无机苯的结构式为 ,该分子属于平面形分子,分子中N原子和B原子都属于sp2杂化,N形
成4个价键,故大π键的电子全部由N原子提供。
(2020山东卷节选)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 mol该配合物中通过螯合作用形成的配位键有 mol,该螯合物中N的杂化方式有 种。
真题示例2
6 1
解析 由题意可知,只有成环的配位键才能起到螯合作用,再结合题给结构可知 N中的2个O原子和C、N杂环上的4个N原子通过螯合作用与Cd2+形成配位键,故1 mol该配合物中通过螯合作用形成6 mol配位键; N中N原子的价层电子对数为3+0=3, N
中N原子的价层电子对数为2+1=3,C、N杂环上的4个N原子的价层电子对数为3+0=3,故该配合物中N原子均采取sp2杂化。
1.离子键、共价键及金属键的比较
化学键 类型 离子键 共价键(包括配位键) 金属键
非极性键 极性键
定义 阴、阳离子通过静电作用所形成的化学键 原子间通过共用电子对(电子云重叠)而形成的化学键 金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子共用,从而把所有金属原子维系在一起
成键粒子 阴、阳离子 原子 金属阳离子和自由电子
知识梳理———————夯实基础 强化要点
化学键类型 离子键 共价键(包括配位键) 金属键
非极性键 极性键
形成 条件 活泼金属元素与活泼非金属元素经电子得失,形成离子键 通常为同种元素原子之间成键 不同种元素原子之间成键 金属阳离子和自由电子间成键
形成的 物质 离子化合物 非金属单质;某些共价化合物或离子化合物 共价化合物或离子化合物 金属晶体
微点拨(1)离子键和金属键均含金属阳离子。
(2)离子化合物中的复杂阳离子和阴离子内含共价键。
2.化学键与物质类别的关系
方法技巧
(1)σ键与π键的判断方法
3.判断共价键的方法
④共价键强度,σ键强度较大,较稳定;π键活泼,比较容易断裂。
注意:N≡N 中π键较稳定。
(2)极性键与非极性键的判断,看形成共价键的两原子,不同种元素的原子之间形成的是极性共价键,同种元素的原子之间形成的是非极性共价键。
(3) 配位键:形成配位键的条件是成键原子一方(A)能够提供孤电子对,另一方(B)具有能够接受孤电子对的空轨道,可表示为A→B。
配合物的组成特点
示,下列说法正确的是(
示,下列说法正确的是(
[练1]在下列物质中:①HCl、②N2、③NH3、④Na2O2、⑤H2O2、
⑥NH4Cl、⑦NaOH、⑧Ar、⑨CO2、⑩C2H4
(1)只存在非极性键的分子是___________;既存在非极性键又存在极性键的分子是___________;只存在极性键的分子是___________。
(2)只存在单键的分子是______,存在三键的分子是_____,只存在双键的分子是___________,既存在单键又存在双键的分子是___________。
(3)只存在σ键的分子是___________,既存在σ键又存在π键的分子是___________。
(4)不存在化学键的是___________。
(5)既存在离子键又存在极性键的是___________;既存在离子键又存在非极性键的是___________。
②
⑤⑩
①③⑨
①③⑤ ②
⑨ ⑩
①③⑤ ②⑨⑩
⑧
⑥⑦ ④
[练后归纳] 判断离子化合物和共价化合物的3种方法
[练2]结合事实判断CO和N2相对活泼的是___________,试用下表中的
键能数据解释其相对活泼的原因:___________。
CO C—O C===O C≡O
键能(kJ·mol-1) 357.7 798.9 1071.9
N2 N—N N===N N≡N
键能(kJ·mol-1) 154.8 418.4 941.7
CO
断开CO分子的第一个化学键所需要的能量(273.0 kJ·mol-1)比断开N2分子的第一个化学键所需要的能量(523.3 kJ·mol-1)小
解析:由断开CO分子的第一个化学键所需要的能量[1071.9-798.9=273.0 (kJ·mol-1)]比断开N2分子的第一个化学键所需要的能量[941.7-418.4=523.3(kJ·mol-1)]小,可知CO相对更活泼。
共价键 H—H F—F H—F H—Cl H—I
键能E(kJ·mol-1) 436 157 568 432 299
【练3】已知各共价键的键能如表所示,下列说法正确的是( )
A.稳定性:H—I>H—Cl>H—F
B.表中看出F2能量最低
C.432 kJ·mol-1>E(H—Br)>299 kJ·mol-1
D.H2(g)+F2(g)===2HF(g) ΔH=+25 kJ·mol-1
解析:键能越大,共价键越稳定,根据题表中数据,H—F最稳定,A 错误;键能越大,形成的分子越稳定,能量越低。根据数据,H—F 最稳定,HF 能量最低,F—F 最不稳定,F2能量最高,B 错误;同主族从上往下半径逐渐增大,即 Br 的半径介于 Cl 和 I 之间,因此,H—Br 的键能介于 H—Cl 和 H—I之间,C 正确;根据ΔH=反应物的键能总和-生成物的键能总和=(436+157-2×568) kJ·mol-1=-543 kJ·mol-1,D错误。
C
[练4](1)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4中含有 mol配位键。
(2)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”(或大π键)。大π键可用 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为 。
①下列粒子中存在“离域Π键”的是 。
A.CH2=CH—CH=CH2 B.CCl4 C.H2O D.SO2
②NaN3中阴离子 与CO2均为直线形结构, 中的2个大π键可表示为 。
2
AD
(3)二氧化钛与COCl2(光气)、SOCl2(二氯亚砜)等氯化试剂反应可用于制取四氯化钛。
①COCl2(光气)的空间结构为 ,COCl2中σ键和π键的数目比为 。
②SOCl2(二氯亚砜)是 (填“极性”或“非极性”)分子。
平面三角形 3∶1
极性
解析:①[TiCl4(H2NCH2CH2NH2)]中,Ti与H2NCH2CH2NH2形成2个配位键,Ti与Cl形成4个配位键,从而得出配位键的数目为6。
②1个H2NCH2CH2NH2分子含有11个共价单键,从而得出1 mol H2NCH2CH2NH2中含 11 mol σ键。
(4)TiCl4可以与胺形成配合物,如[TiCl4(CH3NH2)2]、[TiCl4(H2NCH2CH2NH2)]等。
①[TiCl4(H2NCH2CH2NH2)]中Ti的配位数是 。
②1 mol H2NCH2CH2NH2中含有的σ键的物质的量为 。
6
11 mol
考向2 化学键、分子间作用力对物质性质的影响
真题示例1
(2020山东卷)下列关于C、Si及其化合物结构与性质的论述错误的是( )
A.键能C—C>Si—Si、C—H>Si—H,因此C2H6稳定性大于Si2H6
B.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度
C.SiH4中Si的化合价为+4价,CH4中C的化合价为-4价,因此SiH4还原性小于CH4
D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成p-p π键
C
解析 A项,键能C—C>Si—Si、C—H>Si—H,则C2H6的稳定性>Si2H6;B项,金刚石与SiC均属于共价晶体,具有很高的硬度;C项,C与Si在同一主族,非金属性C>Si,故CH4的还原性弱于SiH4,C项错误;D项,由于Si的原子半径较大,p轨道重叠程度小,所以Si原子间难以形成p-p π键。
(2020海南卷)下列有关事实的解释正确的是( )
选项 事实 解释
A 某些金属盐灼烧呈现不同焰色 电子从低能轨道跃迁至高能轨道时吸收光波长不同
B CH4与NH3分子的空间结构不同 两者中心原子杂化轨道类型不同
C HF的热稳定性比HCl强 H—F比H—Cl的键能大
D SiO2的熔点比干冰高 SiO2分子间的范德华力大
真题示例2
C
解析
A项,某些金属盐灼烧呈现不同焰色是因为电子从高能轨道跃迁到低能轨道时释放不同的光,错误;B项,CH4和NH3的中心原子都是sp3杂化,甲烷分子中C上无孤电子对,而NH3中N上有一个孤电子对,错误;C项,H—F的键长比H—Cl的短,H—F的键能大,HF的热稳定性强,正确;D项,SiO2是共价晶体,原子间形成共价键三维骨架结构,而干冰是分子晶体,通过分子间作用力结合,错误。
1.三种作用力及对物质性质的影响
作用力类型 范德华力 氢键 共价键
作用粒子 分子 H与N、O、F 原子
强度比较 共价键>氢键>范德华力
影响因素 组成和结构相似的物质,相对分子质量越大,范德华力越大 形成氢键的元素的电负性 原子半径
对性质的影响 影响物质的熔点、沸点、溶解度等物理性质 分子间氢键使物质的熔点、沸点升高,使溶解度增大 键能越大,物质的稳定性越强
知识梳理———————夯实基础 强化要点
归纳总结
[练1](1)(2020海南卷节选)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有 种键能数据。CH3OH可以与水以任意比例互溶的原因是 。
解析 (1)CH3OH中存在C—H、C—O、O—H,故CH3OH键参数中有3种键能数据;水与甲醇均具有羟基,彼此可以形成氢键,根据“相似相溶”规律,甲醇可与水以任意比例混溶。
答案 3 极性相近,形成分子间氢键
水之间形成氢键,而氯乙烷与水之间不能形成分子间氢键
[练1] (2)(2020山东卷节选)NH3、PH3、AsH3的沸点由高到低的顺序为 (填化学式,下同),还原性由强到弱的顺序为 ,键角由大到小的顺序为 。
解析 NH3、PH3、AsH3的分子组成相似,因NH3分子间存在氢键,AsH3分子间的范德华力大于PH3分子间的范德华力,所以沸点由高到低的顺序是NH3、AsH3、PH3。
非金属性N>P>As,故氢化物的还原性AsH3>PH3>NH3。
NH3、PH3、AsH3都是三角锥形分子,原子半径N
答案 NH3、AsH3、PH3 AsH3、PH3、NH3 NH3、PH3、AsH3
[练1 ](3)(2020浙江卷节选)①CaCN2是离子化合物,各原子均满足8电子稳定结构,CaCN2的电子式是 。
②常温下,在水中的溶解度乙醇大于氯乙烷,原因是 。
答案
②乙醇与水之间形成氢键,而氯乙烷与水之间不能形成分子间氢键
解析 ①CaCN2是离子化合物,则阳离子为Ca2+、阴离子为 ;Ca原子最外层有2个电子,易失去最外层的2个电子达到8电子的稳定结构;N原子最外层有5个电子,易得到3个电子或形成3对共用电子对达到8电子的稳定结构;C原子最外层有4个电子,通常形成4对共用电子对达到8电子的稳定结构;则每个N原子分别得到Ca失去的1个电子、与C原子形成两对共用电子对,Ca、C、N都达到8电子的稳定结构,CaCN2的电子式为
②乙醇和氯乙烷都属于极性分子,但乙醇与水分子之间形成氢键,而氯乙烷与水分子间不能形成氢键,故常温下在水中的溶解度乙醇大于氯乙烷。
[练2]正氰酸(H—O—C≡N)与异氰酸(H—N=C=O)、雷酸(H—O—N≡C)互为同分异构体,均可以与氨水形成相应铵盐。下列说法错误的是( )
A.三种酸的分子均能形成分子间氢键
B.正氰酸和雷酸的分子中,氧原子的杂化方式不同
C.三种酸的组成元素中,碳的第一电离能最小
D.三种酸的铵盐中,只有雷酸铵的阴、阳离子均含有配位键
B
解析 三种酸中都含有H—N或H—O,则均可形成分子间氢键,A项正确。正氰酸、雷酸中的O都是只形成单键,均采取sp3杂化,B项错误。电离能大小:N>O>C,C与H相比,H原子半径较小且核外只有1个电子,原子核对该电子的吸引作用强,难以失去,则第一电离能H>C,则碳的第一电离能最小,C项正确。铵根离子中有一个配位键,雷酸中N—O之间还有配位键,而其他酸根中的所有原子刚好满足8电子结构,不存在配位键,D项正确。
[练3]M分子的部分结构如图所示(…表示氢键)。W、X、Y、Z是短周期主族元素,M中含有碳、氮、W、Z四种元素,化合物W2Z能与Y2反应产生Z2,X元素是地壳中含量最高的金属元素。下列说法正确的是( )
A.氢键是一种特殊的化学键
B.稳定性:W2Z>WY
C.X的氧化物的水化物是强碱
D.简单离子半径:Z>Y>X
M
D
解析 W、X、Y、Z是短周期主族元素,X元素是地壳中含量最高的金属元素,X为Al;M中含有碳、氮、W、Z四种元素,结合图中氢键结构可知W为H,Z为O;化合物W2Z能与Y2反应产生Z2,可知Y为F。氢键不属于化学键,A项错误。非金属性F大于O,则稳定性:W2Z
[练4](1)化合物CH3NH2、CH3CH3常温下均为气体,沸点较高的是 。
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3 (填“>”或“<”)PH3,原因是 。
答案 (1)CH3NH2
(2)> 原子半径N
解析 (1)CH3NH2分子中存在N—H,所以分子间存在氢键,沸点较高。
(2)原子半径N
[练5] 配位化学创始人维尔纳发现,取CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)四种化合物各1 mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3 mol、2 mol、1 mol和1 mol。
(1)请根据实验事实用配合物的形式写出它们的化学式。
CoCl3·6NH3___________,CoCl3·5NH3___________,
CoCl3·4NH3(绿色和紫色)___________。
(2)后两种物质组成相同而颜色不同的原因是 ___________。
(3)上述配合物中,中心离子的配位数都是___________。
解析:由题意知,四种配合物中的自由Cl-分别为3、2、1、1,则它们的化学式分别为[Co(NH3)6]Cl3、[Co(NH3)5Cl]Cl2、[Co(NH3)4Cl2]Cl。最后两种应互为同分异构体。
答案:
(1)[Co(NH3)6]Cl3 [Co(NH3)5Cl]Cl2 [Co(NH3)4Cl2]Cl
(2)它们互为同分异构体
(3)6
同课章节目录
