第19讲+反应热的计算与比较(32张ppt)(精讲课件)-2023届高考二轮精准复习45讲(全国通用)
文档属性
| 名称 | 第19讲+反应热的计算与比较(32张ppt)(精讲课件)-2023届高考二轮精准复习45讲(全国通用) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-31 16:43:06 | ||
图片预览










文档简介
(共32张PPT)
高中
化学
二轮精准复习45讲
反应热的计算与比较
2023
第19讲
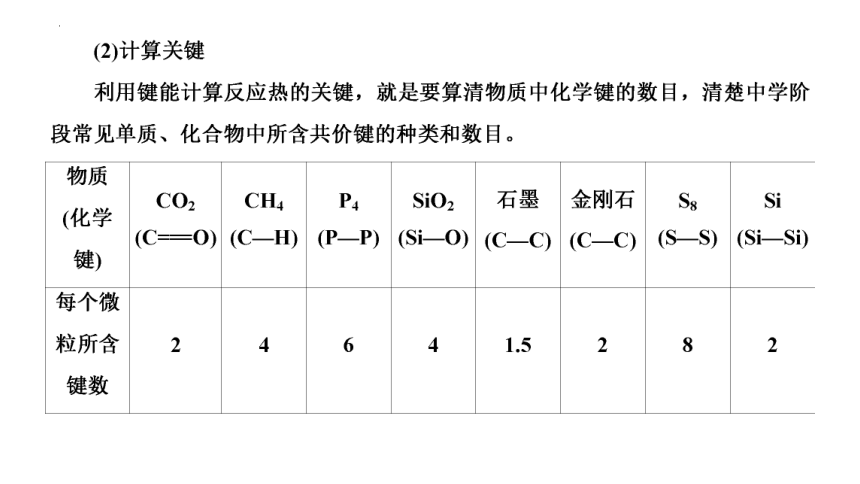
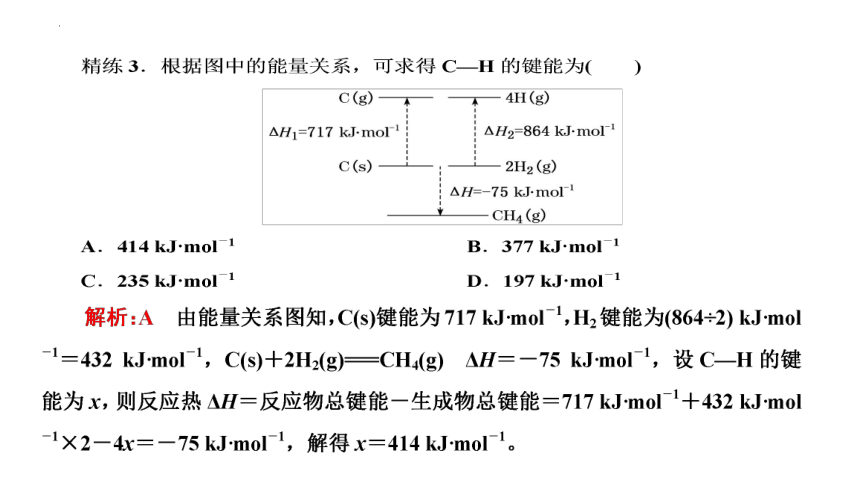
反应热的计算及比较是高考命题的热点和重点,在选择题中结合能量—反应过程图像考查反应热与活化能的关系、反应热的比较等;在非选择题中侧重考查利用盖斯定律计算反应热,或书写热化学方程式,另外还考查根据键能计算反应热等。此类试题大多以最新科研成果、化工生产中反应机理等为命题情境,命题形式和命题角度灵活多变,体现《中国高考评价体系》对知识获取能力、思维认知能力的要求,考生要能够客观全面地获取相关信息,能够从情境中提取有效信息;能够准确概括和描述学科所涉及基本现象的特征及其相互关系,并从中发现问题;能够灵活地、创造性地运用不同方法,发散地、逆向地解决问题能够通过敏锐的洞察能力,发现复杂、新颖情境中的关键事实特征和有价值的新问题;能够将所学知识迁移到新情境,解决新问题,得出新结论。
考情分析
题型一 利用键能计算ΔH
考向一 反应热ΔH的计算
甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:
由此计算ΔH1= kJ· mol-1;已知ΔH2=-58 kJ· mol-1,则ΔH3= kJ· mol-1。
典题示例1
答案:-99 +41
物质 CO2(g) H2(g) CH2 CH2(g) H2O(g)
能量/(kJ·mol-1) -394 0 52 -242
化学键 C=== O H—H C=== C H—C H—O
键能/(kJ·mol-1) 803 436 615 a 463
答题模板 根据盖斯定律计算ΔH的步骤和方法:
(1)计算步骤。
题型二 利用盖斯定律计算ΔH
(2)计算方法。
要特别注意三个关键:
(1)参照新的热化学方程式(目标热化学方程式),结合原热化学方程式(一般为2~3个)进行合理“变形”,如热化学方程式颠倒、乘或除以某一个数,然后将它们相加、减,得到目标热化学方程式,可得出目标热化学方程式的ΔH与原热化学方程式之间ΔH的换算关系。
(2)当热化学方程式乘、除以某一个数时,ΔH也应相应地乘、除以某一个数;方程式进行加减运算时,ΔH也同样要进行加减运算,且要带“+”“-”符号。
(3)将一个热化学方程式颠倒书写时,ΔH的符号也随之改变,但数值不变。
[典例1]
+53.1
物质 C2H6(g) C2H4(g) H2(g)
燃烧热ΔH/(kJ·mol-1) -1 560 -1 411 -286
ΔH= kJ·mol-1。
+137
[典例2](2021广东卷改编)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①根据盖斯定律,反应a的ΔH1= (写出一个代数式即可)。
②一定条件下,CH4分解形成碳的反应历程如图所示。该过程分 步进行,其中,第 步的正反应活化能最大。
ΔH2+ΔH3-ΔH5(或ΔH3-ΔH4)
4
4
解析 (2)①根据题目所给出的化学方程式关系可知,a=b+c-e=c-d,根据盖斯定律则有ΔH1=ΔH2+ΔH3-ΔH5=ΔH3-ΔH4。
②由图可知,反应过程中能量变化出现了4个峰,即经历了4步反应;且从左往右看4次活化能吸收中,第4次对应的峰最高,对应的正反应活化能最大。
精练1.(2020·全国卷Ⅰ)钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为____________________________
解析:
据题图知,V2O4(s)+SO3(g)===V2O5(s)+SO2(g) ΔH2=-24 kJ·mol-1①,V2O4(s)+2SO3(g)===2VOSO4(s) ΔH1=-399 kJ·mol-1②。根据盖斯定律,由②-①×2得2V2O5(s)+2SO2(g)===2VOSO4(s)+V2O4(s) ΔH=(-399+48)kJ·mol-1=-351 kJ·mol-1。
2V2O5(s)+2SO2(g)===2VOSO4(s)+V2O4(s) ΔH=-351 kJ·mol-1
精练2.已知:4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH1=-a kJ/mol
4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH2=-b kJ/mol
H2O(l)=H2O(g) ΔH3=+c kJ/mol
则反应4NH3(g)+3O2(g)===2N2(g)+6H2O(l)的ΔH=_______ kJ/mol
解析:①4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH1=-a kJ/mol
②4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH2=-b kJ/mol
③H2O(l)=H2O(g)ΔH3=+c kJ/mol
根据盖斯定律,将(①×2+②×3-③×30)×1/5,
整理可得4NH3(g)+3O2(g)===2N2(g)+6H2O(l) ΔH=-(2a+3b+30c)/5 kJ/mol。
答案:-(2a+3b+30c)/5
精练3.(2019·北京高考节选)已知反应器中还存在如下反应:
ⅰ.CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH1
ⅱ.CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2
ⅲ.CH4(g)===C(s)+2H2(g) ΔH3
……
ⅲ为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用____________________________反应的ΔH。
解析:根据盖斯定律,ⅰ式+ⅱ式可得:CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH1+ΔH2,则(ⅰ式+ⅱ式)-ⅲ式可得:C(s)+2H2O(g)===CO2(g)+2H2(g) ΔH;ⅰ式-ⅱ式可得:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH1-ΔH2,则(ⅰ式-ⅱ式)-ⅲ式可得:C(s)+CO2(g)===2CO(g) ΔH。因此,要求反应ⅲ式的ΔH3,还必须利用反应C(s)+2H2O(g)===CO2(g)+2H2(g)或C(s)+CO2(g)===2CO(g)的ΔH。
C(s)+2H2O(g)===CO2(g)+2H2(g)或C(s)+CO2(g)===2CO(g)
精练4.回答下列问题:
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)===HNO3(aq)+HNO2(aq) ΔH=-116.1 kJ·mol-1
3HNO2(aq)===HNO3(aq)+2NO(g)+H2O(l) ΔH=+75.9 kJ·mol-1
反应3NO2(g)+H2O(l)===2HNO3(aq)+NO(g)的
ΔH=________ kJ·mol-1。
对不同的反应热(ΔH)进行大小比较,是高考考查的又一种形式。对于可求得准确数值的反应热(ΔH),直接比较反应热(ΔH)即可得出大小关系,而对于无法求得准确数值的反应热:
①可通过放热反应和吸热反应来判定,吸热反应的反应热(ΔH>0)一定大于放热反应的反应热(ΔH<0);
②可利用盖斯定律来判定,如由盖斯定律可得出ΔH1-ΔH2=ΔH3,又因ΔH3>0可求出ΔH1>ΔH2;
③同一反应的反应物和生成物的状态不同,反应热也不同,比较时要考虑物质的状态变化时的吸热或放热情况,特别说明的是放热反应的反应热(ΔH)为负数,放热越多,ΔH的值反而越小,如H2(g)与O2(g)反应生成液态水(还可生成气态水)时放热较多,反应热(ΔH)小。
考向二 反应热ΔH的大小比较
(1)直接比较法
(3)对于可逆反应,因反应不能进行完全,实际反应过程中放出或吸收的热量要小于相应热化学方程式中的反应热数值。例如:2SO2(g)+O2(g)??2SO3(g) ΔH=-197 kJ·mol-1,表示2 mol SO2(g)和1 mol O2(g)完全反应生成2 mol SO3(g)时,放出的热量为197 kJ,实际上向密闭容器中通入2 mol SO2(g)和1 mol O2(g),反应达到平衡后,放出的热量要小于197 kJ。
ΔH1+ΔH3=ΔH2,
ΔH1<0,ΔH2<0,ΔH3<0,
所以ΔH2<ΔH1。
ΔH2+ΔH3=ΔH1,
ΔH1<0,ΔH2<0,ΔH3<0,
所以ΔH1<ΔH2。
[典例1]已知:C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是 ( )
A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+2ΔH5
解析:物质的燃烧反应均为放热反应,则ΔH1、ΔH3、ΔH4均小于0,故A、B项错误;将题给的5个热化学方程式依次编号为①、②、③、④、⑤,根据盖斯定律,①=②+③,故ΔH1=ΔH2+ΔH3,C项正确;根据盖斯定律,3×③=④+2×⑤,故3ΔH3=ΔH4+2ΔH5,D项错误。
C
[典例2](3)(2021全国甲节选)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为CO2(g)+3H2(g) === CH3OH(g)+H2O(g)
该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g) === CO(g)+H2O(g) ΔH1=+41 kJ·mol-1
②CO(g)+2H2(g) === CH3OH(g)
ΔH2=-90 kJ·mol-1
总反应的ΔH= kJ·mol-1;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是 (填字母),判断的理由是 。
-49
A
ΔH1为正值,ΔH2和ΔH为负值,反应①的活化能大于反应②的
解析:
二氧化碳加氢制甲醇的总反应可表示为CO2(g)+3H2(g) === CH3OH(g)+H2O(g),根据盖斯定律可知,①+②可得二氧化碳加氢制甲醇的总反应:CO2(g)+3H2(g) === CH3OH(g)+H2O(g) ΔH=(+41 kJ·mol-1)+(-90 kJ·mol-1)=-49 kJ·mol-1;该反应总反应为放热反应,因此生成物总能量低于反应物总能量,反应①为慢反应,因此反应①的活化能高于反应②,同时反应①的反应物总能量低于生成物总能量,反应②的反应物总能量高于生成物总能量,因此示意图中能体现反应能量变化的是A项。
精练1.根据Ca(OH)2/CaO 体系的能量循环图:
判断下列说法正确的是( )
A.ΔH5>0
B.ΔH1+ΔH2=0
C.ΔH3=ΔH4+ΔH5
D.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0
解析: 水蒸气变成液态水会放出热量,则ΔH5<0,故A错误;氢氧化钙分解生成氧化钙固体和水蒸气与液态水和氧化钙反应生成氢氧化钙不是可逆过程,因此ΔH1+ΔH2≠0,故B错误;由图可知,ΔH3>0,ΔH4<0,ΔH5<0,故ΔH3≠ΔH4+ΔH5,故C错误;根据盖斯定律,ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0,故D正确。
D
精练2.已知:①2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) ΔH1
②2CO(g)+O2(g)===2CO2(g) ΔH2
③2H2(g)+O2(g)===2H2O(l) ΔH3
④2H2(g)+O2(g)===2H2O(g) ΔH4
⑤CO(g)+2H2(g)===CH3OH(g) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1>0,ΔH2<0
B.ΔH3>ΔH4
C.ΔH1=ΔH2+2ΔH3-ΔH5
D.2ΔH5+ΔH1<0
解析:A项,甲醇燃烧是放热反应,ΔH1<0,错误;B项,H2O(g)===H2O(l),放出热量,反应③放出的热量多,ΔH3小,错误;C项,根据盖斯定律,ΔH1=ΔH2+2ΔH3-2ΔH5,错误;D项,根据盖斯定律可得2CO(g)+4H2(g)+3O2(g)===2CO2(g)+4H2O(l) ΔH=2ΔH5+ΔH1,相当于CO、H2的燃烧,均为放热反应,正确。
D
精练3.
已知:①2H2(g)+O2(g)===2H2O(g) ΔH1
②3H2(g)+Fe2O3(s)===2Fe(s)+3H2O(g) ΔH2
③2Fe(s)+3/2O2(g)===Fe2O3(s) ΔH3
④2Al(s)+3/2O2(g)===Al2O3(s) ΔH4
⑤2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1<0,ΔH3>0
B.ΔH5<0,ΔH4<ΔH3
C.ΔH1=ΔH2+ΔH3
D.ΔH3=ΔH4-ΔH5
解析:BD 铁的氧化反应为放热反应,ΔH3<0,A项错误;铝热反应为放热反应,ΔH5<0,将④-③得2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5=ΔH4-ΔH3<0,故ΔH4<ΔH3,B项正确;根据盖斯定律,将(②+③)×2/3得2H2(g)+O2(g)===2H2O(g) ΔH1=(ΔH2+ΔH3)/3,C项错误;将④-③得2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5=ΔH4-ΔH3,即ΔH3=ΔH4-ΔH5,D项正确。
高中
化学
二轮精准复习45讲
反应热的计算与比较
2023
第19讲
反应热的计算及比较是高考命题的热点和重点,在选择题中结合能量—反应过程图像考查反应热与活化能的关系、反应热的比较等;在非选择题中侧重考查利用盖斯定律计算反应热,或书写热化学方程式,另外还考查根据键能计算反应热等。此类试题大多以最新科研成果、化工生产中反应机理等为命题情境,命题形式和命题角度灵活多变,体现《中国高考评价体系》对知识获取能力、思维认知能力的要求,考生要能够客观全面地获取相关信息,能够从情境中提取有效信息;能够准确概括和描述学科所涉及基本现象的特征及其相互关系,并从中发现问题;能够灵活地、创造性地运用不同方法,发散地、逆向地解决问题能够通过敏锐的洞察能力,发现复杂、新颖情境中的关键事实特征和有价值的新问题;能够将所学知识迁移到新情境,解决新问题,得出新结论。
考情分析
题型一 利用键能计算ΔH
考向一 反应热ΔH的计算
甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:
由此计算ΔH1= kJ· mol-1;已知ΔH2=-58 kJ· mol-1,则ΔH3= kJ· mol-1。
典题示例1
答案:-99 +41
物质 CO2(g) H2(g) CH2 CH2(g) H2O(g)
能量/(kJ·mol-1) -394 0 52 -242
化学键 C=== O H—H C=== C H—C H—O
键能/(kJ·mol-1) 803 436 615 a 463
答题模板 根据盖斯定律计算ΔH的步骤和方法:
(1)计算步骤。
题型二 利用盖斯定律计算ΔH
(2)计算方法。
要特别注意三个关键:
(1)参照新的热化学方程式(目标热化学方程式),结合原热化学方程式(一般为2~3个)进行合理“变形”,如热化学方程式颠倒、乘或除以某一个数,然后将它们相加、减,得到目标热化学方程式,可得出目标热化学方程式的ΔH与原热化学方程式之间ΔH的换算关系。
(2)当热化学方程式乘、除以某一个数时,ΔH也应相应地乘、除以某一个数;方程式进行加减运算时,ΔH也同样要进行加减运算,且要带“+”“-”符号。
(3)将一个热化学方程式颠倒书写时,ΔH的符号也随之改变,但数值不变。
[典例1]
+53.1
物质 C2H6(g) C2H4(g) H2(g)
燃烧热ΔH/(kJ·mol-1) -1 560 -1 411 -286
ΔH= kJ·mol-1。
+137
[典例2](2021广东卷改编)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①根据盖斯定律,反应a的ΔH1= (写出一个代数式即可)。
②一定条件下,CH4分解形成碳的反应历程如图所示。该过程分 步进行,其中,第 步的正反应活化能最大。
ΔH2+ΔH3-ΔH5(或ΔH3-ΔH4)
4
4
解析 (2)①根据题目所给出的化学方程式关系可知,a=b+c-e=c-d,根据盖斯定律则有ΔH1=ΔH2+ΔH3-ΔH5=ΔH3-ΔH4。
②由图可知,反应过程中能量变化出现了4个峰,即经历了4步反应;且从左往右看4次活化能吸收中,第4次对应的峰最高,对应的正反应活化能最大。
精练1.(2020·全国卷Ⅰ)钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为____________________________
解析:
据题图知,V2O4(s)+SO3(g)===V2O5(s)+SO2(g) ΔH2=-24 kJ·mol-1①,V2O4(s)+2SO3(g)===2VOSO4(s) ΔH1=-399 kJ·mol-1②。根据盖斯定律,由②-①×2得2V2O5(s)+2SO2(g)===2VOSO4(s)+V2O4(s) ΔH=(-399+48)kJ·mol-1=-351 kJ·mol-1。
2V2O5(s)+2SO2(g)===2VOSO4(s)+V2O4(s) ΔH=-351 kJ·mol-1
精练2.已知:4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH1=-a kJ/mol
4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH2=-b kJ/mol
H2O(l)=H2O(g) ΔH3=+c kJ/mol
则反应4NH3(g)+3O2(g)===2N2(g)+6H2O(l)的ΔH=_______ kJ/mol
解析:①4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH1=-a kJ/mol
②4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH2=-b kJ/mol
③H2O(l)=H2O(g)ΔH3=+c kJ/mol
根据盖斯定律,将(①×2+②×3-③×30)×1/5,
整理可得4NH3(g)+3O2(g)===2N2(g)+6H2O(l) ΔH=-(2a+3b+30c)/5 kJ/mol。
答案:-(2a+3b+30c)/5
精练3.(2019·北京高考节选)已知反应器中还存在如下反应:
ⅰ.CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH1
ⅱ.CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2
ⅲ.CH4(g)===C(s)+2H2(g) ΔH3
……
ⅲ为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用____________________________反应的ΔH。
解析:根据盖斯定律,ⅰ式+ⅱ式可得:CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH1+ΔH2,则(ⅰ式+ⅱ式)-ⅲ式可得:C(s)+2H2O(g)===CO2(g)+2H2(g) ΔH;ⅰ式-ⅱ式可得:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH1-ΔH2,则(ⅰ式-ⅱ式)-ⅲ式可得:C(s)+CO2(g)===2CO(g) ΔH。因此,要求反应ⅲ式的ΔH3,还必须利用反应C(s)+2H2O(g)===CO2(g)+2H2(g)或C(s)+CO2(g)===2CO(g)的ΔH。
C(s)+2H2O(g)===CO2(g)+2H2(g)或C(s)+CO2(g)===2CO(g)
精练4.回答下列问题:
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)===HNO3(aq)+HNO2(aq) ΔH=-116.1 kJ·mol-1
3HNO2(aq)===HNO3(aq)+2NO(g)+H2O(l) ΔH=+75.9 kJ·mol-1
反应3NO2(g)+H2O(l)===2HNO3(aq)+NO(g)的
ΔH=________ kJ·mol-1。
对不同的反应热(ΔH)进行大小比较,是高考考查的又一种形式。对于可求得准确数值的反应热(ΔH),直接比较反应热(ΔH)即可得出大小关系,而对于无法求得准确数值的反应热:
①可通过放热反应和吸热反应来判定,吸热反应的反应热(ΔH>0)一定大于放热反应的反应热(ΔH<0);
②可利用盖斯定律来判定,如由盖斯定律可得出ΔH1-ΔH2=ΔH3,又因ΔH3>0可求出ΔH1>ΔH2;
③同一反应的反应物和生成物的状态不同,反应热也不同,比较时要考虑物质的状态变化时的吸热或放热情况,特别说明的是放热反应的反应热(ΔH)为负数,放热越多,ΔH的值反而越小,如H2(g)与O2(g)反应生成液态水(还可生成气态水)时放热较多,反应热(ΔH)小。
考向二 反应热ΔH的大小比较
(1)直接比较法
(3)对于可逆反应,因反应不能进行完全,实际反应过程中放出或吸收的热量要小于相应热化学方程式中的反应热数值。例如:2SO2(g)+O2(g)??2SO3(g) ΔH=-197 kJ·mol-1,表示2 mol SO2(g)和1 mol O2(g)完全反应生成2 mol SO3(g)时,放出的热量为197 kJ,实际上向密闭容器中通入2 mol SO2(g)和1 mol O2(g),反应达到平衡后,放出的热量要小于197 kJ。
ΔH1+ΔH3=ΔH2,
ΔH1<0,ΔH2<0,ΔH3<0,
所以ΔH2<ΔH1。
ΔH2+ΔH3=ΔH1,
ΔH1<0,ΔH2<0,ΔH3<0,
所以ΔH1<ΔH2。
[典例1]已知:C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是 ( )
A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+2ΔH5
解析:物质的燃烧反应均为放热反应,则ΔH1、ΔH3、ΔH4均小于0,故A、B项错误;将题给的5个热化学方程式依次编号为①、②、③、④、⑤,根据盖斯定律,①=②+③,故ΔH1=ΔH2+ΔH3,C项正确;根据盖斯定律,3×③=④+2×⑤,故3ΔH3=ΔH4+2ΔH5,D项错误。
C
[典例2](3)(2021全国甲节选)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为CO2(g)+3H2(g) === CH3OH(g)+H2O(g)
该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g) === CO(g)+H2O(g) ΔH1=+41 kJ·mol-1
②CO(g)+2H2(g) === CH3OH(g)
ΔH2=-90 kJ·mol-1
总反应的ΔH= kJ·mol-1;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是 (填字母),判断的理由是 。
-49
A
ΔH1为正值,ΔH2和ΔH为负值,反应①的活化能大于反应②的
解析:
二氧化碳加氢制甲醇的总反应可表示为CO2(g)+3H2(g) === CH3OH(g)+H2O(g),根据盖斯定律可知,①+②可得二氧化碳加氢制甲醇的总反应:CO2(g)+3H2(g) === CH3OH(g)+H2O(g) ΔH=(+41 kJ·mol-1)+(-90 kJ·mol-1)=-49 kJ·mol-1;该反应总反应为放热反应,因此生成物总能量低于反应物总能量,反应①为慢反应,因此反应①的活化能高于反应②,同时反应①的反应物总能量低于生成物总能量,反应②的反应物总能量高于生成物总能量,因此示意图中能体现反应能量变化的是A项。
精练1.根据Ca(OH)2/CaO 体系的能量循环图:
判断下列说法正确的是( )
A.ΔH5>0
B.ΔH1+ΔH2=0
C.ΔH3=ΔH4+ΔH5
D.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0
解析: 水蒸气变成液态水会放出热量,则ΔH5<0,故A错误;氢氧化钙分解生成氧化钙固体和水蒸气与液态水和氧化钙反应生成氢氧化钙不是可逆过程,因此ΔH1+ΔH2≠0,故B错误;由图可知,ΔH3>0,ΔH4<0,ΔH5<0,故ΔH3≠ΔH4+ΔH5,故C错误;根据盖斯定律,ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0,故D正确。
D
精练2.已知:①2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) ΔH1
②2CO(g)+O2(g)===2CO2(g) ΔH2
③2H2(g)+O2(g)===2H2O(l) ΔH3
④2H2(g)+O2(g)===2H2O(g) ΔH4
⑤CO(g)+2H2(g)===CH3OH(g) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1>0,ΔH2<0
B.ΔH3>ΔH4
C.ΔH1=ΔH2+2ΔH3-ΔH5
D.2ΔH5+ΔH1<0
解析:A项,甲醇燃烧是放热反应,ΔH1<0,错误;B项,H2O(g)===H2O(l),放出热量,反应③放出的热量多,ΔH3小,错误;C项,根据盖斯定律,ΔH1=ΔH2+2ΔH3-2ΔH5,错误;D项,根据盖斯定律可得2CO(g)+4H2(g)+3O2(g)===2CO2(g)+4H2O(l) ΔH=2ΔH5+ΔH1,相当于CO、H2的燃烧,均为放热反应,正确。
D
精练3.
已知:①2H2(g)+O2(g)===2H2O(g) ΔH1
②3H2(g)+Fe2O3(s)===2Fe(s)+3H2O(g) ΔH2
③2Fe(s)+3/2O2(g)===Fe2O3(s) ΔH3
④2Al(s)+3/2O2(g)===Al2O3(s) ΔH4
⑤2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1<0,ΔH3>0
B.ΔH5<0,ΔH4<ΔH3
C.ΔH1=ΔH2+ΔH3
D.ΔH3=ΔH4-ΔH5
解析:BD 铁的氧化反应为放热反应,ΔH3<0,A项错误;铝热反应为放热反应,ΔH5<0,将④-③得2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5=ΔH4-ΔH3<0,故ΔH4<ΔH3,B项正确;根据盖斯定律,将(②+③)×2/3得2H2(g)+O2(g)===2H2O(g) ΔH1=(ΔH2+ΔH3)/3,C项错误;将④-③得2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5=ΔH4-ΔH3,即ΔH3=ΔH4-ΔH5,D项正确。
同课章节目录
