化学人教版(2019)选择性必修2 2.2.2 价层电子对互斥理论(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.2.2 价层电子对互斥理论(共21张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 24.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-31 17:16:08 | ||
图片预览






文档简介
(共21张PPT)
价层电子对互斥理论
TITLE TITLE
选择性必修2 第二章 第二节
01
02
03
目录
根据VSEPR模型 预测分子结构
价层电子对互斥模型
价层电子对数计算
01
第一部分 价层电子对互斥模型
01
三原子分子
02
四原子分子
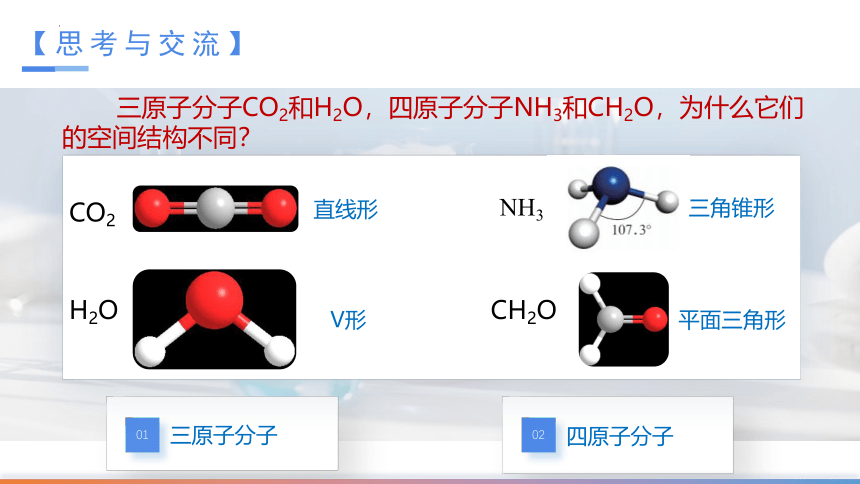
【思考与交流】
三原子分子CO2和H2O,四原子分子NH3和CH2O,为什么它们的空间结构不同?
CO2
H2O
NH3
直线形
V形
三角锥形
CH2O
平面三角形
内容内容内容
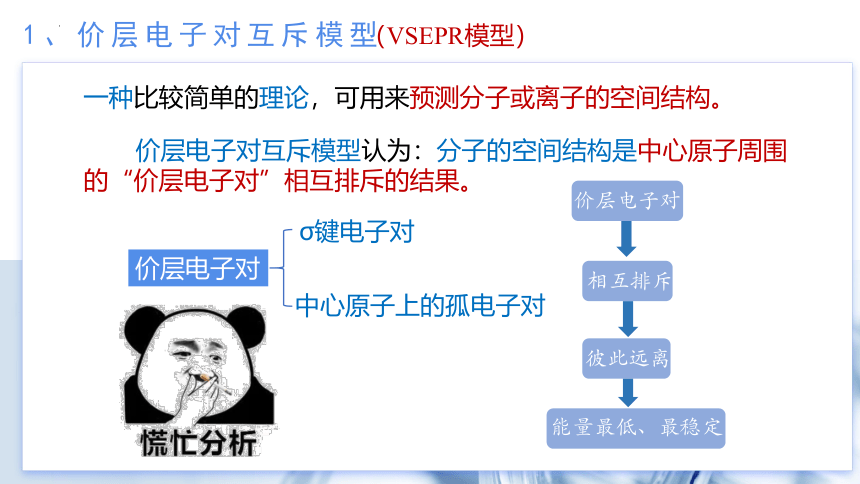
1、价层电子对互斥模型
一种比较简单的理论,可用来预测分子或离子的空间结构。
价层电子对互斥模型认为:分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。
价层电子对
相互排斥
彼此远离
能量最低、最稳定
σ键电子对
中心原子上的孤电子对
价层电子对
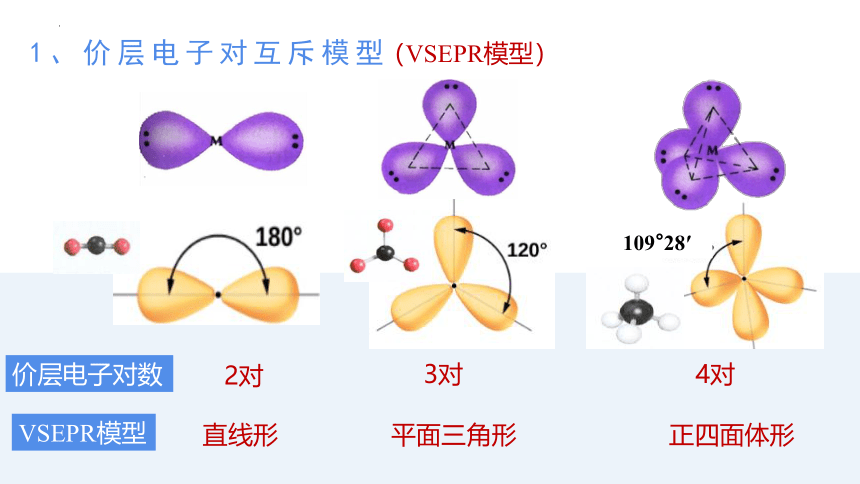
(VSEPR模型)
直线形
平面三角形
正四面体形
109°28′
1、价层电子对互斥模型
(VSEPR模型)
2对
3对
4对
VSEPR模型
价层电子对数
2、价层电子对数的计算
σ键电子对数 +
中心原子上的孤电子对数
价层电子对数=
等于 结合的原子数
1) σ键电子对可从分子式来确定
(ABn型)
A——中心原子,
B——与A结合的原子
n——与A结合的原子数
例如:H2O中O的σ键电子对数是______;
NH3 中的σ键电子对数是________。
2
3
【练一练】
1、CO2中O的σ键电子对数是______;
2、SO3中O的σ键电子对数是______;
3、H3O+中O的σ键电子对数是______;
4、NH4+ 中的σ键电子对数是________。
2
3
3
4
01
第二部分 价层电子对数计算
1、根据电子式确定
中心原子上的
孤电子对数
0对
1对
2对
2、计算公式:
中心原子上的孤电子对数 =
—
2
1
(a – xb)
中心原子的
价电子数
与中心原子
结合的原子数
与中心原子结合的原子
最多能接受的电子数
对主族元素:
a=最外层电子数
8-其价电子数
(除H为1 )
如:O为2、N为3
SO2 :
—
2
1
(a – xb) =
a=6,
x=2,
b=2
—
2
1
(6 – 2×2) =
1
(中心原子为S,价电子为6)
(结合原子为O,数目为2)
(结合原子为O,可接受2个电子)
【练一练】
分子或离子
中心原子
a
x
b
中心原子上的
孤电子对数
—
2
1
(a – xb)
CO2
NH3
SO3
C
4
2
2
(4-2×2)÷2=0
N
5
3
1
(3-3×1)÷2=0
S
6
3
2
(6-3×2)÷2=0
中心原子上的孤电子对数 =
—
2
1
(a – xb)
2、计算公式:
中心原子上的孤电子对数计算
【注意】
阳离子:
阴离子:
a=中心原子的价电子数 -离子的电荷数
a=中心原子的价电子数+离子的电荷数
SO42- :
—
2
1
(a – xb) =
—
2
1
(6+2 – 4×2) =
0
01
第三部分 根据VSEPR模型 预测
分子结构
1、VSEPR模型预测分子空间结构
价层电子对数
含孤电子对VSEPR模型
略去孤电子对数
价层电子对互斥理论
分子或离子的空间结构
计算
找理论模型
略去孤电子对
分子/离子的空间构型
VSEPR模型
无孤电子对时
1、VSEPR模型预测分子空间结构
分子或离子 σ键电子对数 中心原子上的孤电子对数 中心原子上的价层电子对数 VSEPR模型及其名称 分子或离子的
空间结构名称
CO2
BF3
NH4+
0
0+2=2
2
直线形
直线形
0
0+3=3
3
平面
三角形
平面
三角形
0
0+4=4
4
正四面体形
正四面体形
VSEPR模型略去孤电子对后的构型
有孤电子对时
1、VSEPR模型预测分子空间结构
分子/离子的空间构型
分子或离子 σ键电子对数 中心原子上的孤电子对数 中心原子上的价层电子对数 VSEPR模型及其名称 分子或离子的
空间结构名称
CO32-
SO2
0
3+0=3
3
平面
三角形
平面
三角形
1
2+1=3
2
平面
三角形
V形
VSEPR模型略去孤电子对后的构型
有孤电子对时
1、VSEPR模型预测分子空间结构
分子/离子的空间构型
分子或离子 σ键电子对数 中心原子上的孤电子对数 中心原子上的价层电子对数 VSEPR模型及其名称 分子或离子的
空间结构名称
0
4+0=4
4
1
3+1=4
3
H2O
NH3
CH4
正四面体
形
正四面体
形
三角锥形
正四面体
形
2
2+2=4
2
“V”形
正四面体
形
【特殊分子】
分子或离子 σ键电子对数 中心原子上的孤电子对数 中心原子上的价层电子对数 VSEPR模型及其名称 分子或离子的
空间结构名称
HCN
O3
I3 -
4+0=4
2
(4-1×1-1×3)÷2=0
直线形
直线形
O(O)2
2+1=3
2
(6-2×2)÷2=1
平面
三角形
V形
2+2=4
2
(7+1-2×1)÷2=2
I(I2)-
V形
正四面体
形
【练习】
1、下列物质中,分子的空间结构与氨分子相似的是( )
A、CO2 B、H2S
C、PCl3 D、SiCl4
C
THANKS
THANKS
感谢观看
价层电子对互斥理论
TITLE TITLE
选择性必修2 第二章 第二节
01
02
03
目录
根据VSEPR模型 预测分子结构
价层电子对互斥模型
价层电子对数计算
01
第一部分 价层电子对互斥模型
01
三原子分子
02
四原子分子
【思考与交流】
三原子分子CO2和H2O,四原子分子NH3和CH2O,为什么它们的空间结构不同?
CO2
H2O
NH3
直线形
V形
三角锥形
CH2O
平面三角形
内容内容内容
1、价层电子对互斥模型
一种比较简单的理论,可用来预测分子或离子的空间结构。
价层电子对互斥模型认为:分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。
价层电子对
相互排斥
彼此远离
能量最低、最稳定
σ键电子对
中心原子上的孤电子对
价层电子对
(VSEPR模型)
直线形
平面三角形
正四面体形
109°28′
1、价层电子对互斥模型
(VSEPR模型)
2对
3对
4对
VSEPR模型
价层电子对数
2、价层电子对数的计算
σ键电子对数 +
中心原子上的孤电子对数
价层电子对数=
等于 结合的原子数
1) σ键电子对可从分子式来确定
(ABn型)
A——中心原子,
B——与A结合的原子
n——与A结合的原子数
例如:H2O中O的σ键电子对数是______;
NH3 中的σ键电子对数是________。
2
3
【练一练】
1、CO2中O的σ键电子对数是______;
2、SO3中O的σ键电子对数是______;
3、H3O+中O的σ键电子对数是______;
4、NH4+ 中的σ键电子对数是________。
2
3
3
4
01
第二部分 价层电子对数计算
1、根据电子式确定
中心原子上的
孤电子对数
0对
1对
2对
2、计算公式:
中心原子上的孤电子对数 =
—
2
1
(a – xb)
中心原子的
价电子数
与中心原子
结合的原子数
与中心原子结合的原子
最多能接受的电子数
对主族元素:
a=最外层电子数
8-其价电子数
(除H为1 )
如:O为2、N为3
SO2 :
—
2
1
(a – xb) =
a=6,
x=2,
b=2
—
2
1
(6 – 2×2) =
1
(中心原子为S,价电子为6)
(结合原子为O,数目为2)
(结合原子为O,可接受2个电子)
【练一练】
分子或离子
中心原子
a
x
b
中心原子上的
孤电子对数
—
2
1
(a – xb)
CO2
NH3
SO3
C
4
2
2
(4-2×2)÷2=0
N
5
3
1
(3-3×1)÷2=0
S
6
3
2
(6-3×2)÷2=0
中心原子上的孤电子对数 =
—
2
1
(a – xb)
2、计算公式:
中心原子上的孤电子对数计算
【注意】
阳离子:
阴离子:
a=中心原子的价电子数 -离子的电荷数
a=中心原子的价电子数+离子的电荷数
SO42- :
—
2
1
(a – xb) =
—
2
1
(6+2 – 4×2) =
0
01
第三部分 根据VSEPR模型 预测
分子结构
1、VSEPR模型预测分子空间结构
价层电子对数
含孤电子对VSEPR模型
略去孤电子对数
价层电子对互斥理论
分子或离子的空间结构
计算
找理论模型
略去孤电子对
分子/离子的空间构型
VSEPR模型
无孤电子对时
1、VSEPR模型预测分子空间结构
分子或离子 σ键电子对数 中心原子上的孤电子对数 中心原子上的价层电子对数 VSEPR模型及其名称 分子或离子的
空间结构名称
CO2
BF3
NH4+
0
0+2=2
2
直线形
直线形
0
0+3=3
3
平面
三角形
平面
三角形
0
0+4=4
4
正四面体形
正四面体形
VSEPR模型略去孤电子对后的构型
有孤电子对时
1、VSEPR模型预测分子空间结构
分子/离子的空间构型
分子或离子 σ键电子对数 中心原子上的孤电子对数 中心原子上的价层电子对数 VSEPR模型及其名称 分子或离子的
空间结构名称
CO32-
SO2
0
3+0=3
3
平面
三角形
平面
三角形
1
2+1=3
2
平面
三角形
V形
VSEPR模型略去孤电子对后的构型
有孤电子对时
1、VSEPR模型预测分子空间结构
分子/离子的空间构型
分子或离子 σ键电子对数 中心原子上的孤电子对数 中心原子上的价层电子对数 VSEPR模型及其名称 分子或离子的
空间结构名称
0
4+0=4
4
1
3+1=4
3
H2O
NH3
CH4
正四面体
形
正四面体
形
三角锥形
正四面体
形
2
2+2=4
2
“V”形
正四面体
形
【特殊分子】
分子或离子 σ键电子对数 中心原子上的孤电子对数 中心原子上的价层电子对数 VSEPR模型及其名称 分子或离子的
空间结构名称
HCN
O3
I3 -
4+0=4
2
(4-1×1-1×3)÷2=0
直线形
直线形
O(O)2
2+1=3
2
(6-2×2)÷2=1
平面
三角形
V形
2+2=4
2
(7+1-2×1)÷2=2
I(I2)-
V形
正四面体
形
【练习】
1、下列物质中,分子的空间结构与氨分子相似的是( )
A、CO2 B、H2S
C、PCl3 D、SiCl4
C
THANKS
THANKS
感谢观看
