化学人教版(2019)必修第二册5.2.2 氨和铵盐(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.2.2 氨和铵盐(共28张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-31 17:17:59 | ||
图片预览






文档简介
(共28张PPT)
第五章 化工生产中的重要非金属元素
第2节 氮及其化合物
第2课时 氨 铵盐
课程学习目标
掌握铵盐的性质和铵根离子的检验
3
理解喷泉实验的原理
2
了解氨气的性质、用途和实验室制法
1
阅读材料思考:氨气有哪些物理性质?
思考·交流
1、为什么在氨气泄漏时工厂里会寒气逼人?
2、如何吸收弥漫在空气中的大量氨气?
3、被围困在污染区的群众怎样做才能不吸入氨气?
2013年8月31日11时许,上海宝山区丰翔路一冷库发生液氨泄漏事件,造成15人遇难。
泄漏事件发生以后,整个厂区是白茫茫的一片,方圆数百米,空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难。厂区内寒气逼人。
消防中心出动上百名消防队员、十余量消防车,向泄漏点不停洒水以处理灾情。
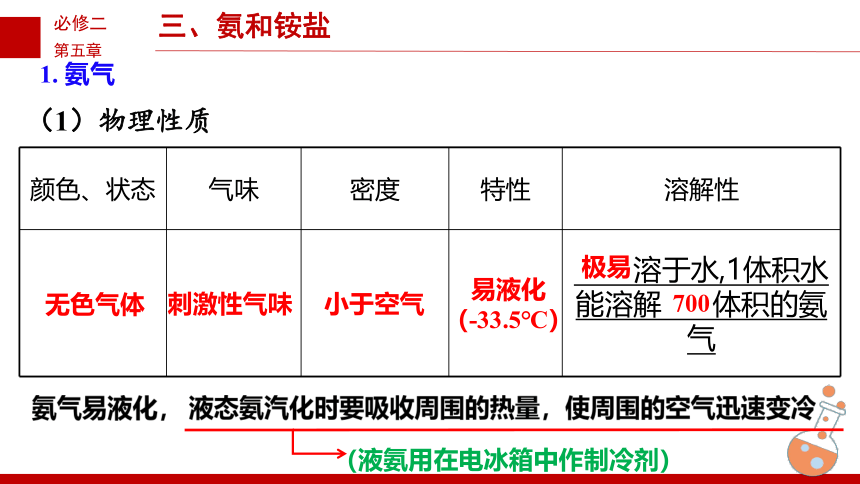
1. 氨气
颜色、状态 气味 密度 特性 溶解性
溶于水,1体积水能溶解 体积的氨气
无色气体
刺激性气味
小于空气
易液化
(-33.5℃)
极易
700
氨气易液化, 液态氨汽化时要吸收周围的热量,使周围的空气迅速变冷
(液氨用在电冰箱中作制冷剂)
三、氨和铵盐
(1)物理性质
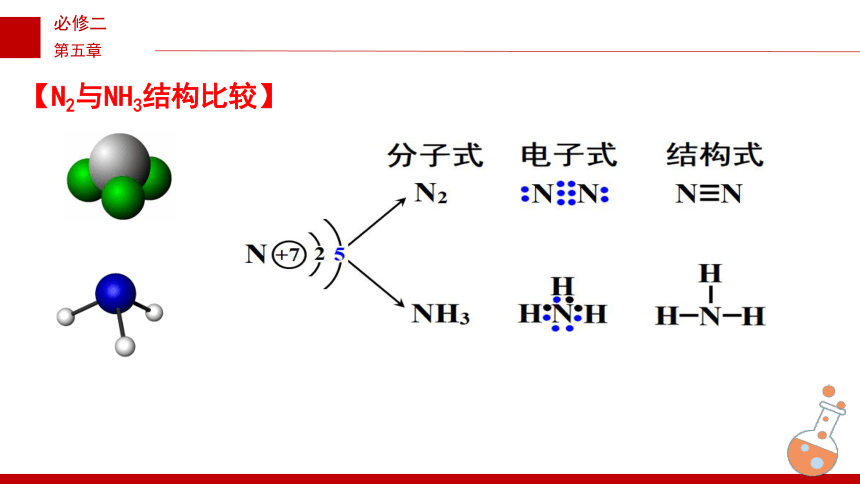
【N2与NH3结构比较】
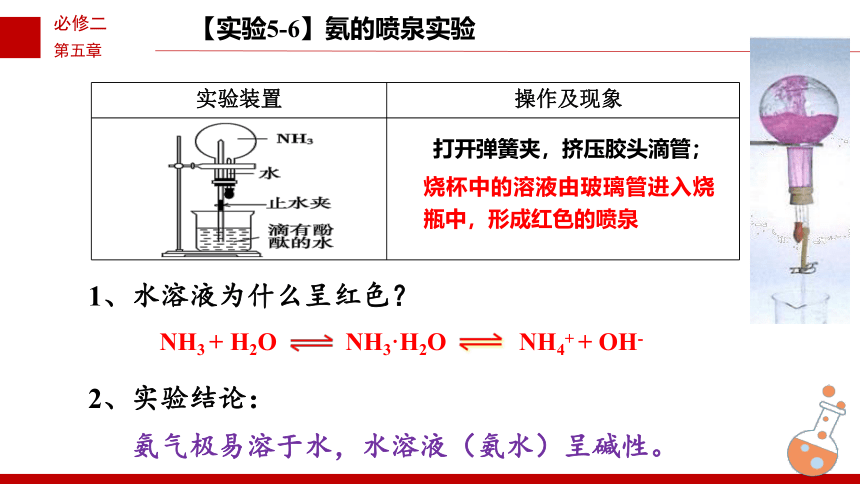
实验装置 操作及现象
【实验5-6】氨的喷泉实验
烧杯中的溶液由玻璃管进入烧瓶中,形成红色的喷泉
打开弹簧夹,挤压胶头滴管;
1、水溶液为什么呈红色?
NH3 + H2O
NH3·H2O
NH4+ + OH-
2、实验结论:
氨气极易溶于水,水溶液(氨水)呈碱性。
1、探究形成喷泉的原因是什么
因氨气迅速溶解在从胶头滴管挤压出的少量水中,使烧瓶内的压强迅速减小,与外界大气形成较大的压强差,在压强差作用下,液体迅速流动,通过带尖嘴的导管喷出来,形成喷泉。
思考讨论
2、若将 NH3 换为 NO2,能否形成喷泉 若能形成,则实验后液体能否充满烧瓶
3NO2+H2O = 2HNO3+NO
能形成喷泉,但不能充满烧瓶。
思维启迪
气体
吸收剂
水或盐酸
水或NaOH溶液
浓NaOH溶液
水
NH3
HCl
SO2
NO2+O2
常见能形成喷泉的物质组合
CO2
还有哪些气体可以形成喷泉
常见喷泉
装置
【拓展】如果将上述实验中的胶头滴管去掉如何引发喷泉实验呢?
具体做法:
打开止水夹,用热毛巾对烧瓶热敷或者用冷毛巾对烧瓶冷敷都可以引发喷泉。
引发喷泉的方式:形成内外压强差
1、减小内压法 2、增大外压法
增大外压法
课堂练习
如图所示:烧瓶中充满干燥气体 a,将胶头滴管中的液体 b 挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则 a、b 不可能是 ( )
A.a 为 HCl 气体,b 为 H2O
B.a 为 CO2 气体,b 为浓 NaOH 溶液
C.a 为 Cl2 气体,b 为饱和 NaCl 溶液
D.a 为 Cl2 气体,b 为浓 NaOH 溶液
C
(2)化学性质
①与水反应
NH3 + H2O
NH3·H2O
一水合氨,是一种弱碱,只有一小部分发生电离。
注:
a. 氨水属于混合物,一水合氨属于纯净物;
b. 氨气属于非电解质,一水合氨属于电解质。
能使酚酞溶液变红
能使红色石蕊试纸变蓝
氨气是一种碱性气体
NH4+
+ OH-
②与酸反应
NH3 + HCl = NH4Cl
烟是一种固体小颗粒
现象:有大量白烟产生
原因:NH3 与 HCl 相遇迅速反应生成 NH4Cl 固体小颗粒
思考:浓氨水遇浓硫酸、浓硝酸也会产生白烟吗
NH3 + HNO3 = NH4NO3
浓硫酸没有挥发性,浓硝酸有挥发性
沾有浓盐酸的玻棒
沾有浓氨水的玻棒
HCl
NH3
现象:产生大量白烟
NH3+HCl=NH4Cl
NH4Cl
——此反应可检验NH3或HCl
小魔术:
【应用】
管道工人用浓氨水检验氯气管道是否漏气,如果管道某处漏气,会产生白烟,原理是什么 (已知2NH3+3Cl2 = N2+6HCl)
提示:若氯气管道漏气,发生反应:2NH3+3Cl2 = N2+6HCl、NH3+HCl = NH4Cl,产生的白烟是固体NH4Cl。
③还原性
拓展:与氯气等强氧化性物质的反应
8NH3 + 3Cl2 = N2 + 6NH4Cl
氨的催化氧化
氨的催化氧化是工业_________的基础。
制硝酸
催化剂
4NH3 + 5O2 4NO + 6H2O
2NH3 + 3Cl2 = N2 + 6HCl
(1)液氨可用作制冷剂,是因为其汽化时吸收大量的热( )
(2)氨水能导电,所以氨水是电解质( )
(3)新制饱和氨水中含氮粒子物质的量浓度最大的是NH4+ ( )
(4)将蘸有浓氨水的玻璃棒靠近浓硫酸有白烟产生( )
(5)氨中氮元素的化合价为-3价,在反应中只能升高而具有还原性( )
√
×
×
×
√
2.下列关于氨气、液氨、氨水的叙述正确的是( )
A.氨气、液氨、氨水的成分相同,均为纯净物
B.蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒相互靠近,有白烟生成
C.氨水的密度比水小,且浓度越大,密度越大
D.氨水的溶质为NH3·H2O,是氨水中含量最多的微粒
解析 氨水是混合物,氨水的密度随浓度的增大而减小,氨水中水的含量最多。
B
1.判断正误
2. 铵盐
(1) 概念:由铵根离子(NH4+)和酸根离子构成的化合物
如:NH4Cl、(NH4)2SO4、 NH4NO3
(2) 物理性质:一般铵盐都是白色或无色晶体且易溶于水
(3) 化学性质
① 受热易分解
NH4Cl NH3↑ + HCl↑
NH4HCO3 NH3↑ + H2O↑ + CO2↑
② 与碱反应
离子方程式:
NH4+ + OH- NH3↑ + H2O (水溶液)
注:不加热条件下
NH4+ + OH- NH3·H2O
2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑ + 2H2O
实验展示
【实验5-7】
向盛有少量 NH4Cl 溶液、NH4NO3 溶液和 (NH4)2SO4 溶液的三支试管中分别加入 NaOH 溶液并加热(注意通风),用镊子夹住一片湿润的红色石蕊试纸放在试管口。观察现象,分析现象产生的原因,写出反应的离子方程式。
实验分析
实验现象
湿润的红色石蕊试纸变蓝
实验分析
产生了碱性气体,即 NH3
实验结论
铵盐与强碱反应产生 NH3
实验启发
NH4+ + OH- NH3↑ + H2O
问:如何检验 NH4+
思维启迪
铵根离子的检验方法
① 取少量样品于试管中,加入碱后共热,
将湿润的红色石蕊试纸靠近管口,
若试纸变蓝,则证明含有 NH4+
② 取少量样品于试管中,加入碱后共热,
将蘸有浓盐酸的玻璃棒靠近试管口,
若有白烟产生,则证明含有 NH4+
NH4+的检验
①湿润的红色石蕊试纸变蓝色
②浓盐酸或浓硝酸产生白烟
某物质+碱 气体
△
答题模板:取少量固体样品或溶液于试管中,再加入浓的NaOH溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体(或将蘸有浓盐酸的玻璃棒靠近管口,有白烟产生),证明固体样品或溶液中含有NH4+ 。
思考讨论
氨气的实验室制法
(1) 装置类型:
(2) 实验试剂:
(3) 收集方法:
(4) 棉花作用:
固固加热型装置
向下排空气法
减少氨气与空气的对流
NH4Cl 与 Ca(OH)2
(5) 实验原理:
2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑ + 2H2O
P15
(6) 集满验证:
a. 湿润的红色石蕊试纸
接近试管口变蓝
b. 蘸有浓HCl的玻璃棒
接近试管口产生白烟
(8) 环保措施:
硫酸(或水)吸收多余的氨气
(7) 干燥装置:
防倒吸
用碱石灰干燥
方法一:
加热浓氨水制氨气
浓氨水滴入生石灰(或NaOH)中制氨气
2. 快速简易制法
3. 工业制法
思维拓展
方法二:
CaO或NaOH
浓氨水
人工合成氨
N2 + 3H2 2NH3
催化剂
NH3·H2O NH3↑ + H2O
氨 铵盐
一、氨气
二、铵盐
1、物理性质:
2、喷泉原理:
3、化学性质:
课堂总结
1、物理性质:
2、化学性质:
3、铵根离子的检验:
三、实验室制氨气
第五章 化工生产中的重要非金属元素
第2节 氮及其化合物
第2课时 氨 铵盐
课程学习目标
掌握铵盐的性质和铵根离子的检验
3
理解喷泉实验的原理
2
了解氨气的性质、用途和实验室制法
1
阅读材料思考:氨气有哪些物理性质?
思考·交流
1、为什么在氨气泄漏时工厂里会寒气逼人?
2、如何吸收弥漫在空气中的大量氨气?
3、被围困在污染区的群众怎样做才能不吸入氨气?
2013年8月31日11时许,上海宝山区丰翔路一冷库发生液氨泄漏事件,造成15人遇难。
泄漏事件发生以后,整个厂区是白茫茫的一片,方圆数百米,空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难。厂区内寒气逼人。
消防中心出动上百名消防队员、十余量消防车,向泄漏点不停洒水以处理灾情。
1. 氨气
颜色、状态 气味 密度 特性 溶解性
溶于水,1体积水能溶解 体积的氨气
无色气体
刺激性气味
小于空气
易液化
(-33.5℃)
极易
700
氨气易液化, 液态氨汽化时要吸收周围的热量,使周围的空气迅速变冷
(液氨用在电冰箱中作制冷剂)
三、氨和铵盐
(1)物理性质
【N2与NH3结构比较】
实验装置 操作及现象
【实验5-6】氨的喷泉实验
烧杯中的溶液由玻璃管进入烧瓶中,形成红色的喷泉
打开弹簧夹,挤压胶头滴管;
1、水溶液为什么呈红色?
NH3 + H2O
NH3·H2O
NH4+ + OH-
2、实验结论:
氨气极易溶于水,水溶液(氨水)呈碱性。
1、探究形成喷泉的原因是什么
因氨气迅速溶解在从胶头滴管挤压出的少量水中,使烧瓶内的压强迅速减小,与外界大气形成较大的压强差,在压强差作用下,液体迅速流动,通过带尖嘴的导管喷出来,形成喷泉。
思考讨论
2、若将 NH3 换为 NO2,能否形成喷泉 若能形成,则实验后液体能否充满烧瓶
3NO2+H2O = 2HNO3+NO
能形成喷泉,但不能充满烧瓶。
思维启迪
气体
吸收剂
水或盐酸
水或NaOH溶液
浓NaOH溶液
水
NH3
HCl
SO2
NO2+O2
常见能形成喷泉的物质组合
CO2
还有哪些气体可以形成喷泉
常见喷泉
装置
【拓展】如果将上述实验中的胶头滴管去掉如何引发喷泉实验呢?
具体做法:
打开止水夹,用热毛巾对烧瓶热敷或者用冷毛巾对烧瓶冷敷都可以引发喷泉。
引发喷泉的方式:形成内外压强差
1、减小内压法 2、增大外压法
增大外压法
课堂练习
如图所示:烧瓶中充满干燥气体 a,将胶头滴管中的液体 b 挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则 a、b 不可能是 ( )
A.a 为 HCl 气体,b 为 H2O
B.a 为 CO2 气体,b 为浓 NaOH 溶液
C.a 为 Cl2 气体,b 为饱和 NaCl 溶液
D.a 为 Cl2 气体,b 为浓 NaOH 溶液
C
(2)化学性质
①与水反应
NH3 + H2O
NH3·H2O
一水合氨,是一种弱碱,只有一小部分发生电离。
注:
a. 氨水属于混合物,一水合氨属于纯净物;
b. 氨气属于非电解质,一水合氨属于电解质。
能使酚酞溶液变红
能使红色石蕊试纸变蓝
氨气是一种碱性气体
NH4+
+ OH-
②与酸反应
NH3 + HCl = NH4Cl
烟是一种固体小颗粒
现象:有大量白烟产生
原因:NH3 与 HCl 相遇迅速反应生成 NH4Cl 固体小颗粒
思考:浓氨水遇浓硫酸、浓硝酸也会产生白烟吗
NH3 + HNO3 = NH4NO3
浓硫酸没有挥发性,浓硝酸有挥发性
沾有浓盐酸的玻棒
沾有浓氨水的玻棒
HCl
NH3
现象:产生大量白烟
NH3+HCl=NH4Cl
NH4Cl
——此反应可检验NH3或HCl
小魔术:
【应用】
管道工人用浓氨水检验氯气管道是否漏气,如果管道某处漏气,会产生白烟,原理是什么 (已知2NH3+3Cl2 = N2+6HCl)
提示:若氯气管道漏气,发生反应:2NH3+3Cl2 = N2+6HCl、NH3+HCl = NH4Cl,产生的白烟是固体NH4Cl。
③还原性
拓展:与氯气等强氧化性物质的反应
8NH3 + 3Cl2 = N2 + 6NH4Cl
氨的催化氧化
氨的催化氧化是工业_________的基础。
制硝酸
催化剂
4NH3 + 5O2 4NO + 6H2O
2NH3 + 3Cl2 = N2 + 6HCl
(1)液氨可用作制冷剂,是因为其汽化时吸收大量的热( )
(2)氨水能导电,所以氨水是电解质( )
(3)新制饱和氨水中含氮粒子物质的量浓度最大的是NH4+ ( )
(4)将蘸有浓氨水的玻璃棒靠近浓硫酸有白烟产生( )
(5)氨中氮元素的化合价为-3价,在反应中只能升高而具有还原性( )
√
×
×
×
√
2.下列关于氨气、液氨、氨水的叙述正确的是( )
A.氨气、液氨、氨水的成分相同,均为纯净物
B.蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒相互靠近,有白烟生成
C.氨水的密度比水小,且浓度越大,密度越大
D.氨水的溶质为NH3·H2O,是氨水中含量最多的微粒
解析 氨水是混合物,氨水的密度随浓度的增大而减小,氨水中水的含量最多。
B
1.判断正误
2. 铵盐
(1) 概念:由铵根离子(NH4+)和酸根离子构成的化合物
如:NH4Cl、(NH4)2SO4、 NH4NO3
(2) 物理性质:一般铵盐都是白色或无色晶体且易溶于水
(3) 化学性质
① 受热易分解
NH4Cl NH3↑ + HCl↑
NH4HCO3 NH3↑ + H2O↑ + CO2↑
② 与碱反应
离子方程式:
NH4+ + OH- NH3↑ + H2O (水溶液)
注:不加热条件下
NH4+ + OH- NH3·H2O
2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑ + 2H2O
实验展示
【实验5-7】
向盛有少量 NH4Cl 溶液、NH4NO3 溶液和 (NH4)2SO4 溶液的三支试管中分别加入 NaOH 溶液并加热(注意通风),用镊子夹住一片湿润的红色石蕊试纸放在试管口。观察现象,分析现象产生的原因,写出反应的离子方程式。
实验分析
实验现象
湿润的红色石蕊试纸变蓝
实验分析
产生了碱性气体,即 NH3
实验结论
铵盐与强碱反应产生 NH3
实验启发
NH4+ + OH- NH3↑ + H2O
问:如何检验 NH4+
思维启迪
铵根离子的检验方法
① 取少量样品于试管中,加入碱后共热,
将湿润的红色石蕊试纸靠近管口,
若试纸变蓝,则证明含有 NH4+
② 取少量样品于试管中,加入碱后共热,
将蘸有浓盐酸的玻璃棒靠近试管口,
若有白烟产生,则证明含有 NH4+
NH4+的检验
①湿润的红色石蕊试纸变蓝色
②浓盐酸或浓硝酸产生白烟
某物质+碱 气体
△
答题模板:取少量固体样品或溶液于试管中,再加入浓的NaOH溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体(或将蘸有浓盐酸的玻璃棒靠近管口,有白烟产生),证明固体样品或溶液中含有NH4+ 。
思考讨论
氨气的实验室制法
(1) 装置类型:
(2) 实验试剂:
(3) 收集方法:
(4) 棉花作用:
固固加热型装置
向下排空气法
减少氨气与空气的对流
NH4Cl 与 Ca(OH)2
(5) 实验原理:
2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑ + 2H2O
P15
(6) 集满验证:
a. 湿润的红色石蕊试纸
接近试管口变蓝
b. 蘸有浓HCl的玻璃棒
接近试管口产生白烟
(8) 环保措施:
硫酸(或水)吸收多余的氨气
(7) 干燥装置:
防倒吸
用碱石灰干燥
方法一:
加热浓氨水制氨气
浓氨水滴入生石灰(或NaOH)中制氨气
2. 快速简易制法
3. 工业制法
思维拓展
方法二:
CaO或NaOH
浓氨水
人工合成氨
N2 + 3H2 2NH3
催化剂
NH3·H2O NH3↑ + H2O
氨 铵盐
一、氨气
二、铵盐
1、物理性质:
2、喷泉原理:
3、化学性质:
课堂总结
1、物理性质:
2、化学性质:
3、铵根离子的检验:
三、实验室制氨气
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
