化学人教版(2019)必修第二册5.1.1 硫和二氧化硫(共34张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.1.1 硫和二氧化硫(共34张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-31 17:20:22 | ||
图片预览










文档简介
(共34张PPT)
第一节 硫及其化合物
第1课时:硫和二氧化硫
第五章 化工生产中的重要非金属元素
新人教版2019 化学 必修二
课程学习目标 1.认识硫元素在物质中具有不同价态,可通过氧化还原反应实现含有不同价态硫元素的物质的相互转化。 2.结合真实情境中的应用实例或通过实验探究,了解硫、二氧化硫的主要性质,认识其在生产中的应用和对生态环境的影响。 3.能说明二氧化硫的应用对环境的影响。 核心素养水平 1.宏观辨识与微观探析:能从物质类别和元素化合价的角度,预测硫、SO2的性质及转化。
2.科学探究与创新意识:能根据教材中给出的有关硫、SO2的性质,设计简单的实验方案,完成操作,观察现象,对实验现象作出解释。
3.科学态度与社会责任:能主动关心与环境保护,资源综合利用等有关的社会热点问题,形成与环境和谐共处,合理利用自然资源的观念。
课程学习目标与核心素养水平
同学们,你们认识硫吗
新课导入
新课导入
黑火药的成分为“一硫二硝三木炭”(S + 2KNO3 + 3C == K2S + N2↑ + 3CO2↑ )
中国古代四大发明之“黑火药”
自然界中游离态的硫一般存在于火山口附近或岩层里。
硫的存在
硫铁矿(FeS2)
黄铜矿(CuFeS2)
石膏(CaSO4·2H2O)
芒硝(Na2SO4·10H2O)
自然界中化合态的硫主要以硫化物或硫酸盐形式存在。
一、硫
1.存在形式:
游离态:火山口附近或地壳的岩石
化合态:
2.物理性质:
硫铁矿(FeS2)
黄铜矿(CuFeS2)
石膏(CaSO4 2H2O)
芒硝(Na2SO4 10H2O)
黄色晶体,俗称硫黄,质脆,
易研成粉末。不溶于水,微溶于
酒精,易溶于CS2。
硫化物:
硫酸盐:
画出硫的原子结构示意图,并回答以下问题:
(1)硫在元素周期表中的位置如何?
(2)硫的常见化合价有哪些?
位置
第三周期、第VIA族
化合价
硫原子最外层有6个电子,在化学反应中易得2个电子,形成-2价硫的化合物
硫原子比氧原子多一个电子层,得电子能力相对较弱,含硫化合物中,硫常为+4价或+6价
O
非金属性:比氧弱
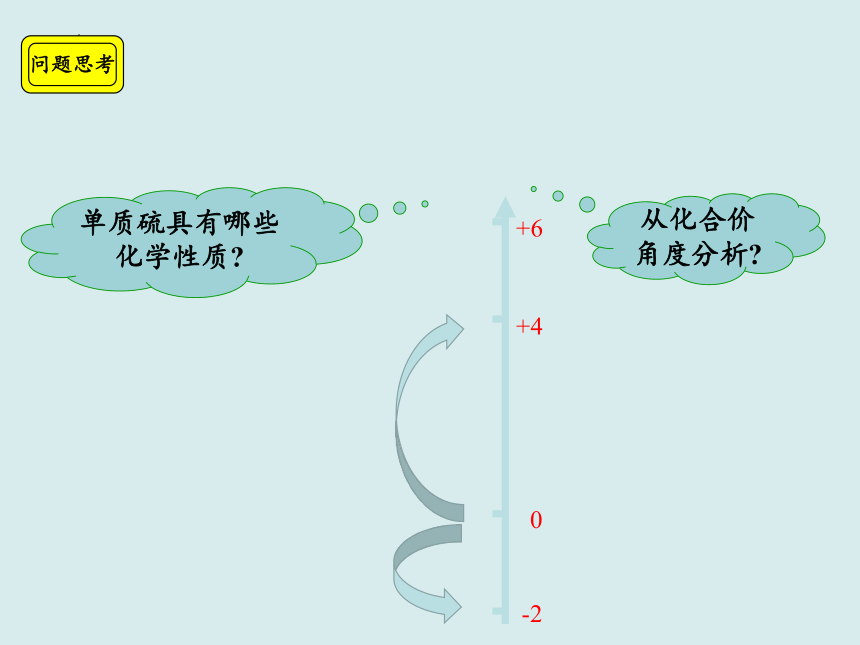
问题思考
S
单质硫具有哪些化学性质
从化合价角度分析
问题思考
-2
0
+4
+6
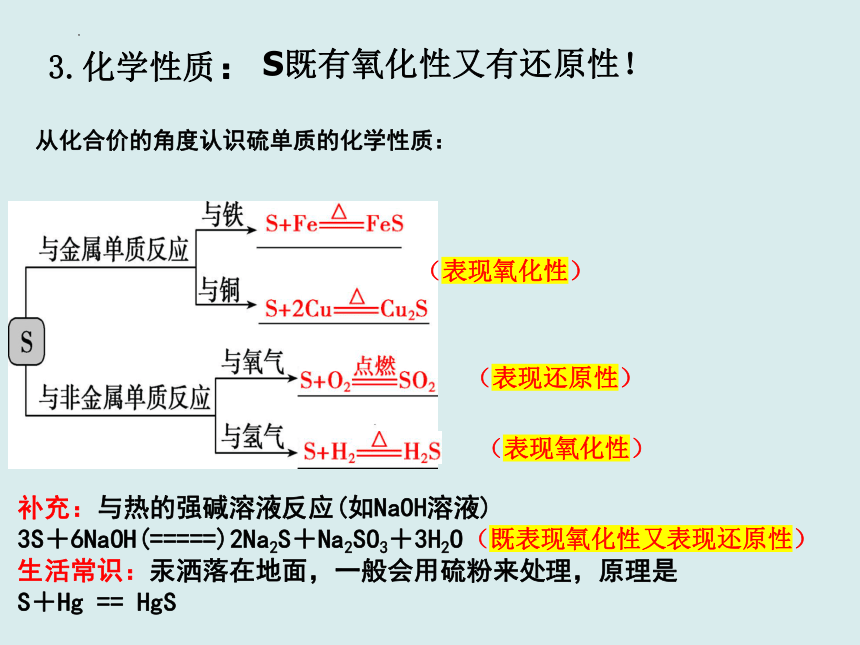
从化合价的角度认识硫单质的化学性质:
(表现氧化性)
(表现还原性)
(表现氧化性)
3.化学性质:
S既有氧化性又有还原性!
补充:与热的强碱溶液反应(如NaOH溶液)
3S+6NaOH(=====)2Na2S+Na2SO3+3H2O
生活常识:汞洒落在地面,一般会用硫粉来处理,原理是
S+Hg == HgS
(既表现氧化性又表现还原性)
4.硫的用途
硫常用于制造硫酸、化肥、农药、火药等,还可用于制造硫化橡胶。
【例1】下列说法中正确的是 ( )
A.硫是一种不溶于水的黄色晶体
B.硫与金属反应时作氧化剂,与非金属反应时作还原剂
C.硫与铁反应时生成硫化铁
D.硫在自然界中仅以化合态存在
A
【例2】氯气的氧化性比硫的氧化性强,能证明这一结论的事实是( )
A.通常情况下硫为浅黄色固体,而氯气为黄绿色气体
B.硫不溶于水,而氯气能溶于水
C.与金属反应时,硫被还原为-2 价而氯被还原为-1价
D.与同一种金属反应时,金属被硫氧化成低价态,但被氯气氧化成高价态
D
【例1】下列说法中正确的是 ( )
A.硫是一种不溶于水的黄色晶体
B.硫与金属反应时作氧化剂,与非金属反应时作还原剂
C.硫与铁反应时生成硫化铁
D.硫在自然界中仅以化合态存在
A
【例2】氯气的氧化性比硫的氧化性强,能证明这一结论的事实是( )
A.通常情况下硫为浅黄色固体,而氯气为黄绿色气体
B.硫不溶于水,而氯气能溶于水
C.与金属反应时,硫被还原为-2 价而氯被还原为-1价
D.与同一种金属反应时,金属被硫氧化成低价态,但被氯气氧化成高价态
D
典例精讲
思维启迪
被酸雨腐蚀的森林
SO2一种无色、有刺激性气味的有毒气体, 密度比空气大、容易液化、易溶于水。
1.物理性质:
2.化学性质:
二、二氧化硫
(1)具有酸性氧化物的通性
(2)既有氧化性又有还原性
(3)漂白性
→物质类别看:
→从化合价看:
→特殊性:
-2、 0、 +4、+6
SO2
2.化学性质:
二、二氧化硫
①与H2O反应生成酸
SO2 + H2O
H2SO3
(亚硫酸)
亚硫酸是一种弱酸,不稳定,容易分解成水和二氧化硫。
可逆反应:在相同条件下,既能向正反应方向进行,同时又能向逆反应方向进行的化学反应。
(1)酸性氧化物的通性:
(类似CO2)
与碱性氧化物反应生成盐
与H2O反应生成酸
酸性氧化物
与碱反应生成盐和水
【例3】判断下列反应哪些不属于可逆反应?
√
A.2NO2 N2O4
B.2H2+O2 2H2O
C.SO2+ H2O H2SO3
D.CO2+ H2O H2CO3
点燃
电解
典例精讲
2NaOH+SO2=Na2SO3 +H2O
Ca(OH)2+SO2=CaSO3 ↓ +H2O
(澄清石灰水变浑浊)
SO2少量:
SO2过量:
NaOH+SO2=NaHSO3
(亚硫酸氢钠)
②与碱反应生成盐和水
③与碱性氧化物反应生成盐
CaSO3+O2 =CaSO4
SO2+CaO =CaSO3
2H2S + SO2 = 3S ↓ + 2H2O
2SO2 + O2 2SO3
催化剂
▲
得4e-
SO2+Cl2+2H2O= H2SO4+2HCl
②还原性:
(KMnO4 溶液褪色)
5SO2+2KMnO4+2H2O =K2SO4 +2MnSO4+2H2SO4
(氯水褪色)
①氧化性:
(2)既有氧化性又有还原性
加热,又恢复原来的颜色。
实验现象:
品红溶液褪色
是SO2跟有色物质化合生成一种无色的不稳定化合物。
SO2的漂白原理:
特别注意:SO2不能漂白酸碱指示剂
应用:SO2可以用来漂白纸浆、毛、丝、草编制品等。
SO2 的漂白性特点:
1、暂时性、可逆的
2、选择性
属于非氧化还原反应.
向SO2水溶液中滴加紫色石蕊试液,溶液 。
只变红不褪色
(3)SO2的漂白性:
—常用于检验 SO2
[实验5-2]
原因:
SO2能使溴水、KMnO4溶液褪色与SO2使品红褪色,实质相同吗
不同。前者体现SO2的还原性,发生的是氧化还原反应。后者体现其漂白性,发生的是非氧化还原反应。
思考与交流
几种具有漂白性物质的性质比较:
物质 氯水 SO2 木炭
原理
实质
效果
范围
氯水中的次氯酸将有色物质氧化成无色物质
氧化还原反应
(化学变化)
永久性
可漂白大多数有色物质,能使紫色石蕊褪色。
二氧化硫与有色物质结合生成不稳定的无色物质
非氧化还原反应(化学变化)
暂时性
可漂白某些有色物质,不能使石蕊试液褪色
将有色物质的分子吸附在其表面
物理吸附
(物理变化)
暂时性
可吸附某些有色物质的分子
2SO2 + O2 2SO3
SO3 + H2O = H2SO4
⑵可以漂白纸浆、毛、丝、草编制品等
⑶杀灭霉菌和细菌
⑷作食物和干果的防腐剂
⑴制造硫酸:
△
催化剂
3.二氧化硫的用途
【例4】下列可以用来鉴别SO2 和CO2 的方法是 ( )
A.通入紫色石蕊试液 B.闻气味
C.通入澄清石灰水 D.通入品红溶液中
都是酸性氧化物,都可以使石蕊变红
SO2有刺激性气味,而CO2没有
都可以使澄清石灰水变浑浊
SO2可使品红褪色,而CO2不能
B D
【例5】下列能说明SO2具有漂白作用的是( )
A.SO2能使酸性高锰酸钾褪色
B.SO2能使品红溶液褪色
C.SO2能溴水褪色
D.SO2难使品红试液变红
B
典例精讲
【例6】下列能说明SO2体现什么性质?
(1)SO2使滴有酚酞的NaOH溶液红色褪去,
SO2体现 性;
(2) SO2使品红褪色,SO2体现 性;
(3) SO2使溴水褪色,SO2体现 性。
酸
漂白
还原
【例7】SO2具有漂白性,氯水有漂白性,如果混在一起,有漂白性吗?
可能失去漂白性
二氧化硫和氯水发生化学反应生成新物质,而HCl 和H2SO4是没有漂白性的,因此漂白性可能消失。
SO2 + Cl2 + 2H2O = 2HCl + H2SO4
课堂小结
效果检测
谢谢观赏
第一节 硫及其化合物
第1课时:硫和二氧化硫
第五章 化工生产中的重要非金属元素
新人教版2019 化学 必修二
课程学习目标 1.认识硫元素在物质中具有不同价态,可通过氧化还原反应实现含有不同价态硫元素的物质的相互转化。 2.结合真实情境中的应用实例或通过实验探究,了解硫、二氧化硫的主要性质,认识其在生产中的应用和对生态环境的影响。 3.能说明二氧化硫的应用对环境的影响。 核心素养水平 1.宏观辨识与微观探析:能从物质类别和元素化合价的角度,预测硫、SO2的性质及转化。
2.科学探究与创新意识:能根据教材中给出的有关硫、SO2的性质,设计简单的实验方案,完成操作,观察现象,对实验现象作出解释。
3.科学态度与社会责任:能主动关心与环境保护,资源综合利用等有关的社会热点问题,形成与环境和谐共处,合理利用自然资源的观念。
课程学习目标与核心素养水平
同学们,你们认识硫吗
新课导入
新课导入
黑火药的成分为“一硫二硝三木炭”(S + 2KNO3 + 3C == K2S + N2↑ + 3CO2↑ )
中国古代四大发明之“黑火药”
自然界中游离态的硫一般存在于火山口附近或岩层里。
硫的存在
硫铁矿(FeS2)
黄铜矿(CuFeS2)
石膏(CaSO4·2H2O)
芒硝(Na2SO4·10H2O)
自然界中化合态的硫主要以硫化物或硫酸盐形式存在。
一、硫
1.存在形式:
游离态:火山口附近或地壳的岩石
化合态:
2.物理性质:
硫铁矿(FeS2)
黄铜矿(CuFeS2)
石膏(CaSO4 2H2O)
芒硝(Na2SO4 10H2O)
黄色晶体,俗称硫黄,质脆,
易研成粉末。不溶于水,微溶于
酒精,易溶于CS2。
硫化物:
硫酸盐:
画出硫的原子结构示意图,并回答以下问题:
(1)硫在元素周期表中的位置如何?
(2)硫的常见化合价有哪些?
位置
第三周期、第VIA族
化合价
硫原子最外层有6个电子,在化学反应中易得2个电子,形成-2价硫的化合物
硫原子比氧原子多一个电子层,得电子能力相对较弱,含硫化合物中,硫常为+4价或+6价
O
非金属性:比氧弱
问题思考
S
单质硫具有哪些化学性质
从化合价角度分析
问题思考
-2
0
+4
+6
从化合价的角度认识硫单质的化学性质:
(表现氧化性)
(表现还原性)
(表现氧化性)
3.化学性质:
S既有氧化性又有还原性!
补充:与热的强碱溶液反应(如NaOH溶液)
3S+6NaOH(=====)2Na2S+Na2SO3+3H2O
生活常识:汞洒落在地面,一般会用硫粉来处理,原理是
S+Hg == HgS
(既表现氧化性又表现还原性)
4.硫的用途
硫常用于制造硫酸、化肥、农药、火药等,还可用于制造硫化橡胶。
【例1】下列说法中正确的是 ( )
A.硫是一种不溶于水的黄色晶体
B.硫与金属反应时作氧化剂,与非金属反应时作还原剂
C.硫与铁反应时生成硫化铁
D.硫在自然界中仅以化合态存在
A
【例2】氯气的氧化性比硫的氧化性强,能证明这一结论的事实是( )
A.通常情况下硫为浅黄色固体,而氯气为黄绿色气体
B.硫不溶于水,而氯气能溶于水
C.与金属反应时,硫被还原为-2 价而氯被还原为-1价
D.与同一种金属反应时,金属被硫氧化成低价态,但被氯气氧化成高价态
D
【例1】下列说法中正确的是 ( )
A.硫是一种不溶于水的黄色晶体
B.硫与金属反应时作氧化剂,与非金属反应时作还原剂
C.硫与铁反应时生成硫化铁
D.硫在自然界中仅以化合态存在
A
【例2】氯气的氧化性比硫的氧化性强,能证明这一结论的事实是( )
A.通常情况下硫为浅黄色固体,而氯气为黄绿色气体
B.硫不溶于水,而氯气能溶于水
C.与金属反应时,硫被还原为-2 价而氯被还原为-1价
D.与同一种金属反应时,金属被硫氧化成低价态,但被氯气氧化成高价态
D
典例精讲
思维启迪
被酸雨腐蚀的森林
SO2一种无色、有刺激性气味的有毒气体, 密度比空气大、容易液化、易溶于水。
1.物理性质:
2.化学性质:
二、二氧化硫
(1)具有酸性氧化物的通性
(2)既有氧化性又有还原性
(3)漂白性
→物质类别看:
→从化合价看:
→特殊性:
-2、 0、 +4、+6
SO2
2.化学性质:
二、二氧化硫
①与H2O反应生成酸
SO2 + H2O
H2SO3
(亚硫酸)
亚硫酸是一种弱酸,不稳定,容易分解成水和二氧化硫。
可逆反应:在相同条件下,既能向正反应方向进行,同时又能向逆反应方向进行的化学反应。
(1)酸性氧化物的通性:
(类似CO2)
与碱性氧化物反应生成盐
与H2O反应生成酸
酸性氧化物
与碱反应生成盐和水
【例3】判断下列反应哪些不属于可逆反应?
√
A.2NO2 N2O4
B.2H2+O2 2H2O
C.SO2+ H2O H2SO3
D.CO2+ H2O H2CO3
点燃
电解
典例精讲
2NaOH+SO2=Na2SO3 +H2O
Ca(OH)2+SO2=CaSO3 ↓ +H2O
(澄清石灰水变浑浊)
SO2少量:
SO2过量:
NaOH+SO2=NaHSO3
(亚硫酸氢钠)
②与碱反应生成盐和水
③与碱性氧化物反应生成盐
CaSO3+O2 =CaSO4
SO2+CaO =CaSO3
2H2S + SO2 = 3S ↓ + 2H2O
2SO2 + O2 2SO3
催化剂
▲
得4e-
SO2+Cl2+2H2O= H2SO4+2HCl
②还原性:
(KMnO4 溶液褪色)
5SO2+2KMnO4+2H2O =K2SO4 +2MnSO4+2H2SO4
(氯水褪色)
①氧化性:
(2)既有氧化性又有还原性
加热,又恢复原来的颜色。
实验现象:
品红溶液褪色
是SO2跟有色物质化合生成一种无色的不稳定化合物。
SO2的漂白原理:
特别注意:SO2不能漂白酸碱指示剂
应用:SO2可以用来漂白纸浆、毛、丝、草编制品等。
SO2 的漂白性特点:
1、暂时性、可逆的
2、选择性
属于非氧化还原反应.
向SO2水溶液中滴加紫色石蕊试液,溶液 。
只变红不褪色
(3)SO2的漂白性:
—常用于检验 SO2
[实验5-2]
原因:
SO2能使溴水、KMnO4溶液褪色与SO2使品红褪色,实质相同吗
不同。前者体现SO2的还原性,发生的是氧化还原反应。后者体现其漂白性,发生的是非氧化还原反应。
思考与交流
几种具有漂白性物质的性质比较:
物质 氯水 SO2 木炭
原理
实质
效果
范围
氯水中的次氯酸将有色物质氧化成无色物质
氧化还原反应
(化学变化)
永久性
可漂白大多数有色物质,能使紫色石蕊褪色。
二氧化硫与有色物质结合生成不稳定的无色物质
非氧化还原反应(化学变化)
暂时性
可漂白某些有色物质,不能使石蕊试液褪色
将有色物质的分子吸附在其表面
物理吸附
(物理变化)
暂时性
可吸附某些有色物质的分子
2SO2 + O2 2SO3
SO3 + H2O = H2SO4
⑵可以漂白纸浆、毛、丝、草编制品等
⑶杀灭霉菌和细菌
⑷作食物和干果的防腐剂
⑴制造硫酸:
△
催化剂
3.二氧化硫的用途
【例4】下列可以用来鉴别SO2 和CO2 的方法是 ( )
A.通入紫色石蕊试液 B.闻气味
C.通入澄清石灰水 D.通入品红溶液中
都是酸性氧化物,都可以使石蕊变红
SO2有刺激性气味,而CO2没有
都可以使澄清石灰水变浑浊
SO2可使品红褪色,而CO2不能
B D
【例5】下列能说明SO2具有漂白作用的是( )
A.SO2能使酸性高锰酸钾褪色
B.SO2能使品红溶液褪色
C.SO2能溴水褪色
D.SO2难使品红试液变红
B
典例精讲
【例6】下列能说明SO2体现什么性质?
(1)SO2使滴有酚酞的NaOH溶液红色褪去,
SO2体现 性;
(2) SO2使品红褪色,SO2体现 性;
(3) SO2使溴水褪色,SO2体现 性。
酸
漂白
还原
【例7】SO2具有漂白性,氯水有漂白性,如果混在一起,有漂白性吗?
可能失去漂白性
二氧化硫和氯水发生化学反应生成新物质,而HCl 和H2SO4是没有漂白性的,因此漂白性可能消失。
SO2 + Cl2 + 2H2O = 2HCl + H2SO4
课堂小结
效果检测
谢谢观赏
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
