第六章 第一节 第3课时 化学电池(含答案)
文档属性
| 名称 | 第六章 第一节 第3课时 化学电池(含答案) | 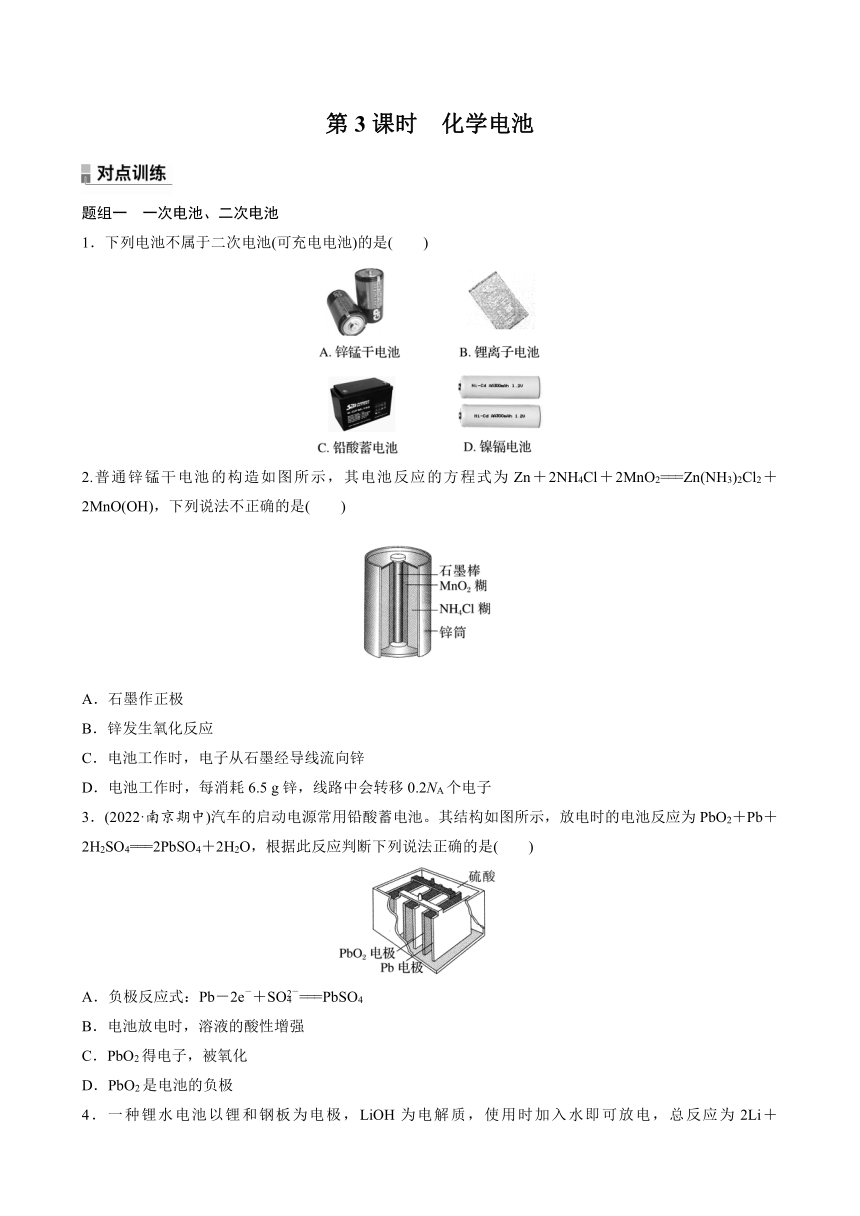 | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-31 17:02:49 | ||
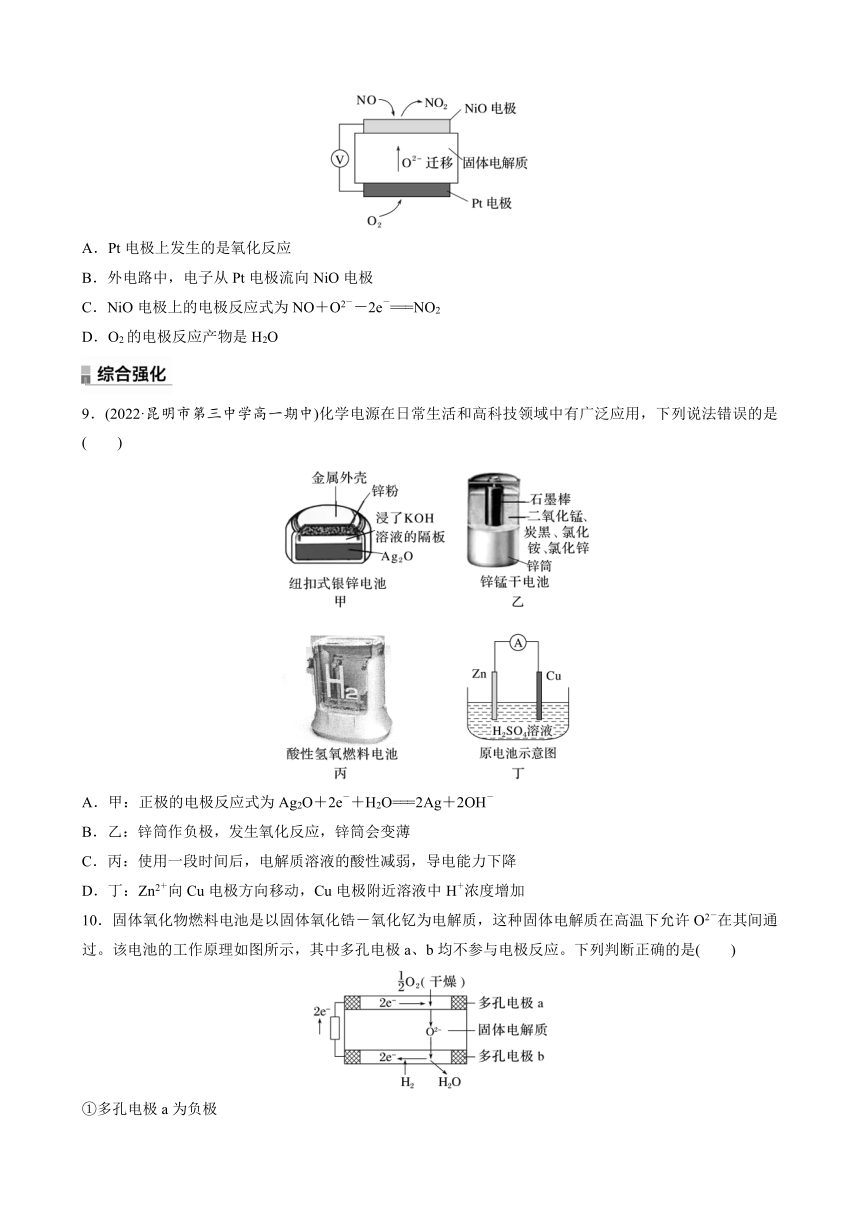
图片预览


文档简介
第3课时 化学电池
题组一 一次电池、二次电池
1.下列电池不属于二次电池(可充电电池)的是( )
2.普通锌锰干电池的构造如图所示,其电池反应的方程式为Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnO(OH),下列说法不正确的是( )
A.石墨作正极
B.锌发生氧化反应
C.电池工作时,电子从石墨经导线流向锌
D.电池工作时,每消耗6.5 g锌,线路中会转移0.2NA个电子
3.(2022·南京期中)汽车的启动电源常用铅酸蓄电池。其结构如图所示,放电时的电池反应为PbO2+Pb+2H2SO4===2PbSO4+2H2O,根据此反应判断下列说法正确的是( )
A.负极反应式:Pb-2e-+SO===PbSO4
B.电池放电时,溶液的酸性增强
C.PbO2得电子,被氧化
D.PbO2是电池的负极
4.一种锂水电池以锂和钢板为电极,LiOH为电解质,使用时加入水即可放电,总反应为2Li+2H2O===2LiOH+H2↑。下列有关该电池的说法错误的是( )
A.锂极为负极
B.OH-移向正极
C.H2为正极产物
D.电子由锂经导线流向钢板
5.银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O===2Ag+Zn(OH)2,下列说法不正确的是( )
A.原电池放电时,负极上发生反应的物质是Zn
B.负极发生的反应是Zn+2OH--2e-===Zn(OH)2
C.工作时,负极区溶液中c(OH-)减小
D.溶液中OH-向正极移动,K+、H+向负极移动
题组二 燃料电池
6.(2022·济南高一检测)目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系,下列说法中错误的是( )
A.燃料电池能够使化学反应产生的能量转化为电能
B.燃料电池中通入H2的一极作负极,发生氧化反应
C.在此循环中发生了反应:2H2O2H2↑+O2↑
D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂
7.某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。下列叙述错误的是( )
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是2H2O+2e-===H2↑+2OH-
C.电池总反应为2H2+O2===2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
8.(2022·武汉高一检测)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示,下列说法正确的是( )
A.Pt电极上发生的是氧化反应
B.外电路中,电子从Pt电极流向NiO电极
C.NiO电极上的电极反应式为NO+O2--2e-===NO2
D.O2的电极反应产物是H2O
9.(2022·昆明市第三中学高一期中)化学电源在日常生活和高科技领域中有广泛应用,下列说法错误的是( )
A.甲:正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-
B.乙:锌筒作负极,发生氧化反应,锌筒会变薄
C.丙:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
D.丁:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
10.固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
①多孔电极a为负极
②a极对应的电极反应式为O2+2H2O+4e-===4OH-
③b极的电极反应式为H2-2e-+O2-===H2O
④该电池的总反应式为2H2+O22H2O
A.①② B.②④ C.②③ D.③④
11.(2022·贵州黔东南高一期中)Li-FeS2电池是目前电池中综合性能最好的一种电池,其原理示意图如图所示。已知电池放电时的反应为4Li+FeS2===Fe+2Li2S。下列说法正确的是( )
A.Li为电池的正极,发生氧化反应
B.电流由Li经负载,流向FeS2极
C.正极的电极反应式为FeS2+4e-===Fe+2S2-
D.将熔融的LiCF3SO3改为LiCl的水溶液,电池性能更好
12.最近,科学家研发了“全氢电池”,其工作原理如图所示。 下列说法正确的是( )
A.右边吸附层中发生氧化反应
B.负极的电极反应是H2-2e-+2OH-===2H2O
C.当右边吸附层中产生标准状况下2.24 L氢气时,电子在溶液中通过了0.2 mol
D.电解质溶液中Na+向左移动,ClO向右移动
13.(2022·西安调研)利用反应6NO2+8NH3===7N2+12H2O设计的电池装置如图所示,该装置能有效消除氮氧化物的排放,减轻环境污染。下列说法错误的是( )
A.电极B为正极,发生还原反应
B.当有0.5 mol NO2参与反应时,外电路中转移3 mol电子
C.电池工作时,OH-从右向左移动
D.电极B的电极反应式为2NO2+8e-+4H2O===N2+8OH-
14.(1)银锌电池是一种常见的化学电源,其反应原理:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其工作原理如图所示。
①在装置中Ag2O作________(填“正”或“负”)极发生________(填“还原反应”或“氧化反应”),电极反应式为_________________________________________________________。
②在装置中Zn作________(填“正”或“负”)极,发生________(填“还原反应”或“氧化反应”),电极反应式为________________________________________________________。
(2)将用导线相连的两个铂电极插入KOH溶液中,然后向两极分别通入CO和O2,则发生了原电池反应,该原电池中的负极反应式为____________________________________________
____________________;正极反应式为_______________________________________________
______________________。
15.(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为3Zn+2K2FeO4+8H2O3Zn(OH)2 +2Fe(OH)3+4KOH。请回答下列问题:
①高铁电池的负极材料是________。
②放电时,正极发生________(填“氧化”或“还原”)反应。已知正极反应式为FeO+3e-+4H2O===Fe(OH)3+5OH-,则负极反应式为______________________________________。
③放电时,________(填“正”或“负”)极附近溶液的碱性增强。
(2)锂锰电池的结构示意图如下,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质转移到MnO2晶格中生成LiMnO2。
①外电路的电流方向是由______极流向______极(填字母)。
②正极材料是________________。
③是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”);原因是_________
_______________________________________________________________________________。
第3课时 化学电池
1.A 2.C 3.A
4.B [由方程式可知,Li失去电子,发生氧化反应,作负极,则钢板作正极,A项正确;正极上的电极反应式为:2H2O+2e-===2OH-+H2↑,可知氢气为正极产物,C项正确;电子会从负极流向正极,即电子由锂经导线流向钢板,D项正确。]
5.D [根据电池总反应式知,Zn失电子发生氧化反应,故Zn作负极,Ag2O作正极,故A正确;负极发生反应:Zn+2OH--2e-===Zn(OH)2,消耗OH-,负极区溶液中c(OH-)减小,正极上发生反应:Ag2O+H2O+2e-===2Ag+2OH-,正极区溶液中c(OH-)增大,故B、C正确;放电时,电解质溶液中OH-向负极移动,K+、H+向正极移动,故D错误。]
6.C 7.B
8.C [由离子的定向移动可知NiO电极为原电池的负极, Pt电极为原电池的正极,发生还原反应,A错误;NiO电极为原电池的负极,外电路中,电子从NiO电极流向Pt电极,B错误;NiO电极上NO失电子和氧离子反应生成二氧化氮,所以电极反应式为NO+O2--2e-===NO2,C正确;Pt电极为原电池的正极,O2的电极反应产物是O2-,D错误。]
9.D [甲为纽扣电池,正极为Ag2O得电子发生还原反应,电极反应式为Ag2O+2e-+H2O===2Ag+2OH-,故A正确;乙为锌锰干电池,锌筒作负极,发生氧化反应被溶解,导致锌筒变薄,故B正确;丙为氢氧燃料电池,放电过程中不断生成水,故电解质溶液的酸性减弱,导电能力下降,故C正确;丁中Zn为负极,Cu为正极,原电池工作时Zn2+向Cu电极方向移动,硫酸中氢离子得电子生成氢气,故溶液中H+浓度减小,故D错误。]
10.D [图中电子由多孔电极b通过导线流向多孔电极a,多孔电极b为负极,多孔电极a为正极,①错误;a极对应的电极反应式为O2+4e-===2O2-,②错误;b极的电极反应式为H2-2e-+O2-===H2O,③正确;根据正、负极得失电子数相等,将正、负极电极反应式相加,该电池的总反应式为2H2+O22H2O,④正确。]
11.C 12.B
13.B [根据电池总反应6NO2+8NH3===7N2+12H2O可知,NO2得电子发生还原反应,NH3失电子发生氧化反应,则通入NH3的电极A为负极,通入NO2的电极B为正极,A项正确;根据电池总反应可知,当有6 mol NO2参与反应时,外电路中转移24 mol e-,则当有0.5 mol NO2参与反应时,外电路中转移电子的物质的量为0.5 mol×=2 mol,B项错误;原电池工作时,阴离子移向负极,故OH-从右向左移动,C项正确;电极B为正极,发生还原反应,电极反应式为2NO2+8e-+4H2O===N2+8OH-,D项正确。]
14.(1)①正 还原反应 Ag2O+2e-+H2O===2Ag+2OH- ②负 氧化反应 Zn-2e-+2OH-===Zn(OH)2
(2)2CO-4e-+8OH-===2CO+4H2O O2+4e-+2H2O===4OH-
解析 (2)该原电池中O2得电子,则O2在正极反应,正极反应式为O2+4e-+2H2O===4OH-,CO在负极反应,负极反应式为2CO+8OH--4e-===2CO+4H2O。
15.(1)①Zn ②还原 Zn+2OH--2e-===Zn(OH)2 ③正
(2)①b a ②MnO2 ③否 电极Li是活泼金属,能与水反应
题组一 一次电池、二次电池
1.下列电池不属于二次电池(可充电电池)的是( )
2.普通锌锰干电池的构造如图所示,其电池反应的方程式为Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnO(OH),下列说法不正确的是( )
A.石墨作正极
B.锌发生氧化反应
C.电池工作时,电子从石墨经导线流向锌
D.电池工作时,每消耗6.5 g锌,线路中会转移0.2NA个电子
3.(2022·南京期中)汽车的启动电源常用铅酸蓄电池。其结构如图所示,放电时的电池反应为PbO2+Pb+2H2SO4===2PbSO4+2H2O,根据此反应判断下列说法正确的是( )
A.负极反应式:Pb-2e-+SO===PbSO4
B.电池放电时,溶液的酸性增强
C.PbO2得电子,被氧化
D.PbO2是电池的负极
4.一种锂水电池以锂和钢板为电极,LiOH为电解质,使用时加入水即可放电,总反应为2Li+2H2O===2LiOH+H2↑。下列有关该电池的说法错误的是( )
A.锂极为负极
B.OH-移向正极
C.H2为正极产物
D.电子由锂经导线流向钢板
5.银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O===2Ag+Zn(OH)2,下列说法不正确的是( )
A.原电池放电时,负极上发生反应的物质是Zn
B.负极发生的反应是Zn+2OH--2e-===Zn(OH)2
C.工作时,负极区溶液中c(OH-)减小
D.溶液中OH-向正极移动,K+、H+向负极移动
题组二 燃料电池
6.(2022·济南高一检测)目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系,下列说法中错误的是( )
A.燃料电池能够使化学反应产生的能量转化为电能
B.燃料电池中通入H2的一极作负极,发生氧化反应
C.在此循环中发生了反应:2H2O2H2↑+O2↑
D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂
7.某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。下列叙述错误的是( )
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是2H2O+2e-===H2↑+2OH-
C.电池总反应为2H2+O2===2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
8.(2022·武汉高一检测)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示,下列说法正确的是( )
A.Pt电极上发生的是氧化反应
B.外电路中,电子从Pt电极流向NiO电极
C.NiO电极上的电极反应式为NO+O2--2e-===NO2
D.O2的电极反应产物是H2O
9.(2022·昆明市第三中学高一期中)化学电源在日常生活和高科技领域中有广泛应用,下列说法错误的是( )
A.甲:正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-
B.乙:锌筒作负极,发生氧化反应,锌筒会变薄
C.丙:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
D.丁:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
10.固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
①多孔电极a为负极
②a极对应的电极反应式为O2+2H2O+4e-===4OH-
③b极的电极反应式为H2-2e-+O2-===H2O
④该电池的总反应式为2H2+O22H2O
A.①② B.②④ C.②③ D.③④
11.(2022·贵州黔东南高一期中)Li-FeS2电池是目前电池中综合性能最好的一种电池,其原理示意图如图所示。已知电池放电时的反应为4Li+FeS2===Fe+2Li2S。下列说法正确的是( )
A.Li为电池的正极,发生氧化反应
B.电流由Li经负载,流向FeS2极
C.正极的电极反应式为FeS2+4e-===Fe+2S2-
D.将熔融的LiCF3SO3改为LiCl的水溶液,电池性能更好
12.最近,科学家研发了“全氢电池”,其工作原理如图所示。 下列说法正确的是( )
A.右边吸附层中发生氧化反应
B.负极的电极反应是H2-2e-+2OH-===2H2O
C.当右边吸附层中产生标准状况下2.24 L氢气时,电子在溶液中通过了0.2 mol
D.电解质溶液中Na+向左移动,ClO向右移动
13.(2022·西安调研)利用反应6NO2+8NH3===7N2+12H2O设计的电池装置如图所示,该装置能有效消除氮氧化物的排放,减轻环境污染。下列说法错误的是( )
A.电极B为正极,发生还原反应
B.当有0.5 mol NO2参与反应时,外电路中转移3 mol电子
C.电池工作时,OH-从右向左移动
D.电极B的电极反应式为2NO2+8e-+4H2O===N2+8OH-
14.(1)银锌电池是一种常见的化学电源,其反应原理:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其工作原理如图所示。
①在装置中Ag2O作________(填“正”或“负”)极发生________(填“还原反应”或“氧化反应”),电极反应式为_________________________________________________________。
②在装置中Zn作________(填“正”或“负”)极,发生________(填“还原反应”或“氧化反应”),电极反应式为________________________________________________________。
(2)将用导线相连的两个铂电极插入KOH溶液中,然后向两极分别通入CO和O2,则发生了原电池反应,该原电池中的负极反应式为____________________________________________
____________________;正极反应式为_______________________________________________
______________________。
15.(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为3Zn+2K2FeO4+8H2O3Zn(OH)2 +2Fe(OH)3+4KOH。请回答下列问题:
①高铁电池的负极材料是________。
②放电时,正极发生________(填“氧化”或“还原”)反应。已知正极反应式为FeO+3e-+4H2O===Fe(OH)3+5OH-,则负极反应式为______________________________________。
③放电时,________(填“正”或“负”)极附近溶液的碱性增强。
(2)锂锰电池的结构示意图如下,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质转移到MnO2晶格中生成LiMnO2。
①外电路的电流方向是由______极流向______极(填字母)。
②正极材料是________________。
③是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”);原因是_________
_______________________________________________________________________________。
第3课时 化学电池
1.A 2.C 3.A
4.B [由方程式可知,Li失去电子,发生氧化反应,作负极,则钢板作正极,A项正确;正极上的电极反应式为:2H2O+2e-===2OH-+H2↑,可知氢气为正极产物,C项正确;电子会从负极流向正极,即电子由锂经导线流向钢板,D项正确。]
5.D [根据电池总反应式知,Zn失电子发生氧化反应,故Zn作负极,Ag2O作正极,故A正确;负极发生反应:Zn+2OH--2e-===Zn(OH)2,消耗OH-,负极区溶液中c(OH-)减小,正极上发生反应:Ag2O+H2O+2e-===2Ag+2OH-,正极区溶液中c(OH-)增大,故B、C正确;放电时,电解质溶液中OH-向负极移动,K+、H+向正极移动,故D错误。]
6.C 7.B
8.C [由离子的定向移动可知NiO电极为原电池的负极, Pt电极为原电池的正极,发生还原反应,A错误;NiO电极为原电池的负极,外电路中,电子从NiO电极流向Pt电极,B错误;NiO电极上NO失电子和氧离子反应生成二氧化氮,所以电极反应式为NO+O2--2e-===NO2,C正确;Pt电极为原电池的正极,O2的电极反应产物是O2-,D错误。]
9.D [甲为纽扣电池,正极为Ag2O得电子发生还原反应,电极反应式为Ag2O+2e-+H2O===2Ag+2OH-,故A正确;乙为锌锰干电池,锌筒作负极,发生氧化反应被溶解,导致锌筒变薄,故B正确;丙为氢氧燃料电池,放电过程中不断生成水,故电解质溶液的酸性减弱,导电能力下降,故C正确;丁中Zn为负极,Cu为正极,原电池工作时Zn2+向Cu电极方向移动,硫酸中氢离子得电子生成氢气,故溶液中H+浓度减小,故D错误。]
10.D [图中电子由多孔电极b通过导线流向多孔电极a,多孔电极b为负极,多孔电极a为正极,①错误;a极对应的电极反应式为O2+4e-===2O2-,②错误;b极的电极反应式为H2-2e-+O2-===H2O,③正确;根据正、负极得失电子数相等,将正、负极电极反应式相加,该电池的总反应式为2H2+O22H2O,④正确。]
11.C 12.B
13.B [根据电池总反应6NO2+8NH3===7N2+12H2O可知,NO2得电子发生还原反应,NH3失电子发生氧化反应,则通入NH3的电极A为负极,通入NO2的电极B为正极,A项正确;根据电池总反应可知,当有6 mol NO2参与反应时,外电路中转移24 mol e-,则当有0.5 mol NO2参与反应时,外电路中转移电子的物质的量为0.5 mol×=2 mol,B项错误;原电池工作时,阴离子移向负极,故OH-从右向左移动,C项正确;电极B为正极,发生还原反应,电极反应式为2NO2+8e-+4H2O===N2+8OH-,D项正确。]
14.(1)①正 还原反应 Ag2O+2e-+H2O===2Ag+2OH- ②负 氧化反应 Zn-2e-+2OH-===Zn(OH)2
(2)2CO-4e-+8OH-===2CO+4H2O O2+4e-+2H2O===4OH-
解析 (2)该原电池中O2得电子,则O2在正极反应,正极反应式为O2+4e-+2H2O===4OH-,CO在负极反应,负极反应式为2CO+8OH--4e-===2CO+4H2O。
15.(1)①Zn ②还原 Zn+2OH--2e-===Zn(OH)2 ③正
(2)①b a ②MnO2 ③否 电极Li是活泼金属,能与水反应
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
