第六章 化学反应与能量 阶段重点突破练(三)(含答案)
文档属性
| 名称 | 第六章 化学反应与能量 阶段重点突破练(三)(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 398.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-31 17:04:08 | ||
图片预览

文档简介
阶段重点突破练(三)
一、吸热反应和放热反应的判断
1.(2022·北京牛栏山一中高一阶段检测)下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀H2SO4反应
B.Ca(OH)2与NH4Cl的反应
C.CO在O2中的燃烧反应
D.灼热的木炭与H2O(g)反应
2.我国新型火箭长征5号采用液氢和液氧作为推进剂。下列有关说法不正确的是( )
A.将氢、氧液化可增加火箭携带燃料总量
B.火箭依靠氢气和氧气燃烧放出的热推进
C.断裂氢、氧分子中的化学键需要吸收能量
D.燃料的总能量小于燃烧产物水的总能量
3.“长征三号乙”运载火箭使用偏二甲肼(C2H8N2)和液态四氧化二氮作推进剂,发生反应:C2H8N2+2N2O4===3N2↑+2CO2↑+4H2O,下列说法正确的是( )
A.断裂C2H8N2和N2O4中的化学键时放出能量
B.C2H8N2具有的能量高于N2具有的能量
C.反应物具有的总能量高于生成物具有的总能量
D.该反应中,C2H8N2作氧化剂
二、吸热反应和放热反应的计算
4.对于放热反应:A+B===C+D,下列说法一定正确的是(EA、EB、EC、ED分别表示物质A、B、C、D所具有的能量)( )
A.EA+EB>EC+ED B.EA>EB+EC
C.EA>EB D.EA+EB<EC+ED
5.(2022·重庆期中)碳燃烧过程中的能量变化如图所示,下列说法正确的是( )
A.1 mol C(s)和 mol O2(g)反应生成1 mol CO(g)放出110.5 kJ热量
B.1 mol CO2(g)反应生成1 mol C(s)和1 mol O2(g)放出393.5 kJ热量
C.1 mol C(s)与 mol O2(g)的总能量小于1 mol CO(g)的总能量
D.碳燃烧时化学能全部转化为热能
6.H2与O2、F2均能发生反应,如图为H2与F2发生反应生成HF过程中的能量变化示意图。请回答下列问题:
(1)完成转化Ⅰ、Ⅱ需要______(填“吸收”或“放出”,下同)能量,完成转化Ⅲ需要______能量。
(2)H2和F2反应的能量变化图可用________(填“A”或“B”)表示。
(3)H2在O2中燃烧的过程主要是________能转化为________能的过程。
三、原电池的工作原理和应用
7.某原电池总反应的离子方程式为:2Fe3++Fe===3Fe2+,能实现该反应的原电池是( )
A B C D
正极 Ag C Fe Cu
负极 Fe Fe Zn Fe
电解质溶液 FeCl3 FeCl2 Fe2(SO4)3 CuSO4
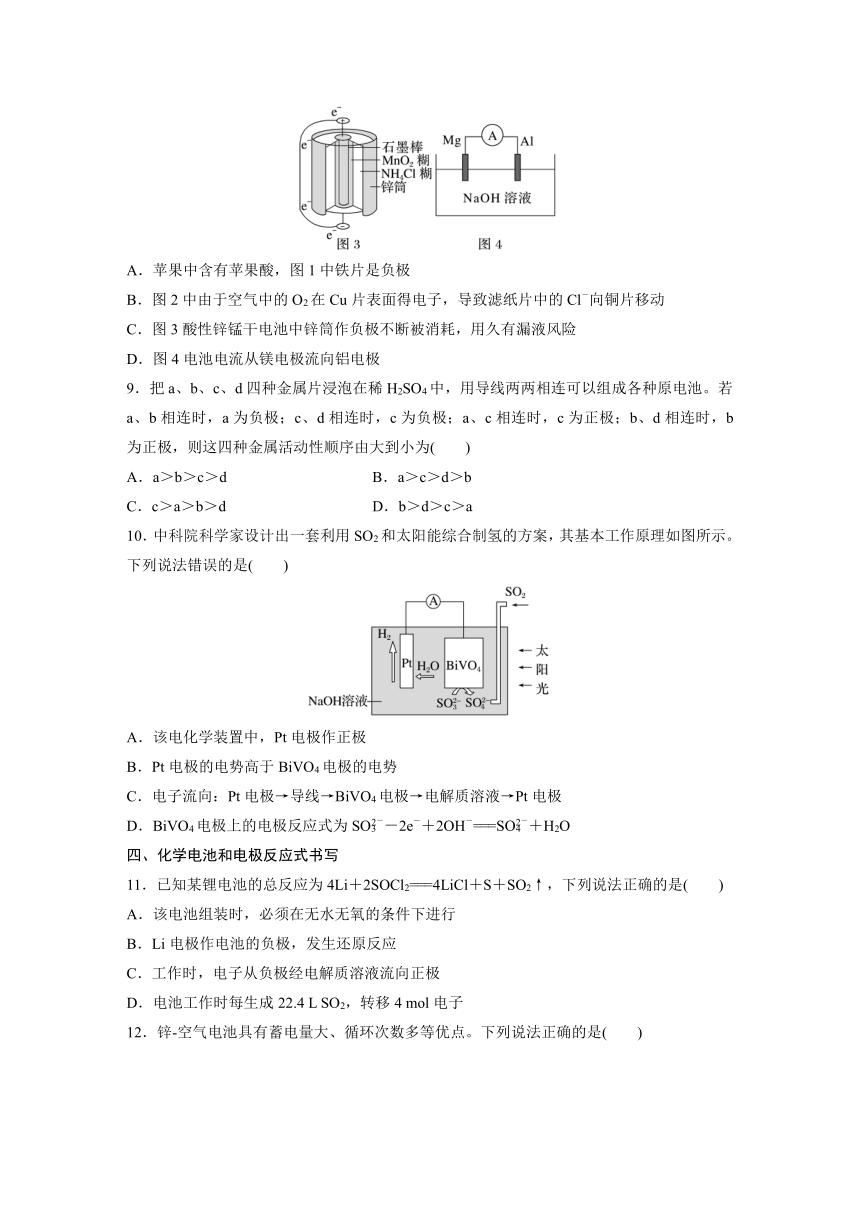
8.我们在课堂上学习和接触过许多有趣的电池,关于下列电池的说法不正确的是( )
A.苹果中含有苹果酸,图1中铁片是负极
B.图2中由于空气中的O2在Cu片表面得电子,导致滤纸片中的Cl-向铜片移动
C.图3酸性锌锰干电池中锌筒作负极不断被消耗,用久有漏液风险
D.图4电池电流从镁电极流向铝电极
9.把a、b、c、d四种金属片浸泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则这四种金属活动性顺序由大到小为( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
10.中科院科学家设计出一套利用SO2和太阳能综合制氢的方案,其基本工作原理如图所示。下列说法错误的是( )
A.该电化学装置中,Pt电极作正极
B.Pt电极的电势高于BiVO4电极的电势
C.电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D.BiVO4电极上的电极反应式为SO-2e-+2OH-===SO+H2O
四、化学电池和电极反应式书写
11.已知某锂电池的总反应为4Li+2SOCl2===4LiCl+S+SO2↑,下列说法正确的是( )
A.该电池组装时,必须在无水无氧的条件下进行
B.Li电极作电池的负极,发生还原反应
C.工作时,电子从负极经电解质溶液流向正极
D.电池工作时每生成22.4 L SO2,转移4 mol电子
12.锌-空气电池具有蓄电量大、循环次数多等优点。下列说法正确的是( )
A.电池放电时Zn电极逐渐溶解
B.石墨为负极
C.电子由石墨经导线流向Zn片
D.电池放电时实现了电能向化学能的转化
13.(2022·杭州高一阶段检测)我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解质溶液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na??2Na2CO3+C。下列说法错误的是( )
A.放电时,ClO向负极移动
B.电子从Na极经导线到Ni极,再经电解质溶液回到Na极
C.放电时,正极反应为3CO2+4e-===2CO+C
D.放电时,Na极发生氧化反应
14.一种铁-空气二次电池放电时的工作原理如图所示,电池反应为2Fe+O2+2H2O===2Fe(OH)2。下列有关该电池放电时的说法正确的是( )
A.能量由电能转变为化学能
B.a极质量不变
C.b极为电池负极
D.电子由电极a经负载流向电极b
15.通过传感器可以监测空气中甲醛含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是( )
A.a为电池的正极,发生还原反应
B.b极的电极反应为HCHO+H2O-4e-===CO2+4H+
C.传感器工作过程中,电解质溶液中硫酸的浓度减小
D.当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
16.电池是人类生产和生活中重要的能量来源,电池的发明是化学对人类的一项重大贡献。
(1)依据NaOH与HCl的反应原理设计原电池,你认为是否可行?__________(填“是”或“否”),理由是______________________________________________________________。
(2)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为__________________________________________________________,
正极反应式为___________________________________________________________________。
(3)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2===4LiCl+S+SO2↑。请回答下列问题:
①电池的负极材料为____________________。
②电池正极发生的电极反应为_____________________________________________________。
阶段重点突破练(三)
1.D 2.D
3.C [断裂化学键时吸收能量,形成化学键时放出能量,故A错误;C2H8N2+2N2O4===3N2↑+2CO2↑+4H2O为放热反应,说明C2H8N2和N2O4具有的能量总和高于N2、CO2和H2O所具有的能量总和,无法确定C2H8N2具有的能量高于N2具有的能量,故B错误、C正确;在C2H8N2+2N2O4===3N2↑+2CO2↑+4H2O反应中,C2H8N2中N元素和C元素的化合价均升高,发生氧化反应,是还原剂,故D错误。]
4.A [反应A+B===C+D是放热反应,则反应物A、B的总能量大于生成物C、D的总能量,即EA+EB>EC+ED。]
5.A [由图可知,1 mol C(s)与1 mol O2(g)的总能量比1 mol CO(g)与 mol O2(g)的总能量高393.5 kJ-283.0 kJ=110.5 kJ,则由1 mol C(s)和 mol O2(g)反应生成1 mol CO(g)放出110.5 kJ热量,A项正确;由图可知,1 mol CO2(g)的总能量比1 mol C(s)和1 mol O2(g)的总能量低,故该反应为吸热反应,应吸收393.5 kJ热量,B项错误;由A项分析可知,1 mol C(s)和 mol O2(g)的总能量大于1 mol CO(g)的总能量,C项错误;碳燃烧时化学能转化为热能、光能等,D项错误。]
6.(1)吸收 放出 (2)A (3)化学 热
解析 (1)断开化学键吸收能量,形成化学键释放能量。转化Ⅰ、Ⅱ是断开化学键的过程,吸收能量;转化Ⅲ是形成化学键的过程,放出能量。(2)由图可知,H2和F2生成HF的反应中,断裂化学键吸收的能量为154 kJ+436 kJ=590 kJ,形成化学键放出的能量为2×565 kJ=1 130 kJ,故是放热反应,则反应物的总能量大于生成物的总能量,A正确。(3)氢气在氧气中燃烧是放热反应,主要是化学能转化为热能的过程。
7.A 8.B
9.B [若a、b相连时,a为负极,根据原电池的工作原理,金属活泼性强的作原电池的负极,故金属的活动性顺序为a>b;c、d相连时,c为负极,所以金属的活动性顺序为c>d;a、c相连时,c为正极,所以金属的活动性顺序为a>c;b、d相连时,b是正极,所以金属的活动性顺序为d>b;则这四种金属活动性顺序为a>c>d>b。]
10.C [A项,该装置为原电池,由Pt电极上的反应:H2O→H2可知,Pt电极上发生还原反应,Pt电极为正极,正确;B项,Pt电极为正极,BiVO4电极为负极,所以Pt电极的电势高于BiVO4电极的电势,正确;C项,电子从BiVO4电极(负极)经导线流向Pt电极(正极),且不能进入溶液,错误;D项,BiVO4电极为负极,发生氧化反应,电极反应式为SO-2e-+2OH-===SO+H2O,正确。]
11.A 12.A
13.B [原电池中,阴离子在电解质溶液中向负极迁移,A正确;电子只在导线中运动,离子在溶液中迁移,形成闭合回路,B错误;放电时,CO2在正极得电子被还原,电极反应式为3CO2+4e-===2CO+C,C正确;放电时,Na作为负极失电子被氧化,发生氧化反应,D正确。]
14.D [电池放电时,化学能转化为电能,故A项错误;a极为负极,铁失去电子生成Fe2+,Fe2+与OH-结合生成Fe(OH)2,电极质量减小,故B项错误;b极为电池正极,故C项错误;a极为负极,电子由电极a经负载流向电极b,故D项正确。]
15.D [氧气得电子,发生还原反应,a为正极,A正确;b极是负极,发生失去电子的氧化反应,故电极反应为HCHO+H2O-4e-===CO2+4H+,B正确;传感器工作过程中,发生氧化还原反应生成水,电解质溶液中硫酸的浓度变小,C正确;负极:HCHO+H2O-4e-===CO2+4H+,当电路中转移2×10-4 mol电子时,反应的甲醛物质的量为5×10-5 mol,质量为1.5 mg,D错误。]
16.(1)否 NaOH与HCl的反应不是氧化还原反应
(2)N2H4-4e-+4OH-===N2+4H2O O2+4e-+2H2O===4OH- (3)①锂 ②2SOCl2+4e-===4Cl-+S+SO2↑
解析 (1)设计成原电池的反应需为氧化还原反应,而NaOH与HCl的反应不是氧化还原反应,故不可行。(2)燃料电池中,通入燃料的电极通常为负极,通入氧气的一极为正极,则通入液体燃料肼(N2H4)的一极为负极,负极发生氧化反应,由图可知负极上有N2生成,电极反应式为N2H4-4e-+4OH-===N2+4H2O;通入氧气的一极为正极,正极发生还原反应,电极反应式为O2+4e-+2H2O===4OH-。(3)①从电池反应4Li+2SOCl2===4LiCl+S+SO2↑可以看出,Li元素由0价升高到+1价,所以电池的负极材料为Li。②SOCl2中的S元素显+4价,产物中S元素为0价,所以一部分SOCl2中的S元素得电子生成S,一部分SOCl2生成SO2,同时氯元素转化为Cl-,电池正极发生的电极反应为2SOCl2+4e-===4Cl-+S+SO2↑。
一、吸热反应和放热反应的判断
1.(2022·北京牛栏山一中高一阶段检测)下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀H2SO4反应
B.Ca(OH)2与NH4Cl的反应
C.CO在O2中的燃烧反应
D.灼热的木炭与H2O(g)反应
2.我国新型火箭长征5号采用液氢和液氧作为推进剂。下列有关说法不正确的是( )
A.将氢、氧液化可增加火箭携带燃料总量
B.火箭依靠氢气和氧气燃烧放出的热推进
C.断裂氢、氧分子中的化学键需要吸收能量
D.燃料的总能量小于燃烧产物水的总能量
3.“长征三号乙”运载火箭使用偏二甲肼(C2H8N2)和液态四氧化二氮作推进剂,发生反应:C2H8N2+2N2O4===3N2↑+2CO2↑+4H2O,下列说法正确的是( )
A.断裂C2H8N2和N2O4中的化学键时放出能量
B.C2H8N2具有的能量高于N2具有的能量
C.反应物具有的总能量高于生成物具有的总能量
D.该反应中,C2H8N2作氧化剂
二、吸热反应和放热反应的计算
4.对于放热反应:A+B===C+D,下列说法一定正确的是(EA、EB、EC、ED分别表示物质A、B、C、D所具有的能量)( )
A.EA+EB>EC+ED B.EA>EB+EC
C.EA>EB D.EA+EB<EC+ED
5.(2022·重庆期中)碳燃烧过程中的能量变化如图所示,下列说法正确的是( )
A.1 mol C(s)和 mol O2(g)反应生成1 mol CO(g)放出110.5 kJ热量
B.1 mol CO2(g)反应生成1 mol C(s)和1 mol O2(g)放出393.5 kJ热量
C.1 mol C(s)与 mol O2(g)的总能量小于1 mol CO(g)的总能量
D.碳燃烧时化学能全部转化为热能
6.H2与O2、F2均能发生反应,如图为H2与F2发生反应生成HF过程中的能量变化示意图。请回答下列问题:
(1)完成转化Ⅰ、Ⅱ需要______(填“吸收”或“放出”,下同)能量,完成转化Ⅲ需要______能量。
(2)H2和F2反应的能量变化图可用________(填“A”或“B”)表示。
(3)H2在O2中燃烧的过程主要是________能转化为________能的过程。
三、原电池的工作原理和应用
7.某原电池总反应的离子方程式为:2Fe3++Fe===3Fe2+,能实现该反应的原电池是( )
A B C D
正极 Ag C Fe Cu
负极 Fe Fe Zn Fe
电解质溶液 FeCl3 FeCl2 Fe2(SO4)3 CuSO4
8.我们在课堂上学习和接触过许多有趣的电池,关于下列电池的说法不正确的是( )
A.苹果中含有苹果酸,图1中铁片是负极
B.图2中由于空气中的O2在Cu片表面得电子,导致滤纸片中的Cl-向铜片移动
C.图3酸性锌锰干电池中锌筒作负极不断被消耗,用久有漏液风险
D.图4电池电流从镁电极流向铝电极
9.把a、b、c、d四种金属片浸泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则这四种金属活动性顺序由大到小为( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
10.中科院科学家设计出一套利用SO2和太阳能综合制氢的方案,其基本工作原理如图所示。下列说法错误的是( )
A.该电化学装置中,Pt电极作正极
B.Pt电极的电势高于BiVO4电极的电势
C.电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D.BiVO4电极上的电极反应式为SO-2e-+2OH-===SO+H2O
四、化学电池和电极反应式书写
11.已知某锂电池的总反应为4Li+2SOCl2===4LiCl+S+SO2↑,下列说法正确的是( )
A.该电池组装时,必须在无水无氧的条件下进行
B.Li电极作电池的负极,发生还原反应
C.工作时,电子从负极经电解质溶液流向正极
D.电池工作时每生成22.4 L SO2,转移4 mol电子
12.锌-空气电池具有蓄电量大、循环次数多等优点。下列说法正确的是( )
A.电池放电时Zn电极逐渐溶解
B.石墨为负极
C.电子由石墨经导线流向Zn片
D.电池放电时实现了电能向化学能的转化
13.(2022·杭州高一阶段检测)我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解质溶液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na??2Na2CO3+C。下列说法错误的是( )
A.放电时,ClO向负极移动
B.电子从Na极经导线到Ni极,再经电解质溶液回到Na极
C.放电时,正极反应为3CO2+4e-===2CO+C
D.放电时,Na极发生氧化反应
14.一种铁-空气二次电池放电时的工作原理如图所示,电池反应为2Fe+O2+2H2O===2Fe(OH)2。下列有关该电池放电时的说法正确的是( )
A.能量由电能转变为化学能
B.a极质量不变
C.b极为电池负极
D.电子由电极a经负载流向电极b
15.通过传感器可以监测空气中甲醛含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是( )
A.a为电池的正极,发生还原反应
B.b极的电极反应为HCHO+H2O-4e-===CO2+4H+
C.传感器工作过程中,电解质溶液中硫酸的浓度减小
D.当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
16.电池是人类生产和生活中重要的能量来源,电池的发明是化学对人类的一项重大贡献。
(1)依据NaOH与HCl的反应原理设计原电池,你认为是否可行?__________(填“是”或“否”),理由是______________________________________________________________。
(2)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为__________________________________________________________,
正极反应式为___________________________________________________________________。
(3)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2===4LiCl+S+SO2↑。请回答下列问题:
①电池的负极材料为____________________。
②电池正极发生的电极反应为_____________________________________________________。
阶段重点突破练(三)
1.D 2.D
3.C [断裂化学键时吸收能量,形成化学键时放出能量,故A错误;C2H8N2+2N2O4===3N2↑+2CO2↑+4H2O为放热反应,说明C2H8N2和N2O4具有的能量总和高于N2、CO2和H2O所具有的能量总和,无法确定C2H8N2具有的能量高于N2具有的能量,故B错误、C正确;在C2H8N2+2N2O4===3N2↑+2CO2↑+4H2O反应中,C2H8N2中N元素和C元素的化合价均升高,发生氧化反应,是还原剂,故D错误。]
4.A [反应A+B===C+D是放热反应,则反应物A、B的总能量大于生成物C、D的总能量,即EA+EB>EC+ED。]
5.A [由图可知,1 mol C(s)与1 mol O2(g)的总能量比1 mol CO(g)与 mol O2(g)的总能量高393.5 kJ-283.0 kJ=110.5 kJ,则由1 mol C(s)和 mol O2(g)反应生成1 mol CO(g)放出110.5 kJ热量,A项正确;由图可知,1 mol CO2(g)的总能量比1 mol C(s)和1 mol O2(g)的总能量低,故该反应为吸热反应,应吸收393.5 kJ热量,B项错误;由A项分析可知,1 mol C(s)和 mol O2(g)的总能量大于1 mol CO(g)的总能量,C项错误;碳燃烧时化学能转化为热能、光能等,D项错误。]
6.(1)吸收 放出 (2)A (3)化学 热
解析 (1)断开化学键吸收能量,形成化学键释放能量。转化Ⅰ、Ⅱ是断开化学键的过程,吸收能量;转化Ⅲ是形成化学键的过程,放出能量。(2)由图可知,H2和F2生成HF的反应中,断裂化学键吸收的能量为154 kJ+436 kJ=590 kJ,形成化学键放出的能量为2×565 kJ=1 130 kJ,故是放热反应,则反应物的总能量大于生成物的总能量,A正确。(3)氢气在氧气中燃烧是放热反应,主要是化学能转化为热能的过程。
7.A 8.B
9.B [若a、b相连时,a为负极,根据原电池的工作原理,金属活泼性强的作原电池的负极,故金属的活动性顺序为a>b;c、d相连时,c为负极,所以金属的活动性顺序为c>d;a、c相连时,c为正极,所以金属的活动性顺序为a>c;b、d相连时,b是正极,所以金属的活动性顺序为d>b;则这四种金属活动性顺序为a>c>d>b。]
10.C [A项,该装置为原电池,由Pt电极上的反应:H2O→H2可知,Pt电极上发生还原反应,Pt电极为正极,正确;B项,Pt电极为正极,BiVO4电极为负极,所以Pt电极的电势高于BiVO4电极的电势,正确;C项,电子从BiVO4电极(负极)经导线流向Pt电极(正极),且不能进入溶液,错误;D项,BiVO4电极为负极,发生氧化反应,电极反应式为SO-2e-+2OH-===SO+H2O,正确。]
11.A 12.A
13.B [原电池中,阴离子在电解质溶液中向负极迁移,A正确;电子只在导线中运动,离子在溶液中迁移,形成闭合回路,B错误;放电时,CO2在正极得电子被还原,电极反应式为3CO2+4e-===2CO+C,C正确;放电时,Na作为负极失电子被氧化,发生氧化反应,D正确。]
14.D [电池放电时,化学能转化为电能,故A项错误;a极为负极,铁失去电子生成Fe2+,Fe2+与OH-结合生成Fe(OH)2,电极质量减小,故B项错误;b极为电池正极,故C项错误;a极为负极,电子由电极a经负载流向电极b,故D项正确。]
15.D [氧气得电子,发生还原反应,a为正极,A正确;b极是负极,发生失去电子的氧化反应,故电极反应为HCHO+H2O-4e-===CO2+4H+,B正确;传感器工作过程中,发生氧化还原反应生成水,电解质溶液中硫酸的浓度变小,C正确;负极:HCHO+H2O-4e-===CO2+4H+,当电路中转移2×10-4 mol电子时,反应的甲醛物质的量为5×10-5 mol,质量为1.5 mg,D错误。]
16.(1)否 NaOH与HCl的反应不是氧化还原反应
(2)N2H4-4e-+4OH-===N2+4H2O O2+4e-+2H2O===4OH- (3)①锂 ②2SOCl2+4e-===4Cl-+S+SO2↑
解析 (1)设计成原电池的反应需为氧化还原反应,而NaOH与HCl的反应不是氧化还原反应,故不可行。(2)燃料电池中,通入燃料的电极通常为负极,通入氧气的一极为正极,则通入液体燃料肼(N2H4)的一极为负极,负极发生氧化反应,由图可知负极上有N2生成,电极反应式为N2H4-4e-+4OH-===N2+4H2O;通入氧气的一极为正极,正极发生还原反应,电极反应式为O2+4e-+2H2O===4OH-。(3)①从电池反应4Li+2SOCl2===4LiCl+S+SO2↑可以看出,Li元素由0价升高到+1价,所以电池的负极材料为Li。②SOCl2中的S元素显+4价,产物中S元素为0价,所以一部分SOCl2中的S元素得电子生成S,一部分SOCl2生成SO2,同时氯元素转化为Cl-,电池正极发生的电极反应为2SOCl2+4e-===4Cl-+S+SO2↑。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
