化学人教版(2019)选择性必修2 2.2.1多样的分子空间结构(共38张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.2.1多样的分子空间结构(共38张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 11.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-01 07:59:34 | ||
图片预览




文档简介
(共38张PPT)
第二节 分子的空间结构
一
二
分子结构的测定
多样的分子空间结构
三
价层电子对互斥模型
四
杂化轨道理论简介
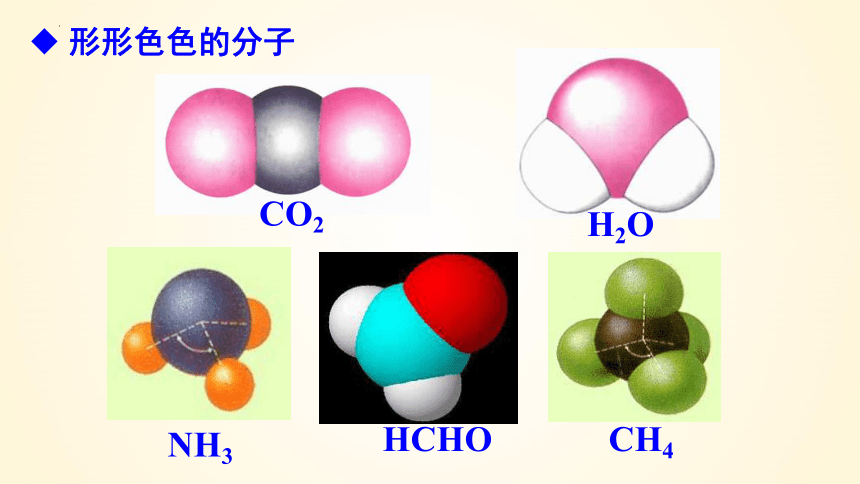
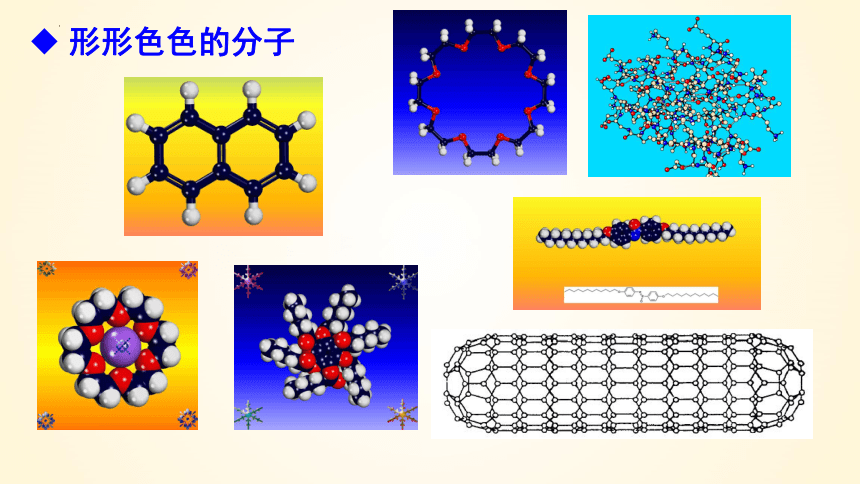
形形色色的分子
H2O
CO2
NH3
HCHO
CH4
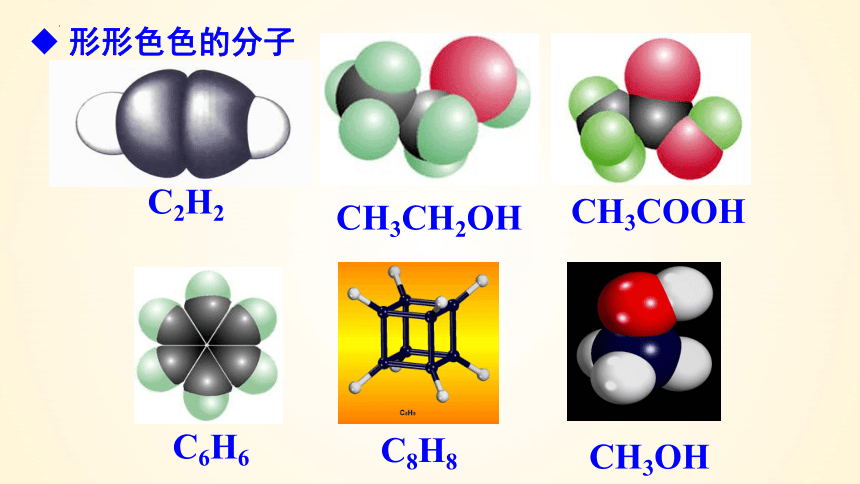
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
C2H2
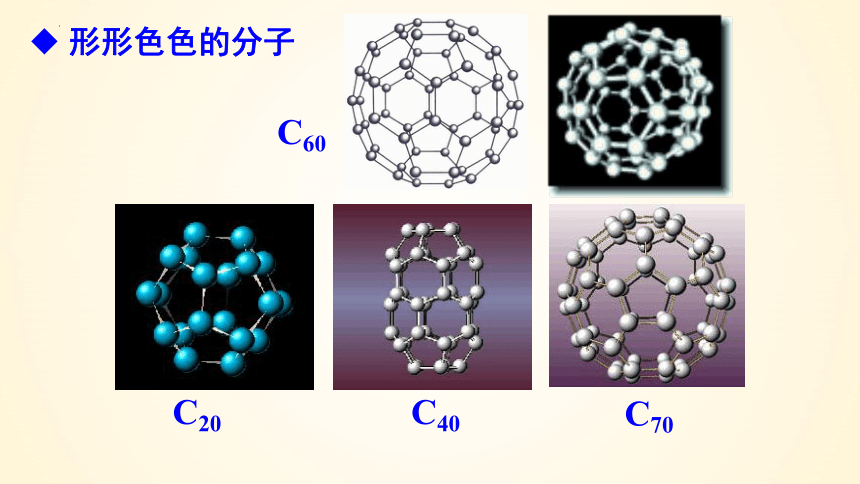
形形色色的分子
C60
C20
C40
C70
形形色色的分子
形形色色的分子
→如今,科学家应用了许多测定分子结构的现代仪器和方法,如红外光谱、质谱法、晶体X射线衍射(下一章讲)等
红外光谱仪
一、分子结构的测定
肉眼不能看到分子,科学家是怎样知道分子的结构的呢?
→早年的科学家主要靠对物质的化学性质进行系统总结,得出规律后推测分子的结构。
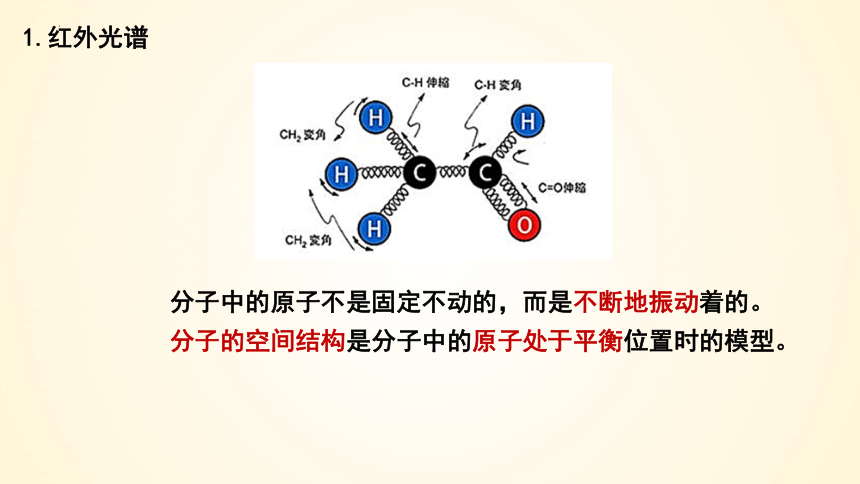
分子中的原子不是固定不动的,而是不断地振动着的。分子的空间结构是分子中的原子处于平衡位置时的模型。
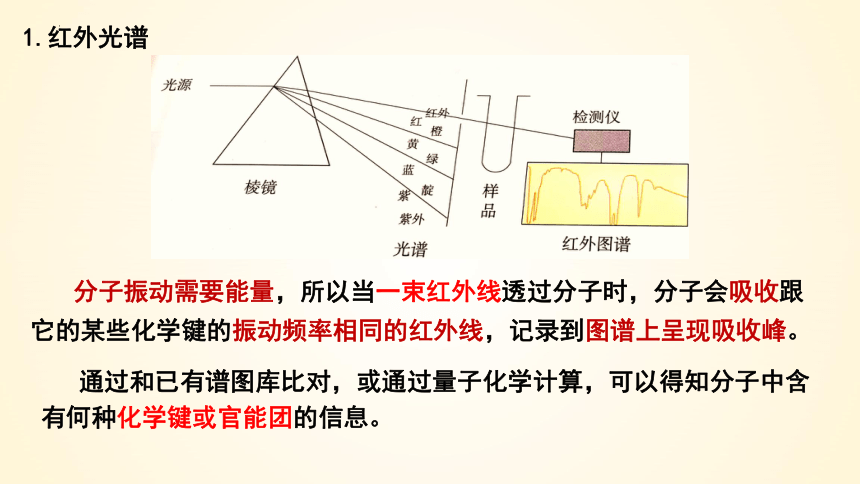
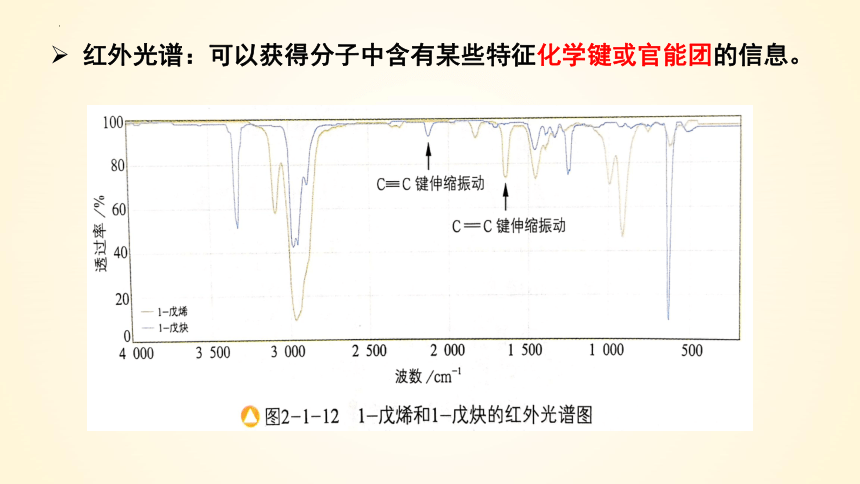
1.红外光谱
分子振动需要能量,所以当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,记录到图谱上呈现吸收峰。
1.红外光谱
通过和已有谱图库比对,或通过量子化学计算,可以得知分子中含有何种化学键或官能团的信息。
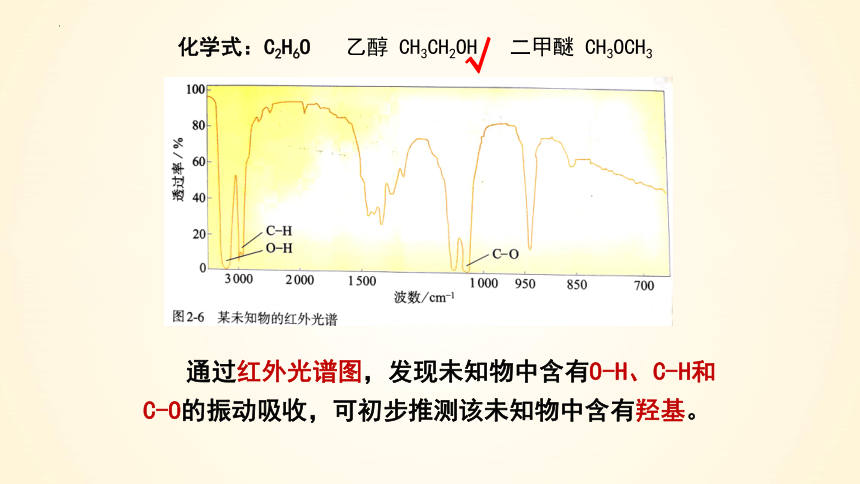
通过红外光谱图,发现未知物中含有O-H、C-H和C-O的振动吸收,可初步推测该未知物中含有羟基。
化学式:C2H6O
乙醇 CH3CH2OH 二甲醚 CH3OCH3
√
红外光谱:可以获得分子中含有某些特征化学键或官能团的信息。
【科学·技术·社会】P42
用质谱法测定分子的相对分子质量
纵坐标表示相对丰度,横坐标表示粒子的相对质量与其电荷数之比(m/z),简称质荷比,化学家通过分析得知,被测物的相对分子质量是92,该物质是甲苯。
核磁共振氢谱法(NMR)
:分析等效氢的种类
1.下列说法中不正确的是( )
A.可用光谱仪鉴定元素
B.可用红外光谱仪判断分子的结构
C.可用质谱仪确定分子的相对分子质量
D.可用焰色试验确定所有金属
D
同步练习
2.已知某分子质谱图如图所示,且分子的红外光谱信息中含有C—O、C—H、O—H共价键的吸收峰。下列关于其分子结构的叙述中正确的是( )
同步练习
A.该分子的结构为CH3CH2OH
B.该分子的相对分子质量可能为27、31、45或46
C.该分子的结构为CH3—O—CH3
D.该分子的红外光谱和质谱都可以反映分子结构的信息
A
3.如图所示是某分子式为C4H8O2的有机物的红外光谱图,则该有机物可能为( )
同步练习
A
A.CH3COOCH2CH3 B.CH3CH2CH2COOH
C.HCOOCH2CH2CH3 D.(CH3)2CHCH2COOH
O2
HCl
二、多样的分子空间结构
→大多数分子是由两个以上原子构成的,于是分子就有了原子的几何学关系和形状,这就是分子的空间结构。
1.双原子分子 直线形
二、多样的分子空间结构
2.三原子分子 直线形 和 V形(角形)
键角180°
键角105°
直线形
V形(角形)
3.四原子分子 平面三角形和三角锥形等
二、多样的分子空间结构
键角约120°
键角107°
甲醛(HCHO)
平面三角形
三角锥形
BF3
B
F
F
F
键角120°
平面正三角形
二、多样的分子空间结构
4.五原子分子
最常见的是四面体形
正四面体形
键角109°28′
→常见的呈现正四面体的粒子:CCl4、CBr4、SiCl4、SiH4、NH4+等
→CH3Cl、CH3Cl2、CHCl3为四面体形,但不是正四面体形
→键长和键角共同决定分子的空间结构
P49
分子空间结构模型
用橡皮泥制作分子的空间结构模型
一些分子的空间结构模型
【资料卡片】P44
正八面体形
足球烯
皇冠形
己烷
>
分子空间结构与其稳定性有关
正四面体
键角60°
为什么甲烷分子的空间结构是正四面体形而不是正方形?
【思考交流1】
空间结构:正四面体形 键角:109°28′
C
H
H
H
H
··
··
··
··
为什么甲烷分子的空间结构是正四面体形而不是正方形?
【思考交流1】
成键电子对之间存在相互排斥作用,为减小斥力,相互之间尽可能远离,因此分子的空间结构受到影响。一般,分子尽可能采取对称的空间结构以减小斥力
C
H
H
H
H
··
··
··
··
电子对数
电子对互斥
气球空间互斥
2
3
4
直线形
空间构型
“气球空间互斥”类比“电子对互斥”
正四面体形
平面三角形
(1)红外光谱可以推断化学键或官能团的种类,能否确认化学键或官能团的个数?
不能
(2)硫化氢(H2S)分子中,两个H—S键的夹角接近90°,H2S分子是哪种空间结构?二硫化碳(CS2)分子中,两个C=S键的夹角是180°,CS2分子是哪种空间结构?
V形
直线形
(3)科学家研制出可望成为高效火箭推进剂的N(NO2)3如图所示。
已知该分子中N—N—N键角都是108.1°,
试推测四个氮原子围成的空间是正四面体吗?
不是正四面体而是三角锥形。
【思考交流2】
1.四原子分子不一定都是平面三角形或三角锥形。如白磷(P4)分子,四个磷原子位于正四面体的四个顶点,键角为60°,且该正四面体的空间结构和键角与CH4的正四面体空间结构和键角均不同
核心归纳:
2.常见的AB4型分子或离子:CX4(X为卤素原子或氢原子)、SiCl4、SiH4、NH4+,通常为正四面体形。AB4型分子(如CH4)中的1~3个B原子被其他原子取代后仍为四面体形,但不是正四面体形结构。
3.记住一些常见分子的空间结构及键角,则可推测组成相似的其他分子的空间结构。如CO2与CS2、H2O与H2S、NH3与PH3、CH4与CCl4等。
1.2013年诺贝尔化学奖授予美国科学家马丁·卡普拉斯、迈克尔·莱维特、阿里耶·瓦谢勒,以表彰他们“在开发多尺度复杂化学系统模型方面所做的贡献”。这种用电脑取代木棒作试验模型,催生了现代化学研究手段的一次新飞跃。下列不属于现代化学对物质结构进行研究的手段的是
A.X射线 B.天平
C.质谱 D.核磁共振
理解应用
B
理解应用
2.科学家最近研制出有望成为高效火箭推进剂的N(NO2)3,如图。已知该分子中N—N—N键键角都是108.1°,下列有关N(NO2)3的说法不正确的是
D
A.该分子中既含有非极性键又含有极性键
B.分子中四个氮原子不共平面
C.该物质既有氧化性又有还原性
D. 15.2 g该物质含有6.02×1022个原子
3.能说明CH4分子不是平面四边形,而是正四面体结构的是 ( )
A.两个键之间的夹角为109°28′
B.C—H为极性共价键
C.4个C—H的键能、键长都相等
D.二氯甲烷(CH2Cl2)只有一种(不存在同分异构体)
AD
理解应用
4.下列物质中,分子的空间结构与氨分子相似的是
A.CO2 B.H2S
C.PCl3 D.SiCl4
C
理解应用
5.下列物质的空间结构不同于其他物质的是
A.H2O B.CS2
C.BeCl2 D.CO2
A
6.下列常见分子的空间结构或键角正确的是( )
A.CH2O:三角锥形
B.NH3:键角109°28′
C.H2O:键角180°
D.CH4:正四面体形
理解应用
D
7.下列分子中,所有原子不可能共处于同一平面上的是( )
A.H2S B.CS2
C.CH2O D.SiH4
理解应用
D
8.下列分子中键角最大的是( )
A.H2O B.CO2 C.CH2O D.NH3
B
9.三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示。下列有关三硫化四磷说法中正确的是 ( )
理解应用
D
A.该物质中磷元素的化合价为+3
B.该物质分子结构中S、P最外层电子数均不为8
C.该物质分子中全是极性共价键
D.22 g该物质含硫原子的数目约为1.806×1023
10.第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其空间结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
理解应用
B
A.R原子不满足8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°两种
C.分子中5个R—Cl键键能不都相同
D.RCl5受热后会分解生成分子空间结构呈三角锥形的RCl3
11. SF6的立体构型如图1所示,请按照图1的表示方法在图2中表示OSF4分子中O、S、F原子的空间位置。已知OSF4分子中O、S间为共价双键,S、F间为共价单键。
理解应用
解析:SF6的立体构型为八面体形,如图1;
根据题目条件知OSF4立体构型为三角双锥形
二、多样的分子空间结构
课堂小结
一、分子结构的测定
红外光谱——化学键或官能团
质谱——相对分子质量
三原子分子的空间结构有直线形和V形(又称角形)两种。
CO2直线形
H2O V形
大多数四原子分子采取平面三角形和三角锥两种空间结构。
五原子分子的形状更多,最常见的是四面体形,如甲烷,键角109°28
第二节 分子的空间结构
一
二
分子结构的测定
多样的分子空间结构
三
价层电子对互斥模型
四
杂化轨道理论简介
形形色色的分子
H2O
CO2
NH3
HCHO
CH4
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
C2H2
形形色色的分子
C60
C20
C40
C70
形形色色的分子
形形色色的分子
→如今,科学家应用了许多测定分子结构的现代仪器和方法,如红外光谱、质谱法、晶体X射线衍射(下一章讲)等
红外光谱仪
一、分子结构的测定
肉眼不能看到分子,科学家是怎样知道分子的结构的呢?
→早年的科学家主要靠对物质的化学性质进行系统总结,得出规律后推测分子的结构。
分子中的原子不是固定不动的,而是不断地振动着的。分子的空间结构是分子中的原子处于平衡位置时的模型。
1.红外光谱
分子振动需要能量,所以当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,记录到图谱上呈现吸收峰。
1.红外光谱
通过和已有谱图库比对,或通过量子化学计算,可以得知分子中含有何种化学键或官能团的信息。
通过红外光谱图,发现未知物中含有O-H、C-H和C-O的振动吸收,可初步推测该未知物中含有羟基。
化学式:C2H6O
乙醇 CH3CH2OH 二甲醚 CH3OCH3
√
红外光谱:可以获得分子中含有某些特征化学键或官能团的信息。
【科学·技术·社会】P42
用质谱法测定分子的相对分子质量
纵坐标表示相对丰度,横坐标表示粒子的相对质量与其电荷数之比(m/z),简称质荷比,化学家通过分析得知,被测物的相对分子质量是92,该物质是甲苯。
核磁共振氢谱法(NMR)
:分析等效氢的种类
1.下列说法中不正确的是( )
A.可用光谱仪鉴定元素
B.可用红外光谱仪判断分子的结构
C.可用质谱仪确定分子的相对分子质量
D.可用焰色试验确定所有金属
D
同步练习
2.已知某分子质谱图如图所示,且分子的红外光谱信息中含有C—O、C—H、O—H共价键的吸收峰。下列关于其分子结构的叙述中正确的是( )
同步练习
A.该分子的结构为CH3CH2OH
B.该分子的相对分子质量可能为27、31、45或46
C.该分子的结构为CH3—O—CH3
D.该分子的红外光谱和质谱都可以反映分子结构的信息
A
3.如图所示是某分子式为C4H8O2的有机物的红外光谱图,则该有机物可能为( )
同步练习
A
A.CH3COOCH2CH3 B.CH3CH2CH2COOH
C.HCOOCH2CH2CH3 D.(CH3)2CHCH2COOH
O2
HCl
二、多样的分子空间结构
→大多数分子是由两个以上原子构成的,于是分子就有了原子的几何学关系和形状,这就是分子的空间结构。
1.双原子分子 直线形
二、多样的分子空间结构
2.三原子分子 直线形 和 V形(角形)
键角180°
键角105°
直线形
V形(角形)
3.四原子分子 平面三角形和三角锥形等
二、多样的分子空间结构
键角约120°
键角107°
甲醛(HCHO)
平面三角形
三角锥形
BF3
B
F
F
F
键角120°
平面正三角形
二、多样的分子空间结构
4.五原子分子
最常见的是四面体形
正四面体形
键角109°28′
→常见的呈现正四面体的粒子:CCl4、CBr4、SiCl4、SiH4、NH4+等
→CH3Cl、CH3Cl2、CHCl3为四面体形,但不是正四面体形
→键长和键角共同决定分子的空间结构
P49
分子空间结构模型
用橡皮泥制作分子的空间结构模型
一些分子的空间结构模型
【资料卡片】P44
正八面体形
足球烯
皇冠形
己烷
>
分子空间结构与其稳定性有关
正四面体
键角60°
为什么甲烷分子的空间结构是正四面体形而不是正方形?
【思考交流1】
空间结构:正四面体形 键角:109°28′
C
H
H
H
H
··
··
··
··
为什么甲烷分子的空间结构是正四面体形而不是正方形?
【思考交流1】
成键电子对之间存在相互排斥作用,为减小斥力,相互之间尽可能远离,因此分子的空间结构受到影响。一般,分子尽可能采取对称的空间结构以减小斥力
C
H
H
H
H
··
··
··
··
电子对数
电子对互斥
气球空间互斥
2
3
4
直线形
空间构型
“气球空间互斥”类比“电子对互斥”
正四面体形
平面三角形
(1)红外光谱可以推断化学键或官能团的种类,能否确认化学键或官能团的个数?
不能
(2)硫化氢(H2S)分子中,两个H—S键的夹角接近90°,H2S分子是哪种空间结构?二硫化碳(CS2)分子中,两个C=S键的夹角是180°,CS2分子是哪种空间结构?
V形
直线形
(3)科学家研制出可望成为高效火箭推进剂的N(NO2)3如图所示。
已知该分子中N—N—N键角都是108.1°,
试推测四个氮原子围成的空间是正四面体吗?
不是正四面体而是三角锥形。
【思考交流2】
1.四原子分子不一定都是平面三角形或三角锥形。如白磷(P4)分子,四个磷原子位于正四面体的四个顶点,键角为60°,且该正四面体的空间结构和键角与CH4的正四面体空间结构和键角均不同
核心归纳:
2.常见的AB4型分子或离子:CX4(X为卤素原子或氢原子)、SiCl4、SiH4、NH4+,通常为正四面体形。AB4型分子(如CH4)中的1~3个B原子被其他原子取代后仍为四面体形,但不是正四面体形结构。
3.记住一些常见分子的空间结构及键角,则可推测组成相似的其他分子的空间结构。如CO2与CS2、H2O与H2S、NH3与PH3、CH4与CCl4等。
1.2013年诺贝尔化学奖授予美国科学家马丁·卡普拉斯、迈克尔·莱维特、阿里耶·瓦谢勒,以表彰他们“在开发多尺度复杂化学系统模型方面所做的贡献”。这种用电脑取代木棒作试验模型,催生了现代化学研究手段的一次新飞跃。下列不属于现代化学对物质结构进行研究的手段的是
A.X射线 B.天平
C.质谱 D.核磁共振
理解应用
B
理解应用
2.科学家最近研制出有望成为高效火箭推进剂的N(NO2)3,如图。已知该分子中N—N—N键键角都是108.1°,下列有关N(NO2)3的说法不正确的是
D
A.该分子中既含有非极性键又含有极性键
B.分子中四个氮原子不共平面
C.该物质既有氧化性又有还原性
D. 15.2 g该物质含有6.02×1022个原子
3.能说明CH4分子不是平面四边形,而是正四面体结构的是 ( )
A.两个键之间的夹角为109°28′
B.C—H为极性共价键
C.4个C—H的键能、键长都相等
D.二氯甲烷(CH2Cl2)只有一种(不存在同分异构体)
AD
理解应用
4.下列物质中,分子的空间结构与氨分子相似的是
A.CO2 B.H2S
C.PCl3 D.SiCl4
C
理解应用
5.下列物质的空间结构不同于其他物质的是
A.H2O B.CS2
C.BeCl2 D.CO2
A
6.下列常见分子的空间结构或键角正确的是( )
A.CH2O:三角锥形
B.NH3:键角109°28′
C.H2O:键角180°
D.CH4:正四面体形
理解应用
D
7.下列分子中,所有原子不可能共处于同一平面上的是( )
A.H2S B.CS2
C.CH2O D.SiH4
理解应用
D
8.下列分子中键角最大的是( )
A.H2O B.CO2 C.CH2O D.NH3
B
9.三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示。下列有关三硫化四磷说法中正确的是 ( )
理解应用
D
A.该物质中磷元素的化合价为+3
B.该物质分子结构中S、P最外层电子数均不为8
C.该物质分子中全是极性共价键
D.22 g该物质含硫原子的数目约为1.806×1023
10.第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其空间结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
理解应用
B
A.R原子不满足8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°两种
C.分子中5个R—Cl键键能不都相同
D.RCl5受热后会分解生成分子空间结构呈三角锥形的RCl3
11. SF6的立体构型如图1所示,请按照图1的表示方法在图2中表示OSF4分子中O、S、F原子的空间位置。已知OSF4分子中O、S间为共价双键,S、F间为共价单键。
理解应用
解析:SF6的立体构型为八面体形,如图1;
根据题目条件知OSF4立体构型为三角双锥形
二、多样的分子空间结构
课堂小结
一、分子结构的测定
红外光谱——化学键或官能团
质谱——相对分子质量
三原子分子的空间结构有直线形和V形(又称角形)两种。
CO2直线形
H2O V形
大多数四原子分子采取平面三角形和三角锥两种空间结构。
五原子分子的形状更多,最常见的是四面体形,如甲烷,键角109°28
