化学人教版(2019)选择性必修3 3.1.2 卤代烃的化学性质及其应用(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 3.1.2 卤代烃的化学性质及其应用(共27张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 8.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-01 08:01:35 | ||
图片预览







文档简介
(共27张PPT)
走进奇妙的化学世界
选择性必修3
第三章 烃的衍生物
第一节 卤代烃
【思考】
分析卤代烃的结构特点,推测卤代烃具有怎样的化学性质。
卤代烃中卤素原子吸引电子能力较强,共用电子对偏向卤素原子,使C—X键具有较强的极性,所以卤代烃具有较强的反应活性,易发生取代反应和消去反应。
碳卤键
官能团:
X
C
δ—
δ+
学习
目标
第2课时
卤代烃的化学性质及应用
PART
01
PART
02
通过从卤代烃的官能团及其转化角度认识卤代烃取代反应、消去反应的特点和规律,了解有机反应类型与有机化合物分子结构特点之间的关系。
掌握卤代烃在有机合成中的桥梁作用,培养“科学探究与社会责任”的核心素养
对比乙烷的结构式,比较两者的异同,预测溴乙烷的化学性质。
溴乙烷和乙烷的结构相似,区别在于C-H键与C-Br键的不同。
C-Br键为极性键,由于溴原子吸引电子能力强,C-Br键易断裂,使溴原子易被取代。由于官能团(C-Br)的作用,溴乙烷的化学性质比乙烷活泼,能发生许多化学反应。
元素 H C Br
电负性 2.1 2.5 2.8
在卤代烃分子中,由于卤素原子的电负性比碳原子的大,使C—X的电子向卤素原子偏移,进而使碳原子带部分正电荷(δ+),卤素原子带部分负电荷(δ-),这样就形成一个极性较强的共价键:Cδ+—Xδ-。
因此,卤代烃在化学反应中,C—X较易断裂,使卤素原子被其他原子或原子团所取代,生成负离子而离去。
由于卤素原子的引入使卤代烃的反应活性增强。
学习任务一:卤代烃的化学性质
1.取代反应(水解反应)
反应条件:
NaOH水溶液、加热
反应原理:
羟基取代溴原子
C2H5—Br + H--OH C2H5—OH + HBr
△
NaOH + HBr == NaBr + H2O
总反应:
CH3CH2Br + NaOH
CH3CH2OH + NaBr
H2O
△
【例】请写出下列卤代烃水解的方程式:
思考:CH3CH2Br+NaCN(aq)反应的产物?
CH3 C CH2Br
CH3
CH3
Br
CH3CH2Br
CH3CH CH2CH3
Br
①所有卤代烃在一定条件下都能发生水解。
②卤素原子直接与苯环相连的卤代芳香烃水解反应条件比较苛刻
R-X + NaOH R-OH + NaX
水
△
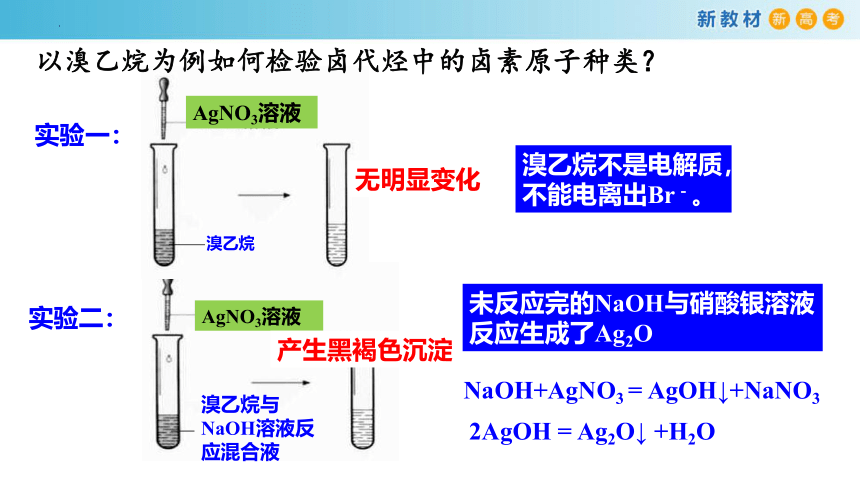
溴乙烷与NaOH溶液反应混合液
AgNO3溶液
实验一:
溴乙烷
AgNO3溶液
无明显变化
溴乙烷不是电解质,不能电离出Br-。
实验二:
产生黑褐色沉淀
未反应完的NaOH与硝酸银溶液反应生成了Ag2O
NaOH+AgNO3 = AgOH↓+NaNO3
2AgOH = Ag2O↓ +H2O
以溴乙烷为例如何检验卤代烃中的卤素原子种类?
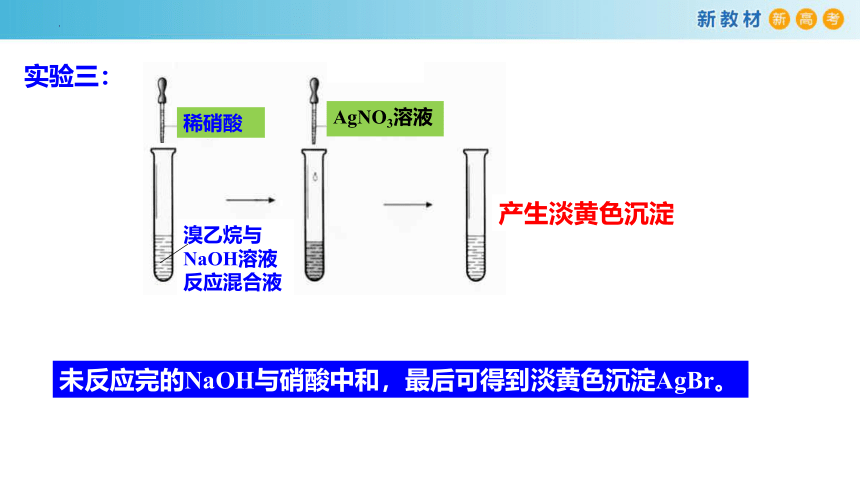
实验三:
未反应完的NaOH与硝酸中和,最后可得到淡黄色沉淀AgBr。
溴乙烷与NaOH溶液反应混合液
稀硝酸
AgNO3溶液
产生淡黄色沉淀
AgNO3溶液
NaOH溶液共热
水解
HNO3溶液
酸化
R-X
有沉淀产生
AgI
白色↓
淡黄色↓
黄色↓
AgCl
AgBr
Cl元素
Br元素
I元素
检验卤代烃中的卤原子一般流程:
该步骤必不可少
在卤代烃分子中,由于卤原子的吸电子作用,不仅使得α-C带部分正电荷,也使β-C带有更少量的正电荷,从而使β-H的活泼性增强,能在强碱的作用下,失去一分子卤化氢,生成烯烃,这就是卤代烃的消去反应。
C
C
Br
H
H
H
H
H
Br
δ+
δ-
δ++
现象:
高锰酸钾酸性溶液褪色
实验:
结论:
生成的气体分子中含有不饱和碳碳键
溴乙烷与NaOH的乙醇混合液
反应原理:
CH2—CH2 +NaOH CH2=CH2↑ +NaBr +H2O
Br
H
乙醇
△
有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而形成不饱和键(双键或三键)的化合物的反应。。
消去反应:
2.溴乙烷的消去反应(消除反应)
思考:下列卤代烃能否发生消去反应?
①CH3I
CH2Br
③
Br
CH3CH CHCH3
Br
⑤
Br
⑥
CH3 C CH2Br
CH3
CH3
②
CH3CHBr2
④
由此你能得出什么结论?
发生消去反应的条件:
①烃中碳原子数≥2
②连卤原子的相邻碳原子上有氢原子
1、反应条件:
+NaOH
— C— C—
H
X
醇
C=C
+NaX+H2O
HX+NaOH ===NaX +H2O
强碱的醇溶液、加热
2、物质结构条件:
写出发生消去反应的方程式。
2. CH3CHCHBrCH3
—
CH3
思考:能发生消去反应的卤代烃,其有机产物仅为一种吗?
有多个邻位碳原子,且邻位碳原子上均有氢原子时,且不对称时消去反应可能生成多种产物。
判断:下列物质中,发生消去反应后可生成几种烯烃?
2种
1种
CH3
CH2CH2CH3
C
Br
CH2CH3
3种
思考:溴乙烷与NaOH的醇溶液的反应,气体产物的检验
(1)分析反应产生的气体中可能含有哪些杂质?
(2)为什么要在气体通入酸性KMnO4溶液前
加一个盛有水的试管?
溴乙烷、乙醇、水蒸汽
除去挥发出来的乙醇。
乙醇也能使酸性高锰酸钾溶液褪色,干扰乙烯的检验。
(3)除酸性高锰酸钾溶液外还可以用什么来检验乙烯,此时气体还用先通入水中吗?理由是?
溴水、溴的四氯化碳溶液。
不用;乙醇与溴不反应,不会干扰乙烯的检验。
反应类型 消去反应 水解(取代)反应
反应条件
卤代烃的 断键规律
结构特点
产物特征
归纳总结
卤代烃的消去反应与水解反应的比较
NaOH醇溶液、加热
NaOH水溶液、加热
与X相连的C的邻位C上有H原子
含C—X键即可
消去HX,引入碳碳双键或碳碳三键
在碳上引入—OH,生成含—OH的有机物(醇)
卤代烯烃的某些化学性质与烯烃的相似,能发生加成反应和加聚反应。
聚氯乙烯和聚四氟乙烯都是用途广泛的高分子材料。
(3)加成和加聚反应
总结
X
C
C
H
OH
C
C
H
C
C
消去反应
取代反应
结构
性质
决定
反映
NaOH
乙醇
水
△
△
δ+
δ-
析疑:首先CH3CH2Br在NaOH乙醇溶液中发生消去反应,生成乙烯,乙烯与Br2发生加成反应得到CH2BrCH2Br, 最后CH2BrCH2Br在NaOH水溶液中发生取代反应,即可得到CH2OHCH2OH。
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,
如何实现
学习任务二:卤代烃在有机合成中的应用
烃、卤代烃、醇之间的衍变关系
CH2=CH2 CH3CH2--Br CH3CH2-OH
①
②
③
④
⑤
⑥
C
OH
O—H
脱去水分子
C=O
+H2O
提示:
2.在烃分子中引入羟基
例如由乙烯制乙二醇,先用乙烯与氯气发生加成反应制取1,2 二氯乙烷,再用1,2 二氯乙烷和氢氧化钠溶液发生水解反应制得乙二醇。
R-X + NaOH R-OH + NaX
H2O
△
消去
1-丁烯
加成
HCl
2-氯丁烷
3.改变某些官能团的位置
例如由1 -丁烯制取2 -丁烯,先由1 丁烯与溴化氢加成得到2 氯丁烷,再由2 氯丁烷发生消去反应得到2 丁烯。
2-丁烯
再例如由1- 溴丙烷制取2- 溴丙烷,先由1- 溴丙烷通过消去反应制丙烯,再由丙烯与溴化氢加成得到2- 溴丙烷。
1-溴丙烷
消去
丙烯
加成
HBr
2-溴丙烷
4.改变某些官能团的数目
例如由1- 溴丙烷制取1,2- 二溴丙烷,先由1- 溴丙烷通过消去反应制丙烯,再由丙烯与溴水加成得到1,2- 二溴丙烷。
1-溴丙烷
丙烯
1,2-二溴丙烷
NaOH醇溶液
加热
溴水
1、 根据下面的反应路线及所给信息填空。
(1)A的结构简式是____________名称是__________
(2)①的反应类型是__________②的反应类型是________
(3)反应④的化学方程式是
________________________________
环己烷
取代
消去
Br
Br
+2NaOH
醇
△
+2NaBr+2H2O
解析:由A在光照条件下与Cl2反应生成一氯环己烷,联想到烷烃的取代,可确定A为环己烷,卤代烃在强碱的醇溶液中加热时发生消去反应生成烯烃,环己烯与Br2的四氯化碳溶液发生加成反应,生成1,2 二溴环己烷,其消去两分子HBr得最终产物。
3。设计合成路线
①、以乙烷为主要原料制备CH3CH2OH。
②、由乙烯为主要原料来制HOCH2CH2OH。
Br2
CH2=CH2
CH2Br
CH2Br
NaOH、 H2O
△
CH2OH
CH2OH
NaOH、 H2O
△
CH2OH
CH3
Cl2
CH3—CH3
CH2Cl
CH3
光照
桥梁
19:23
③如何由 变为 ?
Br2/CCl4
Br
Br
醇、NaOH
△
走进奇妙的化学世界
选择性必修3
第三章 烃的衍生物
第一节 卤代烃
【思考】
分析卤代烃的结构特点,推测卤代烃具有怎样的化学性质。
卤代烃中卤素原子吸引电子能力较强,共用电子对偏向卤素原子,使C—X键具有较强的极性,所以卤代烃具有较强的反应活性,易发生取代反应和消去反应。
碳卤键
官能团:
X
C
δ—
δ+
学习
目标
第2课时
卤代烃的化学性质及应用
PART
01
PART
02
通过从卤代烃的官能团及其转化角度认识卤代烃取代反应、消去反应的特点和规律,了解有机反应类型与有机化合物分子结构特点之间的关系。
掌握卤代烃在有机合成中的桥梁作用,培养“科学探究与社会责任”的核心素养
对比乙烷的结构式,比较两者的异同,预测溴乙烷的化学性质。
溴乙烷和乙烷的结构相似,区别在于C-H键与C-Br键的不同。
C-Br键为极性键,由于溴原子吸引电子能力强,C-Br键易断裂,使溴原子易被取代。由于官能团(C-Br)的作用,溴乙烷的化学性质比乙烷活泼,能发生许多化学反应。
元素 H C Br
电负性 2.1 2.5 2.8
在卤代烃分子中,由于卤素原子的电负性比碳原子的大,使C—X的电子向卤素原子偏移,进而使碳原子带部分正电荷(δ+),卤素原子带部分负电荷(δ-),这样就形成一个极性较强的共价键:Cδ+—Xδ-。
因此,卤代烃在化学反应中,C—X较易断裂,使卤素原子被其他原子或原子团所取代,生成负离子而离去。
由于卤素原子的引入使卤代烃的反应活性增强。
学习任务一:卤代烃的化学性质
1.取代反应(水解反应)
反应条件:
NaOH水溶液、加热
反应原理:
羟基取代溴原子
C2H5—Br + H--OH C2H5—OH + HBr
△
NaOH + HBr == NaBr + H2O
总反应:
CH3CH2Br + NaOH
CH3CH2OH + NaBr
H2O
△
【例】请写出下列卤代烃水解的方程式:
思考:CH3CH2Br+NaCN(aq)反应的产物?
CH3 C CH2Br
CH3
CH3
Br
CH3CH2Br
CH3CH CH2CH3
Br
①所有卤代烃在一定条件下都能发生水解。
②卤素原子直接与苯环相连的卤代芳香烃水解反应条件比较苛刻
R-X + NaOH R-OH + NaX
水
△
溴乙烷与NaOH溶液反应混合液
AgNO3溶液
实验一:
溴乙烷
AgNO3溶液
无明显变化
溴乙烷不是电解质,不能电离出Br-。
实验二:
产生黑褐色沉淀
未反应完的NaOH与硝酸银溶液反应生成了Ag2O
NaOH+AgNO3 = AgOH↓+NaNO3
2AgOH = Ag2O↓ +H2O
以溴乙烷为例如何检验卤代烃中的卤素原子种类?
实验三:
未反应完的NaOH与硝酸中和,最后可得到淡黄色沉淀AgBr。
溴乙烷与NaOH溶液反应混合液
稀硝酸
AgNO3溶液
产生淡黄色沉淀
AgNO3溶液
NaOH溶液共热
水解
HNO3溶液
酸化
R-X
有沉淀产生
AgI
白色↓
淡黄色↓
黄色↓
AgCl
AgBr
Cl元素
Br元素
I元素
检验卤代烃中的卤原子一般流程:
该步骤必不可少
在卤代烃分子中,由于卤原子的吸电子作用,不仅使得α-C带部分正电荷,也使β-C带有更少量的正电荷,从而使β-H的活泼性增强,能在强碱的作用下,失去一分子卤化氢,生成烯烃,这就是卤代烃的消去反应。
C
C
Br
H
H
H
H
H
Br
δ+
δ-
δ++
现象:
高锰酸钾酸性溶液褪色
实验:
结论:
生成的气体分子中含有不饱和碳碳键
溴乙烷与NaOH的乙醇混合液
反应原理:
CH2—CH2 +NaOH CH2=CH2↑ +NaBr +H2O
Br
H
乙醇
△
有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而形成不饱和键(双键或三键)的化合物的反应。。
消去反应:
2.溴乙烷的消去反应(消除反应)
思考:下列卤代烃能否发生消去反应?
①CH3I
CH2Br
③
Br
CH3CH CHCH3
Br
⑤
Br
⑥
CH3 C CH2Br
CH3
CH3
②
CH3CHBr2
④
由此你能得出什么结论?
发生消去反应的条件:
①烃中碳原子数≥2
②连卤原子的相邻碳原子上有氢原子
1、反应条件:
+NaOH
— C— C—
H
X
醇
C=C
+NaX+H2O
HX+NaOH ===NaX +H2O
强碱的醇溶液、加热
2、物质结构条件:
写出发生消去反应的方程式。
2. CH3CHCHBrCH3
—
CH3
思考:能发生消去反应的卤代烃,其有机产物仅为一种吗?
有多个邻位碳原子,且邻位碳原子上均有氢原子时,且不对称时消去反应可能生成多种产物。
判断:下列物质中,发生消去反应后可生成几种烯烃?
2种
1种
CH3
CH2CH2CH3
C
Br
CH2CH3
3种
思考:溴乙烷与NaOH的醇溶液的反应,气体产物的检验
(1)分析反应产生的气体中可能含有哪些杂质?
(2)为什么要在气体通入酸性KMnO4溶液前
加一个盛有水的试管?
溴乙烷、乙醇、水蒸汽
除去挥发出来的乙醇。
乙醇也能使酸性高锰酸钾溶液褪色,干扰乙烯的检验。
(3)除酸性高锰酸钾溶液外还可以用什么来检验乙烯,此时气体还用先通入水中吗?理由是?
溴水、溴的四氯化碳溶液。
不用;乙醇与溴不反应,不会干扰乙烯的检验。
反应类型 消去反应 水解(取代)反应
反应条件
卤代烃的 断键规律
结构特点
产物特征
归纳总结
卤代烃的消去反应与水解反应的比较
NaOH醇溶液、加热
NaOH水溶液、加热
与X相连的C的邻位C上有H原子
含C—X键即可
消去HX,引入碳碳双键或碳碳三键
在碳上引入—OH,生成含—OH的有机物(醇)
卤代烯烃的某些化学性质与烯烃的相似,能发生加成反应和加聚反应。
聚氯乙烯和聚四氟乙烯都是用途广泛的高分子材料。
(3)加成和加聚反应
总结
X
C
C
H
OH
C
C
H
C
C
消去反应
取代反应
结构
性质
决定
反映
NaOH
乙醇
水
△
△
δ+
δ-
析疑:首先CH3CH2Br在NaOH乙醇溶液中发生消去反应,生成乙烯,乙烯与Br2发生加成反应得到CH2BrCH2Br, 最后CH2BrCH2Br在NaOH水溶液中发生取代反应,即可得到CH2OHCH2OH。
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,
如何实现
学习任务二:卤代烃在有机合成中的应用
烃、卤代烃、醇之间的衍变关系
CH2=CH2 CH3CH2--Br CH3CH2-OH
①
②
③
④
⑤
⑥
C
OH
O—H
脱去水分子
C=O
+H2O
提示:
2.在烃分子中引入羟基
例如由乙烯制乙二醇,先用乙烯与氯气发生加成反应制取1,2 二氯乙烷,再用1,2 二氯乙烷和氢氧化钠溶液发生水解反应制得乙二醇。
R-X + NaOH R-OH + NaX
H2O
△
消去
1-丁烯
加成
HCl
2-氯丁烷
3.改变某些官能团的位置
例如由1 -丁烯制取2 -丁烯,先由1 丁烯与溴化氢加成得到2 氯丁烷,再由2 氯丁烷发生消去反应得到2 丁烯。
2-丁烯
再例如由1- 溴丙烷制取2- 溴丙烷,先由1- 溴丙烷通过消去反应制丙烯,再由丙烯与溴化氢加成得到2- 溴丙烷。
1-溴丙烷
消去
丙烯
加成
HBr
2-溴丙烷
4.改变某些官能团的数目
例如由1- 溴丙烷制取1,2- 二溴丙烷,先由1- 溴丙烷通过消去反应制丙烯,再由丙烯与溴水加成得到1,2- 二溴丙烷。
1-溴丙烷
丙烯
1,2-二溴丙烷
NaOH醇溶液
加热
溴水
1、 根据下面的反应路线及所给信息填空。
(1)A的结构简式是____________名称是__________
(2)①的反应类型是__________②的反应类型是________
(3)反应④的化学方程式是
________________________________
环己烷
取代
消去
Br
Br
+2NaOH
醇
△
+2NaBr+2H2O
解析:由A在光照条件下与Cl2反应生成一氯环己烷,联想到烷烃的取代,可确定A为环己烷,卤代烃在强碱的醇溶液中加热时发生消去反应生成烯烃,环己烯与Br2的四氯化碳溶液发生加成反应,生成1,2 二溴环己烷,其消去两分子HBr得最终产物。
3。设计合成路线
①、以乙烷为主要原料制备CH3CH2OH。
②、由乙烯为主要原料来制HOCH2CH2OH。
Br2
CH2=CH2
CH2Br
CH2Br
NaOH、 H2O
△
CH2OH
CH2OH
NaOH、 H2O
△
CH2OH
CH3
Cl2
CH3—CH3
CH2Cl
CH3
光照
桥梁
19:23
③如何由 变为 ?
Br2/CCl4
Br
Br
醇、NaOH
△
