化学人教版(2019)必修第二册5.1.2 硫酸及硫酸根离子的检验(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.1.2 硫酸及硫酸根离子的检验(共25张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 26.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-01 08:09:36 | ||
图片预览






文档简介
(共25张PPT)
第五章
化工生产中的重要非金属元素
第一节 硫及其化合物
课时2
硫酸、硫酸根离子的检验
学习目标
1. 了解硫酸的酸性和浓硫酸的三大特性;
2. 能运用氧化还原反应知识理解浓硫酸的氧化性;
3. 掌握硫酸根离子的检验方法。
纯硫酸是无色、粘稠的油状液体,沸点高,难挥发。
硫酸的性质
物理性质:
常用的浓硫酸中H2SO4的质量分数是98% (物质的量浓度为18.4mol/L,密度为1.84g/ml)。
硫酸能与水以任意比互溶,且溶于水时放出大量的热!!!
将浓硫酸沿着容器内壁(或沿着玻璃棒)缓慢地注入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散。
【学与问】如何稀释浓硫酸?
酸入水!!!
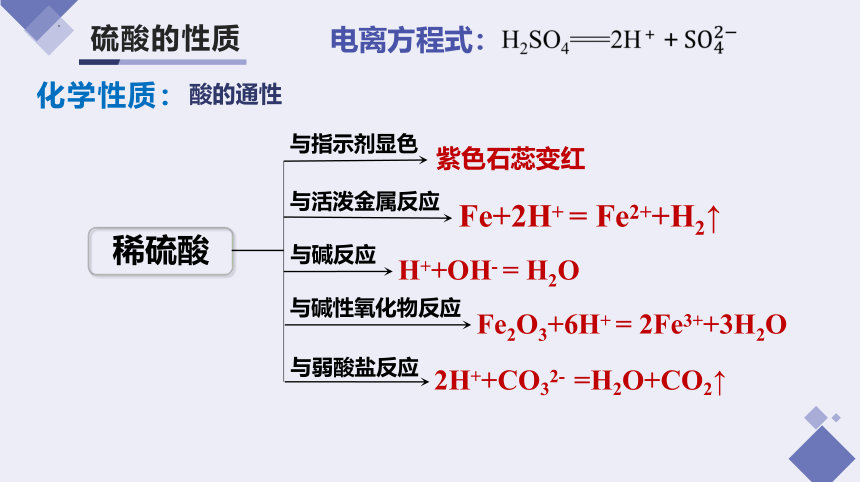
硫酸的性质
酸的通性
与指示剂显色
紫色石蕊变红
与活泼金属反应
与碱反应
与碱性氧化物反应
与弱酸盐反应
电离方程式:
稀硫酸
Fe+2H+ = Fe2++H2↑
H++OH- = H2O
Fe2O3+6H+ = 2Fe3++3H2O
2H++CO32- =H2O+CO2↑
化学性质:
浓硫酸的特性
观察思考
描述现象
结论
浓硫酸滴到硫酸铜晶体上
实验探究
蓝色的硫酸铜晶体变为白色的无水硫酸铜粉末
浓硫酸具有吸水性
吸水性:浓硫酸能吸收存在于周围环境中的水分及结晶水合物中的结晶水,常用做 。
干燥剂
H2S+3H2SO4 = 4SO2↑+4H2O
2NH3+H2SO4=(NH4)2SO4
可用来干燥中性气体和酸性气体,
如 H2、O2、N2、Cl2、CO2、CH4、 SO2、NO2、HCl
不能干燥NH3(碱性)以及H2S(强还原性气体)、HBr、HI等还原性气体
浓硫酸的特性
—— 吸水性
浓硫酸的特性
观察思考
描述现象 ________________________________________________________________________________
反应
结论 _________________
蔗糖变黑,体积膨胀,变成疏松多孔的海绵状的炭,并释放出有刺激性气味的气体
浓硫酸具有脱水性
C12H22O11
浓硫酸
12C+11H2O
(蔗糖)
C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
—— 脱水性
脱水性:把有机物中的氢氧原子按2:1的个数比脱去。
实验探究
设计一实验,证明浓硫酸与碳反应的生成物含有水、二氧化硫和二氧化碳 。供选择试剂和装置如下图(装置可多次使用)。
仪器连接如下:
饱和NaHCO3溶液
无水硫酸铜
品红
KMnO4溶液
澄清石灰水
无水硫酸铜
品红溶液
品红溶液
KMnO4溶液
石灰水
检验水(白色固体为蓝色)
检验二氧化硫(品红褪色)
除去二氧化硫(溶液褪色)
检验二氧化硫是否除尽
检验二氧化碳(溶液变浑浊)
小结
吸水性 脱水性
原理 浓硫酸能够吸收_______ _______________及固体 中的结晶水 浓硫酸能把有机物中_____
___________________脱
去,剩余黑色的炭
区别 _____________ ____________________
_________________
应用 _________
气体、
液体中的水分子
氢、
氧元素按水的组成比
物质中含有H2O
物质中不含有H2O,只是含
有氢元素和氧元素
作干燥剂
有水为吸 无水则脱
浓硫酸的特性
—— 强氧化性
实验现象 a试管中铜丝表面 ;
b试管中的溶液 ;
c试管中的 ;
将a试管里的溶液慢慢倒入水中,___________
实验结论 __________________________________________
有气泡产生
逐渐变为无色
紫色石蕊溶液逐渐变为红色
溶液显蓝色
Cu+2H2SO4(浓)
CuSO4+
SO2↑+2H2O
实验探究
①可抽动的铜丝有什么作用?
答:吸收多余的SO2,以防污染环境,SO2+2NaOH = Na2SO3+H2O。
答:控制反应的发生或停止
③在浓硫酸与铜(加热)的反应中,浓H2SO4表现了哪些性质?
答:浓硫酸既表现了强氧化性,又表现了酸性。
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
浓硫酸的特性
—— 强氧化性
②试管c中“浸NaOH溶液的棉团”的作用是什么?写出反应的化学方程式。
思考讨论
1. 浓硫酸能和金属反应,为什么可用铝罐车和铁罐车来运输浓硫酸?
在常温下,浓硫酸跟某些金属,如铁、铝等接触时,能够使金属表面生成一薄层致密的氧化物薄膜,从而阻止内部的金属继续跟硫酸发生反应,现象叫做——钝化。因此,冷的浓硫酸可以用铁或铝的容器贮存。但受热时,浓硫酸可以与Fe、Al反应。
“钝化”是化学变化吗?
是
思考讨论
2. 实验室用金属和酸反应制取氢气时,往往用稀硫酸、而不用浓硫酸,这是为什么?
答:稀H2SO4属于非氧化性酸,H+表现氧化性(酸的通性),
Zn + H2SO4(稀) = ZnSO4 + H2↑
浓H2SO4属于氧化性酸,+6价的硫表现氧化性,
Zn + 2H2SO4(浓) = ZnSO4 + SO2↑ + 2H2O
思考讨论
3. 将64 g铜片加入盛有浓硫酸(含2 mol H2SO4)的试管中加热,充分反应后,铜片能否完全溶解?请解释原因。
答:铜片不能完全溶解,原因是随着反应的进行,硫酸的浓度变小,而铜与稀硫酸不反应。
牛刀小试
1.下列各过程主要表现了浓硫酸的哪些性质?
①强酸性 ②强氧化性 ③高沸点、难挥发性 ④脱水性 ⑤吸水性
(1)用氯化钠固体和浓硫酸在加热条件下制氯化氢气体 。
(2)用磷矿物[主要成分是磷酸钙]和硫酸反应制磷酸 。
(3)浓硫酸干燥氢气、氧气、氯气、二氧化硫等气体 。
解析: 浓硫酸具有高沸点、难挥发性,氯化氢气体易挥发。
解析:磷酸是高沸点中强酸,利用强酸与弱酸盐反应制弱酸原理制磷酸。
解析: 浓硫酸具有吸水性,可作干燥剂,干燥酸性气体和中性气体。
③
①
⑤
(4)常温下可以用铁或铝的容器贮存浓硫酸________。
牛刀小试
1.下列各过程主要表现了浓硫酸的哪些性质?
①强酸性 ②强氧化性 ③高沸点、难挥发性 ④脱水性 ⑤吸水性
解析: 常温下,浓硫酸和铝、铁反应,在金属表面生成一层薄而致密的氧化物薄膜,阻止内部的金属和浓硫酸继续反应。
②
(5)不能用浓硫酸干燥溴化氢、碘化氢和硫化氢等气体____。
②
解析:浓硫酸具有强氧化性,不可干燥碱性气体和某些还原性气体。
浓硫酸的应用
医药
干燥剂
化学试剂
化肥
铅蓄电池
炸药
浓硫酸的制备
1. 原料:
硫黄或黄铁矿、空气、98.3%的浓硫酸
2. 流程:
三阶段 三反应 三设备
造 气
沸腾炉
催化氧化 接触室
SO3的吸收 吸收塔
高温
4FeS2+11O2 == 2 Fe2O3+8SO2
点燃
( 或 S + O2 == SO2 )
催化剂
2SO2 + O2 2SO3
SO3 + H2O = H2SO4
SO3遇水生成硫酸,会释放出大量的热,易形成酸雾,影响SO3的吸收,故不直接用水吸收SO3。
硫酸盐
硫酸盐 化学式及俗称 用途
CaSO4 CaSO4·2H2O(石膏) 2CaSO4·H2O(熟石膏) 制作模型、绷带、粉笔,调节水泥的硬化速率
BaSO4 BaSO4(重晶石) 医疗上用作“钡餐”
CuSO4 CuSO4·5H2O(胆矾、蓝矾) 与石灰乳混合制农药“波尔多液”
FeSO4 FeSO4·7H2O(绿矾) 制补血剂、生产铁系列净水剂和颜料
KAl(SO4)2 KAl(SO4)2·12H2O(明矾) 用作净水剂(形成Al(OH)3胶体)
硫酸根离子检验
实验探究
硫酸根离子检验
实验操作 实验现象 离子方程式
加入BaCl2生成 ,再加入少量稀盐酸,白色沉淀_______ ______________________
加入BaCl2生成 ,再加入少量稀盐酸,____ ,生成________ _____ ________________________________________________________
白色沉淀
不溶解
白色沉淀
白色
沉淀溶解
无色无味
气体
Ba2++CO32-=BaCO3↓,BaCO3+2H+=Ba2++H2O+CO2↑
Ba2++SO42-=BaSO4↓
硫酸根离子检验
检验原理 Ba2+ + SO42- = BaSO4 ↓ ,BaSO4是不溶于稀盐酸的白色沉淀
所需试剂 BaCl2溶液,稀盐酸
操作方法 取适量待测液于试管中,加足量稀盐酸,无明显现象,再滴加BaCl2溶液,产生白色沉淀
1、稀盐酸和BaCl2溶液加入顺序能否交换?为什么?
2、稀盐酸能否换成稀硝酸? BaCl2溶液能否换成Ba(NO3)2溶液?(已知: ①稀硝酸有强氧化性。②H+和NO3-组合具有强氧化性)
不能用硝酸酸化,第二步也不能用Ba(NO3)2溶液,否则无法排除SO32-的干扰。
不能,否则无法排除Ag+的干扰
先加入盐酸酸化,可排除Ag+、CO32-、SO32-的干扰
粗盐提纯
(1) 经溶解、过滤、蒸发操作得到的粗盐中含有一些可溶性硫酸盐及CaCl2、MgCl2等杂质。如果按照下表所示顺序除去它们,应加入什么试剂?
杂质 加入的试剂 离子方程式
硫酸盐
CaCl2
MgCl2
BaCl2
NaOH
Mg2++2OH- = Mg(OH)2↓
Na2CO3
SO42- + Ba2+ = BaSO4↓
CO32- + Ca2+ = CaCO3↓
粗盐提纯
原理图:
①为使杂质离子完全除去,要加入过量的试剂。后续试剂要能够将前面所加过量的试剂除去,由此可知NaCO3溶液要在____________之后加入。
②最后加入盐酸的目的是___________________________。
BaCl2溶液
除去溶液中过量的OH-和CO32-
牛刀小试
√
第五章
化工生产中的重要非金属元素
第一节 硫及其化合物
课时2
硫酸、硫酸根离子的检验
学习目标
1. 了解硫酸的酸性和浓硫酸的三大特性;
2. 能运用氧化还原反应知识理解浓硫酸的氧化性;
3. 掌握硫酸根离子的检验方法。
纯硫酸是无色、粘稠的油状液体,沸点高,难挥发。
硫酸的性质
物理性质:
常用的浓硫酸中H2SO4的质量分数是98% (物质的量浓度为18.4mol/L,密度为1.84g/ml)。
硫酸能与水以任意比互溶,且溶于水时放出大量的热!!!
将浓硫酸沿着容器内壁(或沿着玻璃棒)缓慢地注入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散。
【学与问】如何稀释浓硫酸?
酸入水!!!
硫酸的性质
酸的通性
与指示剂显色
紫色石蕊变红
与活泼金属反应
与碱反应
与碱性氧化物反应
与弱酸盐反应
电离方程式:
稀硫酸
Fe+2H+ = Fe2++H2↑
H++OH- = H2O
Fe2O3+6H+ = 2Fe3++3H2O
2H++CO32- =H2O+CO2↑
化学性质:
浓硫酸的特性
观察思考
描述现象
结论
浓硫酸滴到硫酸铜晶体上
实验探究
蓝色的硫酸铜晶体变为白色的无水硫酸铜粉末
浓硫酸具有吸水性
吸水性:浓硫酸能吸收存在于周围环境中的水分及结晶水合物中的结晶水,常用做 。
干燥剂
H2S+3H2SO4 = 4SO2↑+4H2O
2NH3+H2SO4=(NH4)2SO4
可用来干燥中性气体和酸性气体,
如 H2、O2、N2、Cl2、CO2、CH4、 SO2、NO2、HCl
不能干燥NH3(碱性)以及H2S(强还原性气体)、HBr、HI等还原性气体
浓硫酸的特性
—— 吸水性
浓硫酸的特性
观察思考
描述现象 ________________________________________________________________________________
反应
结论 _________________
蔗糖变黑,体积膨胀,变成疏松多孔的海绵状的炭,并释放出有刺激性气味的气体
浓硫酸具有脱水性
C12H22O11
浓硫酸
12C+11H2O
(蔗糖)
C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
—— 脱水性
脱水性:把有机物中的氢氧原子按2:1的个数比脱去。
实验探究
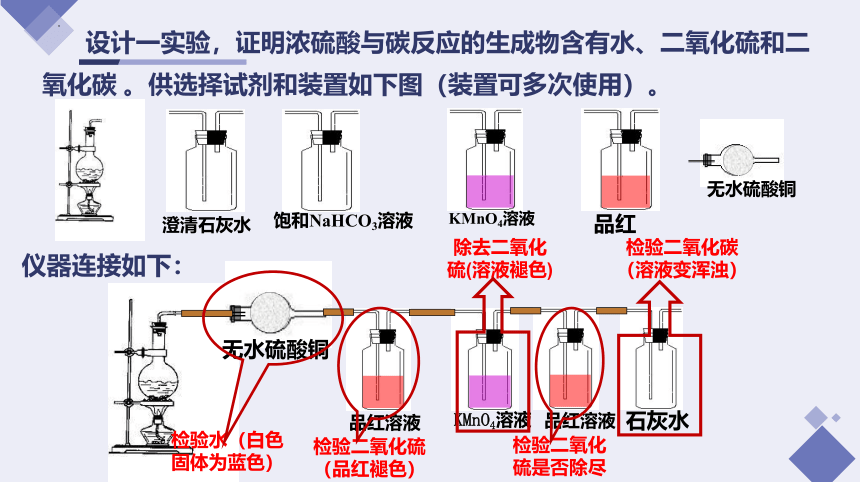
设计一实验,证明浓硫酸与碳反应的生成物含有水、二氧化硫和二氧化碳 。供选择试剂和装置如下图(装置可多次使用)。
仪器连接如下:
饱和NaHCO3溶液
无水硫酸铜
品红
KMnO4溶液
澄清石灰水
无水硫酸铜
品红溶液
品红溶液
KMnO4溶液
石灰水
检验水(白色固体为蓝色)
检验二氧化硫(品红褪色)
除去二氧化硫(溶液褪色)
检验二氧化硫是否除尽
检验二氧化碳(溶液变浑浊)
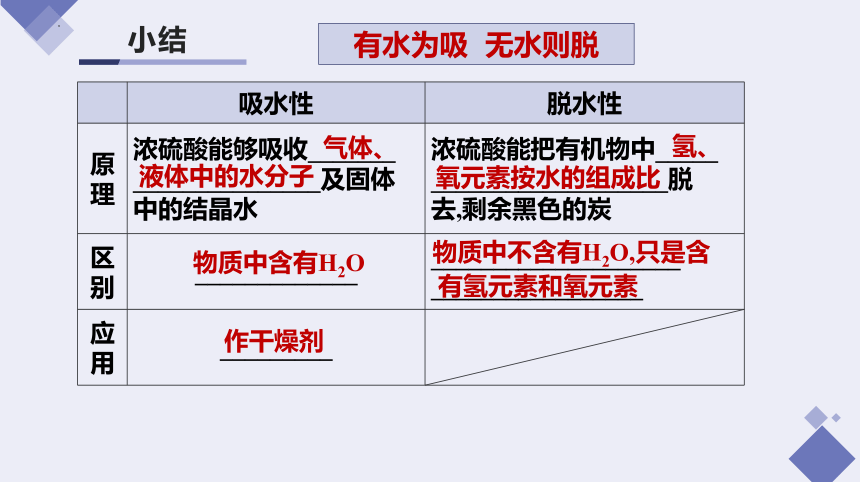
小结
吸水性 脱水性
原理 浓硫酸能够吸收_______ _______________及固体 中的结晶水 浓硫酸能把有机物中_____
___________________脱
去,剩余黑色的炭
区别 _____________ ____________________
_________________
应用 _________
气体、
液体中的水分子
氢、
氧元素按水的组成比
物质中含有H2O
物质中不含有H2O,只是含
有氢元素和氧元素
作干燥剂
有水为吸 无水则脱
浓硫酸的特性
—— 强氧化性
实验现象 a试管中铜丝表面 ;
b试管中的溶液 ;
c试管中的 ;
将a试管里的溶液慢慢倒入水中,___________
实验结论 __________________________________________
有气泡产生
逐渐变为无色
紫色石蕊溶液逐渐变为红色
溶液显蓝色
Cu+2H2SO4(浓)
CuSO4+
SO2↑+2H2O
实验探究
①可抽动的铜丝有什么作用?
答:吸收多余的SO2,以防污染环境,SO2+2NaOH = Na2SO3+H2O。
答:控制反应的发生或停止
③在浓硫酸与铜(加热)的反应中,浓H2SO4表现了哪些性质?
答:浓硫酸既表现了强氧化性,又表现了酸性。
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
浓硫酸的特性
—— 强氧化性
②试管c中“浸NaOH溶液的棉团”的作用是什么?写出反应的化学方程式。
思考讨论
1. 浓硫酸能和金属反应,为什么可用铝罐车和铁罐车来运输浓硫酸?
在常温下,浓硫酸跟某些金属,如铁、铝等接触时,能够使金属表面生成一薄层致密的氧化物薄膜,从而阻止内部的金属继续跟硫酸发生反应,现象叫做——钝化。因此,冷的浓硫酸可以用铁或铝的容器贮存。但受热时,浓硫酸可以与Fe、Al反应。
“钝化”是化学变化吗?
是
思考讨论
2. 实验室用金属和酸反应制取氢气时,往往用稀硫酸、而不用浓硫酸,这是为什么?
答:稀H2SO4属于非氧化性酸,H+表现氧化性(酸的通性),
Zn + H2SO4(稀) = ZnSO4 + H2↑
浓H2SO4属于氧化性酸,+6价的硫表现氧化性,
Zn + 2H2SO4(浓) = ZnSO4 + SO2↑ + 2H2O
思考讨论
3. 将64 g铜片加入盛有浓硫酸(含2 mol H2SO4)的试管中加热,充分反应后,铜片能否完全溶解?请解释原因。
答:铜片不能完全溶解,原因是随着反应的进行,硫酸的浓度变小,而铜与稀硫酸不反应。
牛刀小试
1.下列各过程主要表现了浓硫酸的哪些性质?
①强酸性 ②强氧化性 ③高沸点、难挥发性 ④脱水性 ⑤吸水性
(1)用氯化钠固体和浓硫酸在加热条件下制氯化氢气体 。
(2)用磷矿物[主要成分是磷酸钙]和硫酸反应制磷酸 。
(3)浓硫酸干燥氢气、氧气、氯气、二氧化硫等气体 。
解析: 浓硫酸具有高沸点、难挥发性,氯化氢气体易挥发。
解析:磷酸是高沸点中强酸,利用强酸与弱酸盐反应制弱酸原理制磷酸。
解析: 浓硫酸具有吸水性,可作干燥剂,干燥酸性气体和中性气体。
③
①
⑤
(4)常温下可以用铁或铝的容器贮存浓硫酸________。
牛刀小试
1.下列各过程主要表现了浓硫酸的哪些性质?
①强酸性 ②强氧化性 ③高沸点、难挥发性 ④脱水性 ⑤吸水性
解析: 常温下,浓硫酸和铝、铁反应,在金属表面生成一层薄而致密的氧化物薄膜,阻止内部的金属和浓硫酸继续反应。
②
(5)不能用浓硫酸干燥溴化氢、碘化氢和硫化氢等气体____。
②
解析:浓硫酸具有强氧化性,不可干燥碱性气体和某些还原性气体。
浓硫酸的应用
医药
干燥剂
化学试剂
化肥
铅蓄电池
炸药
浓硫酸的制备
1. 原料:
硫黄或黄铁矿、空气、98.3%的浓硫酸
2. 流程:
三阶段 三反应 三设备
造 气
沸腾炉
催化氧化 接触室
SO3的吸收 吸收塔
高温
4FeS2+11O2 == 2 Fe2O3+8SO2
点燃
( 或 S + O2 == SO2 )
催化剂
2SO2 + O2 2SO3
SO3 + H2O = H2SO4
SO3遇水生成硫酸,会释放出大量的热,易形成酸雾,影响SO3的吸收,故不直接用水吸收SO3。
硫酸盐
硫酸盐 化学式及俗称 用途
CaSO4 CaSO4·2H2O(石膏) 2CaSO4·H2O(熟石膏) 制作模型、绷带、粉笔,调节水泥的硬化速率
BaSO4 BaSO4(重晶石) 医疗上用作“钡餐”
CuSO4 CuSO4·5H2O(胆矾、蓝矾) 与石灰乳混合制农药“波尔多液”
FeSO4 FeSO4·7H2O(绿矾) 制补血剂、生产铁系列净水剂和颜料
KAl(SO4)2 KAl(SO4)2·12H2O(明矾) 用作净水剂(形成Al(OH)3胶体)
硫酸根离子检验
实验探究
硫酸根离子检验
实验操作 实验现象 离子方程式
加入BaCl2生成 ,再加入少量稀盐酸,白色沉淀_______ ______________________
加入BaCl2生成 ,再加入少量稀盐酸,____ ,生成________ _____ ________________________________________________________
白色沉淀
不溶解
白色沉淀
白色
沉淀溶解
无色无味
气体
Ba2++CO32-=BaCO3↓,BaCO3+2H+=Ba2++H2O+CO2↑
Ba2++SO42-=BaSO4↓
硫酸根离子检验
检验原理 Ba2+ + SO42- = BaSO4 ↓ ,BaSO4是不溶于稀盐酸的白色沉淀
所需试剂 BaCl2溶液,稀盐酸
操作方法 取适量待测液于试管中,加足量稀盐酸,无明显现象,再滴加BaCl2溶液,产生白色沉淀
1、稀盐酸和BaCl2溶液加入顺序能否交换?为什么?
2、稀盐酸能否换成稀硝酸? BaCl2溶液能否换成Ba(NO3)2溶液?(已知: ①稀硝酸有强氧化性。②H+和NO3-组合具有强氧化性)
不能用硝酸酸化,第二步也不能用Ba(NO3)2溶液,否则无法排除SO32-的干扰。
不能,否则无法排除Ag+的干扰
先加入盐酸酸化,可排除Ag+、CO32-、SO32-的干扰
粗盐提纯
(1) 经溶解、过滤、蒸发操作得到的粗盐中含有一些可溶性硫酸盐及CaCl2、MgCl2等杂质。如果按照下表所示顺序除去它们,应加入什么试剂?
杂质 加入的试剂 离子方程式
硫酸盐
CaCl2
MgCl2
BaCl2
NaOH
Mg2++2OH- = Mg(OH)2↓
Na2CO3
SO42- + Ba2+ = BaSO4↓
CO32- + Ca2+ = CaCO3↓
粗盐提纯
原理图:
①为使杂质离子完全除去,要加入过量的试剂。后续试剂要能够将前面所加过量的试剂除去,由此可知NaCO3溶液要在____________之后加入。
②最后加入盐酸的目的是___________________________。
BaCl2溶液
除去溶液中过量的OH-和CO32-
牛刀小试
√
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
